

2. 东南大学附属中大医院肾脏内科,江苏 南京 210009
2. Dept of Nephrology, Zhongda Hospital, Southeast University, Nanjing 210009 China
芬戈莫德(fingolimod),又称FTY720,是从冬虫夏草培养液中提取、分离出来,并经过一系列修饰加工而成的一种新开发的免疫抑制剂[1]。芬戈莫德的作用机制不同于常规的免疫抑制剂,目前对芬戈莫德发挥其免疫抑制作用和免疫调控作用机制的研究主要集中在促进淋巴细胞归巢、诱导淋巴细胞凋亡等,但到目前为止,其确切的作用机制仍不清楚。
NLRP3炎性体是由NLRP3、ASC和pro-caspase-1组成的多蛋白复合体,可以活化caspase-1,释放IL-1β和IL-18,从而促进各种炎症性和免疫性疾病的发生和发展。我们之前体内、外的研究发现,肾小管上皮细胞内的NLRP3炎性体激活在白蛋白导致的肾小管间质炎症反应中发挥着重要作用。本文拟通过体内、外实验研究芬戈莫德是否通过抑制NLRP3炎性体激活而发挥抗炎免疫作用,从而探讨芬戈莫德的作用机制。
1 材料与方法 1.1 实验动物与细胞健康♂,Wistar大鼠40只,清洁级,体重(130~160) g,购自军事医学科学院动物实验中心,生产许可证sexk(军)2012-004。细胞来源:HK-2细胞株为人近端肾小管上皮细胞的永生系,购自武汉大学细胞保藏中心。
1.2 药物与试剂芬戈莫德粉剂(美国selleckchem批号S500207);SP试剂盒(福州迈新Kit 9921);NLRP3、caspase-1、IL-1β、IL-18和β-actin(美国Santa Cruz); TRIzol试剂(美国Invitrogen); 反转录试剂盒(日本TaKaRa); 本研究所用引物由南京金斯瑞科技有限公司设计及合成。
1.3 仪器石蜡切片机(德国莱卡公司); 显微镜(日本Olympus,BX41);电泳仪(美国Bio-Rad公司); 凝胶成像系统(美国Bio-Rad公司); 7300型Real-time PCR仪(美国ABI公司)。
1.4 实验动物分组、造模、给药大鼠适应性喂养1周,行右肾切除术1周后随机分为五组:对照组(n=8),经腹腔注射与牛血清白蛋白(BSA,5 g·L-1)等体积的0.9%生理盐水; 蛋白负荷肾病模型组(n=8),经腹腔注射BSA(5 g·L-1); 不同浓度芬戈莫德干预组(每组n=8),经大鼠腹腔注射BSA(5 g·L-1)的同时给予大鼠灌胃芬戈莫德(0.25,0.5,1 mg·kg-1)。
1.5 细胞分组及药物处理HK-2细胞置于37 ℃、5%CO2细胞培养箱中,培养液为含5%胎牛血清的DMEM/F12。将HK-2细胞接种在6孔培养板,培养至部分融合或全部融合时,用无血清DMEM/F12培养液洗2次后,去血清培养24 h,然后细胞分组如下:①加入正常培养液的正常对照组; ②加入高浓度BSA(20 g·L-1)刺激的模型组; ③高浓度BSA刺激HK-2细胞后加入不同浓度芬戈莫德(1,10,100 nmol·L-1)的干预组。
1.6 大鼠肾组织PAS和Masson染色大鼠肾脏组织用福尔马林固定后,脱水、透明、石蜡包埋成蜡块,切片(厚2~3 μm),常规脱蜡至水后行PAS及Masson染色。每例切片显微镜下随机选取10个互不重叠的肾间质视野进行肾脏损伤评分。评分内容包括:肾小管萎缩、小管间质纤维化、有无蛋白管型、间质炎性细胞浸润程度等。小管间质损伤评分标准:0分:正常; 1分:皮质损伤范围<25%;2分:25%~50%;3分:>50%。
1.7 大鼠肾组织免疫组化染色蜡块切片(厚3~4 μm)后常规脱蜡,水化,枸橼酸钠、微波修复后,用SP试剂盒(福州迈新Kit 9921)检测NLRP3 (1:100)、caspase-1(1:50)、IL-1β(1:100)、IL-18(1:100),PBS作为阴性对照,显微镜下观察拍照。
1.8 Western印迹取大鼠新鲜肾组织或收集培养板中的细胞,加适量RIPA裂解液,离心取上清液,按试剂盒说明书操作检测蛋白浓度。取等量蛋白样本变性后SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶室温封闭1 h,加入NLRP3(1:1 000)、caspase-1(1:500)、IL-1β(1:1 000)和IL-18(1:1 000)一抗,放置4 ℃冰箱过夜。最后TBST洗膜,加入TBST稀释的二抗(1:5 000),室温孵育2 h,ECL化学发光法曝光。以β-actin(1:1 000)作为内参。
1.9 荧光实时定量PCR用TRIzol试剂提取大鼠肾组织或培养细胞的总RNA,对总RNA进行纯度、浓度及完整性的测定。用反转录试剂盒将总RNA反转录成cDNA。10 μL反应体系,置于PCR仪中进行反转录。以双蒸水代替cDNA模板作为阴性对照。所用引物由南京金斯瑞科技有限公司设计及合成,引物序列如Tab 1所示。
| Gene | Primer sequence | Length/bp |
| Rat | ||
| NLRP3 | F:5′-GCTGTGTGAGGCACTCCAG-3′ | 125 |
| R:5′-GAAACAGCATTGATGGGTCA-3′ | ||
| caspase-1 | F:5′-GACCGAGTGGTTCCCTCAAG-3′ | 130 |
| R:5′-GACGTGTACGAGTGGGTGTT-3′ | ||
| IL-1β | F:5′-TGTGATGAAAGACGGCACAC-3′ | 106 |
| R:5′-CTTCTTCTTTGGGTATTGTTTGG-3′ | ||
| IL-18 | F:5′-GCCTGATATCGACCGAACA-3′ | 93 |
| R:5′-CCTTCCATCCTTCACAGATAGG-3′ | ||
| GADPH | F:5′-TGTTGCCATCAACGACCCCTT-3′ | 128 |
| R:5′-CTCCACGACATACTCAGCA-3′ | ||
| HK-2 cells | ||
| NLRP3 | F:5′-CCAGGGATGAGAGTGTTGTG-3′ | 95 |
| R:5′-CAGCACTCATGCGAGAGG-3′ | ||
| caspase-1 | F:5′-GCATTCCTTGTGTAAGCCAA-3′ | 96 |
| R:5′-CTCTGGGCACAAAGCACTTA-3′ | ||
| IL-1β | F:5′-GAACGGCTCGTCAGAGGTG-3′ | 135 |
| R:5′-ACAGTGCAGATTCTCATCGCC-3′ | ||
| IL-18 | F:5′-GAACGGCTCGTCAGAGGTG-3′ | 131 |
| R:5′-ACAGTGCAGATTCTCATCGCC-3′ | ||
| GADPH | F:5′-TGTTGCCATCAACGACCCCTT-3′ | 132 |
| R:5′-CTCCACGACATACTCAGCA-3′ |
采用SPSS 16.0统计软件处理数据,符合正态分布计量资料以x±s表示,多组间比较采用单因素方差分析,均数间比较用t检验或方差分析。
2 结果 2.1 芬戈莫德对蛋白负荷肾病大鼠肾脏炎症和纤维化的影响PAS及Masson染色结果显示,与对照组相比,蛋白负荷肾病模型组肾小管上皮细胞颗粒变性或空泡变性明显,小管腔内可见蛋白管型,部分肾小管灶性萎缩,间质中有较多的淋巴细胞和单核巨噬细胞浸润,间质有轻度纤维化,小管间质损伤评分明显升高; 与模型组相比,0.25 mg·kg-1芬戈莫德组肾小管上皮细胞颗粒变性或空泡变性稍有改善,肾小管灶性萎缩减轻,间质中淋巴细胞和单核巨噬细胞浸润有所减少,小管间质损伤评分较模型组稍有下降,0.5 mg·kg-1和1 mg·kg-1芬戈莫德组明显减弱了蛋白尿导致的肾小管间质炎症和纤维化,且小管间质损伤评分明显下降(Fig 1)。
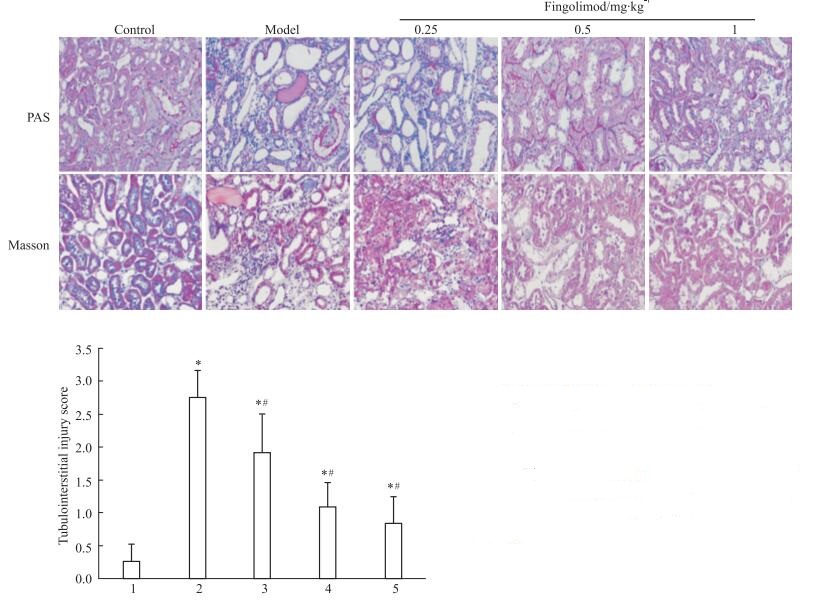
|
| Fig 1 Tubulointerstitial damage attenuated by fingolimod(x±s, n=8) 1:Control; 2:Model; 3: Fingolimod 0.25 mg·kg-1; 4: Fingolimod 0.5 mg·kg-1; 5: Fingolimod 1 mg·kg-1. A: PAS and Masson staining of the rat renal tissues (× 200); B: Tubulointerstitial injury score.*P < 0.05 vs Control group; #P < 0.05 vs Model group. |
免疫组化结果显示,NLRP3、caspase-1、IL-1β和IL-18在对照组的肾小管上皮细胞中仅有少量表达,在模型组中的表达均较对照组增强。与模型组相比,0.25 mg·kg-1芬戈莫德可抑制肾小管上皮中的NLRP3、caspase-1、IL-1β和IL-18的表达,0.5 mg·kg-1和1 mg·kg-1芬戈莫德组则抑制作用更加明显(Fig 2)。
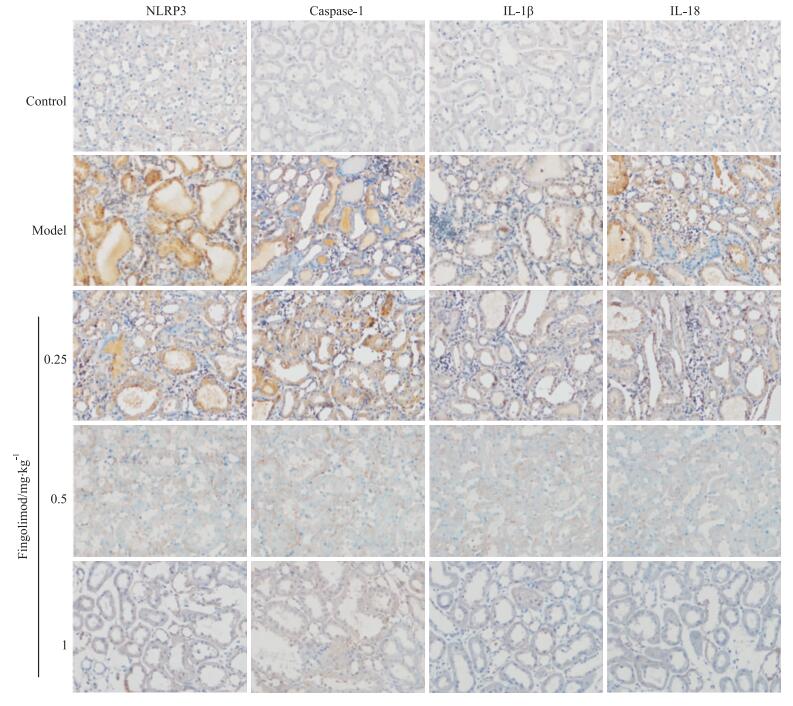
|
| Fig 2 Expression of NLRP3, caspase-1, IL-1β and IL-18 in rat renal tissues by immunohistochemical staining(× 200) |
Western印迹结果显示(Fig 3A),与对照组相比,模型组肾组织NLRP3、caspase-1、IL-1β和IL-18蛋白的表达均明显升高; 与模型组相比,0.25 mg·kg-1芬戈莫德组NLRP3、caspase-1、IL-1β和IL-18蛋白的表达均有所减少,而0.5 mg·kg-1和1 mg·kg-1芬戈莫德组则明显降低。荧光实时定量PCR结果显示(Fig 3B),模型组肾组织中NLRP3、caspase-1、IL-1β和IL-18 mRNA的表达均高于对照组; 与模型组相比,0.25 mg·kg-1芬戈莫德可抑制NLRP3、caspase-1、IL-1β和IL-18 mRNA的表达,0.5 mg·kg-1和1 mg·kg-1芬戈莫德可明显抑制上述mRNA的表达。组间比较差异有统计学意义(P < 0.05)。
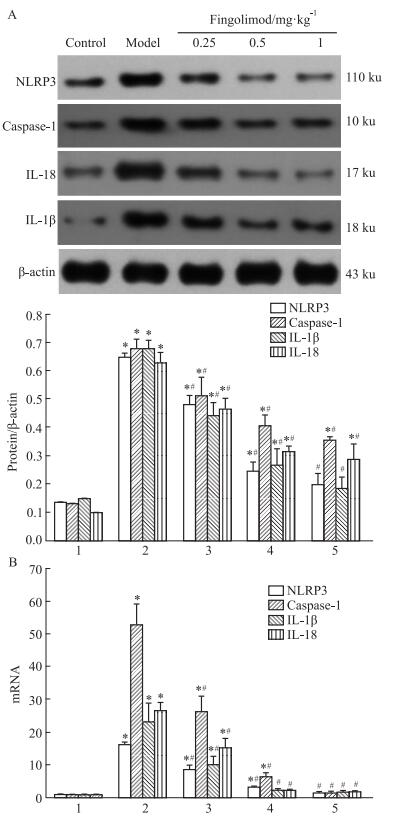
|
| Fig 3 In uence of fingolimod on expression of NLRP3, caspase-1, IL-1β, and IL-18 in rat renal tissues(x±s, n=8) A: Western blot; B:real-time PCR. 1: Control; 2: Model; 3: Fingolimod 0.25 mg·kg-1; 4: Fingolimod 0.5 mg·kg-1; 5: Fingolimod 1 mg·kg-1.*P < 0.05 vs Control group; #P < 0.05 vs Model group. |
在体外实验中,收集各组细胞分别做Western印迹和荧光实时定量PCR,检测各组细胞中NLRP3、caspase-1、IL-1β和IL-18蛋白和mRNA的表达情况。Western印迹结果显示(Fig 4A),模型组细胞NLRP3、caspase-1、IL-1β和IL-18蛋白的表达均较对照组明显升高,用不同浓度的芬戈莫德干预后,与模型组相比,1 nmol·L-1芬戈莫德可抑制NLRP3、caspase-1、IL-1β和IL-18蛋白的表达,10 nmol·L-1和100 nmol·L-1芬戈莫德可抑制各蛋白的表达。荧光实时定量PCR结果显示(Fig 4B),与对照组相比,模型组细胞中NLRP3、caspase-1、IL-1β和IL-18 mRNA的表达均升高; 而与模型组相比,1 nmol·L-1芬戈莫德可抑制NLRP3、caspase-1、IL-1β和IL-18 mRNA的表达,10 nmol·L-1和100 nmol·L-1芬戈莫德组有明显的抑制作用,组间比较差异有统计学意义(P < 0.05)。
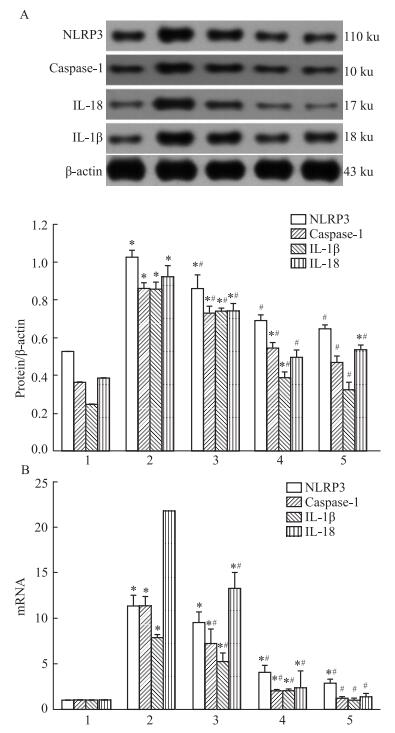
|
| Fig 4 In uence of fingolimod on expression of NLRP3, caspase-1, IL-1β, and IL-18 in HK-2 cells(x±s) A: Western blot; B:real-time PCR.1: Control; 2: Model; 3: Fingolimod 1 nmol·L-1; 4: Fingolimod 10 nmol·L-1; 5: Fingolimod 100 nmol·L-1. *P < 0.05 vs Control group; #P < 0.05 vs Model group. |
芬戈莫德是1995年日本Fujita教授从冬虫夏草(子囊菌亚门赤僵菌)培养液中提取并分离出的一种鞘氨醇样抗生素——多球壳菌素(又名嗜热菌杀酵母素),化学名:2-amino-2[-2-(4-octyophenyI)ethyI]-1, 3-propanedioI hydrochIoride; 分子式:C19H33NO2·HCl; 分子量:343.94道尔顿。芬戈莫德是一种新型免疫抑制剂,该制剂从结构和作用机制上不同于传统的免疫抑制剂,如他克莫司、环孢素以及雷帕霉素等[2]。芬戈莫德具有较强的免疫抑制作用,且毒副作用小,生物利用度高,并与常规免疫抑制剂具有协同作用,在2010年9月22日被美国食品药品监督管理局批准为自身免疫性疾病多发性硬化症的一线口服药物,其免疫抑制效果明显优于其他免疫抑制剂[3]。
芬戈莫德药理作用独特,目前研究认为其免疫抑制机制可能有3种:①“归巢”学说:芬戈莫德可能通过调节淋巴细胞的分化、迁移以及炎性因子的产生,使淋巴细胞归巢并“滞留”在淋巴结及肠道集合淋巴结等次级淋巴器官中,抑制淋巴组织内淋巴细胞的游出,从而减少外周血中淋巴细胞的数量[4]。芬戈莫德在发挥免疫抑制和免疫调控作用的同时并不影响淋巴细胞的激活和增殖,也不损害机体的免疫记忆功能和免疫应答[5]。②“细胞凋亡”学说:芬戈莫德可以诱导淋巴细胞的凋亡,可能与Bcl-2家族[6]、内质网释放Ca2+引起钙超载、Fas/FasL等有关[7],还有研究表明,芬戈莫德诱导的细胞凋亡与其抑制Akt-NF-κB信号,促进抗凋亡蛋白Mcl-1的蛋白酶体降解以及增加活性氧(reactive oxygen species,ROS)生成的能力有关[8]。③通过作用神经鞘氨醇-1-磷酸(Sphingosine-1-phosphate,S1P)抑制淋巴细胞外流:研究表明,芬戈莫德主要是通过拮抗S1P与淋巴细胞表面的S1P1受体,使淋巴细胞滞留在淋巴器官内,减少淋巴细胞外流而发挥相应的免疫抑制作用[9]。但到目前为止,上述作用机制并不能很好的解释芬戈莫德在体内的相关现象和全部作用机理,仍需寻找芬戈莫德的其他作用机制。
炎性体是机体固有免疫及应激系统的重要防御成分,其中NLRP3炎性体是目前研究最为深入且在多种细胞中表达的炎性体,各种内源性或外源性的刺激可通过不同的信号通路激活NLRP3炎性体,使caspase-1活化,引起IL-1β、IL-18等促炎细胞因子成熟分泌,进而促进炎症的发生[10],多种药物通过调节NLRP3炎性体激活而发挥抗炎等作用[11]。我们既往的体内实验研究表明,蛋白尿可导致肾小管上皮细胞NLRP3炎性体激活,IL-1β和IL-18水平升高,使间质内淋巴细胞及单核细胞浸润,最终导致慢性肾小管间质炎症和纤维化的发生,从而导致慢性肾脏病的进展[12]。在体外实验中,我们用高浓度BSA体外长时间刺激HK-2细胞后,发现白蛋白是通过刺激Cathepsin B释放和ROS生成这两种途径激活肾小管上皮细胞中的NLRP3炎性体[13]。因此NLRP3炎性体激活在肾小管间质炎症的发生、发展中起到重要作用,抑制NLRP3炎性体激活可以抑制肾小管间质炎症。
芬戈莫德在肾脏疾病研究领域中除了在肾移植中的免疫抑制作用研究较多外,在其他肾脏疾病中也有广泛研究,如芬戈莫德可改善5/6肾大部切除大鼠的炎症和纤维化程度[14],通过不同的机制对肾脏缺血/再灌注、肾小球肾炎及糖尿病肾病等动物模型均有肾脏保护作用,保护肾小管上皮细胞及足细胞避免凋亡、抗纤维化等作用,减缓肾缺血/再灌注损伤并发症等[15]。而Scheiblich等[16]在神经酰胺对小胶质细胞中NLRP3炎性体激活的研究中发现,芬戈莫德可以使脂多糖诱导的小胶质细胞中NLRP3炎性体激活后caspase-1和IL-1β的水平升高。但是本研究发现芬戈莫德可抑制蛋白负荷大鼠肾组织中NLRP3、caspase-1、IL-1β和IL-18的表达,从而改善大鼠肾脏炎症和纤维化的程度。这可能与芬戈莫德作为S1P受体调节剂,与存在不同细胞表面的5种S1P受体之间有不同的相互作用有关,尤其是神经细胞,芬戈莫德作为多发性硬化症的一线口服药物,对不同的神经细胞作用可能更为复杂,其机制目前尚未完全清楚。而我们的实验发现,对于白蛋白引起的肾小管间质的非免疫性炎症,芬戈莫德同样可发挥抗炎作用,而且与抑制肾小管上皮细胞中NLRP3炎性体激活有关。另外,本实验为了排除存在芬戈莫德对淋巴细胞的归巢、凋亡、抑制外流影响的可能,我们又设计了体外实验,在体外没有淋巴细胞的影响下,芬戈莫德同样可抑制白蛋白导致的肾小管上皮细胞中NLRP3炎性体的激活,使IL-1β和IL-18的表达减少,这提示芬戈莫德可能是通过抑制NLRP3炎性体激活而抑制炎症的发生和发展,这可能是芬戈莫德发挥抗炎的另一个作用机制。
总之,本研究发现芬戈莫德可抑制肾小管上皮细胞NLRP3炎性体激活,从而减轻肾小管间质炎症和纤维化。虽然芬戈莫德抗炎免疫作用的具体机制目前仍不明确,本实验表明芬戈莫德可能通过抑制肾小管上皮细胞NLRP3炎性体激活而发挥作用,这为芬戈莫德作为抗炎免疫药物在肾脏疾病的治疗中发挥作用提供了新的思路和实验证据。
| [1] |
Fujita T, Inoue K, Yamamoto S, et al. Fungal metabolites. Part 11. A potent immunosuppressive activity found in Isaria sinclairii metabolite[J]. J Antibiot (Tokyo, 1994, 47(2): 208-15. doi:10.7164/antibiotics.47.208 |
| [2] |
Kiuchi M, Adachi K, Kohara T, et al. Synthesis and immunosuppressive activity of 2-substituted 2-aminopropane-1, 3-diols and 2-aminoethanols[J]. J Med Chem, 2000, 43(15): 2946-61. doi:10.1021/jm000173z |
| [3] |
Brinkmann V, Billich A, Baumruker T, et al. Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis[J]. Nat Rev Drug Discov, 2010, 9(11): 883-97. doi:10.1038/nrd3248 |
| [4] |
Luo Z J, Tanaka T, Kimura F, et al. Analysis of the mode of action of a novel immunosuppressant FTY720 in mice[J]. Immunopharmacology, 1999, 41(3): 199-207. |
| [5] |
郭敦明, 谈文峰, 张缪佳, 等. 新型免疫抑制剂FTY720对大鼠胶原诱导性关节炎的抑制作用[J]. 中国药理学通报, 2010, 26(10): 1280-5. Guo D M, Tan W F, Zhang M J, et al. Inhibition of development of collagen-induced arthritis in rats by a novel immunosuppressant FTY720[J]. Chin Pharmacol Bull, 2010, 26(10): 1280-5. |
| [6] |
Nagahara Y, Ikekita M, Shinomiya T. T cell selective apoptosis by a novel immunosuppressant, FTY720, is closely regulated with Bcl-2[J]. Br J Pharmacol, 2002, 137(7): 953-62. doi:10.1038/sj.bjp.0704970 |
| [7] |
Takasaki T, Hagihara K, Satoh R, et al. More than just an immunosuppressant: the emerging role of FTY720 as a novel inducer of ROS and apoptosis[J]. Oxid Med Cell Longev, 2018, 2018: 4397159. |
| [8] |
Bai L Y, Chiu C F, Chiu S J, et al. FTY720 induces autophagy-associated apoptosis in human oral squamous carcinoma cells, in part, through a reactive oxygen species/Mcl-1-dependent mechanism[J]. Sci Rep, 2017, 7(1): 5600. |
| [9] |
Sim-Selley L J, Wilkerson J L, Burston J J, et al. Differential tolerance to FTY720-induced antinociception in acute thermal and nerve injury mouse pain models: role of sphingosine-1-phosphate receptor adaptation[J]. J Pharmacol Exp Ther, 2018, 366(3): 509-18. doi:10.1124/jpet.118.248260 |
| [10] |
Jo E K, Kim J K, Shin D M, et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J]. Cell Mol Immunol, 2016, 13(2): 148-59. |
| [11] |
方晨, 梅咏玉, 王晶, 等. 消退素D1抑制NLRP3信号通路对DSS结肠炎小鼠的影响[J]. 中国药理学通报, 2019, 35(4): 580-5. Fang C, Mei Y Y, Wang J, et al. Resolvin D1 mitigates inflammatory response in DSS-induced colitis miceby inhibiting NLRP3 inflammasome activation[J]. Chin Pharmacol Bull, 2019, 35(4): 580-5. doi:10.3969/j.issn.1001-1978.2019.04.027 |
| [12] |
丁丽红, 刘丹, 徐敏, 等. 蛋白负荷大鼠肾脏热蛋白结构域相关蛋白3炎性体的表达[J]. 中华肾脏病杂志, 2014, 30(9): 689-94. Ding L H, Liu D, Xu M, et al. Expression of NLRP3 inflammasome in the BSA-overloaded rats kidney[J]. Chin J Nephrol, 2014, 30(9): 689-94. doi:10.3760/cma.j.issn.1001-7097.2014.09.009 |
| [13] |
丁丽红, 吕林莉, 王德光, 等. 白蛋白导致肾小管上皮细胞NLRP3炎性体激活的机制分析[J]. 临床与实验病理学杂志, 2017, 33(12): 1341-5. Ding L H, Lyu L L, Wang D G, et al. Mechanism of NLRP3 inflammasome activation caused by albumin in renal tubulointerstitial cells[J]. J Clin Exp Pathol, 2017, 33(12): 1341-5. |
| [14] |
Ni H F, Chen J F, Pan M M, et al. FTY720 prevents progression of renal fibrosis by inhibiting renal microvasculature endothelial dysfunction in a rat model of chronic kidney disease[J]. J Mol Histol, 2013, 44(6): 693-703. |
| [15] |
Foster AD, Vicente D, Clark N, et al. FTY720 effects on inflammation and liver damage in a rat model of renal ischemia-reperfusion injury[J]. Mediators Inflamm, 2019, 2019: 3496836. |
| [16] |
Scheiblich H, Schlutter A, Golenbock D T, et al. Activation of the NLRP3 inflammasome in microglia: the role of ceramide[J]. J Neurochem, 2017, 143(5): 534-50. doi:10.1111/jnc.14225 |

