

2. 北京中医药大学北京中医药研究院,北京 100029
2. Beijing Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
诃子为使君子科植物诃子(Terminalia chebula Retz.)或绒毛诃子(Terminalia chebula Retz. var. tomentella Kurt.)的干燥成熟果实[1],是蒙药、藏药等民族药的常用药,在藏药中的地位,类似于甘草在中药中地位,其在藏药中有“藏药之王”的美称。诃子药性温和,属收涩药,有涩肠止泻、敛肺止咳、降火利咽的功效,临床上用于治疗脱肛、肺虚咳喘、咽喉肿痛,也是治疗失音之要药;现代研究对诃子的药理学作用多有涉及,但毒性学研究却鲜有报道。课题组前期通过动物实验,确定绒毛诃子的肝毒性,通过小鼠急性毒性实验得出,绒毛诃子水煎液的半数致死量(median lethal dose,LD50)LD50为18.926 g生药·kg-1BW,绒毛诃子水煎液的LD50是70 kg人最大日用量的147.8倍。综合分析血清生化与病理等指标,绒毛诃子的急性毒性与蓄积毒性的作用靶器官为肝脏。为了保障中药的临床安全用药,迫切需要明确诃子致肝毒性的物质基础,因此,采用一种高效、快速、灵敏度高、特异性强的体外细胞毒性检测方法对于药物早期筛选及上市后药物安全性再评价都具有重要意义。
高内涵分析技术(high content screening,HCS)拥有自动定量细胞成像系统(thermo scientific toxInsight IVT平台),荧光试剂标记特定的靶点,优化的分析和成像方案被广泛应用于中药复杂的毒性成分和活性成分筛选及药物潜在毒性筛选。利用荧光染液对相应靶点的特异性染色,用高内涵细胞成像分析平台和药物性肝伤分析平台联合考察4种单体成分对人源肝癌细胞HepG2的毒性作用,可以筛选出绒毛诃子中的单体对细胞形态、复制、周期、转录、翻译、凋亡等方面的影响[2]。本实验通过用人源肝癌细胞HepG2进行高内涵肝毒性筛选试验,因为HepG2细胞背景清晰,表型、性状稳定,来源于人肝胚细胞瘤,分化程度较高,其所含的生物转化代谢酶活性稳定且与人体寻常肝细胞同根同源。肖珠[3]用HepG2细胞和人正常肝细胞L02细胞进行高内涵肝毒性的方法学考察,对其结果进行综合统计分析,发现当HepG2细胞数量是2×105个/mL,是较合适的肝脏毒性筛选模型。
高内涵分析技术主要通过分析图像中各个指标的荧光强度,从而检测细胞核的形态和数目、核酸是否有损伤、DNA含量的变化、谷胱甘肽(glutathione,GSH)水平降低的变化、细胞内钙离子的浓度、活性氧簇(reactive oxygen species,ROS)含量、线粒体膜电位(mitochondrial membrane potential,MMP)指标等有关指标,并且根据阴性药阿司匹林的反应值确定毒性阈值。通过比对受试药反应值与毒性阈值的关系,确定其肝毒性风险[2-5]。
1 材料与方法 1.1 材料 1.1.1 细胞人肝癌细胞系HepG2细胞,置于北京药检所药理室实验室细胞库(-196 ℃)保存, 购自中国细胞库(上海)。
1.1.2 药物与试剂没食子酸(批号:PRF9012344);苯甲酸(批号:PRF9112842);莽草酸(批号:PRF9112843);1, 2, 3, 4, 6-O-五没食子酰葡萄糖(批号:PRF9101104);噻氯吡啶(ticlopidine,批号:101296953,Sigma公司),阴性对照阿司匹林(aspirin,批号:00209,Dr. Ehrenstorfer GmbH公司);Ⅰ型胶原蛋白包被的96孔细胞培养板(BD BioCoatTM Plate Product N0.354407,批号34217010);DMEM(dulbecco′s modified eagle media)培养基(批号:1719980,Gibco公司);标准胎牛血清(批号:1739464,Gibco公司);青链霉素(批号:1780186,Gibco公司);胰蛋白酶(批号:1742078,Amresco公司);DMSO(批号:19947100813,默克股份有限公司);PBS缓冲液(批号:20190629);0.4%台盼蓝溶液(批号:1189952,Invitrogen公司);95%乙醇试剂(山东利尔康医疗科技股份有限公司)。MitoTrackerTM Orange CMTMRos-Special Packaging Reduced rosamine MitoTraacher probes(批号:1985376);CellROXTM Green Reagent,for oxidative stress detection(批号:2018177);Hoechst 33342 Trihydrochloride(批号:2048155);Thiol-Reactive Probes Reactive dye(lyophilized solids)(批号:211582)。
1.1.3 主要仪器Thermso Scientific Cellomics,(美国);NSF-1389-A2生物安全柜;Olympus 1 X71生物显微镜;Thermo 311 CO2培养箱;Invitrogen全自动细胞计数仪;SN510C立式压力蒸汽灭菌器。
1.1.4 对照品溶液及工作曲线的制备在无菌环境中配制,根据Thermo Scientific Toxlnsight Drug Induced Liver Injury Assay的指导手册中推荐的对照品加样浓度,阴性对照阿司匹林的最大血药浓度(Cmax)为0.995 mg·L-1,阳性对照品噻氯吡啶的Cmax为2.13 mg·L-1,用不含血清的DMEM培养基将对照品配成200、100、50、25、12.5、6.25、3.12、1.56 Cmax共8个浓度。
1.1.5 供试品的配制取没食子酸(t1),苯甲酸(t2),莽草酸(t3),1, 2, 3, 4, 6-O-五没食子酰葡萄糖(t4),在无菌EP管内,用不含血清的DMEM培养基配制成500、125、62.5、31.25、15.62、7.81、3.91 mg·L-1共8个浓度的待测物溶液。
1.2 方法 1.2.1 HepG2细胞的复苏与传代培养将储存在实验室细胞库(-196 ℃)的HepG2细胞,迅速取出,放入提前保温的37 ℃水浴锅中,注意水位线,避免液面污染。将融化的细胞冻存液将其移入15 mL灭菌离心管中,加入37 ℃ 10 mL的DMEM完全培养基(15%的胎牛血清(FBS,V/V),100 U·mL-1的青链霉素),700 r·min-1离心9 min,吸出上清,加入5 mL完全培养基,吹打均匀,接种于细胞培养瓶中。细胞每隔3 d进行一次1 : 3的传代,传代时,弃掉原培养液,再用PBS缓冲溶液冲洗2次后,加入0.25%胰酶2 mL消化约30 s,弃去胰酶,放入培养箱中继续消化约3 min,观察细胞是否脱离培养瓶壁,之后加入2~3 mL的DMEM完全培养基进行吹打,在倒置显微镜下观察细胞相互分散,吹打均匀。再将细胞混悬液分装至若干个细胞培养瓶中,加入5~8 mL的DMEM完全培养基,轻轻吹打均匀,在37 ℃,5% CO2的培养箱中培养。
1.2.2 细胞铺板与加样在倒置显微镜下观察,将处于对数增长期的HepG2细胞,弃去原培养液,用PBS洗2~3次,吸取残留的PBS,加入0.25%胰酶2 mL消化30 s,弃去胰酶,放在37 ℃,5% CO2的环境中继续让胰酶反应约3 min。加入2~3 mL的DMEM完全培养基进行吹打,使细胞均匀分散开。取吹打均匀的10 μL细胞混悬液,加入10 μL 0.4%台盼蓝溶液混匀,取混合均匀的混合液10 μL加入到计数板中,经全自动细胞计数仪计数后。用DMEM细胞培养基调整细胞浓度为2×105个/mL, 以100 μL/孔接种到I型胶原蛋白包被的96孔板中,在37 ℃,5% CO2条件下培养24 h。24 h后,将I型胶原蛋白包被的96孔板弃去原培养液,每孔分别加入含有不同浓度的不同药物(没食子酸,苯甲酸,莽草酸,1, 2, 3, 4, 6-O-五没食子酰葡萄糖)。横向设置3个平行孔为同一浓度,每个药物的最大浓度为500 mg·L-1,依次倍比稀释,最低给药浓度为3.91 mg·L-1。实验设置阴性对照阿司匹林、阳性对照噻氯吡啶和溶媒对照,设置8个浓度。加样结束后,将96孔板在37 ℃,5% CO2条件下,培养24 h。
1.2.3 染色按试剂盒说明书的要求,药物加入细胞24 h后,取出I型胶原蛋白包被的96孔板,弃去原药液,之后将避光放置的染液,以100 μL/孔避光加入到培养板内,37 ℃条件下孵育45 min。45 min后,将I型胶原蛋白包被的96孔板内染液小心吸去(不要接触板孔内壁),再加入放置室温的PBS缓冲溶液,吸出,最后每孔中加入100 μL PBS,即可上机检测。
1.2.4 ToxInsight IVT平台成像与分析与预测在ToxInsight IVT平台上自动获取荧光标记的细胞的图像,以检测不同的荧光标记的细胞靶点,然后通过Cellomics Compartmental Analysis BioApplication进行存储和自动分析。采用ToxInsight IVT平台的采集图像。
第一通道通过测量图像中的细胞数量来计算细胞密度和细胞损失。通过用DNA染色测量每个细胞核区域中DNA探针(Hoechst 33342)的总整合荧光强度来监测核DNA含量。第二通道GSH水平的降低是通过利用细胞可渗透的还原型荧光谷胱甘肽指示剂对细胞质区域中的总荧光强度进行积分测定。第三通道通过对每个细胞核区域中由荧光ROS染料染色产生的总荧光强度进行积分,可以对ROS水平进行定量。第四通道用对线粒体膜电位变化敏感的探针,并通过测量该探针在核和细胞质区域之间的积分荧光强度差异,检测MMP变化。
对采集的图像进行分析,将获得的定量多参数细胞靶数据导入到ToxInsight DILI检测分析模板,以确定目标化合物是否具有肝毒性,并根据其多参数反应的强度对其进行排名,通过检测样品对结构和功能完整细胞的生长、凋亡、形态及代谢的影响,从而确定化合物的潜在毒性及相关药物的生物活性[5]。
2 结果 2.1 阴性对照阈值的确定如Fig 1和Fig 2所示,阳性药噻氯吡啶5个指标检测结果均为阳性,随着浓度的一系列变化,5个指标都超出其安全阈值范围。结果表明阳性药噻氯吡啶对HepG2细胞增殖有抑制作用,具有明显的肝毒性风险。如Fig 1所示,阴性药阿司匹林随着浓度变化,5个指标检测结果均为阴性。表明阿司匹林对HepG2细胞在细胞数目、DNA含量、GSH降低水平、ROS含量及MMP改变5个指标均在安全阈值范围内,阿司匹林对HepG2细胞无毒性作用,无肝毒性风险。这两个药物的结果与其前期文献报道相一致,因此表明本实验所采用的方法及操作准确。
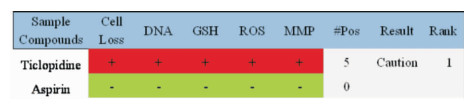
|
| Fig 1 Results of liver toxicity analysis of aspirin and ticlopidine (n=3) |
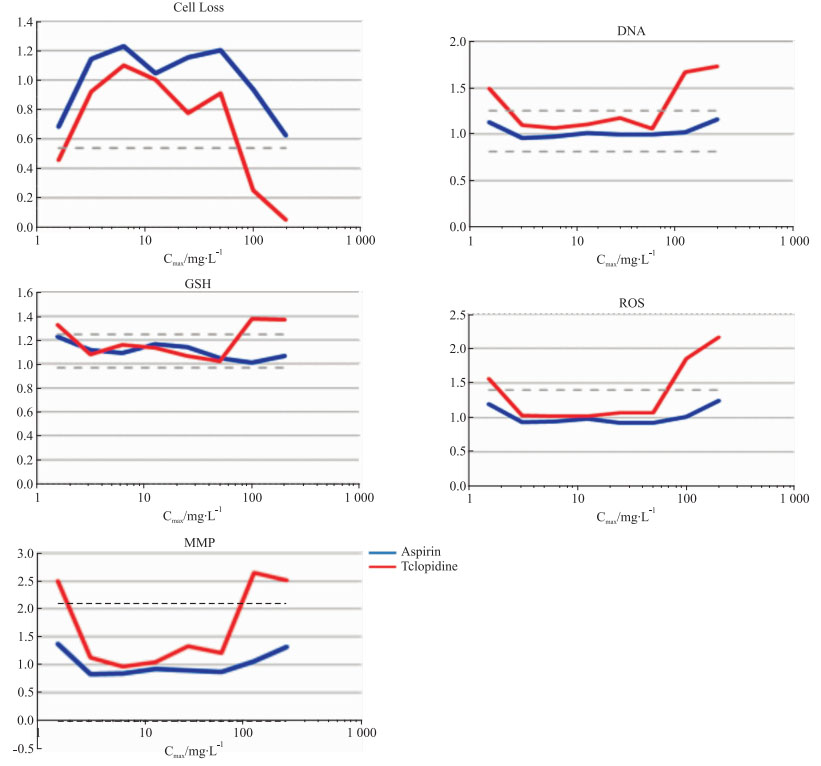
|
| Fig 2 Influence of aspirin and ticlopidine on cell number, DNA number, GSH levels, ROS content, and MMP of HepG2 cells (n=3) |
如Fig 3所示,没食子酸有4个指标检测结果为阳性,在Fig 4中,①第一通道细胞核内的荧光数目反映了HepG2细胞数目的变化,细胞数目只有下限阈值。②第一通道细胞核内的荧光强度反映了HepG2细胞核中DNA含量的变化,没食子酸和噻氯吡啶与阴性对照阿司匹林相比,数量有明显差异,细胞数量减少,细胞出现皱缩,发生细胞凋亡。③第二通道细胞质中的荧光强度反映了GSH降低水平, 1, 2, 3, 4, 6-O-五没食子酰葡萄糖与阴性对照阿司匹林相比,可以看到荧光强度减弱,GSH含量降低明显。④第三通道细胞中的荧光强度反映了ROS含量的变化,ROS只有上限阈值,没食子酸的第三通道荧光强度与阿司匹林相比,明显变弱。⑤第四通道细胞质与细胞核中的荧光强度的差值反映了线粒体膜电位的变化[6]。
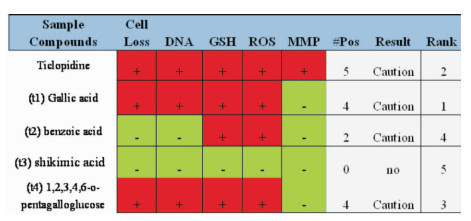
|
| Fig 3 Sample high-content hepatotoxicity risk assessment (n=3) |
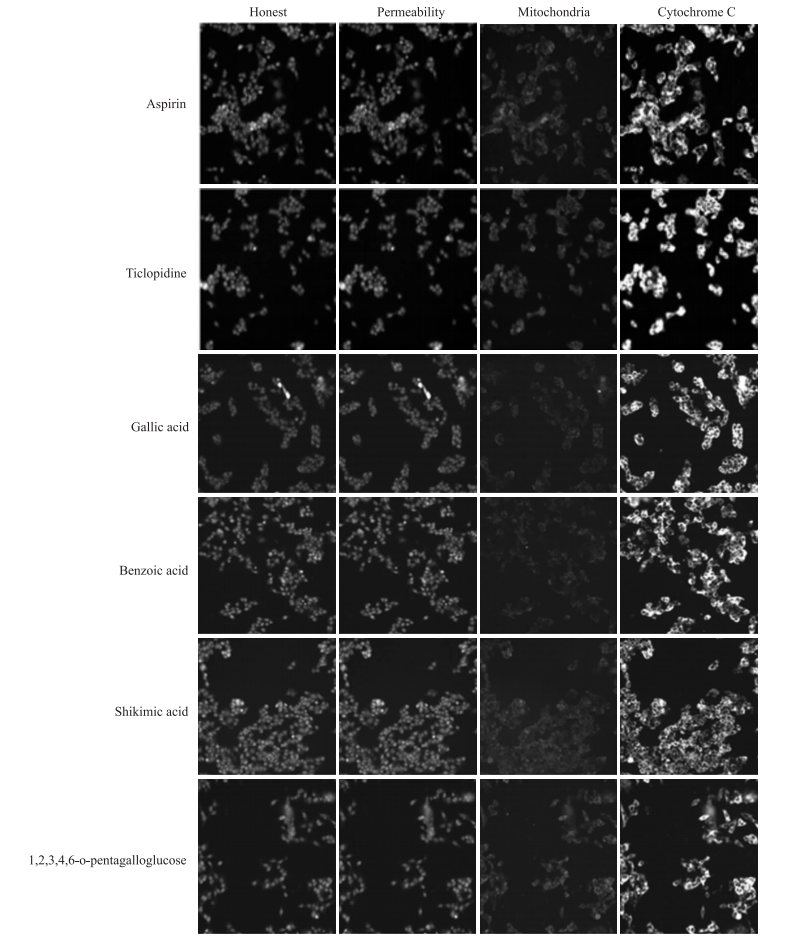
|
| Fig 4 Representative images of drugs obtained at different wave length by HCS assay (×20) |
如Fig 5和Fig 6所示,没食子酸在30 mg·L-1的给药浓度下,DNA含量和细胞数量在安全阈值范围内,当给药浓度超过30 mg·L-1时,DNA含量下降,细胞出现凋亡,数量明显减少,当浓度达到30 mg·L-1时,细胞数量减少至安全阈值以下。当没食子酸的给药浓度62.5 mg·L-1以上,对GSH降低水平、ROS含量的影响较大,偏离其安全阈值。如Fig 7和Fig 8所示。
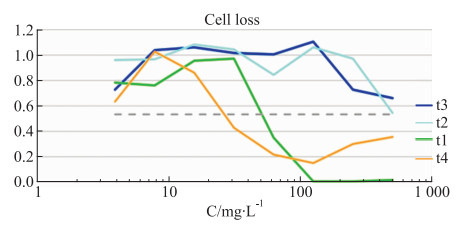
|
| Fig 5 Dose-effect curve of different concentrations of shikimic acid(t1), benzoic acid(t2), gallic acid(t3), 1, 2, 3, 4, 6-o-pentagalloglucose(t4) on number of cells (n=3) |

|
| Fig 6 Dose-effect curve of different concentrations of shikimic acid(t1), benzoic acid(t2), gallic acid(t3), 1, 2, 3, 4, 6-o-pentagalloglucose(t4)on DNA content (n=3) |
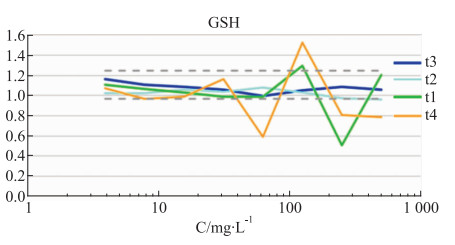
|
| Fig 7 Dose-effect curve of different concentrations of shikimic acid(t1), benzoic acid(t2), gallic acid(t3), 1, 2, 3, 4, 6-o-pentagalloglucose(t4)on GSH level (n=3) |
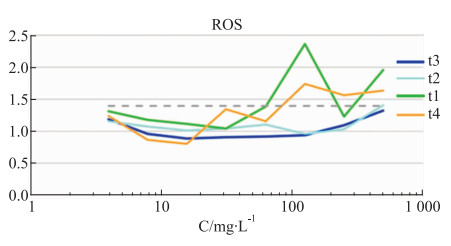
|
| Fig 8 Dose-effect curve of different concentrations of shikimic acid(t1), benzoic acid(t2), gallic acid(t3), 1, 2, 3, 4, 6-o-pentagalloglucose(t4) on ROS content (n=3) |
苯甲酸随着给药浓度的增加,对HepG2细胞在细胞数目、DNA含量和MMP变化等指标上,均未超出安全阈值范围,随着给药剂量浓度增加到100 mg·L-1时,GSH降低水平触及阈值,随着剂量增加,GSH含量保持平稳接近下限阈值。随着剂量增加至500 mg·L-1,ROS呈现上升趋势,超出其安全阈值。
2.2.3 1, 2, 3, 4, 6-O-五没食子酰葡萄糖高内涵分析结果1, 2, 3, 4, 6-O-五没食子酰葡萄糖在10 mg·L-1的给药浓度下,细胞数量呈上升趋势,随着给药浓度增加,DNA含量急剧变化,对细胞数量影响较大,细胞呈快速下降趋势。1, 2, 3, 4, 6-O-五没食子酰葡萄糖在10~500 mg·L-1的给药浓度下,随着剂量增加,DNA含量、GSH含量和ROS含量如Fig 6、Fig 7和Fig 8所示,成折线变化。
2.2.4 莽草酸高内涵分析结果在一系列浓度的变化下,莽草酸在MMP变化、细胞数目、DNA含量、GSH降低水平和ROS含量均呈阴性,表明对HepG2细胞无毒性作用,如Fig 5~9所示。
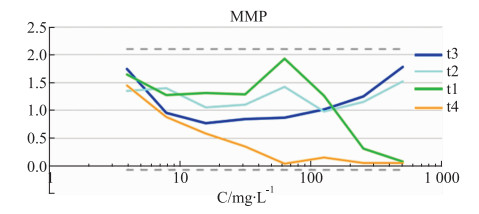
|
| Fig 9 Dose-effect curve of different concentrations of shikimic acid(t1), benzoic acid(t2), gallic acid(t3), 1, 2, 3, 4, 6-o-pentagalloglucose(t4) on MMP (n=3) |
通过高内涵筛选技术分析绒毛诃子中单体成分对HepG2细胞的毒性作用,结果显示,没食子酸致肝毒风险最高,而后由高到低依次为1, 2, 3, 4, 6-O-五没食子酰葡萄糖、苯甲酸、莽草酸,莽草酸显示无肝毒性风险。没食子酸的MMP指标呈现阴性结果,其他指标都偏离安全阈值呈现阳性结果,且其肝毒性风险超过了阳性对照药物噻氯吡啶。鞣质作为一类结构复杂的多元酚类化合物,可对肝脏造成严重的毒性损害,而诃子中鞣质的含量约为32%~34%,由此推测归于鞣质的没食子酸是绒毛诃子致肝毒的主要成分。实验结果表明30 mg·L-1为没食子酸致肝损伤的临界浓度,在30 mg·L-1的浓度以下无致肝毒风险。通过HCS分析结果可得,给药浓度在10 mg·L-1以下,各单体的各个指标的量效曲线都在安全阈值内。
当没食子酸的给药浓度达到100 mg·L-1时,其GSH含量成折线急剧变化,GSH是由甘氨酸、谷氨酸以及半胱氨酸组成的三肽类化合物,发挥抗氧化和解毒的作用,在应激状态下保护肝脏避免氧化损害,随着GSH含量的变化,ROS含量也随着变化,当ROS过量时,易攻击线粒体,当线粒体受损时,引发ROS过量生成,造成恶性循环[7, 8]。
查阅相关文献及古籍,绒毛诃子并无毒性记载。在实验过程中,课题组发现诃子的毒性,并对其毒性靶器官及毒性特点进行进一步研究。通过用HCS分析技术来预测受试物的肝毒性已经非常成熟,无论是成分复杂,多靶点多效应的中药注射液还是新药的研发阶段,HCS分析技术用于不仅可以预测其受试物的肝毒性,还可以阐明与多个指标(细胞数目,DNA含量,降低GSH水平,诱导ROS过度产生及改变MMP)之间的联系,从而确定化合物的潜在毒性及相关药物的生物活性,可用于大规模药物筛选[8-10]。
( 致谢: 本实验在北京市药品检验所药理毒理科室实验室完成,感谢药理毒理室各位老师和同学对实验的指导和帮助 )
| [1] |
中华人民共和国卫生部药典委员会.中华人民共和国药典: 一部[S].北京: 化学工业出版社2005: 129. The Pharmacopoeia Committee of the Ministry of Health of the People′s Republic of China. The Pharmacopoeia of the People′s Republic of China: a[S].Beijing: Chem Ind Press, 2005: 129. |
| [2] |
高阳, 胡宇驰, 左泽平, 等. 应用高内涵分析技术进行药物肝毒性风险评估的研究[J]. 药学研究, 2015, 34(12): 688-91, 702. Gao Y, Hu Y H, Zuo Z P, et al. Study on risk assessment of drug liver toxicity using high content analysis technology[J]. J Pharm Res, 2015, 34(12): 688-91, 702. |
| [3] |
肖珠.高内涵肝毒筛选的方法学考察及在中药注射液中的应用[D].北京: 北京中医药大学, 2017. Xiao Z. Methodological investigation of high content liver toxicity screening and its application in traditional Chinese medicine injection[D]. Beijing: Beijing Univ Tradit Chin Med, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10026-1017162267.htm |
| [4] |
Pfundstein B, El Desouky S K, Hull W E, et al. Polyphenolic compounds in the fruits of Egyptian medicinal plants(Terminalia bellerica, Terminaliachebula and Terminalia horrida)characterization, quantitation and determination of antioxidant capacities[J]. Phytochemistry, 2010, 71(10): 1132. doi:10.1016/j.phytochem.2010.03.018 |
| [5] |
吴宇.药物性肝损伤体外筛选模型和何首乌致肝损伤的初步研究[D].北京: 北京协和医学院, 2016. Wu Y. In vitro screening model of drug-induced liver injury and preliminary study on liver injury caused by Polygonum multiflorum[D]. Beijing: Peking Union Medical College, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10023-1016236177.htm |
| [6] |
金家金.诃子肝毒性研究及高内涵肝毒性筛选方法的初探[D].北京: 北京中医药大学, 2015. Jin J J. Preliminary study on hepatotoxicity of Gardenia jasminoides and screening methods for high content hepatotoxicity[D]. Beijing: Beijing Univ Tradit Chin Med, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10026-1015390096.htm |
| [7] |
富欣, 潘晓靓, 李华, 等. 体外评价马兜铃酸对HepG2细胞线粒体功能的影响[J]. 世界临床药物, 2015, 36(4): 236-42. Fu X, Pan X L, Li H, et al. Evaluation of the effect of aristolochic acid on mitochondrial function of HepG2 cells in vitro[J]. World Clin Drugs, 2015, 36(4): 236-42. |
| [8] |
任艳青, 田宇柔, 李琛, 等. 京尼平苷及其体内代谢产物京尼平对HepG2细胞毒性的比较及机制研究[J]. 中国药理学通报, 2016, 32(12): 1755-61. Ren Y Q, Tian Y R, Li C, et al. Comparison and mechanism of genipin and its metabolite genipin on HepG2 cells[J]. Chin Pharmacol Bull, 2016, 32(12): 1755-61. doi:10.3969/j.issn.1001-1978.2016.12.023 |
| [9] |
王立娜, 郑虎占, 王志斌, 等. 应用蛋白质组学技术探讨诃子醇提物诱导小鼠肝毒性机制[J]. 中华中医药杂志, 2016, 31(4): 1475-8. Wang L N, Zheng H Z, Wang Z B, et al. Application of proteomics to explore the mechanism of liver toxicity induced by gardenia alcohol extracts in mice[J]. Chin J Trad Chin Med Pharm, 2016, 31(4): 1475-8. |
| [10] |
程源, 王志斌, 金家金, 等. 以诃子为研究对象建立高内涵肝毒性分析方法与验证[J]. 中华中医药杂志, 2016, 31(3): 1077-80. Cheng Y, Wang Z B, Jin J J, et al. Establishing a high-content hepatotoxicity analysis method and verification using Xunzi as the research object[J]. Chin J Trad Chin Med Pharm, 2016, 31(3): 1077-80. |

