

2. 华中科技大学 生命科学与技术学院,湖北 武汉 430074
2. College of Life Science & Technology, Huazhong University of Science and Technology, Wuhan 430074, China
乳腺增生是一种临床常见的乳腺良性病变,作为女性乳腺疾病的高发疾病,近年来发病龄逐渐年轻化,发病率逐年升高[1]。该病发展过程遵循“正常组织-单纯性增生(轻、中、重度)-非典型性增生-原位癌-浸润性癌”的规律[2]。且研究发现,乳腺增生症与乳腺癌的发生具有相关性[3]。在乳腺癌发病每年近百万患者的情形下[4],对乳腺增生患者进行及时、有效的诊断与治疗具有重要临床意义。
西黄丸又名犀黄丸,出自清代名医王洪绪所著《外科证治全生集·卷四》[5], 作为现代临床治疗乳腺癌的常用药之一。课题组前期基于下丘脑-垂体-卵巢轴对西黄丸进行了在体动物实验研究,发现西黄丸具有抗乳腺增生作用[6]。通过对轴上FSH、LH等激素及GPR54、GnRHR等受体的调节作用来实现,但并未说明西黄丸对乳腺组织是否有直接干预作用。叶媚娜等[7]研究发现,体外培养的原代正常人乳腺上皮细胞仍具有体内细胞的二倍体遗传特性,在体外联合应用雌二醇和孕酮可以促进其增殖。因此,本实验通过联合应用E2和P促进乳腺上皮细胞增殖,拟构建体内乳腺组织良性增生模型,于体外进行西黄丸抗乳腺增生研究,为西黄丸治疗乳腺增生提供理论依据。
1 材料与方法 1.1 实验动物与细胞 1.1.1 动物SD大鼠,♀,未孕50只(SPF级),体质量(200±20)g,购自甘肃中医药大学实验动物中心,生产许可证号:SCXK(甘)2015-0002。
1.1.2 细胞大鼠乳腺上皮细胞,购自赛佰康生物技术有限公司,并进行免疫荧光鉴定。将细胞接种于DMEM培养基上,于5%CO2、37 ℃培养箱中培养。
1.1.3 药品与试剂西黄丸,批号:11020073,北京同仁堂科技发展股份有限公司制药厂,规格:每20丸重1 g;枸橼酸他莫昔芬片,批号:31021545,扬子江药业集团有限公司,规格:每片10 mg;黄体酮注射液,批号:131003,浙江仙琚制药股份有限公司,规格1 mL含黄体酮20 mg; 苯甲酸雌二醇注射液,批号:090801,上海通用药业股份有限公司,规格:每1mL含雌二醇2 mg。Annexin V-FITC/PI凋亡检测试剂盒,购于BD公司,批号:556547;SP检测试剂盒,购于索莱宝公司,批号:SP0041。
1.1.4 仪器CO2培养箱,Thermo公司,型号:311;电子显微镜,日立公司,型号:HT7700;IMS图像分析系统,凝胶成像仪,Azure biosystems公司,型号:C300;电泳仪,北京六一生物科技有限公司,型号:DYCZ-24DN;Benchmark Plus酶标仪,美国伯腾仪器有限公司产品。
1.2 实验方法 1.2.1 动物分组及给药按随机数字表法将大鼠分为5组,即空白组、对照组(他莫昔芬)、西黄丸高、中、低剂量组,每组10只。空白组灌胃等体积蒸馏水,对照组给予每日1.8 mg·kg-1他莫昔芬灌胃,西黄丸高、中、低剂量组分别给予每日2.16,1.08,0.54 g·kg-1西黄丸灌胃,连续7 d[8]。
1.2.2 西黄丸含药血清制备末次灌胃后1h(灌胃前禁食12 h),10%水合氯醛(0.3 mL/100g)腹腔注射麻醉,腹主动脉采血,4 ℃离心,无菌分离血清,0.22 μm微孔滤膜滤过,置-80 ℃保存备用。
1.2.3 细胞分组及给药大鼠乳腺上皮细胞的培养方法:取大鼠乳腺组织,物理剪碎法结合胰蛋白酶消化法处理组织,待消化后,加入混合培养液,培养液为89%DMEM培养基+1%青链霉素混合液+10%大鼠血清,前两天每24 h换液一次,之后每隔1 d换液1次[7]。
将大鼠乳腺上皮细胞分为①空白组:乳腺上皮细胞+10%空白组血清;②增殖组:乳腺上皮细胞+E2、P干预+10%空白组血清;③西黄丸高剂量组:乳腺上皮细胞+ E2、P干预+10%西黄丸高剂量组血清;④西黄丸中剂量组:乳腺上皮细胞+ E2、P干预+10%西黄丸中剂量组血清;⑤西黄丸低剂量组:乳腺上皮细胞+ E2、P干预+10%西黄丸低剂量组血清;⑥他莫昔芬组:乳腺上皮细胞+ E2、P干预+10%对照组血清。
1.2.4 免疫荧光鉴定原代培养的乳腺上皮细胞细胞爬片,固定,封闭,一抗孵育,二抗孵育,滴加一滴Fluoromount-G荧光封片剂,包埋。
1.2.5 CCK-8法检测大鼠乳腺上皮细胞增殖最佳培养浓度用无水乙醇将E2、P、E2+P配制成1 g·L-1的母液,之后用生长培养基分别稀释成0.1、10-2、10-3、10-4、10-5 g·L-1 5种浓度[6]。以无水乙醇与生长培养基作为空白组,以加入等量无水乙醇与生长培养基的大鼠乳腺上皮细胞为对照组,每组设5个复孔,采用CCK-8法检测各浓度药物培养液下各组乳腺上皮细胞增殖情况,得到其增殖最佳浓度药物培养液为E2+P混合培养液(浓度为0.1 g·L-1)。
1.2.6 CCK-8法检测给予西黄丸后大鼠乳腺上皮细胞的存活率采用CCK-8法检测给予西黄丸后各组乳腺上皮细胞于第24 h、48 h、72 h的存活率。细胞存活率/%=(实验组/增殖组-1)×100%
1.2.7 Giemsa染色法进行西黄丸干预后大鼠乳腺上皮形态学观察取各组对数生长期的细胞,细胞爬片,滴加瑞式-吉姆萨染液2~3滴覆盖整个标本,2 min后滴加等量pH 6.4的磷酸缓冲液,充分混匀,水洗、吸干、镜检。
1.2.8 流式细胞仪检测给予西黄丸后大鼠乳腺上皮凋亡率收集大鼠乳腺上皮细胞,PBS洗涤,冰预冷的70%乙醇固定,将细胞重悬于200 μL binging buffer,400目筛网过滤离心,染色,按照Annexin V-FITC/PI试剂盒严格操作,于流式细胞仪上进行检测,使用CYEXPERT分析软件进行结果分析。
1.2.9 免疫组化法检测给予西黄丸后大鼠乳腺上皮细胞凋亡因子表达采用SP试剂盒进行检测,细胞爬片固定后,PBS漂洗两次,加入0.5%Triton X-100室温孵育20 min,PBS漂洗两次,加入3%H2O2处理15 min,PBS漂洗。吸去上清液,血清室温封闭20 min,一抗、二抗孵育,DAB显色,蒸馏水洗涤终止反应,苏木素复染,封片,显微镜观察[8]。
1.2.10 蛋白免疫印迹技术测定蛋白表达Western blot法测定乳腺上皮细胞雌二醇受体α(estradiol receptorα,ER-α)、雌二醇受体β(estradiol receptor β,ER-β)、孕激素受体(progesterone receptor,PR)蛋白表达水平。待细胞密度生长至80%,提取细胞蛋白,绘制标准曲线进行蛋白定量。制胶,室温下电泳,将蛋白分离并转至PVDF膜上,5%脱脂奶粉进行膜的封闭,抗体孵育,ECL显色,拍照,ImageJ软件分析。
1.3 统计学方法采用SPSS 25.0软件进行统计学分析,计量资料采用x±s表示,用One-way ANOVA进行组间比较。方差齐性用LSD法进行多重比较;方差不齐用Tamhane’s T2进行多重比较。
2 结果 2.1 原代培养正常大鼠乳腺上皮细胞的鉴定结果如下图所示,均为阴性表达,经免疫荧光鉴定,细胞为原代大鼠乳腺上皮细胞,纯度达到90%以上。
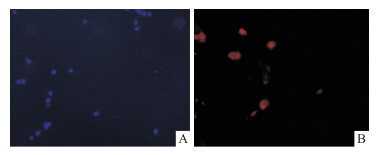
|
| Fig 1 Immunofluorescence identification of primarily cultured rat mammary epithelial cells (×100) A:DAPI; B:Fluorescence |
结果如Tab 1所示,原代培养的正常大鼠乳腺上皮细胞增殖实验结果为E2+P混合培养液组(E2、P浓度为10-1 g·L-1)时OD值最大,差异有统计学意义(P < 0.05)。
| Group | OD value/g·L-1 | ||||
| 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | |
| E2 treated | 0.27±0.14 | 0.23±0.02 | 0.21±0.01 | 0.21±0.01 | 0.20±0.01 |
| P treated | 0.21±0.01 | 0.22±0.24 | 0.21±0.01 | 0.21±0.01 | 0.22±0.14 |
| E2 plus P treated | 0.39±0.01* | 0.34±0.01* | 0.23±0.14 | 0.22±0.01 | 0.23±0.01 |
| *P < 0.05 vs multiple comparisons | |||||
结果如Tab 2所示,与增殖组比较,对照组,西黄丸高、中、低剂量组OD值均显著降低,差异有统计学意义(P < 0.01)。西黄丸高、中、低剂量组及他莫昔芬组均对E2、P诱导的大鼠乳腺上皮细胞有明显抑制作用,且随着时间延长,抑制率逐渐升高,西黄丸高剂量组于72 h抑制率达到最高。
| Group | OD value | ||
| 24 h | 48 h | 72 h | |
| Blank | 0.42±0.006 9** | 0.74±0.007 2** | 0.92±0.007 1** |
| Proliferation | 0.46±0.006 2 | 0.87±0.006 6 | 1.15±0.006 6 |
| Control | 0.41±0.006 9** | 0.68±0.0044** | 0.82±0.007 4** |
| Experimental-H | 0.40±0.006 8** | 0.64±0.005 1** | 0.73±0.007 1** |
| Experimental-M | 0.41±0.005 9** | 0.70±0.006 4** | 0.84±0.006 5** |
| Experimental-L | 0.43±0.006 3** | 0.75±0.005 9** | 0.93±0.005 4** |
| **P < 0.01 vs proliferation | |||
结果如Fig 2所示,活细胞为淡紫色,凋亡细胞为深蓝色,结果可见空白组及增殖组多为淡紫色,可见淡紫色细胞核,而西黄丸高剂量组及对照组多为深蓝色染色,且未能观察到细胞核,即凋亡细胞。
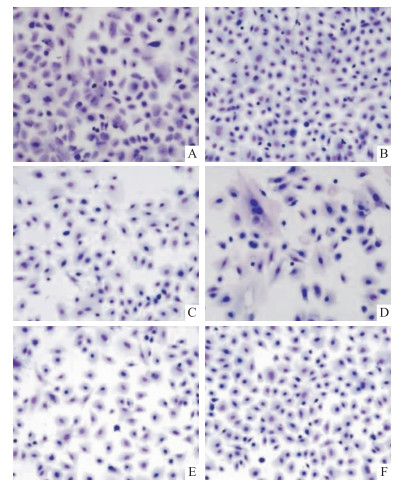
|
| Fig 2 Morphological observation of rat mammary epithelial cells treated with Xihuang pills (×200) Rat mammary epithelial cells stained with Giemsa:A:Blank group, B:Proliferation group, C:Control group, D:Experimental-H group, E:Experimental-M group, F:Experimental-L group, in which dark blue indicates apoptotic cells. |
| Group | Apoptotic rate/% |
| Blank | 2.93±0.031 1** |
| Proliferation | 1.43±0.041 0 |
| Control | 32.10±0.051 4** |
| Experimental-H | 43.79±0.043 0** |
| Experimental-M | 30.54±0.016 7** |
| Experimental-L | 24.23±0.027 0** |
| **P < 0.01 vs proliferation | |
结果如Fig 3所示,经PI染色后,乳腺上皮细胞细胞核为红色,正常细胞分布于B3下左区,B2与B4区主要为凋亡细胞,由图可以得出,西黄丸高、中、低剂量组及对照组均会促进E2、P干预的大鼠乳腺上皮细胞凋亡,且主要影响乳腺上皮细胞的晚期凋亡,以西黄丸高剂量组影响最明显,凋亡率为43.79%。
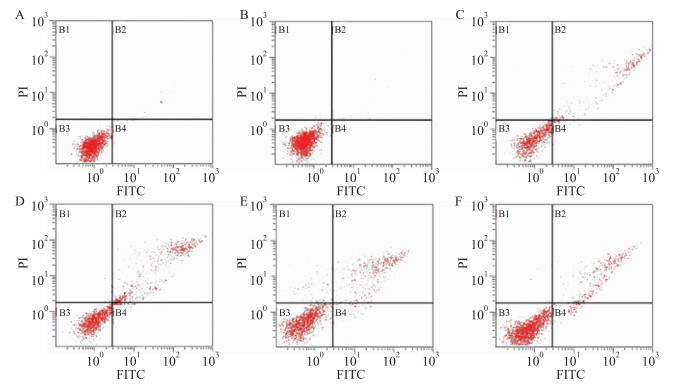
|
| Fig 3 Effect of Xihuang pills on apoptotic rate of rat mammary epithelial cells Representative images of flow cytometry, B1 quadrant:dead cell, B2 quadrant:late apoptotic cell, B3 quadrant: normal cell, B4 quadrant:early apoptotic cell.A:Blank group, B:Proliferation group, C:Control group, D:Experimental-H group, E:Experimental-M group, F:Experimental-L group. |
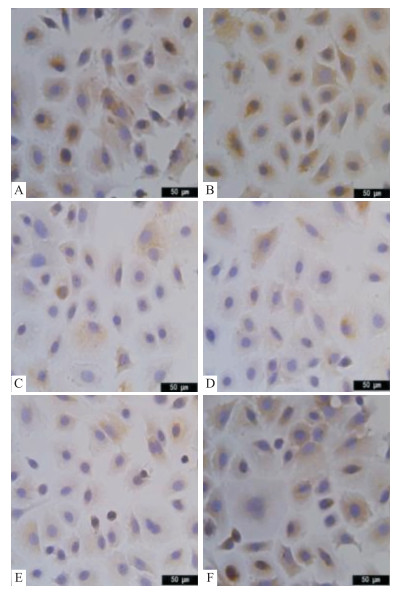
结果如Fig 4、5及Tab 4所示,正常生长的大鼠乳腺上皮细胞为蓝紫色,凋亡细胞在光学显微镜下阳性表达为棕黄色,结合光密度值来看,Fig 4中西黄丸高、中剂量组阳性表达最为显著(P < 0.01),即西黄丸可促进Bax的表达;Fig 5中西黄丸高、中剂量组及对照组多为蓝紫色,即抑制Bcl-2的表达(P < 0.01)。故西黄丸可通过改变Bax/ Bcl-2来促进大鼠乳腺上皮细胞凋亡。
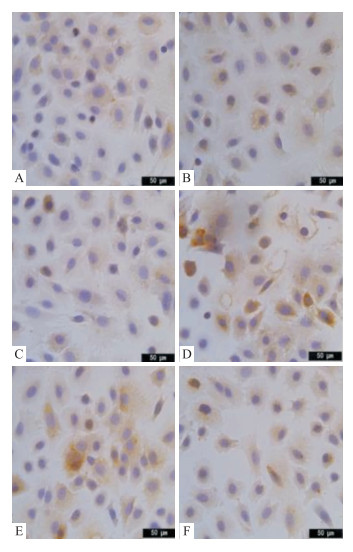
|
| Fig 4 Effect of Xihuang pills containing serumon Bax expression in proliferating mammary epithelial cells (×400) Expression of Bax protein under immunohistochemistry: A:Blank group, B:Proliferation group, C:Control group, D:Experimental-H group, E:Experimental-M group, F:Experimental-L group, in which the positive expression was brownish yellow. |
|
| Fig 5 Effect of Xihuang pills containing serum on Bcl-2 expressionin proliferating mammary epithelial cells (×400) Expression of Bcl-2 protein under immunohistochemistry: A:Blank group, B:Proliferation group, C:Control group, D:Experimental-H group, E:Experimental-M group, F:Experimental-L group, in which the positive expression was brownish yellow. |
| Group | MOD value | |
| Bcl-2 | Bax | |
| Blank | 45.56±2.84** | 31.88±3.43** |
| Proliferation | 59.01±4.31 | 18.45±2.79 |
| Control | 37.01±2.42** | 39.59±6.11** |
| Experimental-H | 22.58±2.60** | 51.98±5.91** |
| Experimental-M | 34.13±3.06** | 43.33±2.29** |
| Experimental-L | 45.55±2.64** | 29.22±5.37** |
| **P < 0.01 vs proliferation | ||
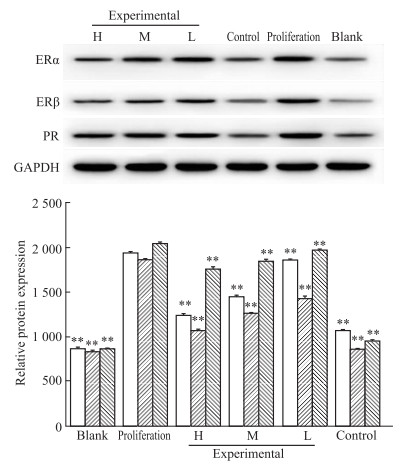
结果如Fig 6所示,与空白组比较,增殖组灰度值差异具有显著性(P < 0.01),说明E2、P可增加正常乳腺上皮细胞ERα、ERβ、PR表达;而增殖组与西黄丸高、中、低剂量组及对照组比较,差异均有显著性(P < 0.01),说明西黄丸含药血清各剂量组及他莫昔芬组均对ERα、ERβ、PR表达有抑制作用。以ERα、ERβ灰度值看,对照组的抑制作用优于西黄丸高剂量组,即可有效抑制乳腺组织增生,以PR看,抑制作用亦高于西黄丸高剂量组,即不利于乳腺组织的复旧。
|
| Fig 6 Effect of Xihuang pills on expression of ER-α, ER-β and PR protein in rat mammary epithelial cells Gray value strip chart of ER-α, ER-β and PR by Western blot; Gray value histogram of ER-α, ER-β and PR.**P < 0.01 vs proliferation |
细胞凋亡是指为维护内环境稳定,由基因控制的细胞自主有序的死亡,对机体正常发育、维护内环境稳态有重要的作用[9]。乳腺增生的发病、加重、甚至癌变的过程就是乳腺上皮细胞增殖过度及凋亡减弱的结果。而乳腺细胞凋亡和增殖过程是由生长因子和营养激素相互调节的。研究表明,乳腺增生的发病与E2/P直接相关,ER过度表达导致乳腺上皮细胞及间质纤维出现增生,使乳腺上皮细胞的修复能力减弱。PR的过度表达可诱导乳腺上皮细胞的形态发生改变,可激活特异性生长因子,使乳腺上皮细胞对P的应答出现异常,进而影响乳腺组织的复旧[10]。实验结果表明,西黄丸可有效抑制ER、PR的表达,改变ER/PR,从而改变乳腺组织的增生与复旧。
线粒体作为诱导细胞凋亡的核心。Behera等[11]研究发现,孕激素能通过Fas L途径激活诱导的细胞凋亡。Simpkins等[12]研究表明,雌激素对线粒体功能有显著影响,并将雌激素受体ER定位于线粒体内。有研究认为,E2通过膜受体ER或线粒体受体ER在乳腺细胞中通过与线粒体呼吸复合物(MRC)的直接相互作用产生ROS导致蛋白激酶活化而改变线粒体,从而导致细胞凋亡[13]。本实验对调节线粒体介导细胞凋亡的Bcl-2家族成员进行研究,发现西黄丸通过上调抗细胞凋亡蛋白Bax/促细胞凋亡蛋白Bcl-2的转录来促进乳腺细胞凋亡,其结果可能与E2直接调节Bcl-2家族有关。
综上所述,西黄丸能通过抑制ER、PR的表达, 从线粒体途径诱导乳腺上皮细胞凋亡,抑制其增殖,对乳腺增生有显著的疗效。而Bcl-2、Bax作为促凋亡因子,能诱导细胞色素C释放和凋亡小体的形成。因而本课题组下一阶段将针对线粒体、mtDNA、雌激素、ER在乳腺增生中的关系,从细胞色素C入手进行下一步实验。
| [1] |
谷丽艳, 易佳丽, 樊延宏, 等. 中医药疗法治疗乳腺增生研究进展[J]. 辽宁中医药大学学报, 2014, 16(1): 173-6. Gu L Y, Yi J L, Fan Y H, et al. Research progress of traditional Chinese medicine in the treatment of breast hyperplasia[J]. J Liaoning Univ Tradit Chin Med, 2014, 16(1): 173-6. |
| [2] |
李杰茹, 傅天, 李志丽, 等. 动物源性蛋白与女性乳腺增生发病关系病例对照研究[J]. 中国妇幼保健, 2014, 29(29): 4794-6. Li J R, Fu T, Li Z L, et al. A case-control study on the relationship between animal-derived proteins and breast hyperplasia in women[J]. Chin Matern Child Health Care, 2014, 29(29): 4794-6. |
| [3] |
Conner P. Breast response to menopausal hormone therapy-aspects on proliferation, apoptosis and mammographic density[J]. Ann Med, 2007, 39(1): 28-41. doi:10.1080/07853890601039842 |
| [4] |
孙燕, 冯琳迤, 雷蕾, 等. 氯氧喹对不同类型乳腺癌细胞系的抑制作用及机制[J]. 中国药理学通报, 2019, 35(3): 347-53. Sun Y, Feng L Y, Lei L, et al. Inhibition effect and mechanism of chloroquine on different types of breast cancer cell lines[J]. Chin Pharmacol Bull, 2019, 35(3): 347-53. doi:10.3969/j.issn.1001-1978.2019.03.011 |
| [5] |
戴一. 西黄丸的药理作用及临床应用概况[J]. 药物评价研究, 2012, 35(6): 473-6. Dai Y. Pharmacological action and clinical application of Xihuang pills[J]. Drug Eval Res, 2012, 35(6): 473-6. |
| [6] |
韩涛, 程志强, 兰咏梅, 等. 西黄丸抗乳腺增生作用的实验研究[J]. 中药药理与临床, 2009, 25(5): 15-6. Han T, Cheng Z Q, Lan Y M, et al. Experimental study on the effect of Xihuang pill on hyperplastic mammary gland[J]. Pharmacol Clin Chin Mater Clin Med, 2009, 25(5): 15-6. |
| [7] |
叶媚娜, 陈红风. 温肾中药对原代培养正常人乳腺上皮细胞增殖的影响[J]. 中西医结合学报, 2006, 8(4): 397-401. Ye M N, Chen H F. Effect of traditional Chinese medicine for warming kidney on proliferation of primary cultured normal human mammary epithelial cells[J]. Chin J Integr Tradit West Med, 2006, 8(4): 397-401. |
| [8] |
赵敏, 连小龙, 刘景楠, 等. 西黄丸对大鼠卵巢相关激素及其受体的影响[J]. 中国临床药理学杂志, 2018, 34(24): 2844-6. Zhao M, Lian X L, Liu J N, et al. Effect of Xihuang pills on ovarian related hormones and their receptors in rats[J]. Chin J Clin Pharmacol, 2018, 34(24): 2844-6. |
| [9] |
王珏, 林胜友. 中药抑制细胞凋亡的研究进展[J]. 云南中医中药杂志, 2007(11): 46-8. Wang Y, Lin S Y. Research progress in inhibition of apoptosis by traditional Chinese medicine[J]. Yunnan J Tradit Chin Med Mater Medica, 2007(11): 46-8. doi:10.3969/j.issn.1007-2349.2007.11.035 |
| [10] |
宋潇逸, 卲华. 中西医对治疗乳腺增生症的研究进展[J]. 当代医药论丛, 2018, 16(9): 136-7. Song X Y, Shao H. Research progress of traditional Chinese and western medicine in the treatment of breast hyperplasia[J]. Contemp Med Symp, 2018, 16(9): 136-7. doi:10.3969/j.issn.2095-7629.2018.09.094 |
| [11] |
Behera M, Dai Q, Garde R, et al. Progesterone stimulates mitochondrial activity with subsequent inhibition of apoptosis in MCF-10A benign breast epithelial cells[J]. Am J Physiol Endocrinol Metab, 2009, 297(5): E1089-96. doi:10.1152/ajpendo.00209.2009 |
| [12] |
Simpkins J, Yang S, Sarkar S, et al. Estrogen actions on mitochondria-physiological and pathological implications[J]. Mol Cell Endocrinol, 2008, 290(1-2): 51-9. doi:10.1016/j.mce.2008.04.013 |
| [13] |
Felty Q, Roy D. Estrogen, mitochondria, and growth of cancer and non-cancer cells[J]. J Carcinog, 2005, 4(1): 1. doi:10.1186/1477-3163-4-1 |

