

冠状动脉粥样硬化是全世界冠心病患者死亡的主要原因[1]。动脉粥样硬化被认为是一种全身性、脂质驱动的大中型动脉硬化性疾病,导致多灶性斑块的形成[2]。动脉粥样硬化斑块的发展涉及异常的炎症细胞募集、泡沫细胞形成、平滑肌细胞增殖、细胞外基质合成、活性氧产生和动脉重塑等[3, 4]。在这些变化中,炎症在动脉粥样硬化的发生和发展过程中占据着主导作用。在动脉粥样硬化发展初期,进入动脉壁的低密度脂蛋白被过量的活性氧(reactive oxygen species, ROS)氧化并被巨噬细胞吞噬后在巨噬细胞内形成脂滴进而诱导泡沫细胞形成[2, 5]。大量研究证据表明,动脉粥样硬化病灶处有大量炎症因子释放,促进动脉粥样硬化的发展和进展[6-7],但炎症和动脉粥样硬化病变进展的机制尚未完全确定,而且也缺乏治疗动脉粥样硬化的药物。
五味子丙素(五味子醇C,schisandrin C,Sch C)是五味子的一种二苯并环辛二烯衍生物,被证明能够缓解脂磷壁酸刺激小胶质细胞和痤疮丙酸杆菌引起巨噬细胞的细胞炎症[8-9]。尽管尚不清楚Sch C的这些抗炎活性的机制,但这些抗炎活性的机制可能通过抑制核转录因子NF-κB驱动的炎症反应来介导的[8]。因此,通过Sch C改善动脉炎症可能成为治疗动脉粥样硬化的潜在策略。为了研究五味子丙素对动脉粥样硬化的可能作用与机制,本项目拟观察Sch C干预治疗高脂饮食喂养ApoE-/-小鼠12周后,检测动脉粥样硬化斑块和动脉炎症,以及炎症信号通路相关蛋白。
1 材料 1.1 实验动物ApoE-/-小鼠购自某大学模式动物研究所(生产许可证号:SCXK(苏)2018-0008)。
1.2 药物与试剂五味子丙素购自美国selleck公司;油红O染色试剂盒(批号:MKCG9293)购自美国sigma公司;高密度脂蛋白胆固醇(high-density lipoprotein,HDL)检测试剂盒(批号:20190809)、低密度脂蛋白胆固醇(low-density lipoprotein,LDL)检测试剂盒(批号:20190813)、总胆固醇(total cholesterol,TCH)检测试剂盒(批号:20190814)和甘油三酯(triglyceride, TG)检测试剂盒(批号:20190813)购自南京建成生物工程研究院;逆转录试剂盒(批号:H6906340)和实时定量PCR试剂盒(批号:H7825250)购自上海Yeasen公司;TRIzol(批号:AI61056A)购自大连TaKaRa公司。
1.3 主要仪器正置荧光显微镜购自日本Nikon公司;SpectraMaxM2型酶标仪购自Molecular Devices生物科技公司;蛋白电泳、转膜与曝光系统购自美国Bio-rad公司。
2 方法 2.1 实验动物选择8周龄的雄性ApoE-/-小鼠,SPF级。在本研究中,16只C57BL/6J背景的ApoE-/-小鼠被安置在一12 :12 h的光-暗循环中,在恒定的室温下,用标准的啮齿动物饲料喂养,并给予水。实验前,动物至少在实验室驯化2周。所有动物护理和实验程序均按照《实验室动物护理和使用指南》(美国国立卫生研究院)中概述的指令执行。通过医院动物伦理审查委员会的同意,所有小鼠均置于标准条件下,符合国家制定的《实验动物管理条例》各项标准。
2.2 动脉粥样硬化动物模型建立将ApoE-/-小鼠随机分为两组:(i)高脂饮食喂养ApoE-/-小鼠(HFD组,n=8);(ii)高脂饮食喂养ApoE-/-小鼠,从高脂饮食喂养的d 1开始口服五味子丙素(1%CMC-Na溶液),剂量为5 mg·kg-1·d-1,持续12周(HFD+Sch C组,n=8)。HFD组小鼠单独接受1%的CMC-NA溶液,时间与Sch C治疗组相同。动物在戊巴比妥钠麻醉下被处死。小鼠死亡后,解剖动脉并拍照,将动脉组织置于液氮中快速冷冻,进行基因和蛋白质表达分析和/或放入4%多聚甲醛中进行病理分析。此外,在死亡时,用含肝素的针注射器从右心室采集血液。
2.3 实时定量聚合酶链式反应根据说明书,动脉组织由TRIzol提取RNA。跟据逆转录试剂盒操作说明利用转录酶将RNA逆转录成cDNA。通过实时定量聚合酶链式反应(RT-qPCR)检测cDNA的IL-6、TNF-α、细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)和β-肌动蛋白(β-actin)的mRNA表达水平,引物序列见Tab 1。
| Gene | Species | Primers(FW)(5′-3′) | Primers(RW)(5′-3′) |
| TNF-α | Mouse | TGATCCGCGACGTGGAA | ACCGCCTGGAGTTCTGGAA |
| IL-6 | Mouse | GAGGATACCACTCCCAACAGACC | AAGTGCATCATCGTTGTTCATACA |
| β-actin | Mouse | CCGTGAAAAGATGACCCAGA | TACGACCAGAGGCATACAG |
| ICAM-1 | Mouse | GCCTTGGTAGAGGTGACTGAG | GACCGGAGCTGAAAAGTTGTA |
用相应的试剂盒检测血液中的TG、TC、LDL、HDL水平。
2.5 蛋白免疫印迹利用蛋白裂解液裂解组织提取组织总蛋白,通过BCA测蛋白浓度并将每个样本的上样总蛋白量保持一致。利用10%SDS胶将所有样本的蛋白进行分级分离,随后将蛋白湿转至PVDF膜上(0.2 μm孔径的膜用于小分子量蛋白,0.45 μm孔径的膜用于分子量大的蛋白)。湿转达90 min 5%脱脂牛奶孵育2 h起封闭,TBST洗涤, 加入一抗IκB-α (inhibitor of nuclear factor-κB, IκB-α)兔多克隆抗体、p-IκB-α鼠单克隆抗体和抗GAPDH兔单克隆抗体,均为1 :1 000稀释孵育,于摇床室温孵育2 h后放至4 ℃过夜处理。次日TBST洗涤后,用HRP结合的二抗(均为1 :5 000稀释)孵育1 h,二抗孵育结束后用TBST洗涤3次,ECL液曝光,曝光仪成像并处理结果。
2.6 油红O染色收集动物心脏,于4%多聚甲醛中固定过夜,次日用20%蔗糖脱水12 h后利用冰冻包埋剂将心脏做出冰冻切片样本,切至主动脉根部收取主动脉三尖瓣切片(8 μm)。利用油红O工作液染色,并在光学显微镜下观察标本并获取图片。
2.7 统计学处理所有计量资料以x±s表示。采用SPSS for Window 16.0软件进行统计分析,两组间的比较采用Student′s t检验分析,多组间的差异比较采用单因素方差分析并以Bonferroni校正作后比较。
3 结果 3.1 五味子丙素不影响高脂饮食喂养ApoE-/-小鼠的血脂我们首先研究了Sch C对高脂饮食喂养ApoE-/-小鼠血脂的影响。所有ApoE-/-小鼠通过高脂饮食喂养12周后处死小鼠,我们检测了血清的血脂水平。如Fig 1所示,与HFD组相比,五味子丙素处理的ApoE-/-小鼠血清的血脂水平(TG/TC/LDL/HDL)无显著性变化,表明,五味子丙素不影响高脂饮食喂养ApoE-/-小鼠的血脂水平。
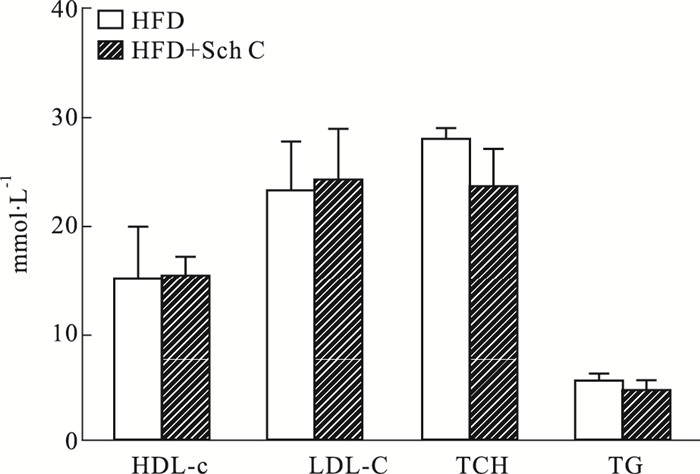
|
| Fig 1 Sch C does not affect the changes of blood lipid levels (serum HDL-c/LDL-c/ TCH/TG level) induced by high fat diet in ApoE-/- mice (x±s, n=8) |
随后,我们探究了五味子丙素对高脂饮食喂养ApoE-/-小鼠动脉粥样硬化的影响。Fig 2A显示五味子丙素处理组小鼠主动脉弓及分叉处动脉粥样硬化病变面积减少。此外,相比HFD组,五味子丙素处理后主动脉根部的斑块面积亦有显著减少(Fig 2B~D)。以上结果表明,在高脂饮食喂养诱导动脉粥样硬化的ApoE-/-小鼠模型中,五味子丙素能有效缓解动脉粥样硬化的发展。
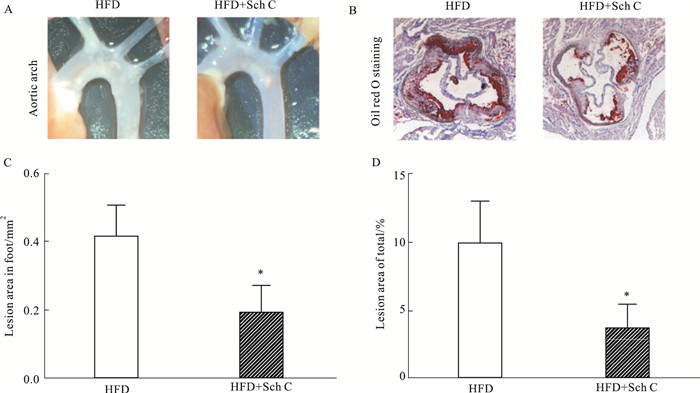
|
| Fig 2 Oral administration of Sch C can significantly alleviate the development of atherosclerosis in ApoE-/- mice A. Representative pictures of the aortic arch; B. Oil red O staining of aortic root. C. Oil red O staining area analysis of aortic root. D. Percentage analysis of oil red O staining area in the aortic root. *P < 0.05 vs HFD group |
炎症反应贯穿于动脉粥样硬化发生与发展的整个过程中[10]。我们进一步研究了五味子丙素对高脂饮食喂养ApoE-/-小鼠动脉炎症的影响。RT-qPCR分析显示,与HFD组相比,五味子丙素处理后,炎症因子和粘附分子包括TNF-α,IL-6和ICAM- 1在动脉中的表达显著降低(Fig 3),表明五味子丙素显著抑制高脂饮食喂养ApoE-/-小鼠的动脉炎症,且这可能与其抗动脉粥样硬化的作用有关。
3.4 五味子丙素抑制高脂饮食喂养ApoE-/-小鼠动脉中IκB-α的磷酸化和降解为进一步研究五味子丙素的作用机制,我们检测了炎症信号通路IκB-α的磷酸化和降解。如Fig 4所示,与HFD组相比,五味子丙素处理可抑制ApoE-/-小鼠主动脉中的IκB-α的磷酸化和降解,表明其抗炎作用可能是通过抑制IκB-α的磷酸化和降解所实现的。
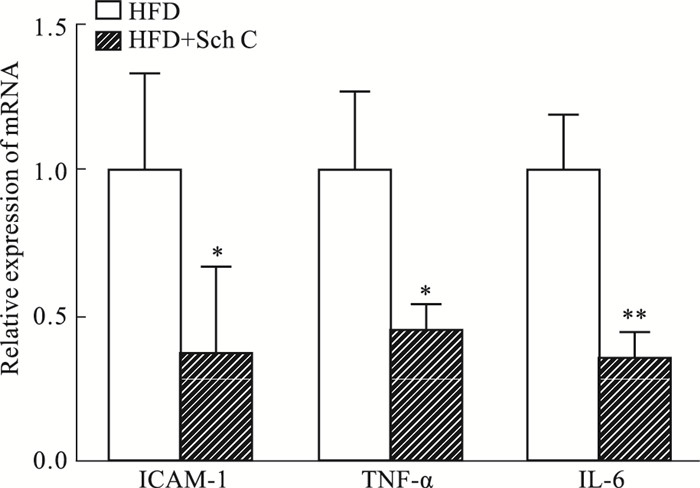
|
| Fig 3 Sch C can significantly reduce the arterial inflammation induced by high fat diet in ApoE-/- mice(x±s, n=8) mRNA expression of inflammatory factors (ICAM-1, TNF-α and IL-6) in the arteries of ApoE-/- mice.*P < 0.05, ** P < 0.01 vs HFD group. |
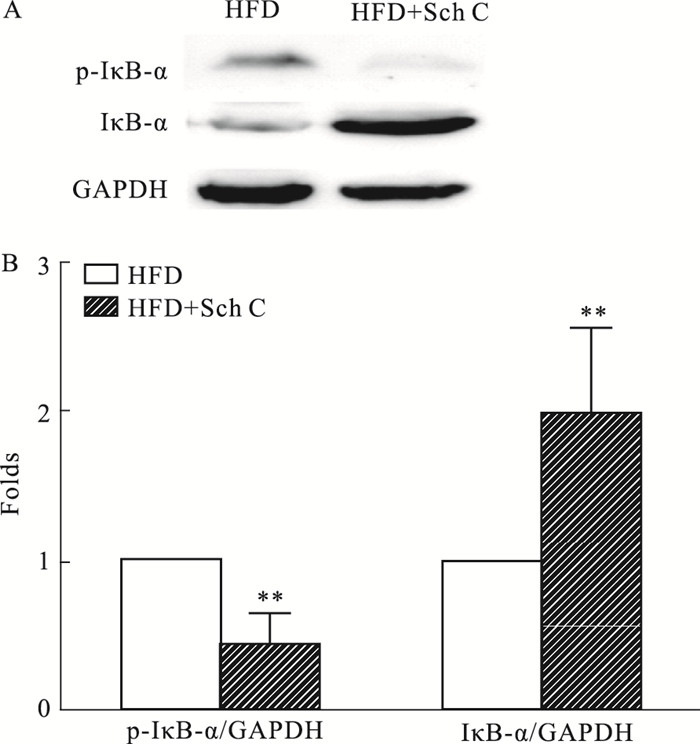
|
| Fig 4 Sch C inhibits the phosphorylation and degradation of IκB-α in the arteries of ApoE-/- mice induced by high-fat diet(x±s, n=8) A: Phosphorylation and degradation of IκB-α; B: Relative quantitative analysis. *P < 0.05, **P < 0.01 vs HFD group. |
动脉粥样硬化是一种慢性炎症性疾病,涉及斑块形成不同阶段的多种细胞类型,包括淋巴细胞、内皮细胞、平滑肌细胞和单核细胞/巨噬细胞[11]。Moore等[2]和Libby等[2, 12]的研究表明,免疫介质和炎性巨噬细胞在动脉粥样硬化的发展过程中有着举足轻重的作用。近年来,越来越多的证据表明动脉粥样硬化斑块逐步发展导致的动脉狭窄和病灶处斑块破裂形成的血栓是动脉粥样硬化导致心血管临床危险事件发生的重要原因[7, 13]。
在本研究中,我们探索Sch C对高脂饮食喂养ApoE-/-小鼠动脉粥样硬化的影响。正如在本研究中观察到的,高脂饮食喂养持续12周,我们观察到ApoE-/-小鼠出现了动脉粥样硬化病变,其特征是脂质堆积形成斑块。有趣的是,口服给予Sch C显著改善了HFD诱导的动脉粥样硬化的进展,减少了脂质在病灶中的积累,却对ApoE-/-小鼠的血清TCH、TG、HDL-C和LDL-C水平没有影响。以上结果提示了Sch C具有抗动脉粥样硬化形成的作用。
炎症微环境在多种慢性疾病中均有着介导作用,例如脑卒中、糖尿病和动脉粥样硬化[14]。而在动脉粥样硬化中,炎症贯穿于整个发生和发展过程,起着至关重要的作用[10]。从早期病变到斑块破裂,在动脉粥样硬化斑块中存在着许多类型的细胞,包括T淋巴细胞、巨噬细胞、单核细胞、平滑肌细胞和肥大细胞,且伴随着许多炎症因子的分泌[8]。在本研究中,我们发现口服给予Sch C明显降低了高脂饮食喂养诱导的ApoE-/-小鼠动脉中粘附分子和炎症因子的mRNA表达。这些结果表明,Sch C通过抑制炎症反应缓解动脉粥样硬化发展。为了进一步探讨Sch C缓解动脉粥样硬化发展的分子机制,我们发现与HFD组相比,Sch C减少了IκB-α的磷酸化并抑制IκB-α的降解。这些结果表明Sch C可能通过抑制IκB-α的磷酸化与降解缓解动脉炎症。
因此,我们推测Sch C可能通过抑制IκB-α介导的炎症反应缓解动脉粥样硬化的发生发展。但本研究中,并未进一步在细胞实验中深入探索Sch C的抗炎作用是否依赖其IκB-α的抑制作用。综上所述,本研究发现Sch C可能是一个治疗动脉粥样硬化的有效单体。
| [1] |
Murphy S A, Cannon C P, Wiviott S D, et al. Effect of intensive lipid-lowering therapy on mortality after acute coronary syndrome (a patient-level analysis of the Aggrastat to Zocor and Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 trials)[J]. Am J Cardiol, 2007, 100(7): 1047-51. doi:10.1016/j.amjcard.2007.04.053 |
| [2] |
Moore K J, Tabas I. Macrophages in the pathogenesis of atherosclerosis[J]. Cell, 2011, 145(3): 341-55. doi:10.1016/j.cell.2011.04.005 |
| [3] |
Stary H C, Chandler A B, Dinsmore R E, et al. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis. A report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association[J]. Circulation, 1995, 92(5): 1355-74. doi:10.1161/01.CIR.92.5.1355 |
| [4] |
Major A S, Harrison D G. What fans the fire: insights into mechanisms of inflammation in atherosclerosis and diabetes mellitus[J]. Circulation, 2011, 124(25): 2809-11. doi:10.1161/CIRCULATIONAHA.111.070565 |
| [5] |
Patel K M, Strong A J, Tohyama J, et al. Macrophage sortilin promotes LDL uptake, foam cell formation, and atherosclerosis[J]. Circ Res, 2015, 116(5): 789-96. doi:10.1161/CIRCRESAHA.116.305811 |
| [6] |
Nahrendorf M, Swirski F K. Neutrophil-macrophage communication in inflammation and atherosclerosis[J]. Science, 2015, 349(6245): 237-8. doi:10.1126/science.aac7801 |
| [7] |
Hansson G K, Libby P, Tabas I. Inflammation and plaque vulnerability[J]. J Int Med, 2015, 278(5): 483-93. doi:10.1111/joim.12406 |
| [8] |
Park S Y, Park S J, Park T G, et al. Schizandrin C exerts anti-neuroinflammatory effects by upregulating phase Ⅱ detoxifying/antioxidant enzymes in microglia[J]. Int Immunopharmacol, 2013, 17(2): 415-26. |
| [9] |
Guo M, An F, Yu H, et al. Comparative effects of schisandrin A, B, and C on Propionibacterium acnes-induced, NLRP3 inflammasome activation-mediated IL-1beta secretion and pyroptosis[J]. Biomed Pharmacother, 2017, 96: 129-36. doi:10.1016/j.biopha.2017.09.097 |
| [10] |
Sadat U, Jaffer F A, Zandvoort M A, et al. Inflammation and neovascularization intertwined in atherosclerosis: imaging of structural and molecular imaging targets[J]. Circulation, 2014, 130(9): 786-94. doi:10.1161/CIRCULATIONAHA.114.010369 |
| [11] |
Lusis A J. Atherosclerosis[J]. Nature, 2000, 407(6801): 233-41. doi:10.1038/35025203 |
| [12] |
Libby P, Lichtman A H, Hansson G K. Immune effector mechanisms implicated in atherosclerosis: from mice to humans[J]. Immunity, 2013, 38(6): 1092-104. doi:10.1016/j.immuni.2013.06.009 |
| [13] |
Kolodgie F D, Virmani R, Burke A P, et al. Pathologic assessment of the vulnerable human coronary plaque[J]. Heart, 2004, 90(12): 1385-91. doi:10.1136/hrt.2004.041798 |
| [14] |
朱婷, 孙桂波, 孟祥宝, 等. 小胶质细胞/巨噬细胞的极化及在脑卒中修复中的作用[J]. 中国药理学通报, 2019, 35(8): 1046-50. Zhu T, Sun G B, Meng X B, et al. Polarization of microglia/macrophages and its role in ischemic stroke repair[J]. Chin Pharmacol Bull, 2019, 35(8): 1046-50. doi:10.3969/j.issn.1001-1978.2019.08.003 |

