

阿霉素(doxorubicin, DOX), 又名多柔比星, 是一种广谱的蒽环类抗生素。自1960年被临床上广泛用于抗肿瘤, 特别是针对肺癌、乳腺癌、白血病、淋巴癌等效果显著[1]。但DOX由于具有严重的心脏毒副作用, 从而限制了其临床应用。目前DOX已经被大量用于复制细胞及动物水平的心肌病模型, 为心肌保护的新机制、新靶点研究及药物的筛选奠定基础。DOX诱导的心肌细胞损伤, 主要呈现扩张型心肌病的病理学特征:激活心肌细胞凋亡信号通路, 线粒体功能紊乱, 心功能下降等[2]。活性氧(release of oxygen species, ROS)的产生被认为是DOX心肌病的经典机制, 但抗氧化剂并没有显示出很好的抵抗DOX心肌病的效果[3], 提示该疾病的发生发展机制可能更为复杂。
组蛋白去甲基化酶(histone demethylase Jumonji D3, JMJD3), 又称为KDM6b(lysine-specific demethylase 6b), 主要分布于细胞核[4]。JMJD3可以将发生了甲基化修饰的甲基去除, 进而激活或者抑制相关基因的表达。目前有文献报道[5], JMJD3在肿瘤、炎症、细胞增殖分化、神经退行性疾病中发挥重要作用。此外, 我们实验室前期研究发现, JMJD3能够通过调节β-MHC启动子区域的H3K27me3程度来影响异丙肾上腺素诱导的病理性心肌肥大, 且JMJD3在心脏中高表达[6], 这表明JMJD3与心脏疾病可能存在密切关系。但JMJD3与DOX诱导的扩张型心肌病是否有关, 尚未见报道。
信号转导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)作为STAT家族重要一员, 在心脏疾病中也发挥着重要的作用[7]。有临床研究表明, 在心脏中过表达STAT3能够缓解DOX引起的心脏毒副作用[8]。STAT3蛋白在细胞质、细胞核以及线粒体中广泛分布, STAT3可以有效减少mPTP的开放, 进而抑制细胞凋亡[9]。线粒体靶向过表达STAT3能够显著减少ROS的生成和细胞色素C的释放[10]。此外, STAT3在其他疾病中也发挥重要作用, 比如, 激活mTOR-STAT3信号通路能够改善脂多糖诱导的血管内皮屏障功能障碍和细胞凋亡, 有助于减少微血管损伤和肺损伤[11]。
关于JMJD3在DOX心肌病中的功能学研究及JMJD3是否通过调控STAT3磷酸化水平, 进而参与对DOX心肌病调控, 目前尚未见报道。基于此, 本文探究了JMJD3对STAT3的调控作用及其在DOX心肌病中的机制, 为心肌保护新靶点的寻找提供理论依据。
1 材料与方法 1.1 材料阿霉素(DOX, 纯度>99 %, 美国Boston, T1020);胰酶(美国Sigma, 25200-072);BCA蛋白定量试剂盒(美国Pierce, 23225);胎牛血清(美国Gibco, 10270-106);Bax抗体、JMJD3抗体(英国Abcam, ab32503、ab169197);STAT3抗体、p-STAT3(Ser727和Tyr705)抗体(美国CST, 9139S、9134T和9145P); Caspase-3抗体(美国ProteinTech, 19677-1-AP); Bcl-2抗体(中国Boster, A0040-1);Cleaved Caspase-3抗体(美国CST, 9661T;以上抗体稀释比是1 :1 000。α-Tubulin抗体(美国Sigma-Aldrich, T6199, 稀释比1 :2 000);兔二抗、鼠二抗(美国CST, 7074S, 7076S, 稀释比1 :2 000);腺病毒JMJD3、STAT3和阴性对照GFP(吉凯基因, 中国上海); RNA逆转录试剂盒(美国Thermo, K1622);TRIzol(日本TaKaRa, 9109)。
1.2 仪器超净工作台(中国苏净安泰); 荧光定量PCR仪(美国Thermo); 二氧化碳培养箱(美国Thermo); 冷冻台式高速离心机(德国Eppendorf); 恒温水浴锅(德国Memmert); 蛋白电泳仪、电转仪(美国Bio-Red); 倒置显微镜(德国Leica); 化学发光图像分析系统(中国Tanno)。
1.3 方法 1.3.1 细胞培养心肌细胞系H9C2购于中国科学院细胞库, 用含10%胎牛血清的DMEM培养, 置于37 ℃、5% CO2的细胞培养箱中孵育, 待细胞充分贴壁生长至密度达70%~80%, 弃培养基, 用PBS缓冲液冲洗3次, 加入含0.25% EDTA胰酶进行消化, 离心后加入新的含10%胎牛血清的DMEM重悬细胞, 根据实验需要将细胞接种于细胞皿中, 取对数生长期的细胞进行实验。
1.3.2 RT-qPCR(1) RNA提取:将H9C2细胞或心肌组织用PBS清洗, 加入1 mL TRIzol, 细胞轻柔吹打, 组织于冰上匀浆, 收集液体至1.5 mL EP管中。加入200 μL氯仿, 震荡、静置、离心。将上层转移至新的EP管中, 加入异丙醇, 室温放置后离心10 min, 弃上清。加入1 mL用DEPC水配置的75 %的乙醇, 离心后弃上清, 在室温下干燥20 min。加入15-20 μL DEPC水, 于58 ℃恒温水浴10 min, 随后测定RNA的浓度及纯度。(2)逆转录合成cDNA:根据Thermo公司提供的RvertAid cDNA试剂盒说明书构建体系。第一步, 将试剂Oligo(dT)18 primer、Total RNA、RNase Free dH2O按说明书剂量在冰上混匀, 瞬离后放入PCR仪中65 ℃孵育5 min; 第二步:按说明书剂量将5×Reaction Buffer、RiboLockTM RNase Inhibitor、dNTP Mix、RevertAidTM M-MuLV Revert混匀加入至上一步产物中, 体系总体积为20 μL, 瞬离后放入PCR仪中, 设置反应参数42 ℃×60 min, 70 ℃×5 min, 最后降温至4 ℃。(3)PCR扩增:首先在Pubmed Primer BLAST网站设计目的基因的引物序列, 如下:JMJD3:正向5′- TCAGGAGAGGAAGGCCTCAG-3′, 反向5′-AGCTGGGTATGGATGAGGGT-3′; β-actin:正向5′-TCGTGCGTGACATTAAAGAG-3′; 反向5′-ATTGCCGATAGTGATGACCT-3′。本实验的引物委托上海生工合成。根据Toyobo公司生产的SYBR Premix ExTaq说明书构建反应体系, 实验设计三个复孔以及空白对照, 瞬离5 s后放入qPCR仪中, 设置参数为:95 ℃×1 min; 95 ℃×15 s; 60 ℃×30 s循环50次; 95 ℃×15 s; 60 ℃×1 h; 65 ℃×30 s, 循环61次。内参基因为β-actin, 分析数据方法均采用2-ΔΔCt法。
1.3.3 阿霉素心肌病动物模型的建立SPF级Sprague-Dawley大鼠, ♂, 体质量(260±20)g, 购买于中山大学实验动物中心, 动物质量合格证(No 44008500018368)。随机分为2组, 分别为生理盐水对照组(NS)和阿霉素模型组(DOX), 每组6只。将盐酸阿霉素粉末用生理盐水配置成浓度为0.5 g·L-1的溶液, 模型中SD大鼠于d 1、5、9给予腹腔注射阿霉素(1 mL·100 g-1), 每次剂量为5 mg·kg-1, 最终累积剂量为15 mg·kg-1[2]。对照组SD大鼠给予腹腔注射等体积的生理盐水。所有动物实验流程均严格按照《Guide for the Care and Use of Laboratory Animals》执行。
1.3.4 SD大鼠心室壁注射JMJD3腺病毒采用腹腔注射10%水合氯醛(0.35 mL·100 g-1)的方法待大鼠麻醉后, 将其固定, 将特质的气管插管经口腔插入气道中, 连接呼吸机以辅助呼吸。剔除大鼠仰卧位左侧胸腔处的鼠毛并用碘伏擦拭消毒。开胸腔:在大鼠左侧第3~4根胸骨之间剪开一个约2~3 cm小口, 暴露心脏。用胰岛素针将200 μL JMJD3腺病毒(用无菌PBS缓冲液稀释为5×109 PFU)分散成3~5个位点注入左心室壁。快速缝合、消毒, 观察大鼠伤口愈合情况, 待恢复1周后, 可进行后续实验。
1.3.5 超声心动检测用4%异氟烷经小动物麻醉机将大鼠麻醉, 剔除胸部皮毛, 使其平躺于37 ℃恒温板。用超声心动仪检测SD大鼠的各项心功能指标。
1.3.6 心脏组织取材对SD大鼠给予腹腔注射0.45%戊巴比妥钠(45 mg·kg-1)进行麻醉。消毒后迅速打开胸腔, 灌注0.1 mol·L-1 KCl溶液使心脏在舒张期停搏, 随后灌注生理盐水除去淤血, 快速取出心脏, 用滤纸吸去多余液体后进行称重、拍照。沿横截面进行分切, 随后冻存于液氮中用于后续Western blot等实验。
1.3.7 心肌细胞及心脏组织总蛋白提取心肌细胞:弃去培养基, 预冷PBS清洗, 加入100 μL RIPA裂解液(含有蛋白酶和磷酸酶抑制剂), 刮下细胞, 冰上孵育30 min, 在4 ℃, 12 000 g条件下离心20 min, 取上清。BCA法测定蛋白浓度并制备样品。
心脏组织:称取约15 mg组织于离心管中, 剪碎, 加入预冷PBS, 弃上清后加入含蛋白酶抑制剂的RIPA裂解液, 于冰上匀浆。在4 ℃, 12 000 g条件下离心15 min, 取上清。BCA法测定蛋白浓度并制备样品以备后续检测。
1.3.8 蛋白免疫印迹法制备12 %和8 % SDS-PAGE凝胶, 上样后设置电泳条件为80 V ×35 min, 进入分离胶后调整参数为120 V ×65 min, 转膜条件240 mA×100 min。5 %脱脂牛奶封闭2 h, 4 ℃孵育一抗过夜, TBST清洗, 室温孵育二抗1 h, 拍照、灰度值分析。
1.3.9 细胞水平干预目的基因过表达JMJD3及STAT3:采用JMJD3或STAT3腺病毒感染的方法处理H9C2细胞48 h, 对照组加入含绿色荧光蛋白的腺病毒(Ad-GFP)。腺病毒购买于上海吉凯基因化学技术有限公司。
敲低JMJD3:将细胞接种于8 cm2培养皿中, 用250 μL Opti-MEM培养基分别与5 μL Lipo2000、10 μL浓度为20 μmol·L-1的JMJD3干扰序列轻柔混匀, 静置25 min后加入培养皿中, 6 h后更换新的含10% DMEM的培养基继续培养。JMJD3干扰序列为:sense:5′-GCCUUCAUGCGAGUAACAUTT-3, antisense:5′-AUGUUACUCGCAUGAAGGCTT-3′。NC干扰序列为:sense:5′-UUCUCCGAACGUGUCACGUTT-3′, antisense:5′-ACGUGACACGUUCGGAGAATT-3′[6]。
1.4 统计学方法使用GraphPad Prism 6.0进行统计学分析, 所有数据均表示为x±s。采用t检验、单因素方差分析(ANOVA)和Bonferroni法进行组间比较。
2 结果 2.1 JMJD3在DOX诱导的心肌细胞损伤模型的变化采用1 μmol·L-1 DOX分别刺激H9C2细胞0、6、12、24 h, Fig 1A~B结果显示, 与正常对照组相比, 当DOX处理细胞12 h和24 h时, 细胞发生明显凋亡:凋亡相关蛋白Bax/Bcl-2、C-Caspase-3/T-Caspase-3比值升高(P < 0.05), 明场下观察到凋亡细胞数目增多。TMRE染色结果显示, DOX处理细胞12 h和24 h时, 细胞膜电位发生明显下降(Fig 1C)。以上结果提示, 1 μmol·L-1 DOX刺激细胞12 h, 可明显诱导心肌细胞损伤。在此模型下, JMJD3的mRNA和蛋白表达水平明显增高(Fig 1D~E)。
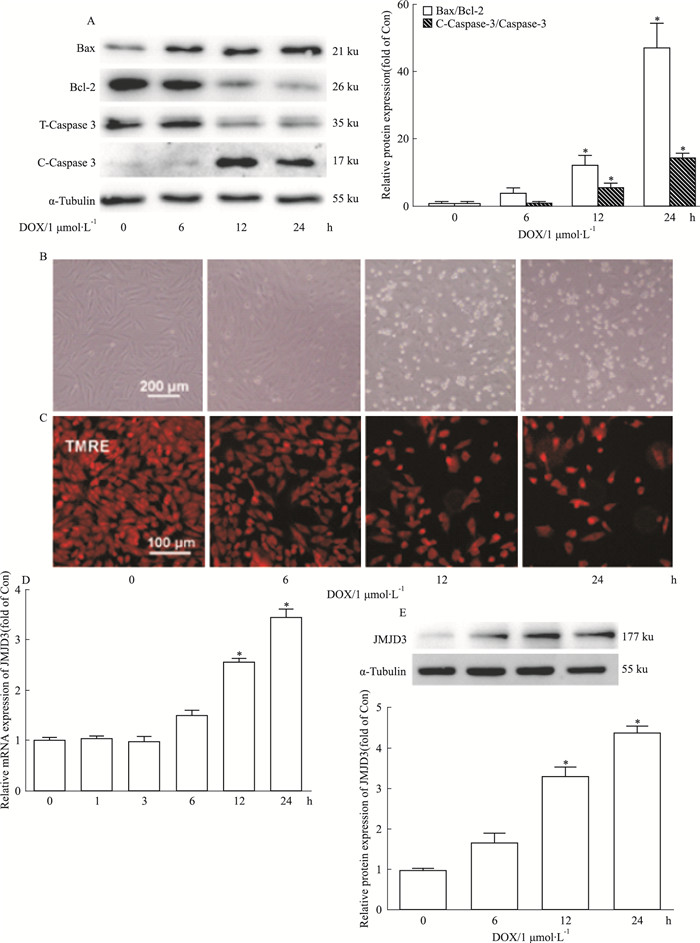
|
| Fig 1 Changes of JMJD3 expression in doxorubicin(DOX)-induced cardiotoxicity in H9C2 cells(x±s, n=3) H9C2 cells were incubated with 1 μmol·L-1 DOX for the indicated durations. A:The ratios of Bax/Bcl-2 and C-Caspase-3/T-Caspase-3 were detected by Western blot. B:The cellular morphology of H9C2 was observed by light microscopy. Scale bar: 200 μm. C:The mitochondrial membrane depolarization was measured by TMRE staining. Scale bar: 100 μm. D: The mRNA expression of JMJD3 was detected by qRT-PCR.(E) The protein expression of JMJD3 was determined by Western blot.*P < 0.05 vs control group. |
与生理盐水对照组(normal saline, NS)相比, DOX组的大鼠心脏横截面直径变小(Fig 2A), 心动图紊乱(Fig 2B), 心重胫骨长比降低, 但心重/体重比值无明显变化(Fig 2C), 左室射血分数(ejection Fraction, EF)降低, 心输出量降低(cardiac output, CO), 左室短轴缩短率(fractional shortening, FS)降低(Fig 2D), 舒张期末左室后壁厚度(left ventricular end-diastolic posterior wall thickness, LVPW-d)降低(Fig 2E)。qRT-PCR结果显示, 与NS组相比, DOX模型组大鼠心脏组织中JMJD3的mRNA表达明显升高(Fig 2F)。采用Western blot方法检测JMJD3的蛋白表达:与NS组相比, DOX组大鼠心脏组织中JMJD3的蛋白表达明显升高(Fig 2G)。
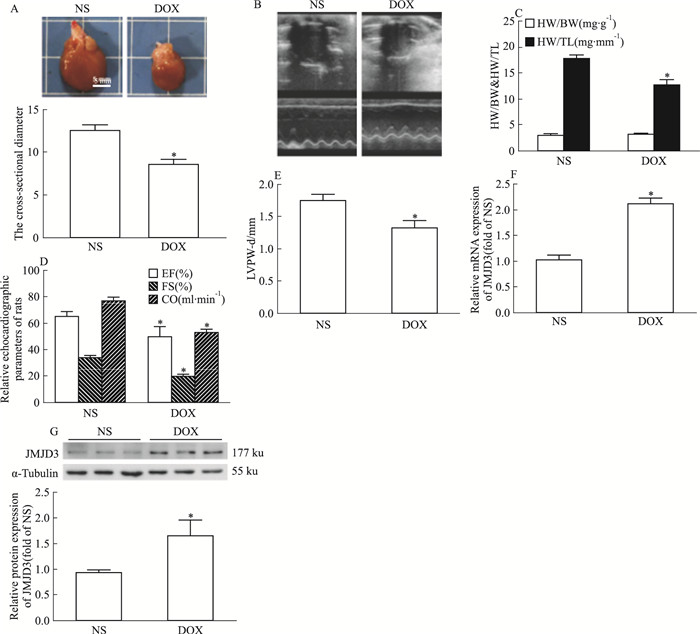
|
| Fig 2 JMJD3 expression increased in DOX-induced cardiomyopathy in SD rats(x±s, n=6) SD rats were submitted to the intraperitoneal injected with DOX(with a cumulative dose, 15 mg·kg-1). The control animals obtained an equal volume of normal saline(NS).A: The gross hearts were obscured by morphologic examination. Scale bar: 5 mm. B: Representative echocardiographic graphs. C: The ratios of HW/BW, HW/TL were detected. D~E:Parameters of Cardiac function of EF, CO, FS, LVPW-d were detected by echocardiographic. F: The mRNA expression of JMJD3 was detected by qRT-PCR. G: The protein expression of JMJD3 was determined by Western blot.*P < 0.05 vs NS group. |
在H9C2细胞中加入JMJD3腺病毒感染48 h, 由Fig 3可知, JMJD3过表达成功。与对照组相比, 过表达JMJD3组的切割型Caspase-3(C- Caspase-3)表达水平升高, 提示凋亡因子Caspase-3被激活, 且过表达JMJD3可以加剧DOX引起的Caspase-3的激活。
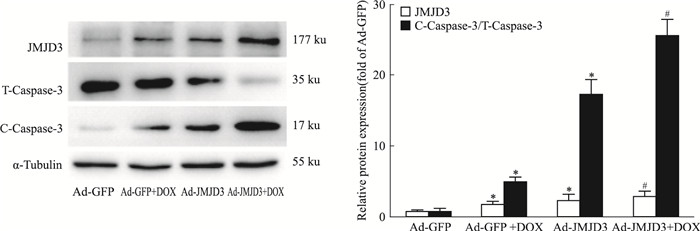
|
| Fig 3 JMJD3 overexpression aggravated DOX-induced apoptosis(x±s, n=3) H9C2 cells were incubated with 1 μmol·L-1 DOX for 12 h or infected with adenovirus encoding JMJD3(Ad-JMJD3) or GFP(Ad-GFP). The intracellular protein expression of JMJD3 and Caspase 3 were determined by Western blot.*P < 0.05 vs Ad-GFP group, #P < 0.05 vs Ad-GFP+DOX group |
在细胞水平敲低JMJD3后, 与对照组相比, 敲低JMJD3处理组C-caspase-3/T-caspase-3比值差异没有显著性。与DOX处理组相比, si-JMJD3+DOX处理能够明显抑制切割型caspase3的激活(Fig 4)。
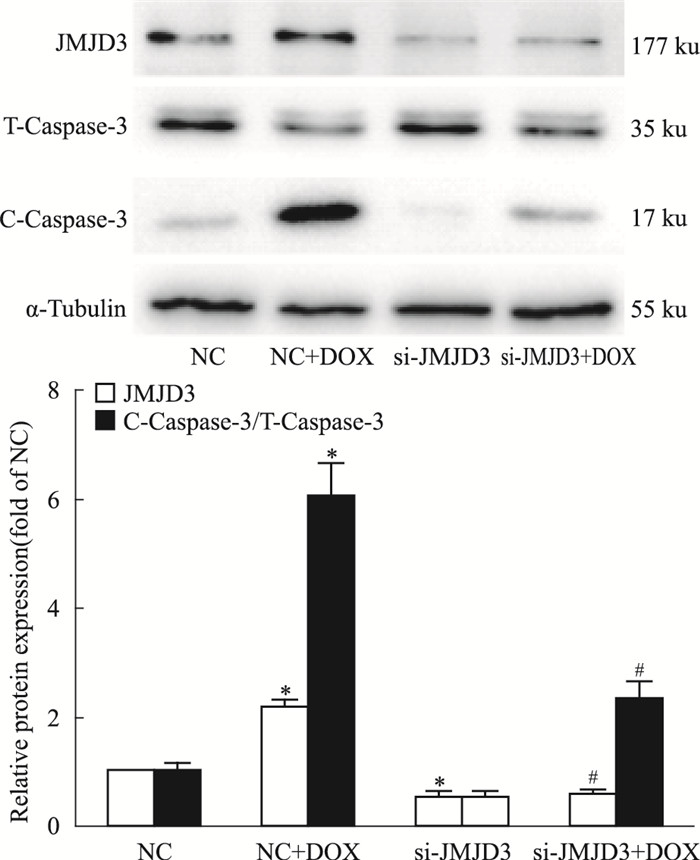
|
| Fig 4 JMJD3 knockdown relieved DOX-induced apoptosis(x±s, n=3) H9C2 cells were incubated with 1 μmol·L-1 DOX for 12 h or transfected with siRNA targeting JMJD3(si-JMJD3) or NC.(A) The intracellular protein expression of JMJD3 and Caspase-3 were determined by Western blot.*P < 0.05 vs NC group, #P < 0.05 vs NC+DOX group. |
如Fig 5A结果显示:单独过表达STAT3(Ad-STAT3)对心肌细胞凋亡无明显影响; 与DOX模型组相比, DOX合并Ad-STAT3组, 可以减轻DOX引起的Bax/Bcl-2以及C-caspase-3/T-Caspase-3的升高; 与Ad-JMJD3+DOX处理组相比, Ad-STAT3+Ad-JMJD3+DOX处理组中的Bax/Bcl-2以及C-Caspase-3/T-Caspase-3明显下降。这些结果提示, JMJD3可能是通过抑制STAT3表达, 从而加剧DOX诱导的心肌细胞凋亡的作用。
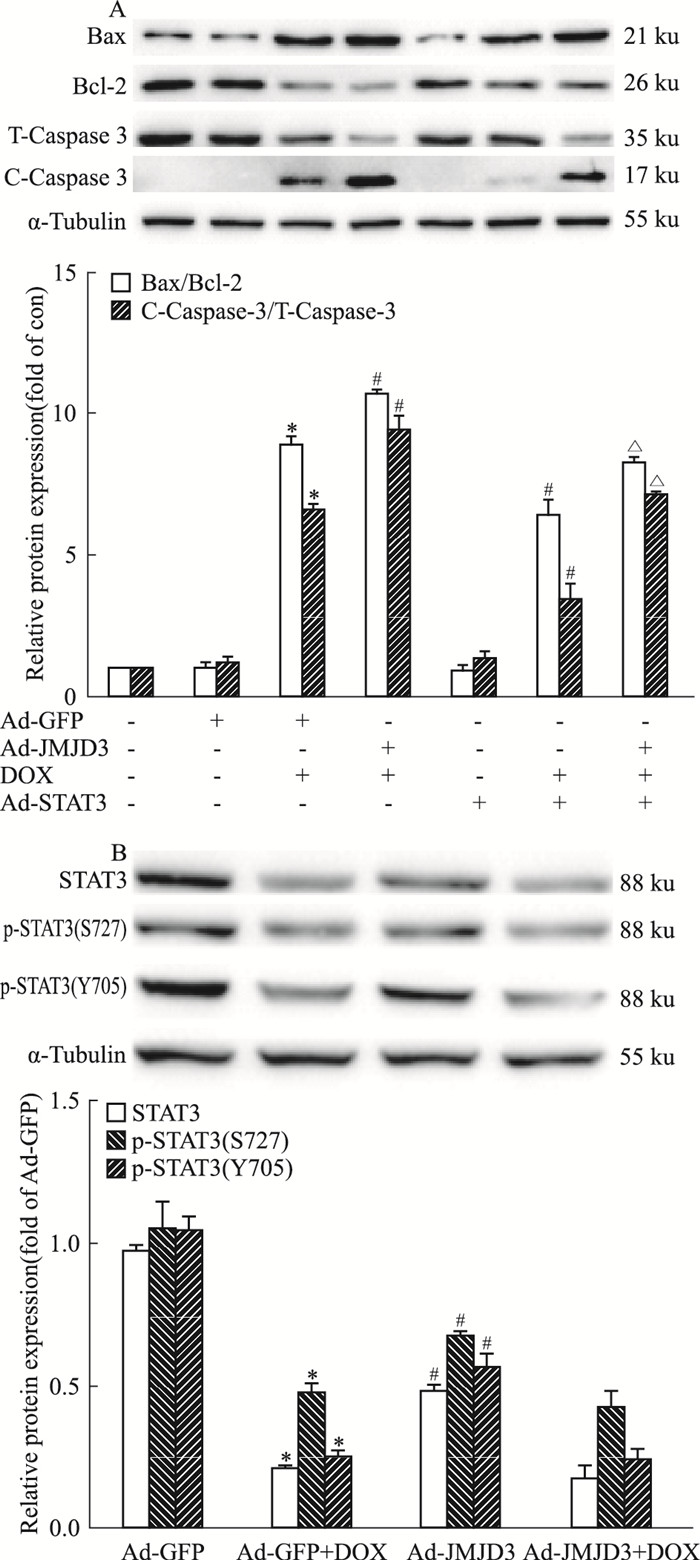
|
| Fig 5 Effects of JMJD3 and STAT3 on DOX-induced cardiotoxicity in H9C2 cells(x±s, n=3) H9C2 cells were incubated with 1 μmol·L-1 DOX for 12 h or infected with Ad-JMJD3, Ad-STAT3 or Ad-GFP. A:The ratios of Bax/Bcl-2 and C-Caspase-3/T-Caspase-3 were analyzed by Western blot.*P < 0.05 vs Ad-GFP group; #P < 0.05 vs Ad-GFP+DOX group; △P < 0.05 vs Ad-JMJD3+DOX group. B:The protein expressions were detected by Western blot.*P < 0.05 vs Ad-GFP group; #P < 0.05 vs Ad-GFP+DOX group. |
由Fig 5B可以看出, 与对照组相比, DOX心肌病细胞模型中STAT3的蛋白表达及磷酸化水平降低; 过表达JMJD3也可降低STAT3的蛋白表达及磷酸化水平; 与Ad-GFP+DOX组相比, DOX合并过表达JMJD3对STAT3的蛋白表达及磷酸化水平的变化差异无统计学意义, 提示二者并未出现叠加作用。
3 讨论DOX心肌病的作用机制复杂, 氧化应激和细胞凋亡被认为是主要机制[12]。心肌细胞在DOX刺激下, 经过各类氧化还原酶的作用, 在线粒体、肌浆网、胞质中形成半醌自由基, 该自由基可与醌环之间形成循环, 进而传递电子给O2, 并产生大量的ROS[13]。大量研究表明, DOX进入细胞, 能够直接引起细胞坏死、凋亡及自噬。本实验发现JMJD3在DOX心肌细胞毒性模型中呈现时间依赖性上调; 且在整体动物模型中同样表达升高, 提示JMJD3可能参与了DOX心肌病发生发展过程。
JMJD3是含有JmjC结构域的组蛋白去甲基化酶家族的重要成员之一, 在肿瘤、炎症、细胞增殖分化、神经退行性疾病中发挥重要作用[5]。有研究证实, JMJD3通过水解组蛋白H3K27me3上的甲基进而去除其对基因转录的抑制[14]。我们实验室在前期研究证实, JMJD3通过调节β-MHC启动子区域的H3K27me3程度, 改变β-MHC表型向α-MHC转化, 进而影响异丙肾上腺素诱导的心肌肥大[6]。在本实验中, 过表达JMJD3检测凋亡相关蛋白的变化, 发现JMJD3单独即引起心肌细胞凋亡, 也可以加重DOX诱导的细胞凋亡。
STAT家族在调节多种生物功能过程中发挥着重要作用, 迄今发现该家族7个成员, 分别是STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6, 它们可被细胞因子、生长因子激活, 进而调节基因的转录[7]。有文献报道, STAT3可以保护DOX引起的心肌细胞凋亡和线粒体损伤[8]。我们发现, 过表达STAT3可以减轻Ad-JMJD3和DOX引起的心肌细胞凋亡, 这提示STAT3可能参与了JMJD3对DOX心肌病的调控过程。
心血管疾病如心衰、心肌肥大、扩张型心肌病等发病机制复杂, 其发生发展与营养-环境及基因的改变密切相关。近年来, 从表观遗传学角度研究众多疾病机制成为研究热点, 表观修饰对基因的选择性转录表达的调控成为研究表观遗传学与疾病关系的重要内容[6]。本研究中的JMJD3本身是重要的组蛋白去甲基化酶, STAT3作为转录因子与JMJD3之间存在调控关系, 从表观遗传的角度出发, 我们猜测可能是JMJD3通过其组蛋白修饰的作用抑制STAT3的转录, 进而引起心肌细胞损伤。本实验通过过表达JMJD3发现其可以抑制STAT3的蛋白表达及其磷酸化水平。但是关于JMJD3与STAT3之间具体是如何调控的, 是否与JMJD3对STAT3启动子区域的H3K27me3水平的影响有关, 这是我们今后的研究方向之一。
| [1] |
Li L, Takemura G, Li Y, et al. Preventive effect of erythropoietin on cardiac dysfunction in doxorubicin-induced cardiomyopathy[J]. Circulation, 2006, 113(4): 535-43. doi:10.1161/CIRCULATIONAHA.105.568402 |
| [2] |
Gao S, Li H, Cai Y, et al. Mitochondrial binding of a-enolase stabilizes mitochondrial membrane:Its role in doxorubicin-induced cardiomyocyte apoptosis[J]. Arch Biochem Biophys, 2014, 542: 46-55. doi:10.1016/j.abb.2013.12.008 |
| [3] |
Viswanatha Swamy A H, Wangikar U, Koti B C, et al. Cardioprotective effect of ascorbic acid on doxorubicin-induced myocardial toxicity in rats[J]. Indian J Pharmacol, 2011, 43(5): 507-11. doi:10.4103/0253-7613.84952 |
| [4] |
Salminen A, Kaarniranta K, Hiltunen M, Kauppinen A. Histone demethylase Jumonji D3(JMJD3/KDM6B) at the nexus of epigenetic regulation of inflammation and the aging process[J]. J Mol Med(Berl), 2014, 92(10): 1035-43. |
| [5] |
Zhang X, Liu L, Yuan X, et al. JMJD3 in the regulation of human diseases[J]. Protein Cell, 2019, 10(12): 864-82. doi:10.1007/s13238-019-0653-9 |
| [6] |
Guo Z, Lu J, Li J, et al. JMJD3 inhibition protects against isoproterenol-induced cardiac hypertrophy by suppressing β-MHC expression[J]. Mol Cell Endocrinol, 2018, 477: 1-14. doi:10.1016/j.mce.2018.05.009 |
| [7] |
Wang L, Li Z, Tan Y, Li Q, et al. PARP1 interacts with STAT3 and retains active phosphorylated-STAT3 in nucleus during pathological myocardial hypertrophy[J]. Mol Cell Endocrinol, 2018, 474: 137-50. doi:10.1016/j.mce.2018.02.020 |
| [8] |
Kunisada K, Negoro S, Tone E, et al. Signal transducer and activator of transcription 3 in the heart transduces not only a hypertrophic signal but a protective signal against doxorubicin-induced cardiomyopathy[J]. Proc Natl Acad Sci USA, 2000, 97(1): 315-9. doi:10.1073/pnas.97.1.315 |
| [9] |
Boengler K, Hilfiker-Kleiner D, Heusch G, Schulz R. Inhibition of permeability transition pore opening by mitochondrial STAT3 and its role in myocardial ischemia/reperfusion[J]. Basic Res Cardiol, 2010, 105(6): 771-85. doi:10.1007/s00395-010-0124-1 |
| [10] |
Szczepanek K, Chen Q, Derecka M, et al. Mitochondrial-targeted Signal transducer and activator of transcription 3(STAT3) protects against ischemia-induced changes in the electron transport chain and the generation of reactive oxygen species[J]. J Biol Chem, 2011, 286(34): 29610-20. doi:10.1074/jbc.M111.226209 |
| [11] |
Meng S S, Guo F M, Zhang X W, et al. mTOR/STAT-3 pathway mediates mesenchymal stem cell-secreted hepatocyte growth factor protective effects against lipopolysaccharide-induced vascular endothelial barrier dysfunction and apoptosis[J]. J Cell Biochem, 2019, 120(3): 3637-50. |
| [12] |
张婷婷, 矫建, 邵纯君, 刘进朋. 心肌肽对阿霉素诱导心肌细胞H9c2损伤的影响[J]. 中国药理学通报, 2019, 35(7): 991-4. Zhang T T, Jiao J, Shao C J, Liu J P. Protective effect of cardiomyopeptide on doxorubicin induced cell injury in H9c2 cardiomyocytes[J]. Chin Pharmacol Bull, 2019, 35(7): 991-4. doi:10.3969/j.issn.1001-1978.2019.07.020 |
| [13] |
Hu Y, Guo Z, Lu J, et al. sFRP1 has a biphasic effect on doxorubicin-induced cardiotoxicity in a cellular location-dependent manner in NRCMs and Rats[J]. Arch Toxicol, 2018, 93(2): 533-46. |
| [14] |
Wijayatunge R, Liu F, Shpargel K B, et al. The histone demethylase Kdm6b regulates a mature gene expression program in differentiating cerebellar granule neurons[J]. Mol Cell Neurosci, 2018, 87: 4-17. doi:10.1016/j.mcn.2017.11.005 |

