2. 昆明医科大学 基础医学院, 云南 昆明 650500
李利华(1966 -), 男, 教授, 研究方向:毒品滥用机制及戒断干预治疗,通讯作者,E-mail:lilihua1229@ sohu.com
 ,
HE Cui-hua1,
HONG Shi-jun1,
LI Juan2,
HUANG Jian1,
SHEN Bao-yu1,
LI Yuan-yuan1,
LIU Liu1,
ZENG Xiao-feng1
,
HE Cui-hua1,
HONG Shi-jun1,
LI Juan2,
HUANG Jian1,
SHEN Bao-yu1,
LI Yuan-yuan1,
LIU Liu1,
ZENG Xiao-feng1
 ,
LI Li-hua1
,
LI Li-hua1

2. School of Basic Medicine, Kunming Medical University, Kunming 650500, China
甲基苯丙胺(methamphetamine, METH)是一种苯丙胺类中枢神经兴奋剂, 外观呈白色透明不规则晶体, 又称为"冰毒", 其具有依赖性强、复吸率高、神经毒性大等特点[1]。最新中国毒品的形势报告显示, 近年来, 新型合成毒品滥用呈蔓延之势, METH已成为我国毒品滥用人数最多的毒品。METH成瘾一方面严重危害毒品滥用者的身心健康, 同时也对社会的安定造成严重影响。关于毒品成瘾的神经生物学假说较多, 目前被普遍认可的是奖赏物替代学说, 并以此来解释药物滥用产生的机制[2]。但迄今为止, METH滥用成瘾机制尚不清楚, 并且还缺乏公认有效地治疗药物和治疗手段。
NMDAR是一种谷氨酸离子型的受体, 由NR1和NR2A-D亚基组成。在神经元分化、记忆形成和学习过程中具有重要作用[3]。NR2B是NMDAR发挥生理作用的重要亚基, 具有增强学习和记忆能力的作用, 并参与药物依赖发生发展过程。CREB (cAMP反应元件结合蛋白)是机体中一种重要的调节因子, 磷酸化的CREB对基因的转录和蛋白的合成具有较为重要的调节作用, 并可参与NR2B表达的调节。此外, CREB在学习记忆中也扮演着重要作用, 对海马认知功能具有较为重要的调节作用。
条件位置偏爱(conditioned place preference, CPP)是一种衡量药物滥用诱导奖赏效应的模型, 能够评价药物滥用的精神依赖性, 也是寻找治疗药物滥用成瘾的有效工具。
人参皂苷Rb1 (ginsenoside Rb1, Rb1)主要分布在人参、三七、西洋参等植物中, 其在中枢神经系统、心血管系统、免疫系统和抗肿瘤等方面均发挥着较为重要的药理作用。并且Rb1作为一种保护神经系统和心血管系统的抗氧化剂和抗炎剂, 近年来受到越来越多的关注。研究表明, 人参皂苷Rb1对HIV-TAT蛋白和METH协同诱导大鼠血脑屏障损伤具有明显的保护作用[4]。然而Rb1对METH成瘾方面的研究较少。因此, 本研究旨在研究人参皂苷Rb1对METH诱导大鼠CPP的作用并观察NR2B和CREB是否参上述调节作用。
1 材料与方法 1.1 动物SD大鼠, ♂, 体质量(180 ~ 220) g, 购买于昆明医科大学实验动物中心[SCXK(滇) K2015-0002]。动物饲养条件为12 h白天/黑夜循环, 温度控制在(23 ±1) ℃, 大鼠可以自由饮用食物和水, 所有大鼠在CPP装置中适应环境3 d, 然后进行实验。
1.2 试剂和药品METH来源于中国食品药品检定研究院(#171212-200603), METH溶于生理盐水, 终浓度为为2 mg·kg -1。Rb1(纯度89%)购自成都曼斯特生物科技有限公司(#41753-43-9), Rb1溶于生理盐水溶液中, 终浓度为以10 mg·kg-1。抗NR2B, 抗CREB和抗p-CREB体购买于CST (Danvers, MA, USA), 抗β-actin和抗兔以及抗鼠二抗购买于Sigma-Aldrich (St. Louis, MO, USA)。
1.3 CPP装置CPP设备(上海欣软信息有限公司, 型号XR-XT401)由两个相等大小的黑白箱组成, 一侧是白箱, 栅栏状黑色底面; 另一侧是黑色, 网格状黑色底面, 黑白箱之间有一个黑色的小箱分隔, 可让大鼠自由穿梭于黑白箱之间。
1.4 CPP实验方案本实验动物随机分成4个组, 对照组: 10 mg·kg -1生理盐水(i. p), METH组: 2 mg·kg -1 METH (i. p), Rb1组: 10 mg·kg -1 Rb1 (i. p), Rb1 + METH组:给予METH前1 h注射Rb1。CPP实验试验阶段(1 ~ 3 d), 每只大鼠在黑白箱之间自由活动30 min。在d 3, 记录大鼠CPP 15 min。CPP实验阶段(4 - 13 d), 封闭黑白箱, d 4、6、8、10和12, 注射生理盐水或Rb1 1 h之后, 再进行METH腹腔注射, 随后放在伴药箱30 min; d 5、7、9、11和13, 注射生理盐水或Rb1 1 h后, 腹腔注射生理盐水并放入非伴药箱30 min。第14 d, 对大鼠进行CPP测试15 min。CPP分数统计分析方法参照文献[5]。
1.5 Western blot分析用生理盐水进行心脏灌注, 目的是便于固定和方便分离脑组织, 取出大鼠全脑组织后立即置于冰上, 分离出海马组织并保存于- 80 ℃备用。用含有1% PMSF和蛋白酶及磷酸酶抑制剂的RIPA蛋白裂解液裂解适量的海马组织, 并用BCA试剂盒测蛋白浓度。用12% SDS-PAGE分离等量的蛋白质(25 μg)并转移至0.45 μm PVDF膜。膜用5%脱脂牛奶或者5% BSA在室温下封闭2 h, 随后加入相应的一抗(1 : 1 000)于4 ℃冰箱过夜。d 2加相应的二抗(1 : 5 000)并于室温下孵育1 h, 最后用ECL显影并于Bio-Rad凝胶成像仪上观察结果。值得注意的是p-CREB蛋白很容易失活, 因此分离完脑组织后应立即保存在-80 ℃, 并及时提蛋白, 提蛋白必须在冰上进行且裂解液应加入蛋白酶及磷酸酶抑制剂, 蛋白变性后及时进行Western blot检测。用β-actin作为内参, 应用ImageJ软件对Western blot条带进行灰度值比较。
1.6 统计分析实验所有数据均使用SPSS 19.0和GraphPad Prism 5.0进行统计分析。实验数据表示为x ± s。使用单因素方差分析(ANOVA)并进行Tukey检验进行组间比较。
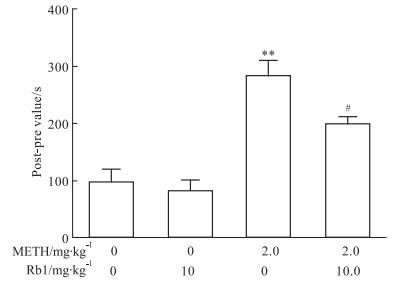
2 结果 2.1 Rb1对METH诱导大鼠CPP的作用METH显着增加了大鼠在伴药箱的时间。而提前注射10 mg·kg -1 Rb1后; 与生理盐水组相比, Rb1对大鼠CPP并没有影响, 而与METH组相比, 大鼠在伴药箱的时间明显减少, 说明Rb1对METH诱导大鼠CPP具有一定抑制作用。
大鼠在CPP箱的运动轨迹图如Fig 2所示, 注射Rb1和METH前, 各组在非伴药箱(黑箱)的轨迹比伴药箱(白箱)多; 给Rb1和METH后, 给药前后自身配对比较, METH组在伴药箱的轨迹明显增加; 而提前注射Rb1后, 与METH组相比, 大鼠在伴药箱的轨迹有所减少。

|
| Fig 2 Effect of Rb1 on METH-induced trajectories in rats A-D-1 represents pre-treated: control group (A-1), Rb1 group (B-1), METH group (C-1) and Rb1 + METH group (D-1); A-D-2 repre-sents post-treated: control group (A-2), Rb1 group (B-2), METH group (C-2) and Rb1 + METH group (D-2) |
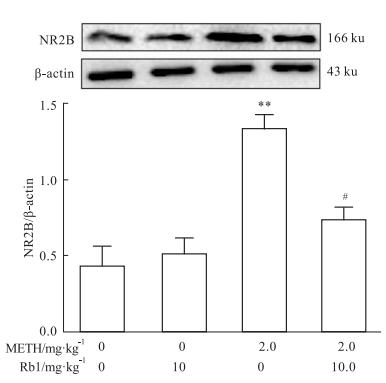
METH组中NR2B的表达水平显着升高, 而提前1 h用Rb1预处理后, 与METH组相比, NR2B的表达水平有所降低(Fig 3)。
|
| Fig 3 Effect of Rb1 on NR2B in hippocampus of METH-induced CPP rats(x ± s, n = 3) Rats were pretreated with Rb1 (10 mg·kg -1 i. p) for 1 h before METH (2 mg·kg -1 i. p), and the expression level of NR2B in hippocampus was detected by Western blot. ** p < 0.01 vs control; # p < 0.05 vs METH. |
如Fig 4所示, METH显着增加了海马组织中p-CREB的表达水平和p-CREB /CREB的比值, 而提前加入Rb1治疗后, 与METH组相比, p-CREB的表达水平和p-CREB /CREB的比值均有所下降, 而给予METH和Rb1后, CREB表达水平均无显著差异。

|
| Fig 4 Effects of Rb1 on CREB and p-CREB in hippocampus of METH-induced CPP rats(x ± s, n = 3) Rats were pretreated with Rb1 (10 mg·kg -1 i. p) for 1 h before METH (2 mg·kg -1 i. p), and the expression levels of CREB and p-CREB in hippocampus were detected by Western blot. **p < 0.01 vs control; # p < 0.05 vs METH. |
本研究主要发现METH可明显诱导大鼠CPP, 这与之前的研究报道一致[6-7]。本研究用人参皂苷Rb1(10 mg·kg -1, i. p)进行前干预后, 发现METH诱导大鼠CPP得到缓解, 与METH组相比, 具有统计学意义, 说明10 mg·kg-1Rb1对METH诱导大鼠CPP具有抑制作用。由于CPP实验可用来评价滥用药物的奖赏效应, 且这种行为表型的缓解可认为与药物戒断治疗具有相同的效果[8]。因此, 本研究结果认为人参皂苷Rb1可作为治疗METH依赖的潜在药物。
海马在调节学习、记忆等方面发挥着至关重要的作用, 也是脑边缘系统中最重要的结构之一, 参与学习、记忆、情绪和条件反射的形成, 海马在药物滥用发展过程中扮演着重要作用[9-10]。因此, 本研究选择的脑区为海马。NMDAR是重要的兴奋性氨基酸离子型受体, 在精神兴奋剂诱导的突触可塑性中具有重要的调节作用, 研究表明, NR-2B激活后, Ca2+大量内流, 胞内Ca2+浓度持续升高, 可引起一系列不良反应。此外, 大量Ca2+超载可诱导自由基连锁反应, 而释放的自由基又可使细胞内Ca2+增加, 如此循环, 最终可致神经元发生变性和死亡[11-12]。CREB对学习和记忆过程尤为重要。本研究发现, 与对照组相比, METH可诱导海马组织中NR2B和p-CREB的表达水平明显升高, 同时p-CREB /CREB的比值升高(P < 0.01), 而提前加入Rb1干预治疗后, 与METH组相比, NR2B和p-CREB的表达水平以及p-CREB/CREB的比值有所下降(P < 0.05)。本研究与先前的研究结果一致, 认为METH可诱导脑组织内NR2B表达水平明显升高[13]。研究表明, 安非他明和METH诱导大鼠CPP与大鼠海马CA1区NR2B的表达以及纹状体和海马中p-CREB和p-Fos的表达有关[14]。上述研究结果均说明NR2B和p-CREB对METH成瘾具有调节作用。本研究使用的Rb1具有广泛的药理作用, 是人参的主要活性成分, 对神经系统具有保护作用[15]。本研究发现, 人参皂苷Rb1对METH诱导的NR2B和p-CREB表达水平升高具有抑制作用, 说明人参皂苷Rb1通过调节NR2B和p-CREB对METH诱导大鼠CPP具有一定的抑制作用。此外, 有研究表明, 钩藤碱可抑制METH诱导斑马鱼CPP效应, 其机制与抑制NR2B的表达有关。说明NR2B在METH成瘾中起着重要作用, 使用药物抑制NR2B对METH成瘾具有潜在治疗作用。
总之, NR2B和p-CREB参与了人参皂苷Rb1对METH诱导大鼠CPP的调节作用, 但METH成瘾的确切机制尚不清楚。在毒品问题全球化的影响下, 寻找并开发新的治疗药物已成为解决当今毒品滥用问题的迫切需求, 也是毒品滥用研究领域今后研究的重点。
| [1] |
杨根梦, 陈逊, 曾晓锋. 甲基苯丙胺诱导神经细胞自噬的研究进展[J]. 中国药理学通报, 2016, 32(10): 1341-4. Yang G M, Chen X, Zeng X F. Research progress of methamphetamine inducing nerve cell's autophagy[J]. Chin Pharmacol Bull, 2016, 32(10): 1341-4. doi:10.3969/j.issn.1001-1978.2016.10.003 |
| [2] |
Arias-Carrion O, Stamelou M, Murillo-Rodriguez E, et al. Dopam- inergic reward system: a short integrative review[J]. Int Arch Med, 2010, 3: 24. doi:10.1186/1755-7682-3-24 |
| [3] |
Knox R, Zhao C, Miguel-Perez D, et al. Enhanced NMDA receptor tyrosine phosphorylation and increased brain injury following neonatal hypoxia-ischemia in mice with neuronal Fyn overexpression[J]. Neurobiol Dis, 2013, 51: 113-9. doi:10.1016/j.nbd.2012.10.024 |
| [4] |
Li J, Zeng B, Hu X, et al. Protective effects of ginsenoside Rb1 against blood-brain barrier damage induced by human immunodefi- ciency virus-1 tat protein and methamphetamine in sprague-dawley rats[J]. Am J Chin Med, 2018, 46(3): 551-6. |
| [5] |
Fu K, Lin H, Miyamoto Y, et al. Pseudoginsenoside-F11 inhibits methamphetamine -induced behaviors by regulating dopaminergic and GABAergic neurons in the nucleus accumbens[J]. Psycho-pharmacology (Berl), 2016, 233(5): 831-40. |
| [6] |
He Z, Chen Y, Dong H, et al. Inhibition of vesicular glutamate transporters contributes to attenuate methamphetamine-induced conditioned place preference in rats[J]. Behav Brain Res, 2014, 267: 1-5. doi:10.1016/j.bbr.2014.02.047 |
| [7] |
Wakida N, Kiguchi N, Saika F, et al. CC-chemokine ligand 2 facilitates conditioned place preference to methamphetamine through the activation of dopamine systems[J]. J Pharmacol Sci, 2014, 125(1): 68-73. |
| [8] |
Zhao Z, Kim YW, Yang Y, et al. Glycyrrhizae radix methanol extract attenuates methamphetamine-induced locomotor sensitization and conditioned place preference[J]. Evid Based Complement Al- ternat Med, 2014, 2014: 152063. |
| [9] |
Liu W, Peng Q X, Lin X L, et al. Effect of rhynchophylline on the expression of p-CREB and sc-Fos in triatum and hippocampal CA1 area of methamphetamine-induced conditioned place preference rats[J]. Fitoterapia, 2014, 92: 16-22. doi:10.1016/j.fitote.2013.10.002 |
| [10] |
Zhou L F, Zhu Y P. Changes of CREB in rat hippocampus, prefrontal cortex and nucleus accumbens during three phases of morphine induced conditioned place preference in rats[J]. J Zhejiang Univ Sci B, 2006, 7(2): 107-13. doi:10.1631/jzus.2006.B0107 |
| [11] |
Yang K. Regulation of excitability in tonic firing substantia gelatinosa neurons of the spinal cord by small-conductance Ca(2 +)-activated K(+) channels[J]. Neuropharm, 2016, 105: 15-24. doi:10.1016/j.neuropharm.2016.01.001 |
| [12] |
Blackstone N W. The impact of mitochondrial endosymbiosis on the evolution of calcium signaling[J]. Cell calcium, 2015, 57(3): 133-9. doi:10.1016/j.ceca.2014.11.006 |
| [13] |
Singhakumar R, Boontem P, Ekthuwapranee K, et al. Melatonin attenuates methamphetamine-induced inhibition of neurogenesis in the adult mouse hippocampus: An in vivo study[J]. Neurosci Lett, 2015, 606: 209-14. doi:10.1016/j.neulet.2015.09.011 |
| [14] |
Kohno M, Okita K, Morales A M, et al. Midbrain functional connectivity and ventral striatal dopamine D2-type receptors: link to impulsivity in methamphetamine users[J]. Mol Psychiatry, 2016, 21(11): 1554-60. doi:10.1038/mp.2015.223 |
| [15] |
Ahmed T, Raza S H, Maryam A, et al. Ginsenoside Rb1 as a neuro-protective agent: A review[J]. Brain Res Bull, 2016, 125: 30-43. doi:10.1016/j.brainresbull.2016.04.002 |