

2. 安徽医科大学第一附属医院高新院区肝胆胰外科,安徽 合肥 230022
2. Dept of Hepatobiliary and Pancreatic Surgery, the First Affiliated Hospital of Anhui Medical University Gao-Xin Branch, Hefei 230022, China
肝纤维化(liver fibrosis,LF)是一种可逆的肝脏损伤修复反应,由病毒性肝炎、酒精性损伤等多种因素引起,以细胞外基质(extracellular matrix,ECM)的过度沉积为特征[1]。肝星状细胞(hepatic stellate cells,HSCs)的激活或活化是细胞外基质的主要来源,被认为是肝纤维化的核心环节[2]。多种生长因子可激活HSCs,如血小板衍生生长因子(platelet derived growth factor,PDGF)。PDGF是HSCs最有效的有丝分裂原,可以通过作用于磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt分子信号通路,激活静止状态的HSCs进而转化为肌成纤维细胞[3]。而真核翻译起始因子4E结合蛋白1(eIF4E-binding protein 1,4EBP1)是PI3K/Akt/mTOR信号通路下游重要的靶分子,主要调控Cap-依赖型的mRNA翻译[4]。
七叶皂苷钠(Sodium Aescinate,SA)是中药娑罗子中提取的主要活性成分,具有抗炎、抗脑水肿等作用[5]。相关研究表明,SA可以改善急性肝损伤[6],具有保护肝细胞的生物学作用。而且本课题组前期研究证实,SA可抑制肝癌细胞系中4EBP1的磷酸化,进而抑制肝癌细胞的增殖等。因此,我们推测SA可能通过抑制4EBP1的磷酸化进而抑制HSCs活性以及肝纤维化的形成。
1 材料与方法 1.1 材料 1.1.1 实验动物及细胞株健康Sprague-Dawley大鼠,♂,体质量(180~200) g,购于安徽医科大学实验动物中心,许可证号:SCXK(皖)2017-001。在室温(20~25) ℃、湿度40%~60%、12 h照明与12 h黑暗交替的环境中饲养,自由进食、饮水,饲养观察一周后进行实验。大鼠肝星状细胞HSC-T6细胞株购于广州吉妮欧生物科技有限公司。
1.1.2 药品与试剂注射用七叶皂苷钠(山东绿叶制药有限公司); 橄榄油(购自市场); 四氯化碳(carbon tetrachloride,CCl4)(上海阿拉丁生化科技股份有限公司, 纯度99.5%); Masson三色染色液(固绿法)(G1343, 北京索莱宝科技有限公司); 超敏二步法免疫组化检测试剂盒(PV9001, 北京中杉金桥公司); 兔抗p-4EBP1单克隆抗体(236B4, #2855, 美国CST公司); 兔抗α平滑肌肌动蛋白单克隆抗体(alpha smooth muscle actin,α-SMA)(A11111, 武汉爱博泰克生物科技有限公司); 兔抗Ⅰ型胶原蛋白多克隆抗体(collagen Ⅰ,COL-Ⅰ)(BA0325, 武汉博士德生物工程有限公司); 鼠抗Ⅲ型胶原蛋白单克隆抗体(collagen Ⅲ,COL-Ⅲ) (BM1625, 武汉博士德生物工程有限公司); 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT); 鼠抗β-actin单克隆抗体(美国Santa Cruz公司); ECL发光试剂盒(美国Pierce公司); 胎牛血清(fetal bovine serum,FBS)(美国Gibco公司); Annexin V-FITC/PI细胞凋亡检测试剂盒(批号:556547, 美国BD公司); PI/RNase Staining Buffer(批号:550825, 美国BD公司); BCA蛋白浓度测定试剂盒(中国碧云天公司)。
1.1.3 主要仪器与设备KHB(ST-360)酶标仪(中国上海),CytoFLEX流式细胞仪(美国Beckman Coulter公司),微量振荡仪(海门市其林贝尔仪器制造有限公司)。
1.2 方法 1.2.1 动物模型制备及给药方案41只健康♂ SD大鼠随机分为:A.正常空白对照组(n=5);B.CCl4模型组(=18);C.七叶皂苷钠治疗组(n=18)。B和C组均腹腔注射体积分数为50%的CCl4橄榄油溶液(橄榄油:CCl4 1 :1),每周2次,共8周(首次剂量为2 mL·kg-1,其余剂量为1 mL·kg-1),A组给予相同剂量的橄榄油,自第3周开始,C组每天腹腔注射3.6 mg·kg-1七叶皂苷钠溶液(溶于生理盐水配制为1 g·L-1溶液)1次,共6周,A和B组同期给予相应量的生理盐水溶液。
1.2.2 标本采集至8周末实验结束时,大鼠称重后,予以腹腔注射3%戊巴比妥钠50 mg·kg-1进行麻醉,手术切取标本(肝脏组织均取自于大鼠肝右中叶)。标本保存于RNA组织保存液(中国碧云天公司),-80℃冻存。
1.2.3 肝脏组织病理学检查组织标本常规10%中性福尔马林固定、石蜡包埋等处理。常规HE染色:切片依次用二甲苯、无水乙醇、95%乙醇、70%乙醇、50%乙醇脱蜡至水,蒸馏水漂洗,苏木素染色10 s,蒸馏水洗10 min,伊红染色20 s,蒸馏水洗5 min,50%、70%、95%梯度乙醇脱水,二甲苯透明,中性树胶封片。Masson染色:切片按上述步骤脱蜡至水,Weigert铁苏木素染色液染色5 min,蒸馏水洗,酸性乙醇分化15 s,蒸馏水洗,Masson蓝化液返蓝5 min,蒸馏水洗,丽春红品红染色液染色4 min,蒸馏水洗,0.2%乙酸溶液洗涤,磷钼酸溶液分化1~2 min(显微镜下控制至胶原纤维呈淡红色),0.2%乙酸溶液洗涤,固绿染色液染色2 min,0.2%乙酸溶液洗涤,依次置于95%乙醇、无水乙醇,二甲苯透明,中性树胶封片。
1.2.4 肝脏组织免疫组化切片脱蜡至水,置于枸橼酸钠缓冲液中(含0.05%Tween-20, pH 6.0),在高压锅中煮沸3 min,3%过氧化氢-甲醇混合液阻断内源性过氧化物活性,正常山羊血清室温封闭1 h,使用一抗(α-SMA、COL-Ⅰ、p-4EBP1 1 :100稀释,COL-Ⅲ 1 :50稀释)4℃孵育过夜,次日室温孵育二抗20 min,DAB显色,苏木精复染细胞核,50%、70%、95%梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.2.5 细胞系和细胞培养大鼠肝星状细胞HSC-T6使用含15%胎牛血清的DMEM培养基中培养,置于37℃、5% CO2的培养箱中,取生长状态良好的处于对数生长期的细胞用于实验。细胞每2 d更换培养基1次,传代次数不超过10代。
1.2.6 MTT检测取对数生长期的HSC-T6,以1.5×103个/孔的密度接种至96孔板,以10、20、30、40、50、60 μmol·L-1的SA处理48 h,对照组给予相同量的DMSO,然后向每个孔中加入10 μL MTT溶液,将细胞在37 ℃下孵育4 h。加入150 μL异丙醇,在微量振荡仪上振荡30 min,待紫色晶体完全溶解后,使用酶标仪在570 nm、630 nm处检测OD值,取其差值,使用以下公式计算细胞生存率:细胞生存率/%=OD实验组/OD对照组×100%。
1.2.7 细胞周期将3×108·L-1呈指数生长的HSC-T6细胞接种至培养皿,用30 μmol·L-1的SA干预细胞48 h后,胰蛋白酶消化、离心,使细胞重悬于PBS液中,离心,弃上清,用1 mL 70%乙醇固定,加入PI染液500 μL,在4 ℃冰箱中避光染色30 min,使样品成为合格的单细胞悬液,上机检测。
1.2.8 细胞凋亡检测将HSC-T6细胞接种于培养皿, 贴壁后用30 μmol·L-1的SA处理48 h, 胰蛋白酶消化, 预冷PBS洗涤2次后, 用100 μL缓冲液(1×108·L-1)重悬后,然后加入5 μL FITC Annexin V和5 μL PI, 避光反应15 min, 最后加入400 μL缓冲液至管中, 通过流式细胞仪检测。
1.2.9 Western blot将细胞在RIPA裂解液中冰浴裂解20 min,4 ℃、13 200 r·min-1离心20 min。将上清液保存在-80 ℃。使用BCA试剂盒测定蛋白质浓度。将等量的蛋白质加载到SDS-聚丙烯酰胺凝胶上进行电泳, 并转移到PVDF膜。5% BSA室温下封闭1 h, 抗体α-SMA(1 :500)、COL-Ⅰ、COL-Ⅲ和p-4EBP1(1 :1 000)在4 ℃孵育过夜。与二抗(1 :10 000)在室温下孵育1 h。ECL试剂盒显色,使用Image J软件分析Western blot灰度值。
1.2.10 统计学分析统计学分析通过软件Prism 6.0 (GraphPad,San Diego,CA)实现。细胞相关数据均独立重复3次。定性资料采用卡方检验进行分析,两组间的计量资料,采用t检验分析,多组(≥3组)之间计量资料比较采用One-way ANOVA分析(Dunnett’s post-hoc检验方法)。
2 结果 2.1 SA减缓CCl4诱导的大鼠肝脏纤维化形成本研究中,CCl4模型组及SA治疗组共36只大鼠,其中17只死亡,存活率53%。正常对照组肝脏表面光滑,边缘锐利,质软。CCl4模型组肝脏表面呈粗颗粒状,边缘钝,质韧。SA治疗组肝脏组织表面呈细小颗粒状,质地较CCl4模型组稍软(Fig 1)。
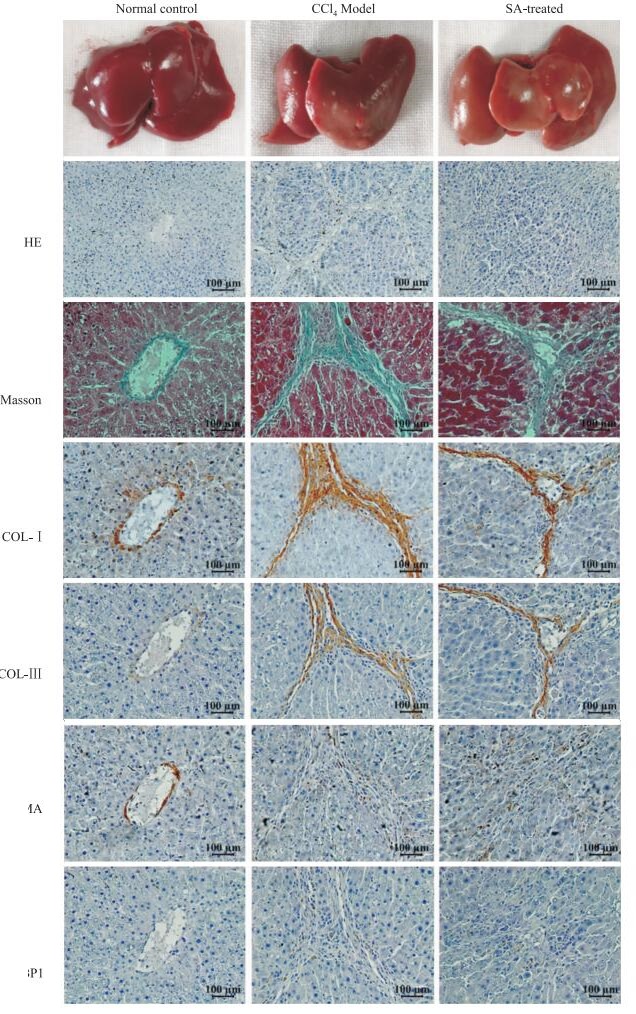
|
| 图 1 Photographs, HE staining (×100), Masson staining (×200), immunohistochemistry (×200) of liver tissues in normal control, CCl4 model and SA-treated groups |
HE染色以及Masson染色结果显示(Fig 1),CCl4模型组及SA治疗组较正常对照组均有纤维组织增生,SA治疗组较CCl4模型组胶原纤维增生明显减少,肝纤维化程度明显减轻。
2.2 SA抑制HSC-T6细胞的增殖并促进其凋亡MTT结果显示(Fig 2),SA处理48 h后可以明显抑制HSC-T6细胞的增殖。Fig 3细胞凋亡结果分析表明,SA(30 μmol·L-1)能明显促进HSC-T6细胞的早期凋亡。但是同样浓度的SA处理HSC-T6细胞后,细胞周期却无明显变化(Fig 4)。
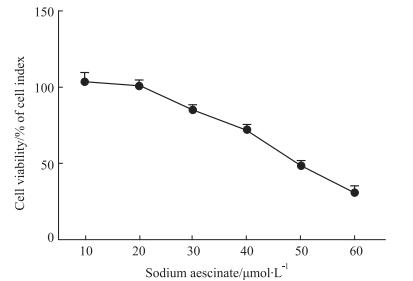
|
| 图 2 Effect of SA on HSC-T6 cell lines for 48 h (x±s, n=3) |
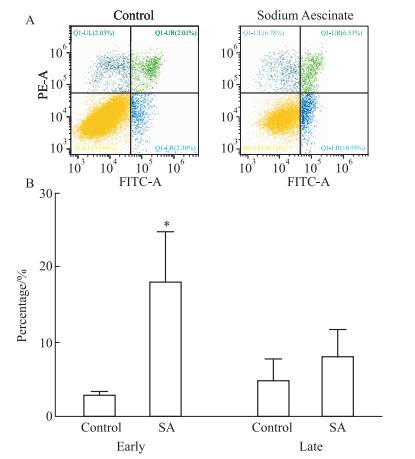
|
| 图 3 Effect of SA on apoptosis of HSC-T6 cells (x±s, n=3) A:The number of early apoptosis of SA-treated HSC-T6 cells was higher than that of the control group; B:The early apoptotic rate of SA-treated HSC-T6 cells was significantly higher than that of the control group, *P < 0.05 vs control. |
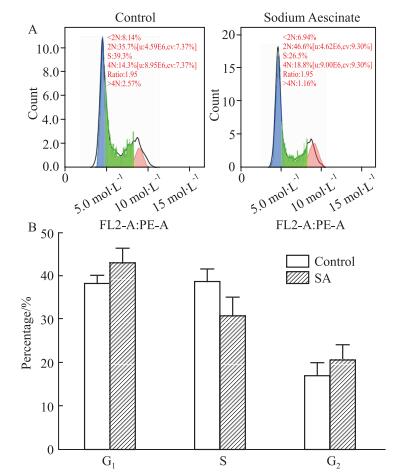
|
| 图 4 Effect of SA on cell cycle of HSC-T6 cells(x±s, n=3) A: The number of HSC-T6 cells in the cell cycle of the control group and SA-treated group; B: SA has no significant effect on the cell cycle of HSC-T6 cells. |
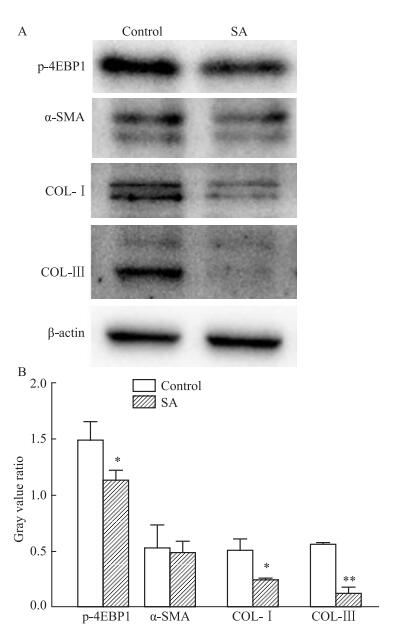
免疫组化结果显示(Fig 1),COL-Ⅰ、COL-Ⅲ以及α-SMA在正常肝脏组织中主要分布于血管壁周围。COL-Ⅰ、COL-Ⅲ在CCl4模型组中的表达明显高于SA治疗组,而α-SMA的表达无差异。Western blot结果表明,SA可下调HSC-T6细胞中COL-Ⅰ及COL-Ⅲ的表达,α-SMA的表达仍无差异(Fig 5)。
2.4 SA下调大鼠体内以及HSC-T6细胞4EBP1的磷酸化水平免疫组化结果提示,SA治疗组的大鼠肝脏组织中4EBP1磷酸化水平较CCl4模型组下调(Fig 1)。同时,Western blot结果显示经过SA处理的HSC-T6细胞4EBP1磷酸化水平降低(Fig 5)。体内体外实验均表明SA可下调4EBP1磷酸化水平。
|
| 图 5 Expression of p-4EBP1, α-SMA, COL-Ⅰ and COL-Ⅲ in HSC-T6 cells after SA treatment (x±s, n=3) A: Western blot was used to detect the expression of p-4EBP1, α-SMA, COL-Ⅰ and COL-Ⅲ in the control group and SA-treated group of HSC-T6 cells; B:p-4EBP1, α-SMA, COL-Ⅰ and COL-Ⅲ gray value ratio, *P < 0.05, **P < 0.01 vs control. |
七叶皂苷钠目前在临床上主要应用于慢性下肢静脉功能不全、脑水肿、创伤性及外科术后软组织肿胀等的治疗[5]。肝纤维化是由于酒精中毒、非酒精性脂肪性肝炎、病毒性肝炎、自身免疫性肝炎和胆汁淤积性肝病等多种因素诱导的情况下,肝细胞和肝库普弗细胞(Kupffer细胞)分泌细胞因子、活性氧、趋化因子和生长因子等化合物并且刺激HSCs活化,从而促进肝脏中细胞外基质的过度积累,并导致纤维性瘢痕形成的病理过程[7]。近年来,国内外研究发现,中药在抑制肝纤维化进展和促进肝纤维化逆转方面有着它独特的优势,并且很多研究从机制上肯定了其作用,但七叶皂苷钠是否能够对肝纤维化具有一定的治疗效果尚无明确研究。
细胞外基质的过度合成,例如胶原蛋白(主要是Ⅰ型和Ⅲ型胶原蛋白),是所有纤维化疾病发生的分子标志。Ⅰ型胶原主要通过整合素α1β1、Ⅲ型胶原主要通过盘状结构域受体1作用于HSCs的激活、增殖以及迁移[8]。HSCs在细胞外基质的过度产生、沉积中发挥主要作用。α-SMA以及Ⅰ型和Ⅲ型胶原蛋白的表达增高是HSCs激活的重要标志[9]。万星等[10]的研究表明,鬼箭羽醇提物可以通过降低Ⅰ型胶原蛋白和α-SMA的生成从而达到抑制实验性肝纤维化的作用。本研究中大鼠肝脏组织免疫组化结果提示七叶皂苷钠可以减少大鼠Ⅰ型、Ⅲ型胶原的合成,而且细胞实验结果证实七叶皂苷钠可以抑制HSCs的增殖并降低Ⅰ型、Ⅲ型胶原的表达。而动物实验的结果提示七叶皂苷钠可明显减缓CCl4诱导的肝纤维化,因此可以认为七叶皂苷钠通过抑制HSCs的增殖降低Ⅰ型、Ⅲ型胶原的表达,进而减少细胞外基质的产生实现其抗纤维化作用。
PI3K/Akt/mTOR信号通路的激活与肝纤维化的发生发展密切相关,阻断该通路可以抑制HSCs的活化、增殖以及胶原的分泌,从而抑制肝纤维化的发展[11]。Walker等[12]证实纤维化过程中间充质细胞中Ⅰ型胶原纤维的表达依赖于mTOR复合物1介导的4EBP1信号轴。Pérez de Obanos等[13]的研究发现亮氨酸可以通过激活4EBP1的磷酸化进而在mRNA翻译水平诱导Ⅰ型胶原蛋白的产生并激活HSCs。Dai等[14]的研究表明,神经肽Y通过激活mTOR/4EBP1信号通路诱导肝纤维化发生,并且其受体拮抗剂可以阻断该纤维化反应。我们课题组前期研究表明,七叶皂苷钠可以下调肝细胞癌细胞中4EBP1的磷酸化水平并抑制肝细胞肝癌细胞系的增殖。因此,我们推断七叶皂苷钠抑制HSCs活性的机制可能与4EBP1的磷酸化有关,通过检测七叶皂苷钠处理后的大鼠肝脏组织以及HSCs中4EBP1的磷酸化水平,我们发现七叶皂苷钠明显抑制了4EBP1的磷酸化水平。因此,我们认为七叶皂苷钠抑制HSCs增殖的生物学过程可能与4EBP1的磷酸化抑制有关。
综上所述,七叶皂苷钠通过抑制HSCs增殖减缓肝纤维化进展,并且与4EBP1的磷酸化的失活有关。本研究结果提示七叶皂苷钠可作为潜在的治疗肝纤维化的药物。但是七叶皂苷钠的分子生物学机制应该是多方面的,并且我们仍然在深入研究七叶皂苷钠在抑制肝纤维化中的机制,为其临床应用的可能性提供更加充分的基础支持。
( 致谢: 本实验主要在安徽医科大学科研实验中心完成,在此特别感谢实验室老师和同学的指导和帮助!)
| [1] |
Hernandez-Gea V, Friedman S L. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011, 6: 425-56. doi:10.1146/annurev-pathol-011110-130246 |
| [2] |
Puche J E, Saiman Y, Friedman S L. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol, 2013, 3(4): 1473-92. |
| [3] |
Lee U E, Friedman S L. Mechanisms of hepatic fibrogenesis[J]. Best Pract Res Clin Gastroenterol, 2011, 25(2): 195-206. doi:10.1016/j.bpg.2011.02.005 |
| [4] |
Hsieh A C, Costa M, Zollo O, et al. Genetic dissection of the oncogenic mTOR pathway reveals druggable addiction to translational control via 4EBP-eIF4E[J]. Cancer Cell, 2010, 17(3): 249-61. doi:10.1016/j.ccr.2010.01.021 |
| [5] |
杨名, 裴晓华. 娑罗子中有效成分的药理学及临床应用[J]. 世界中医药, 2017, 12(12): 3138-41, 3150. Yang M, Pei X H. Pharmacological study on semen aesculi active ingredient and clinical application progress[J]. World Chin Med, 2017, 12(12): 3138-41, 3150. doi:10.3969/j.issn.1673-7202.2017.12.070 |
| [6] |
Du Y, Wang T, Jiang N, et al. Sodium aescinate ameliorates liver injury induced by methyl parathion in rats[J]. Exp Ther Med, 2012, 3(5): 818-22. doi:10.3892/etm.2012.479 |
| [7] |
Sun M, Kisseleva T. Reversibility of liver fibrosis[J]. Clin Res Hepatol Gastroenterol, 2015, 39(1): S60-3. |
| [8] |
Karsdal M A, Manon-Jensen T, Genovese F, et al. Novel insights into the function and dynamics of extracellular matrix in liver fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308(10): G807-30. doi:10.1152/ajpgi.00447.2014 |
| [9] |
Atzori L, Poli G, Perra A. Hepatic stellate cell: a star cell in the liver[J]. Int J Biochem Cell Biol, 2009, 41(8-9): 1639-42. doi:10.1016/j.biocel.2009.03.001 |
| [10] |
万星, 郭琼, 刘向东, 等. 鬼箭羽醇提物对四氯化碳诱导小鼠肝纤维化模型的作用[J]. 中国药理学通报, 2018, 34(4): 485-90. Wan X, Guo Q, Liu X D, et al. The inhibitory effect of Euonymus alatus against mouse hepatic fibrosis induced by CCl4[J]. Chin Pharmacol Bull, 2018, 34(4): 485-90. doi:10.3969/j.issn.1001-1978.2018.04.010 |
| [11] |
吴长会, 沈敏, 李龙, 等. PI3K/Akt/mTOR/p70S6K信号通路在肝纤维化发生发展中的作用[J]. 临床肝胆病杂志, 2015, 31(11): 1928-32. Wu C H, Shen M, Li L, et al. Association between P13K/Akt/mTOR/p70S6K signaling pathway and hepatic fibrosis[J]. J Clin Hepatol, 2015, 31(11): 1928-32. doi:10.3969/j.issn.1001-5256.2015.11.043 |
| [12] |
Walker N M, Belloli E A, Stuckey L, et al. Mechanistic target of rapamycin complex 1 (mTORC1) and mTORC2 as key signaling intermediates in mesenchymal cell activation[J]. J Biol Chem, 2016, 291(12): 6262-71. doi:10.1074/jbc.M115.672170 |
| [13] |
Pérez de Obanos M P, López Zabalza M J, Prieto J, et al. Leucine stimulates procollagen alpha1(I) translation on hepatic stellate cells through ERK and PI3K/Akt/mTOR activation[J]. J Cell Physiol, 2006, 209(2): 580-6. doi:10.1002/jcp.20790 |
| [14] |
Dai W, Liu Y, Zhang Y, et al. Expression of neuropeptide Y is increased in an activated human HSC cell line[J]. Sci Rep, 2019, 9(1): 9500. doi:10.1038/s41598-019-45932-3 |

