


2. 新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830046;
3. 新疆大学应用化学研究所,先进功能材料自治区重点实验室,新疆 乌鲁木齐 830046
赵惠新(1975-), 女,博士,副教授,硕士生导师,研究方向:药用植物生理生化与分子生物学,通讯作者,E-mail: zhaohuixin101@sina.com。
 ,
LI Jin-yao2,
XU Guan-cheng3,
WU Yan-fei1,
LI Xin-yi1,
WANG Ru1,
LI Yan-hong1,
WANG Xiao-jing1,
ZHAO Hui-xin1
,
LI Jin-yao2,
XU Guan-cheng3,
WU Yan-fei1,
LI Xin-yi1,
WANG Ru1,
LI Yan-hong1,
WANG Xiao-jing1,
ZHAO Hui-xin1 ,
LI Jin-yu1
,
LI Jin-yu1

2. Xinjiang Key Lab of Biological Resources and Genetic Engineering, College of Life Science and Technology,Xinjiang University, Urumqi 830046, China;
3. Key Lab of Advanced Functional Material, Institute of Applied Chemistry, Xinjiang University, Urumqi 830046, China
原发性肝癌是一种全球发病率第七、死亡率第三,5年生存率仅为18%的一种常见恶性肿瘤[1-2]。目前手术配合化疗仍然是肝癌的一线治疗方法。诸如顺铂、卡铂、奥沙利铂等铂类药物已用于肝癌的临床治疗。但这些药物伴有严重的副作用和抗药性。因此,急需开发高效低毒的新型化疗药物。
4-酰基吡唑啉酮衍生物是一类含有氮杂环的β-二酮,含有灵活的配位原子和配位方式,可直接与过渡金属离子形成具有生物活性的化合物,具有抗菌[3]、抗肿瘤[4-5]、抗氧化[6]等生物活性,并能克服传统抗肿瘤药物引起的耐药性及毒副作用,因此4-酰基吡唑啉酮金属配合物是具有潜力的新型抗肿瘤药物。研究证实,4-酰基吡唑啉酮金属配合物对卵巢癌[5]、宫颈癌[4, 7]、食管癌[7-9]、黑色素瘤[10]等具有一定的增殖抑制作用,甚至有的活性优于顺铂[9],但对肝癌作用及其机制少见报道。研究发现,某些混合配体铜配合物能强烈结合和切割DNA,表现出显著的抗癌活性[11]。为了寻求更好的具有生物活性的新型过渡金属配合物,本研究设计合成了一种4-酰基吡唑啉酮和呋喃甲酰肼(furoic acid hydrazide,FAH)的新型席夫碱配体,并引入2, 2’-联吡啶(bipyridine,bpy)辅配体,通过溶液法制备了Cu配合物(P-FAH-Cu-bpy),以期探讨此新型配合物的抗肝癌活性和抗肿瘤机制,为进一步开发4-酰基吡唑啉酮金属配合物奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 细胞株人肝癌细胞BEL-7404,购于上海欧易生物医学科技有限公司。
1.1.2 药物与主要试剂P-FAH-Cu-bpy由新疆大学应用化学研究所制备;MTT、二甲基亚砜(DMSO)(美国Sigma公司);顺铂(Cisplatin)(上海源叶生物有限公司);RPMI 1640培养基、胎牛血清(FBS)、胰蛋白酶、双抗(青霉素和链霉素混合液),美国Gibco公司;细胞凋亡试剂盒,上海翊圣生物科技公司;细胞周期试剂盒,美国BD公司;Hoechst 33258染液,活性氧(reactive oxygen species,ROS)和线粒体膜电位(mitochondrial membrane potential,Δψm)试剂盒,β-actin、Bcl-2抗体,上海碧云天生物技术有限公司;BCA蛋白定量试剂盒,ECL显色剂,美国赛默飞公司;caspase-3/7/8/9、Cyto C、Bax抗体、山羊抗鼠IgG和山羊抗兔IgG,美国Cell Signaling Technology公司;PARP、VEGF抗体,武汉博士德公司;MMP-2抗体,武汉伊莱瑞特生物科技有限公司。1-苯基-3-甲基-4-对氯苯甲酰基-5-吡唑啉酮(1-phenyl-3-methyl-4-(4-chlorobenzoyl)-5-pyrazolone,PM4ClBP),FAH,bpy,甲醇,乙醇,冰醋酸,Cu(OAC)2·H2O均为分析纯。
1.1.3 仪器Bruker APEXII CCD X-射线单晶衍射仪(德国Bruker公司),Benchmark plus酶标仪(美国Bio-Rad公司), FACS Calibur流式细胞仪(美国BD Biosciences公司),LAS4000超敏化学发光成像仪(美国GE公司),Eclipse E20荧光倒置显微镜(日本Nikon公司),电泳仪(美国Bio-Rad公司),台式高速冷冻离心机(美国Thermo公司)
1.2 方法 1.2.1 P-FAH-Cu-bpy配合物的合成 1.2.1.1 1-苯基-3-甲基-4-对氯苯甲酰基-5-吡唑啉酮缩呋喃甲酰肼配体(N-(1-phenyl-3-methyl-4-(4-chlorobenzoyl)-5-pyrazolone)-2-furancarboxylic acid hydrazide, PM4ClBP-FAH(H2L))的合成将FAH (2.52 g 20 mmol)溶解于40 mL热的乙醇中,等物质量的PM4ClBP (6.26 g 20 mmol)溶解于40 mL乙醇中,待完全溶解后加入至FAH的乙醇溶液中,再加入7-8滴冰醋酸作为催化剂,回流搅拌4 h后得到黄色溶液。冷却后可得粗产品,抽滤、乙醇重结晶后得到纯净的黄色固体产物,产率75%。将PM4ClBP-FAH (0.042 g 0.1mmol)溶于10 mL乙醇后过滤,滤液缓慢挥发,五天后得到黄色块状晶体。C22H17ClN4O3 (F.w.: 420.85), 元素分析:实测值(理论值%):C 62.73 (62.59), H 4.04 (4.25), N 13.31 (13.64)。
1.2.1.2 [Cu(L)(bpy)]·CH3OH配合物的合成将配体H2L (0.029 5 g 0.07 mmol)溶解于10 mL甲醇与CH2Cl2(8/2, V/V)溶液中,等物质量Cu(OAC)2·H2O (0.0140 g 0.07 mmol)的甲醇溶液逐滴加入到配体溶液中,搅拌10 min后,向混合溶液中加入等物质量2, 2’-联吡啶(0.0109 g 0.07 mmol)的甲醇溶液,室温下搅拌反应2 h后过滤。滤液置于室温下缓慢挥发,1周后得到绿色晶体。C33H27ClCuN6O4 (F.w.: 670.60), 元素分析:实测值(理论值%):C 59.05 (59.28), H 4.02 (4.15), N 12.52 (12.37)。
1.2.1.3 X-射线单晶衍射实验晶体衍射数据在Bruker APEXII CCD X-射线单晶衍射仪上收集,入射线选用λ=0.71073 Å的石墨单色化的Mo-κa射线。采用Bruker Shelxtl程序,用直接法解出晶体结构(Fig 1),用全矩阵最小二乘法对全部非氢原子进行精修。

|
| 图 1 Crystal structure of [Cu(L)(bpy)]·CH3OH with atom numbering scheme |
将BEL-7404细胞接种在含有10% FBS、青霉素-链霉素的RPMI 1640培养基, 并置于37 ℃、5% CO2培养箱培养,取对数生长期的细胞进行实验。
P-FAH-Cu-bpy配合物使用前用DMSO溶解配成7.5 mmol·L-1母液,过滤除菌后4 ℃避光保存,使用时用RPMI 1640培养基稀释成工作液。
1.2.3 MTT法检测细胞增殖取对数生长期的BEL-7404细胞,胰蛋白酶消化,制成8×106·L-1的细胞悬液,每孔100 μL细胞悬液接种于96孔板中,37 ℃培养24 h后,用P-FAH-Cu-bpy(0、3、4.5、6、7.5 nmol·L-1)和0.1% DMSO(相当于7.5 nmol·L-1工作液中DMSO的浓度)分别处理BEL-7404细胞24、48、72 h,以不加配合物为空白对照,顺铂为阳性对照。然后,1 200 r·min-1离心7 min,弃上清,加入100 μL无血清RPMI 1640培养基稀释的MTT溶液(0.5 g·L-1),37 ℃孵育4 h后,移除MTT溶液,每孔加入200 μL DMSO震荡10 min溶解结晶紫,酶标仪490 nm处读取各孔吸光度值,按照如下公式计算细胞的相对活性:细胞的相对活性/%=实验组平均OD值/对照组平均OD值×100%。
1.2.4 倒置显微镜和Hoechst 33258染色法观察细胞及核形态变化按照MTT法接种和培养细胞,P-FAH-Cu-bpy(0、3、4.5、6、7.5 nmol·L-1)作用细胞24 h,采用倒置显微镜观察BEL-7404细胞形态;取对数期生长的BEL-7404细胞,以每孔1×105个细胞接种于24孔细胞培养板,37 ℃培养24 h后,P-FAH-Cu-bpy(0、3、4.5、6 nmol·L-1)作用24 h,移除培养基,PBS清洗1次,预冷的4%多聚甲醛4 ℃固定10 min,PBS清洗2次,移除PBS,每孔加入500 μL Hoechst 33258染色剂, 避光染色10 min,荧光倒置显微镜观察拍照。
1.2.5 流式细胞术检测细胞凋亡取对数生长期的BEL-7404细胞以每皿4×105个细胞接种于60 mm细胞培养皿,37 ℃培养24 h后,P-FAH-Cu-bpy(0、3、4.5、6 nmol·L-1)处理24 h,胰蛋白酶消化制备细胞悬液,1 200 r·min-1离心7 min,移除上清,PBS洗两次。然后按照Annexin V-FITC/PI凋亡检测试剂盒说明书避光染色10 min,流式细胞仪进行检测分析。
1.2.6 流式细胞术检测细胞周期按照“1.2.5”方法接种细胞,37 ℃培养24 h后,P-FAH-Cu-bpy(0、3、4.5 nmol·L-1)作用12 h,胰蛋白酶消化制备细胞悬液,1 200 r·min-1离心7 min,移除上清,PBS洗两次,70%预冷乙醇4 ℃固定3 h,使用碘化丙啶(PI)染色,流式细胞仪进行分析。
1.2.7 流式细胞术检测胞内ROS和Δψm按照“1.2.5”方法接种细胞,37 ℃培养24 h后,P-FAH-Cu-bpy(0、3、4.5、6 nmol·L-1)作用24 h,胰蛋白酶消化制备细胞悬液,1 200 r·min-1离心7 min,移除上清,PBS洗一次,然后采用(1)DCFH-DA荧光探针37 ℃孵育30 min,PBS洗一次,流式细胞仪检测胞内ROS;(2)JC-1荧光探针37 ℃孵育30 min,PBS洗一次,流式细胞仪检测Δψm。
1.2.8 划痕实验检测细胞迁移取对数期生长的BEL-7404细胞以每孔1×105个细胞接种于24孔细胞培养板,37 ℃培养24 h后,待细胞达到80%融合时,用10 μL枪头在每孔中央划线,PBS清洗一遍,分别在P-FAH-Cu-bpy(0、3、4.5、6 nmol·L-1)处理细胞0、24、48 h后,采用明场倒置显微镜观察拍照,按照如下公式计算伤口愈合率/%=(1-某一时间点划痕面积/0 h划痕面积)×100%。
1.2.9 Western blot检测相关蛋白表达取对数期生长的BEL-7404细胞以每皿8×105个细胞接种于100 mm细胞培养皿,37 ℃培养24 h后,P-FAH-Cu-bpy(0、3、4.5、6 nmol·L-1)作用24 h,胰蛋白酶消化并制备细胞悬液,离心去上清液,预冷PBS洗一遍,按1 :100比例加入蛋白酶抑制剂和RIPA裂解液,冰上裂解20 min,4 ℃ 12 000 r·min-1离心10 min收集上清,采用BCA法测定蛋白含量,取相同总蛋白进行12% SDS-PAGE电泳分离,转至硝酸纤维素(PVDF)膜,用含有5%脱脂奶粉的PBST缓冲液37 ℃封闭2 h,一抗(β-actin、caspase-3、7、8、9、PARP、Bcl-2、Bax、Cyto C、MMP-2、VEGF)37 ℃孵育2 h,PBST洗涤3次,每次10 min,二抗(HRP标记的山羊抗鼠IgG或山羊抗兔IgG)37 ℃孵育1 h,PBST洗涤3次,用ECL试剂盒显色观察蛋白条带。
1.2.10 统计学分析利用GraphPad Prism 5.0进行统计学分析,实验数据以x±s,采用单因素方差分析(One Way ANOVA)。
2 结果与分析 2.1 P-FAH-Cu-bpy配合物的晶体结构[Cu(L)(bpy)]·CH3OH结晶于单斜晶系,P21/c空间群,属于单核结构,不对称结构单元中包含了一个中心金属Cu2+离子,一个配体阴离子L2-和一个2, 2’-联吡啶分子以及一个甲醇溶剂分子。Fig 1可知,中心金属Cu2+离子为五配位模式,每个Cu2+离子分别与一个配体阴离子L2-的两个氧原子和一个氮原子(O1、O2和N5)配位,另外两个参与配位的N1和N2原子来自2, 2’-联吡啶分子,共同构成CuN3O2的配位环境,空间构型为扭曲的四方锥。基平面由O1、O2、N1和N5原子构成,其中Cu1-O1,Cu1-O2,Cu1-N1和Cu1-N5的键长分别为1.915(5)Å,1.940(5)Å,1.997(6)Å和1.920(5)Å,其键长数值均属于正常范围。四方锥的顶点由N2占据,其Cu1-N2的键长为2.143(6)Å。O1-Cu1-O2和N5-Cu1-N1的键角分别为156.9(3)°和176.2(3)°,这些键角数据均不同程度的偏离理论值180°,表明Cu2+离子的配位构型为严重扭曲的四方锥。
2.2 P-FAH-Cu-bpy抑制BEL-7404细胞增殖如Fig 2A所示,随着P-FAH-Cu-bpy作用浓度的增加,BEL-7404细胞形态逐渐从有规则到无规则,再到变圆,细胞间隙增大,细胞数量减少。MTT结果显示,与对照组相比,P-FAH-Cu-bpy体外明显抑制了BEL-7404细胞的增殖(P < 0.01),且呈浓度和时间效应(Fig 2B)。其作用24、48、72 h的IC50值分别为:5.85、0.43和0.03 nmol·L-1。
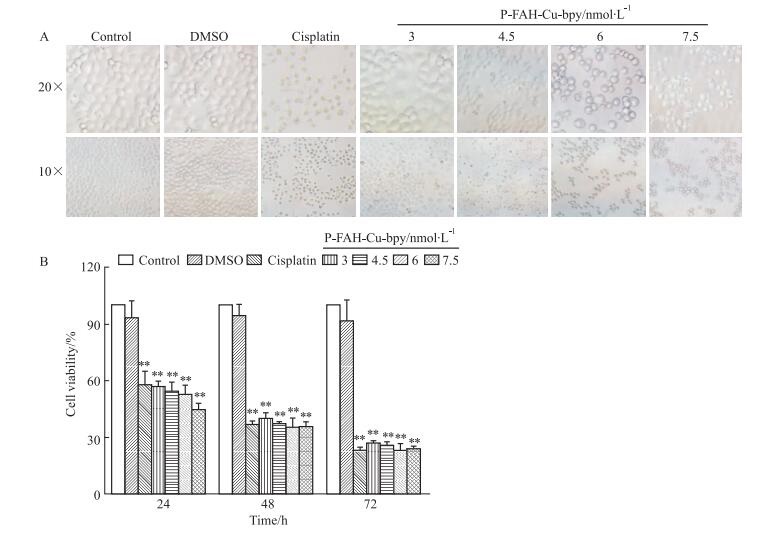
|
| 图 2 Effect of P-FAH-Cu-bpy on growth of BEL-7404 cells in vitro(x±s, n=6) A: morphological changes; B: cell viability.**P < 0.01 vs control group |
如Fig 3A和Fig 3B所示,P-FAH-Cu-bpy浓度依赖性地诱导了细胞凋亡,当浓度达到6 nmol·L-1时,细胞凋亡数(58.38%)明显高于对照组(P < 0.01),而优于顺铂组(细胞凋亡数为43.17%)。此外,与对照组相比,配合物组虽在4.5 nmol·L-1时细胞坏死的比例有明显增加(25.3%)(P < 0.05),但随着浓度升高,细胞坏死的比例并无浓度依赖性。这些结果表明P-FAH-Cu-bpy主要诱导了BEL-7404细胞凋亡。

|
| 图 3 Effect of P-FAH-Cu-bpy on apoptosis of BEL-7404 cells(x±s, n=3) The apoptosis and necrosis of BEL-7404 were analyzed by flow cytometry. A: The individual dot plots; B: the summary data; C: The nuclear morphology of BEL-7404 cells stained with Hoechst 33258. The arrows indicated the chromosomal condensation. *P < 0.05, **P < 0.01 vs control group. |
如Fig 3C所示,对照组和DMSO组细胞染色形态均一,而配合物组蓝白荧光强,染色质固缩和核碎片化现象明显,且呈浓度效应。进一步证明P-FAH-Cu-bpy诱导了细胞凋亡。
2.4 P-FAH-Cu-bpy阻滞了BEL-7404细胞周期如Fig 4所示,与对照组比较,配合物组显著增加了BEL-7404细胞G2/M期的细胞分布(P < 0.01),而降低了G0/G1期(P < 0.05)和S期的细胞分布, 揭示P-FAH-Cu-bpy可能将BEL-7404细胞阻滞在G2/M期。此外,与对照相比, P-FAH-Cu-bpy在4.5 nmol·L-1时明显增加了subG1的比例(P < 0.01),表明随着药物浓度的增加,细胞死亡和凋亡总数目增加,与凋亡检测结果趋势一致。

|
| 图 4 Cell cycle distribution in BEL-7404 cells upon P-FAH-Cu-bpy reatment(x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
JC-1探针可通过检测Δψm的变化而反映线粒体的损伤程度。随着Δψm的减少JC-1聚集体分解成单体,相应的红色荧光会逐渐减少而绿色荧光逐渐增多。JC-1染色流式分析显示(Fig 5A),P-FAH-Cu-bpy浓度依赖性地增加了绿色荧光平均荧光强度,表明P-FAH-Cu-bpy降低了BEL-7404线粒体膜电位。

|
| 图 5 Effects of P-FAH-Cu-bpy on Δψm and intracellular ROS generation in BEL-7404 cells(x±s, n=3) A: The fluorescent intensity of JC-1 in the upper Left panel and the MFI of FITC in the lower left panel(1:Control; 2:DMSO; 3:Cisplatin; 4:P-FAH-Cu-bpy/3 nmol·L-1; 5:P-FAH-Cu-bpy/4.5 nmol·L-1; 6:P-FAH-Cu-bpy/6 nmol·L-1); B: The levels of ROS generation in the upper right panel and the MFI of DCF in the lower right panel(1:Control; 2:DMSO; 3:Cisplatin; 4:P-FAH-Cu-bpy/3 nmol·L-1; 5:P-FAH-Cu-bpy/4.5 nmol·L-1; 6:P-FAH-Cu-bpy/6 nmol·L-1); C: The expression of apoptosis-related protein Bax, Bcl-2 and Cyto C detected by Western blot(1:Control; 2:DMSO; 3:P-FAH-Cu-bpy/3 nmol·L-1; 4:P-FAH-Cu-bpy/4.5 nmol·L-1; 5:P-FAH-Cu-bpy/6 nmol·L-1).*P < 0.05, **P < 0.01 vs control group |
DCFH-DA荧光探针染色流式分析(Fig 5B),与对照相比,随着P-FAH-Cu-bpy作用浓度的增加,BEL-7404胞内ROS水平明显升高(P < 0.05和P < 0.01)。同时Western blot检测到促凋亡蛋白Bax表达增加,抗凋亡蛋白Bcl-2表达减少,细胞色素C表达水平升高(Fig 5C)。
2.6 P-FAH-Cu-bpy抑制了BEL-7404细胞的迁移和侵袭如Fig 6A和Fig 6B所示,配合物作用24和48 h, 中浓度和高浓度组伤口愈合率明显低于对照组(P < 0.01),顺铂组变化不明显。Western blot检测细胞基质金属蛋白酶2(matrix metalloproteinase,MMP-2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达量下降(Fig 6C)。这些结果表明P-FAH-Cu-bpy抑制了BEL-7404细胞迁移和侵袭。

|
| 图 6 Effect of P-FAH-Cu-bpy on migration rate of BEL-7404 cells(x±s, n=3) A:The gating strategy of scratch area by Image J; B: The percentage of wound healing analyzed by Image J; C: The expression of protein VEGF and MMP-2 detected by Western blot. *P < 0.05, **P < 0.01 vs control group |
如Fig 7所示,P-FAH-Cu-bpy作用细胞24 h后,与对照组相比,Cleaved-caspase-3/8/9/PARP蛋白表达上调,caspase-7蛋白表达下调。

|
| 图 7 Effect of P-FAH-Cu-bpy on expression of caspase-9/3/7/8 and PARP in BEL-7404 cells detected by Western blot |
4-酰基吡唑啉酮衍生物由于能以醇式或烯醇式结构形成不同类型的具有生物活性化合物的潜力,在药理和生物学上常作为抗肿瘤药物的理想配体。研究报道4-酰基吡唑啉酮铜配合物对肺癌细胞(A549)、对早幼粒细胞性白血病HL60细胞、人急性淋巴肿瘤REH细胞、小鼠神经胶质瘤C6细胞、纤维肉瘤L929细胞和黑色素瘤B16细胞具有显著的抑制增殖作用[12-13]。本研究发现P-FAH-Cu-bpy体外显著抑制了肝癌细胞BEL-7404的生长,且呈浓度和时间依赖性。
药物诱导的细胞凋亡在抗肿瘤效果中发挥重要作用。本研究中,P-FAH-Cu-bpy处理BEL-7404细胞24 h后,出现了染色质凝聚、DNA断裂等凋亡特征,流式染色分析P-FAH-Cu-bpy阻滞了细胞周期,并浓度依赖性地增加了细胞凋亡比例,且总体细胞凋亡比例高于坏死细胞比例,这些结果表明P-FAH-Cu-bpy主要通过诱导BEL-7404细胞凋亡而发挥抗肿瘤作用。
细胞凋亡可受内源性线粒体途径诱导。线粒体膜的完整性严格受到Bcl-2蛋白家族的调控,促凋亡蛋白Bax促进线粒体外膜的透化,而抗凋亡蛋白Bcl-2阻止线粒体外膜的透化。线粒体膜通透性的改变导致膜电位的改变,从而释放促凋亡因子细胞色素C,进而激活caspase-9。caspase-9能够活化和剪切下游效应因子caspase-3、7和PARP,最终诱导细胞凋亡。其中细胞色素C的释放被认为是细胞发生凋亡的关键环节。本研究发现,P-FAH-Cu-bpy分别增加和降低了Bax和Bcl-2蛋白表达的水平,而这可能导致了线粒体膜完整性的破坏。本研究中P-FAH-Cu-bpy降低了细胞膜电位,同时检测到细胞色素C、Cleaved-caspase-9/3/PARP表达升高,caspase-7表达下调。这些结果表明P-FAH-Cu-bpy可通过内源性线粒体途径诱导BEL-7404细胞凋亡。
ROS的产生在以降低细胞膜电位介导的细胞凋亡中发挥重要作用。本研究发现,P-FAH-Cu-bpy作用细胞24 h后,ROS水平上升,推测ROS的增多改变了细胞膜通透性,降低了膜电位,进而增加了细胞色素C的表达,引发了线粒体凋亡的信号级联放大反应,最终诱导了细胞凋亡。
细胞凋亡也可以由外源性死亡受体途径诱导,通过死亡受体传递信号,促进死亡诱导信号的形成裂解并激活caspase-8,从而引发蛋白水解,最终导致细胞凋亡。本研究中,Cleaved-caspase-8表达上调,表明P-FAH-Cu-bpy也可通过外源性死亡受体途径诱导BEL-7404细胞凋亡。
细胞迁移是恶性肿瘤侵袭和转染的关键步骤。顺铂在肿瘤治疗中很容易导致药物耐药性, 需要和其他抗癌药物联用才能抑制肿瘤转移[14]。铜虽是血管内皮生成的重要因子,然而许多研究证明铜配合物也能直接影响癌细胞的迁移和侵袭[15]。本研究发现,P-FAH-Cu-bpy明显抑制了细胞的迁移,优于顺铂组。MMP-2和VEGF表达下调,进一步证明P-FAH-Cu-bpy抑制了细胞迁移和侵袭。
综上所述,P-FAH-Cu-bpy抑制了人肝癌细胞BEL-7404的增殖、迁移和侵袭,并能够诱导其凋亡,其凋亡机制可能与线粒体(内源信号)和死亡受体(外源信号)途径有关。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. doi:10.3322/caac.21338 |
| [3] |
Hassan A E, Moustafa A H, Tolbah M M, et al. Synthesis and antimicrobial evaluation of novel pyrazolones and pyrazolone nucleosides[J]. Nucleos Nucleot Nucl, 2012, 31(11): 783-800. doi:10.1080/15257770.2012.732250 |
| [4] |
Zhao B, Shang X, Xu L, et al. Novel mixed ligand di-n-butyltin(IV) complexes derived from acylpyrazolones and fluorinated benzoic acids: synthesis, characterization, cytotoxicity and the induction of apoptosis in Hela cancer cells[J]. Eur J Med Chem, 2014, 76: 87-97. doi:10.1016/j.ejmech.2014.02.039 |
| [5] |
Pettinari R, Marchetti F, Pettinari C, et al. Synthesis, structure, and antiproliferative activity of ruthenium(Ⅱ) arene complexes with N, O-chelating pyrazolone-based β-ketoamine ligands[J]. Inorg Chem, 2014, 53(24): 13105-11. doi:10.1021/ic502274b |
| [6] |
Idemudia O G, Sadimenko A P, Hosten E C. Metal complexes of new bioactive pyrazolone phenylhydrazones; Crystal structure of 4-Acetyl-3-methyl-1-phenyl-2-pyrazoline-5-one phenylhydrazone Ampp-Ph[J]. Int J Mol Sci, 2016, 17(5): E687. doi:10.3390/ijms17050687 |
| [7] |
Li Y, Zhao J, He C C, et al. Synthesis, crystal structure and biological activity of two Mn complexes with 4-acyl pyrazolone derivatives[J]. J Inorg Biochem, 2015, 150: 28-37. doi:10.1016/j.jinorgbio.2015.06.003 |
| [8] |
Zhao J, Zhang L, Li J, et al. A novel pyrazolone-based derivative induces apoptosis in human esophageal cells via reactive oxygen species (ROS) generation and caspase-dependent mitochondria-mediated pathway[J]. Chem Biol Interact, 2015, 231: 1-9. doi:10.1016/j.cbi.2015.02.004 |
| [9] |
Luo H Y, Li J Y, Li Y, et al. Cadmium (Ⅱ) complexes with a 4-acyl pyrazolone derivative and co-ligands: crystal structures and antitumor activity[J]. RSC Adv, 2016, 6(116): 114997-5009. doi:10.1039/C6RA23938B |
| [10] |
常晨晨, 吴婷, 汪梅芳, 等. 吡唑啉酮衍生物镉(Ⅱ)配合物体内外对黑素瘤B16细胞的抗肿瘤作用[J]. 中国药理学与毒理学杂志, 2017, 31(5): 405-13. Chang C C, Wu T, Wang M F, et al. Antitumor effect of cadmium (Ⅱ) complex of pyrazolone derivatives on melanoma B16 cells in vitro and in vivo[J]. Chin J Pharmacol Toxicol, 2017, 31(5): 405-13. doi:10.3867/j.issn.1000-3002.2017.05.005 |
| [11] |
Vyas K M, Devkar R V, Prajapati A, et al. Pyrazolone incorporating bipyridyl metallointercalators as effective DNA, protein and lung cancer targets: Synthesis, characterization and in vitro biocidal evaluation[J]. Chem Biol Interact, 2015, 240: 250-66. doi:10.1016/j.cbi.2015.08.022 |
| [12] |
Jadeja R N, Vyas K M, Upadhyay K K, et al. In vitro apoptosis-inducing effect and gene expression profiles of mixed ligand Cu(Ⅱ) complexes derived from 4-acyl pyrazolones on human lung cancer cells[J]. RSC Adv, 2017, 7(28): 17107-16. doi:10.1039/C7RA01025G |
| [13] |
Leovac V M, Bogdanovic G A, Jovanovic L S, et al. Synthesis, characterization and antitumor activity of polymeric copper(Ⅱ) complexes with thiosemicarbazones of 3-methyl-5-oxo-1-phenyl-3-pyrazolin-4-carboxaldehyde and 5-oxo-3-phenyl-3-pyrazolin-4-carboxaldehyde[J]. J Inorg Biochem, 2011, 105(11): 1413-21. doi:10.1016/j.jinorgbio.2011.07.021 |
| [14] |
姚圆圆, 郝吉庆. PJ34对肺腺癌顺铂耐药细胞增殖及耐药性的影响[J]. 中国药理学通报, 2015, 31(6): 865-70. Yao Y Y, Hao J Q. Study of reversal effect of PARP-1 inhibitor PJ34 on cisplatin-resistance in human lung adenocarcinoma cells[J]. Chin Pharmacol Bull, 2015, 31(6): 865-70. doi:10.3969/j.issn.1001-1978.2015.06.025 |
| [15] |
MacDonald G, Nalvarte I, Smirnova T, et al. Memo is a copper-dependent redox protein with an essential role in migration and metastasis[J]. Sci Signal, 2014, 7(329): ra56. doi:10.1126/scisignal.2004870 |