


2. 内蒙古医科大学基础医学院,细胞生物学教研室,内蒙古自治区 呼和浩特 010110
 ,
CAO Gui-fang1
,
CAO Gui-fang1
 ,
YANG Hong-xin1,2,
YU Jian2,
LIU Mo-ning1,
LONG Xin1,
WEI Wei1,
LI Chun-fang1,
SU Hong1
,
YANG Hong-xin1,2,
YU Jian2,
LIU Mo-ning1,
LONG Xin1,
WEI Wei1,
LI Chun-fang1,
SU Hong1
2. Dept of Cell Biology, College of Preclinical Medicine, Inner Mongolia Medical University, Hohhot 010110, China
输卵管作为生殖系统的重要组成,是配子运输通道、受精和早期胚胎发育的场所,其功能受到雌激素的调控。输卵管功能的失调会导致不孕、宫外孕、胚胎发育异常或雌性动物生产能力下降等。
S100钙结合蛋白A8(S100 calcium binding protein A8,S100A8)和S100钙结合蛋白A9(S100 calcium binding protein A9,S100A9)是钙结合蛋白S100家族中的重要成员,分子大小约十几kDa,S100A8和S100A9基因在染色体位置上相邻,位于人染色体1q21和小鼠第3号染色体上的基因簇中,表达于髓系白细胞,在内皮细胞和上皮细胞中也有表达,并可分泌到细胞外[1-3]。S100A8和S100A9蛋白可形成异源二聚体发挥功能,常称为钙防卫蛋白(calprotectin)[4]。Baithalu等[5]的研究发现S100A8和S100钙结合蛋白A12(S100 calcium binding protein A12,S100A12)基因可能对牛子宫有天然免疫保护作用;Wang等[6]通过对猪妊娠期不同时期和非妊娠子宫内膜mRNA表达谱分析发现S100A8可能在胚胎着床和胚胎发育中有作用;人血液中S100A8在月经周期增殖期高表达,并在早孕丢失的子宫褪膜和血液表达升高[7],以上研究提示S100A8和S100A9可能在女性或雌性哺乳动物生殖系统中起重要作用,并受到雌激素调控。目前发现S100A8和S100A9可参与免疫调控、抗菌、炎症、损伤修复等生理、病理过程[8],它们在子宫、阴道、妊娠期子宫蜕膜等生殖系统有广泛分布[5-7],但S100A8和S100A9在输卵管组织的分布情况,以及它们对输卵管功能的影响还知之甚少。输卵管功能受到雌激素的调控,雌激素是否通过调节输卵管S100A8和S100A9,进而影响输卵管的功能这更是未知。
本研究通过免疫组织化学方法测定间情期绵羊S100A8和S100A9蛋白在输卵管的表达情况;体外模拟排卵期高浓度雌激素,通过研究高浓度雌激素对输卵管上皮细胞中S100A8和S100A9表达的调控作用,试探讨随雌激素调控S100A8和S100A9在输卵管中的可能作用。
1 材料与方法 1.1 主要仪器、材料和试剂称量天平(Sartorius,德国),立式高压灭菌锅(TOMY,日本),二氧化碳培养箱(Thermo,美国),倒置相差显微镜(Olympus,日本),超净工作台,水平离心机(Hitachi, 日本),低温离心机,酶标仪(Eppendorf,德国),凝胶成像分析系统(Gene,美国),实时荧光定量PCR仪(CFX96 System,Bio-Rad,美国),激光共聚焦显微镜(Nikon, 日本),恒温水浴锅、水平电泳仪、20 μL、1 000 μL和5 000 μL移液器(Eppendorf,德国),0.22 μm微孔滤膜过滤器(Millipore,美国)、细胞刮刀、75 cm2细胞培养瓶、25 cm2平皿和6孔细胞培养板(Corning,美国)、激光共聚焦皿(Nest, 上海),眼科剪、眼科镊等均为国产。
青-链霉素、DMEM/F12培养基、胰蛋白酶-EDTA(No.15140, No.C11330500BT, No.25300, Gibco, 美国),DMEM/F12无酚红培养基(No.11039-021, Gibco, 美国),胎牛血清(No.SV30087.02, Hyclone, 美国),DNA Marker(DL2000, Gene star, 中国),UltrasensitiveTM SP-超敏试剂盒(No.Kit-9710, 福州迈新,中国),PrimeScriptTM RT reagent Kit with gDNA Eraser(No.RR047A,Takara,中国),SYBR Green Realtime PCR Master Mix(No.QPK-201,Toyobo,日本),总RNA提取试剂盒(No.220011, 上海飞捷,中国),Rabbit Anti-MRP8 antibody(No.ab180735,Abcam,美国),Rabbit Anti-S100A9 antibody(No.ab92507, Abcam, 美国),Goat Anti-rabbit IgG/FITC(No.bs-0295G-FITC,博奥森,中国),Agarose gel(No.16500100,Invitrogen,美国),17-β-Estradiol(No.E2758,Sigma,美国)。
1.2 免疫组织化学检测绵羊输卵管组织中S100A8、S100A9蛋白表达选取处于性成熟且间情期、体格健壮雌性绵羊,屠宰后迅速取出输卵管存放于含有5倍双抗PBS缓冲液的无菌样品瓶中,将样品瓶放置冰盒内带回实验室取壶腹部进行免疫组织化学检测及细胞原代培养。
输卵管甲醛固定后,经过50%~100%乙醇逐级脱水,二甲苯透明,石蜡包埋,切片(厚度5-6 μm)。烘片,脱蜡至水,PBS冲洗,微波抗原修复。之后按照福州迈新免疫组化试剂盒说明进行过氧化酶阻断、封闭、一抗孵育(浓度均为1 :200)、二抗孵育、生物素-过氧化酶孵育、显色、HE染色等步骤处理后,切片脱水、透明,镜下检测目的蛋白S100A8和S100A9蛋白在输卵管组织中的表达及分布。
1.3 输卵管上皮细胞培养取材同1.2,原代培养及传代参考本实验室温世勇等[9]的实验方法, 取传5代内的细胞进行后续实验。
1.4 17-β雌二醇对绵羊输卵管上皮细胞S100A8、S100A9 mRNA表达的影响 1.4.1 实时荧光定量聚合酶链式反应(Quantitative real-time PCR,q-PCR)引物的设计与合成根据NCBI中GeneBank公布的绵羊S100A8基因、S100A9基因、和管家基因β-肌动蛋白(β-actin),用NCBI-Primer BLAST设计引物,并送交Invitrogen公司合成引物(表 1),引物纯化级别为PAGE级别。引物通过PCR验证,PCR产物交于Invitrogen公司测序。
| Gene | Primer sequence(5’-3’) | Tm | Product length |
| S100A8 | |||
| Forward | GTGGGGCAAATCCTTGGACA | 60 ℃ | 188 bp |
| Reverse | TGAACCAAGTGTCCGCATCC | ||
| S100A9 | |||
| Forward | CGGAAACCCTGATCCGGAAA | 60 ℃ | 170 bp |
| Reverse | CCTGGCCACCAGCATAATGA | ||
| β-actin | |||
| Forward | GTCACCAACTGGGACGACA | 60 ℃ | 208 bp |
| Reverse | AGGCGTACAGGGACAGC |
利用上海飞捷RNA提取试剂盒提取细胞总RNA。测定每个样品OD260/OD280比值和总RNA浓度,RNA通过1.5 %琼脂糖凝胶电泳检测总RNA提取质量,质量检测合格样品用于后续反转录反应。
根据测得的总RNA浓度确定每个样品在反转录反应中需要的总RNA量。采用大连宝生物公司反转录试剂盒进行总RNA去除基因组反应和反转录反应。
q-PCR反应体系按照PCR-mix(Toyobo)12.5 μL,q-PCR Forward Primer(10 μmol·L-1)1 μL,q-PCR Reverse Primer(10 μmol·L-1)1 μL,cDNA RT反应液2.5 μL,ddH2O 8 μL配制。三步法进行q-PCR,95 ℃预变性1 min;95 ℃变性15 s,退火60 ℃ 15 s,72 ℃延伸45 s,40个循环;65 ℃至95 ℃绘制熔解曲线;4 ℃保存。反应同时设置阴性对照实验,即以ddH2O代替样本cDNA进行实验,以排除试剂污染。
1.4.3 17-β雌二醇对绵羊输卵管上皮细胞的作用同一批次细胞消化后传代至6孔细胞培养板中培养,待细胞覆盖率至85%左右进行无血清无酚红培养基饥饿12 h处理,以尽可能降低血清对细胞的影响。参照绵羊雌二醇生理浓度[9-10],预添加10-8 mol·L-1的17-β雌二醇(17-β-Estradiol, E2),设不同处理时间2、4、6、12 h组,并设对照组。处理结束后用预冷的无酶PBS快速洗涤细胞,冰上提取总RNA按照方法1.4.2用于荧光定量测定。实验重复3次。
同上饥饿处理细胞后,根据上述雌激素处理不同时间S100A8和S100A9的表达变化,选取表达差异最显著的时间点,设不同E2处理浓度10-6、10-7、10-8、10-9 mol·L-1组,并设对照组。处理结束后用预冷的无酶PBS快速洗涤细胞,冰上提取总RNA按照方法1.4.2用于荧光定量测定。实验重复3次。
1.5 17-β雌二醇对绵羊输卵管上皮细胞S100A8、S100A9蛋白表达的影响免疫荧光检测绵羊输卵管上皮细胞中S100A8,S100A9蛋白,在最适浓度的雌激素、不同时间作用下的表达情况。细胞培养于激光共聚焦皿,饥饿处理方法同“1.4.3”,参考不同浓度雌激素对S100A8、S100A9 mRNA表达的影响,选择最适浓度的雌激素,设不同处理时间3、6、12 h组,并设对照组,处理结束后PBS清洗,冰丙酮固定,-20 ℃保存待用。
保存的细胞爬片经过Triton X-100通透、BSA封闭、孵育一抗(1 :200)、孵育二抗(1 :200)、DAPI核染等操作(每步操作后需用PBST清洗),封片后激光共聚焦显微镜下观察。
1.6 统计学方法利用SPSS 22.0进行统计分析,多组比较采用单因素方差分析。进行两个变量相关性分析,以皮尔森相关系数表示,r值为相关系数。
2 结果 2.1 S100A8及S100A9蛋白在绵羊输卵管的表达及分布经免疫组织化学SP法染色后,结果显示间情期绵羊输卵管壶腹部S100A8和S100A9蛋白的表达及分布情况,图中棕色为阳性反应,S100A8和S100A9均在输卵管黏膜上皮细胞中呈现高表达,并在腺上皮中也为阳性表达,同时在血管中也有表达(Fig 1)。
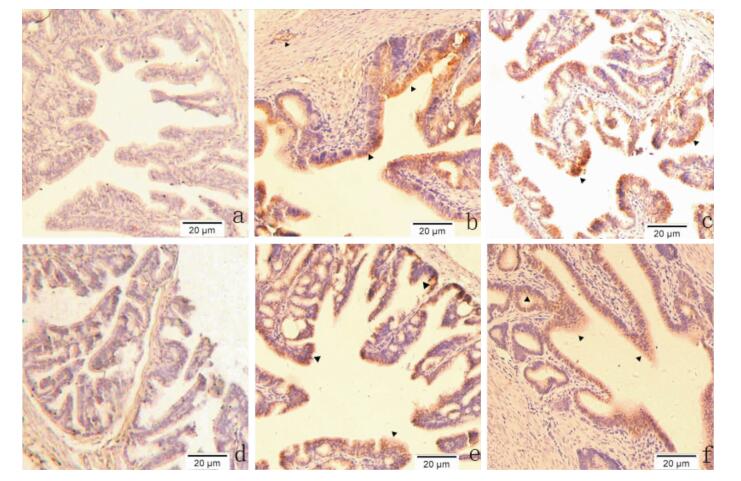
|
| 图 1 Immunohistochemical staining of oviduct ampulla a. S100A8 negative control; b/c: S100A8 expressed in mucous epithelial cells and blood vessels of the ampulla;d: S100A9 negative control e/f: S100A9 expressed in mucous epithelial cells and glandular epithelial cells of the ampulla |
细胞提取总RNA每个样品OD260/OD280比值均在1.8~2.1,琼脂糖凝胶电泳验证无降解,有28S和18S条带(Fig 2a)。合成引物经验证,克隆的片段条带清晰且单一,并符合预期大小(Fig 2b), 克隆产物经测序并将序列进行比对,可与目的基因匹配,说明引物设计成功,产物为目的基因。
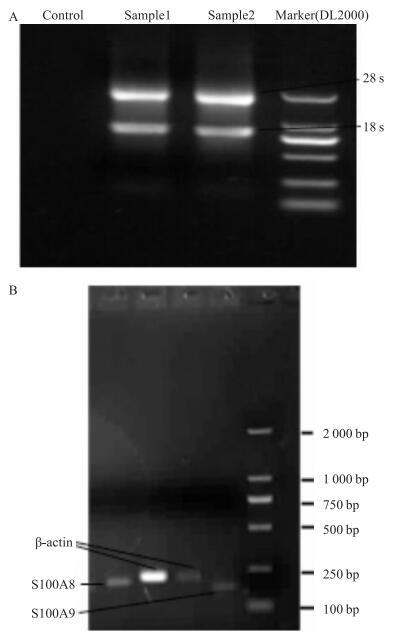
|
| 图 2 Agarose gel electrophorogram A: Total RNA electrophorogram; B: PCR products of S100A8, S100A9, β-actin electrophorogram |
绵羊输卵管上皮细胞进行原代细胞培养,细胞呈多角形,铺路石状生长,细胞形态饱满,并可以稳定传代,传代4代左右细胞活性及细胞形态与原代细胞相比无明显变化。
2.2.3 雌激素作用下S100A8及S100A9表达与时间的动态变化在17β-雌二醇的作用下,绵羊输卵管上皮细胞S100A8及S100A9 mRNA的表达量,随着时间的动态变化如图所示(Fig 3)。S100A8在雌激素作用后2 h及4 h后变化不显著,而在6 h后达到高峰(P < 0.01),在12 h后显著降低并低于对照组(P < 0.05)。S100A9在雌激素作用2 h后有显著降低,之后逐渐升高,在6 h到达高峰(P < 0.01),12 h后显著降低并低于对照组(P < 0.01)。
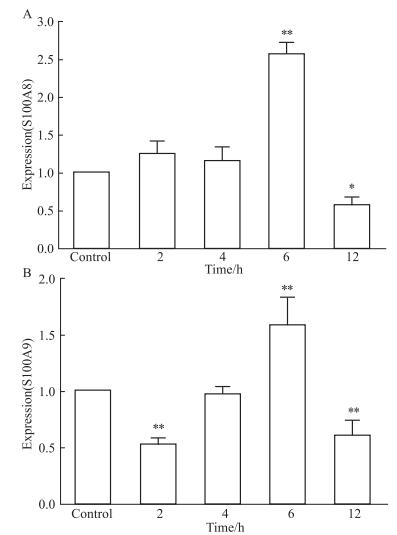
|
| 图 3 Expression of S100A8 and S100A9 mRNA at different time points after E2 treatment (x±s, n=4) A:The expression of S100A8 mRNA in oviduct epithelial cells treated with E2 for 2 h, 4 h, 6 h, 12 h and control; B:The expression of S100A9 mRNA in oviduct epithelial cells treated with E2 for 2 h, 4 h, 6 h, 12 h and control. *P < 0.05, **P < 0.01 vs control |
在不同浓度的17β-雌二醇作用6 h后(根据“2.2.3”的结果,此时表达量最高),S100A8及S100A9表达情况如图所示(Fig 4)。E2浓度为10-7 mol·L-1时S100A8及S100A9表达量均为最高(P < 0.01),并且S100A8及S100A9的表达量在10-7 mol·L-1组与10-8 mol·L-1组之间均无显著差异,10-6 mol·L-1组与10-9 mol·L-1组表达量较低但均显著高于对照组(P < 0.01)。所以用10-8 mol·L-1 E2预处理细胞是可行的,在此浓度下S100A8及S100A9均高表达。
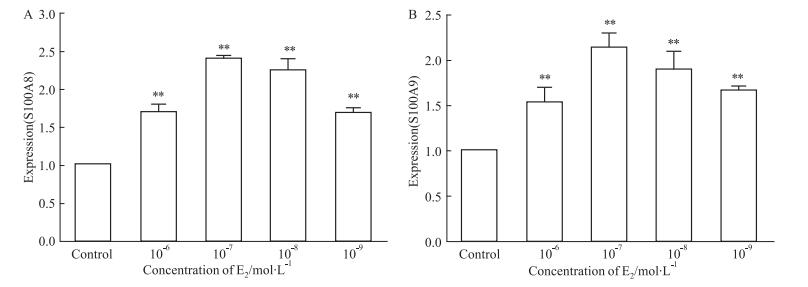
|
| 图 4 Expression of S100A8 and S100A9 mRNA at different concentrations of estrogen (x±s, n=4) A:The expression of S100A8 mRNA in tubal epithelial cells treated with different concentrations of estrogen (10-6, 10-7, 10-8, 10-9 mol·L-1) and control; B:The expression of S100A9 mRNA in tubal epithelial cells treated with different concentrations of estrogen(10-6, 10-7, 10-8, 10-9 mol·L-1) and control.*P < 0.05, **P < 0.01 vs control |
将S100A8及S100A9 mRNA表达量做两个变量的相关性分析,结果显示S100A8及S100A9两个基因随着雌激素不同作用时间,表达呈极显著相关(P < 0.01),r=0.806;S100A8及S100A9两个基因在不同雌激素浓度下,表达呈极显著相关(P < 0.01),r=0.919。说明S100A8及S100A9两个基因功能上可能相关。
2.3 17-β雌二醇对绵羊输卵管上皮细胞S100A8、S100A9蛋白表达的影响输卵管上皮细胞在10-8 mol·L-1浓度(参考“2.2.4”结果选择最适浓度)的E2处理不同时间后,经免疫荧光检测,S100A8、S100A9蛋白的表达情况如图所示(如Fig 5)。S100A8蛋白在E2作用3 h后略高于对照组,6 h后表达明显高于对照组,荧光增强,这与q-PCR结果相似。S100A9蛋白在3 h后与对照组相比没有明显改变,6 h后可以发现部分细胞表达有所上升,荧光强度略有增强,q-PCR也同样显示6 h后S100A9的表达升高。
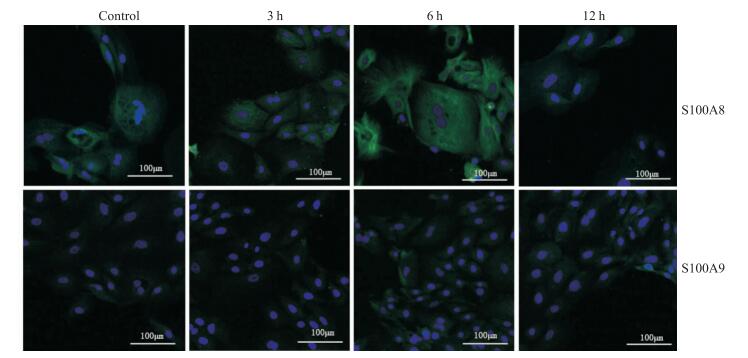
|
| 图 5 Expression of S100A8 and S100A9 proteins at different time points after estrogen treatment by immunofluorescence; Green fluorescence showed the expression intensity of the target protein; blue fluorescence was the nucleus |
输卵管的功能可受到雌激素的巨大影响,随着雌激素的变化,可引起输卵管黏膜在细胞及分子水平的改变,进而影响输卵管的功能[11]。
有研究显示牛输卵管中发现有S100A8和S100A9的表达,并可能参与年龄老化[12],但该研究并没有明确S100A8和S100A9的组织分布,并且认为它们与病理情况相关。然而S100A8和S100A9具有天然免疫作用已被多次证实[8],Baithalu等[5]发现S100A8及S100A12在牛的子宫内膜高表达可能更利于牛子宫的健康,我们也通过检测健壮的间情期绵羊输卵管中S100A8和S100A9的表达,发现健康的绵羊输卵管黏膜上皮内膜上皮中均高表达S100A8和S100A9,并且在输卵管腺上皮也高表达,所以S100A8和S100A9应该是正常生理环境下生殖道调控的重要组成,它们可能通过分泌进入管腔,并对生殖道起到天然防御作用。
这种基础性的表达可能受到雌激素的影响。在乳腺癌组织中S100A8和S100A9的表达受到雌激素受体抑制剂他莫昔芬(tamoxifen)的调控,并且S100A9在雌激素受体(estrogen recepter, ER)ER+组织中的表达明显高于ER-组织[13];人血液中S100A8在月经周期增殖期高表达,并在早孕丢失的子宫蜕膜和血液表达升高[7]。虽然以上研究是基于癌组织或血液,但我们在输卵管细胞中也同样发现S100A8和S100A9的表达可受到雌激素的调控,这种调控可能来源于生理性变化或雌激素药物。本研究发现在体外高浓度雌激素作用下S100A8和S100A9 mRNA均在雌激素作用6 h表达出现峰值,并且两个基因表达变化显著相关。已知在排卵前期,雌激素表达会达到最高峰,我们模拟雌激素高峰期,能够促进输卵管上皮细胞S100A8和S100A9的高表达,这可能与排卵期交配前后输卵管对病原体的防御机制有关,并且这种防御功能可能需要这两个基因协同作用。
另外,雌激素对卵子在输卵管的配子运输有促进作用,而雌激素作用后S100A8和S100A9的高表达是否与排卵和卵子运输有关?最近有研究显示S100A8在卵母细胞表达,认为S100A8可能作为卵母细胞化学趋化因子之一促进颗粒细胞向卵母细胞的定向迁移,在原始卵泡形成中起作用[14]。如果S100A8对颗粒细胞有趋化作用,排卵前雌激素生理高峰或雌激素药物引起输卵管壶腹部上皮细胞S100A8和S100A9的高表达,这可能在排卵时有助于吸引颗粒细胞(卵丘细胞)-卵细胞复合体向输卵管壶腹部的运输。
雌激素可调控输卵管的微环境,雌激素可能通过调控管腔内分泌蛋白S100A8及S100A9对生殖道天然免疫具有调控作用,不仅如此,雌激素可能通过它们而影响排卵。了解雌激素对输卵管的微环境的影响,并进一步关注S100A8及S100A9对输卵管功能的影响及其分子机制,这对于动物的生殖调控或人类输卵管疾病的治疗、辅助生殖技术的改进等可能具有重要意义。
| [1] |
Schenten V, Plançon S, Jung N, et al. Secretion of the phosphorylated form of S100A9 from neutrophils is essential for the proinflammatory functions of extracellular S100A8/A9[J]. Front Immunol, 2018, 13(9): 447. |
| [2] |
Tanaka M, Koyama T, Sakurai T, et al. The endothelial adrenomedullin-RAMP2 system regulates vascular integrity and suppresses tumour metastasis[J]. Cardiovasc Res, 2016, 111(4): 398-409. doi:10.1093/cvr/cvw166 |
| [3] |
Ibrahim M, Peter S, Gärtner M A, et al. Increased mRNA expression of selected antimicrobial peptides around ovulation and during inflammatory processes in the bovine endometrium postpartum[J]. Theriogenology, 2016, 86(8): 2040-53. doi:10.1016/j.theriogenology.2016.06.022 |
| [4] |
Vogl T, Stratis A, Wixler V, et al. Autoinhibitory regulation of S100A8/S100A9 alarmin activity locally restricts sterile inflammation[J]. J Clin Invest, 2018, 128(5): 1852-66. doi:10.1172/JCI89867 |
| [5] |
Baithalu R K, Singh S K, Kumaresan A, et al. Targeted transcript analysis revealed association of suboptimal expression of certain endometrial immunity-related genes with disparate uterine diseases in zebu cows[J]. Trop Anim Health Prod, 2019, 51(8): 2493-503. doi:10.1007/s11250-019-01958-3 |
| [6] |
Wang Y, Xue S, Liu X, et al. Analyses of song non-coding RNA and mRNA profiling using RNA sequencing during the pre-implantation phases in pig endometrium[J]. Sci Rep, 2016, 6: 20238. doi:10.1038/srep20238 |
| [7] |
Nair R R, Khanna A, Singh K. Association of increased S100A8 serum protein with early pregnancy loss[J]. Am J Reprod Immunol, 2015, 73(2): 91-4. doi:10.1111/aji.12318 |
| [8] |
李晓丹, 曹贵方, 杨宏新, 等. S100A8和S100A9的天然免疫作用[J]. 细胞与分子免疫学杂志, 2018, 34(11): 1051-3. Li X D, Cao G F, Yang H X, et al. S100A8 and S100A9 in innate immunity[J]. Chin J Cell Mol Immunol, 2018, 34(11): 1051-3. |
| [9] |
Wen S, Cao G, Bao T, et al. Modulation of ovine SBD-1 expression by 17beta-estradiol in ovine oviduct epithelial cells[J]. BMC Vet Res, 2012, 8: 143. doi:10.1186/1746-6148-8-143 |
| [10] |
秦莉花, 刘洋, 黄娟, 等. 加味脑泰方对去势脑缺血大鼠脑损伤的影响与雌激素水平相关性研究[J]. 中国药理学通报, 2018, 34(3): 428-32. Qin L H, Liu Y, Huang J, et al. Effect of Jiawei Naotaifang on cerebral infarction area and level of estrogen of ovariectomized rats with cerebral ischemia and its correlation[J]. Chin Pharmacol Bull, 2018, 34(3): 428-32. doi:10.3969/j.issn.1001-1978.2018.03.025 |
| [11] |
Li S, Winuthayanon W. Oviduct: roles in fertilization and early embryo development[J]. J Endocrinol, 2017, 232(1): R1-26. |
| [12] |
Nakamura Y, Iwata H, Kuwayama T, et al. S100A8, which increases with age, induces cellular senescence-like changes in bovine oviduct epithelial cells[J]. Am J Reprod Immunol, 2019, 82(3): e13163. |
| [13] |
Fang Q, Yao S, Luo G, et al. Identification of differentially expressed genes in human breast cancer cells induced by 4-hydroxyltamoxifen and elucidation of their pathophysiological relevance and mechanisms[J]. Oncotarget, 2017, 9(2): 2475-501. |
| [14] |
Teng Z, Wang C, Wang Y, et al. S100A8, An oocyte-specific chemokine, directs the migration of ovarian somatic cells during mouse primordial follicle assembly[J]. J Cell Physiol, 2015, 230(12): 2998-3008. doi:10.1002/jcp.25032 |