

2. 三峡大学感染与炎症损伤研究所,湖北 宜昌 443002;
3. 泉州师范学院化工与材料学院,福建 泉州 362000
2. Institute of Infection and Injury, China Three Gorges University, Yichang Hubei 443002, China;
3. College of Chemical Engineering and Materials, Quanzhou Normal University, Quanzhou Fujian 362000, China
肺癌是癌症相关死亡的最常见原因,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%。超过70%的NSCLC患者诊断时已是晚期,预后通常较差。目前,用于治疗晚期NSCLC的分子靶向药物主要有吉非替尼、克唑替尼和贝伐珠单抗等。靶向抑制剂改善了NSCLC患者的预后,然而大多数患者在一年后出现耐药[1]。因此开发新型的靶向抑制剂显得尤为重要。
多胺(polyamine,PA)是天然存在的多阳离子烷基胺,包括腐胺(putrescine,Put)、精脒(spermidine,Spd)和精胺(spermine,Spm)三类,对于真核生物的正常细胞生长和发育是必不可少的。在正常生理条件下,细胞内多胺含量通过合成和代谢的动态网络及转运系统进行严格的调控。这种精确的调控确保将细胞内多胺水平保持在正常范围内。研究表明[2-3],多胺代谢途径以及细胞生长对多胺的需求在肿瘤细胞中处于失调状态,多胺水平的升高与肺癌等多种癌症的发生与发展相关。因此,多胺代谢途径是肿瘤防治研究的重要方向和药物设计的合理靶点。
ODC是多胺生物合成的限速酶,在癌前细胞中表达上调,是多种肿瘤的致癌基因[4]。ODC的降解速率是由其终产物多胺通过独特的自身调控网络调节的。这个调控网络的组成是抗酶AZ与抗酶抑制剂AZIN。目前AZIN存在两种亚型,其中最主要的是AZIN-1。因此,AZIN-1在肿瘤治疗中是理想的分子靶点。本实验运用计算机辅助药物设计技术设计和筛选AZIN-1抑制剂,研究AZIN-1小分子抑制剂对非小细胞肺癌A549细胞的增殖、凋亡、周期和多胺代谢的影响。
1 材料 1.1 药物19号和22号药物称取适量19号和22号药物(见Fig 1)干粉,用DMSO配制成浓度为100 μmol·L-1的药物母液,分装后置于-20 ℃冰箱冻存。药物处理细胞前,用RPMI 1640完全培养基将药物母液稀释至所需浓度。

|
| 图 1 Molecular structure of No.19 and No.22 drug |
非小细胞肺癌细胞系A549细胞(武汉大学典藏中心)。
1.3 试剂19号和22号药物(Specs公司, 荷兰);二甲亚砜(Sigma公司, 美国);四季青胎牛血清(无内毒素)(浙江天杭);RPMI 1640细胞培养基(Thermo Fisher Scientific公司, 美国);CCK-8试剂盒(北京索莱宝);Annexin V-FITC/PI细胞凋亡检测试剂盒(江苏凯基);细胞周期检测试剂盒(江苏凯基);BCA蛋白定量试剂盒(上海碧云天);AZ-1羊抗小鼠一抗(本课题组前期研究制备);AZIN-1和ODC羊抗兔一抗(Proteintech公司, 美国);高效液相色谱柱(YMC公司, 日本)。
1.4 仪器CO2恒温培养箱(上海精学);多功能酶标仪(Tecan公司, 瑞士);Bioshine ChemiQ serises化学发光成像系统(上海欧翔);Waters 2695型高效液相色谱仪、2489 UV/Vis检测仪(Waters公司, 美国);流式细胞仪(BD公司, 美国)。
2 方法 2.1 CCK-8法检测A549细胞增殖将对数生长期的A549细胞接种在96孔板中,每孔含有100 μL培养基和5×103个细胞,放置于CO2恒温培养箱(37 ℃、5% CO2)中培养24 h。细胞贴壁后,用不同浓度的19号或22号药物(12.5、25、50、75、100 μmol·L-1)进行处理,各个药物浓度设置4个复孔,3个时间段(24、48和72 h)。药物处理完毕后去除培养基,每孔加入110 μL现配的CCK-8工作液(RPMI 1640完全培养基:CCK-8溶液=10 :1)。放置于CO2恒温培养箱中避光孵育2 h,用多功能酶标仪测定各孔在450 nm处的吸光度(A)。药物对A549细胞的抑制率计算公式为[(A对照孔-A实验孔)/(A对照孔-A空白孔)]×100%。
2.2 流式细胞术检测A549细胞凋亡收集各组药物处理完毕的A549细胞,室温下离心(离心条件为2 000 r·min-1、5 min)后,PBS洗涤细胞1次。加入500 μL Binding buffer使细胞悬浮,再加入5 μL Annexin V-FITC和5 μL PI后混匀,室温避光孵育15 min,PBS再次洗涤细胞1次,用流式细胞仪检测细胞凋亡。
2.3 流式细胞术检测A549细胞周期收集各组药物处理完毕的A549细胞,室温下离心(离心条件为2 000 r·min-1、5 min)后,PBS洗涤细胞1次。加入500 μL预冷的乙醇溶液(体积分数为0.7)固定细胞,放置在4 ℃冰箱过夜。染色前用PBS洗涤细胞1次,再加入500 μL现配的PI/RNase A染色工作液(体积比为9 :1)染色45 min,用流式细胞仪检测细胞周期。
2.4 Western blot检测A549细胞ODC、AZ-1和AZIN-1蛋白的表达收集各组A549细胞,加入适量的RIPA裂解液,在冰上裂解50 min。使用冷冻离心机离心(离心条件为4 ℃、12 000 r·min-1、10 min)后,吸取上清液至EP管中。BCA法测定上清液的总蛋白浓度后,各EP管加入相应体积的5×蛋白上样缓冲液,加热煮沸10 min,放入-80 ℃冰箱冻存。样品经过SDS-PAGE胶垂直电泳分离后,切下各目的蛋白条带,再转移至PVDF膜。室温下使用脱脂牛奶溶液(体积分数为0.05)封闭1.5 h,再加入各目的蛋白对应的一抗,置于4 ℃摇床孵育过夜。一抗孵育完成后,用TBST洗膜3次,每次10 min;再加入对应二抗,室温摇床孵育1 h,再使用TBST洗膜3次,每次10 min。化学发光法显影检测ODC、AZ-1和AZIN-1蛋白表达。
2.5 HPLC检测A549细胞内多胺含量收集各组A549细胞,加入适量的RIPA裂解液,在冰上裂解50 min。使用冷冻离心机离心(离心条件为4 ℃、12 000 r·min-1、10 min)后,吸取上清液至EP管中,BCA法测定上清液的总蛋白浓度。取适量细胞裂解液,用双蒸水补足体积至800 μL,加入苯甲酰氯10 μL、1 mmol·L-1内标(DAH)20 μL和2 mol·L-1 NaOH溶液500 μL,涡旋震荡30 s,充分混匀反应体系,置于40 ℃水浴中进行反应。20 min后,加入2 mL饱和NaCl溶液终止反应。反应液用适量乙醚萃取三次,通风橱中挥发干燥。将样品用1.5 mL甲醇溶解,使用0.22 μm微孔滤膜过滤至进样瓶中,通过HPLC进行分析。色谱条件:固定相为YMC色谱柱(150 mm×4. 6 mm, 5 μm),流动相为乙腈-水(40 :60),流速为1 mL·min-1,检测波长为254 nm,柱温为30 ℃。
2.6 统计学分析SPSS软件进行统计分析,计量资料以x±s表示,两组间显著性差异使用t检验分析,GraphPad Prism软件作图。
3 结果 3.1 对A549细胞的增殖的影响用不同浓度的19号和22号药物(0、12.5、25、50、75、100 μmol·L-1)分别处理A549细胞24、48、72 h后,CCK-8检测结果见Fig 2。与空白对照组相比,19号药物对A549细胞的增殖具有显著的抑制作用(P < 0.01),且抑制率具有浓度依赖性。而22号药物对A549细胞的增殖无明显抑制作用。经GraphPad Prism 6软件计算,19号药物处理A549细胞48 h的IC50为(14.04±0.21) μmol·L-1。因此,后续实验中以无药物处理48 h的A549细胞作为空白对照组,以15 μmol·L-1的19号药物处理48 h的A549细胞作为实验组,以15 μmol·L-1的22号药物处理48 h的A549细胞作为阴性对照组。

|
| 图 2 Proliferation of A549 cells inhibited by No.19 drug(x±s,n=3) *P < 0.05, **P < 0.01 vs control group |
用15 μmol·L-119号和22号药物分别处理A549细胞48 h后,PI单染结果见Fig 3。与空白对照组相比,19号药物可以明显减少A549细胞的S期细胞的百分比(P < 0.05),明显增加G0/G1期细胞的百分比(P < 0.05),即19号药物使A549细胞阻滞于G0/G1期,而22号药物对A549细胞周期无明显影响。

|
| 图 3 Effect of No.19 drug on cell cycle of A549 cells(x±s,n=3) A:Control (0 μmol·L-1); B: No.19 drug (15 μmol·L-1); C:No.22 drug (15 μmol·L-1); D:Percentage of cell distribution.*P < 0.05 vs control group |
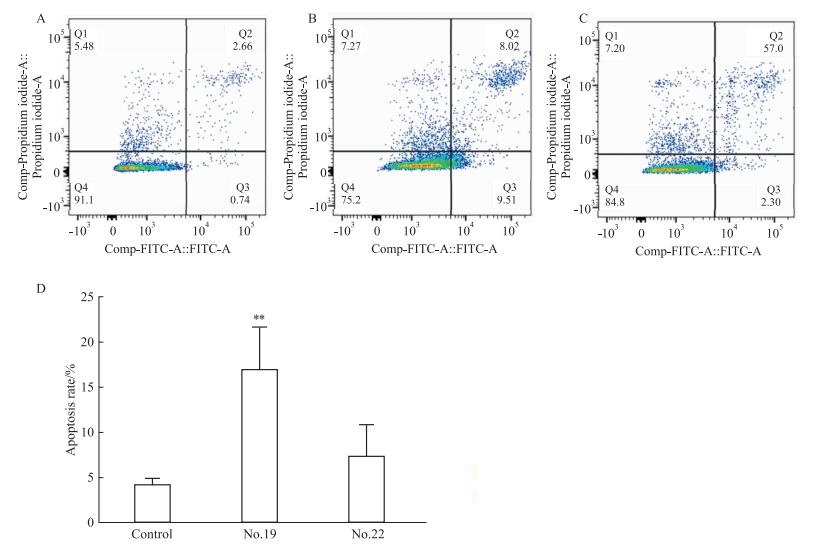
用15 μmol·L-119号和22号药物分别处理A549细胞48 h后,PI/Annexin V-FITC双染结果见Fig 4。与空白对照组相比,19号药物能够使A549细胞的早期凋亡和晚期凋亡细胞百分比明显增加(P < 0.01),说明19号药物能够促进A549细胞发生凋亡,而22号药物对A549细胞的凋亡无明显促进作用。
|
| 图 4 Effect of No.19 drug on apoptosis of A549 cells(x±s,n=3) A:Control (0 μmol·L-1); B: No.19 drug (15 μmol·L-1); C:No.22 drug (15 μmol·L-1); D:Apoptosis rate, **P < 0.01 vs control group |
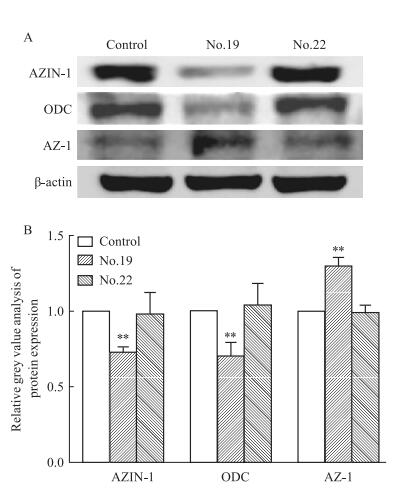
用15 μmol·L-119号和22号药物分别处理A549细胞48 h后,提取蛋白,Western blot结果见Fig 5。与空白对照组相比,19号药物能够明显抑制AZIN-1和ODC的表达(P < 0.01),并且能够使AZ-1过表达(P < 0.01),而22号药物对AZIN-1,ODC和AZ-1的表达无明显影响。
|
| 图 5 Effect of No.19 drug on expression of proteins related to polyamine metabolic enzyme(x±s,n=3) A: protein levels of AZIN-1, ODC and AZ-1by Western blot; B. amount of protein expression, **P < 0.01 vs control group |
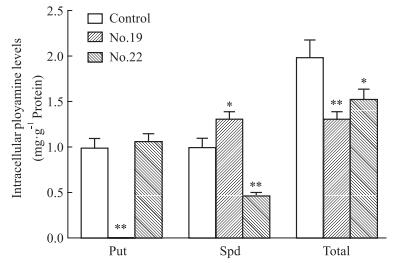
用15 μmol·L-119号和22号药物分别处理A549细胞48 h后,提取多胺,HPLC结果见Fig 6。统计分析结果显示,与空白对照组相比,19号药物能够显著抑制A549细胞内腐胺的生成(P < 0.01),并且最终能够降低细胞内总多胺的含量(P < 0.01)。
|
| 图 6 Effect of No.19 drug on polyamine content in A549 cells(x±s,n=3) *P < 0.05, **P < 0.01 vs control group |
研究表明,ODC,AZ和AZIN组成的负反馈调控网络控制着细胞内的多胺水平。细胞内高多胺水平可刺激AZ合成,AZ可使ODC失活,并通过26S蛋白酶体靶向作用于ODC进行不依赖泛素的降解。此外,AZ可抑制多胺的摄取。AZIN是与ODC高度同源的蛋白质,但是不具有鸟氨酸脱羧活性,可选择性地与AZ相互作用,且对AZ的亲和力远远高于ODC,从而阻止其对ODC和多胺转运系统的作用。AZIN有效地与ODC竞争AZ,使ODC从ODC-AZ复合物中释放,抑制AZ的功能,恢复ODC活性,从而增强细胞内多胺的生成并促进多胺的摄取,同时促进细胞增殖、转化和肿瘤发生。细胞内多胺稳态受到了高度调控,而在这一调控中AZIN成为了一种致癌分子[5-9]。
利用计算机辅助药物设计技术筛选潜在的AZIN-1小分子抑制剂,以AZIN的晶体结构为初始结构,利用Autodock软件进行虚拟筛选,最终筛选出了一系列的AZIN-1小分子抑制剂。通过分子和细胞水平的实验研究,结果发现19号药物对非小细胞肺癌A549细胞增殖具有明显的抑制作用,并选择22号药物作为本研究的阴性对照药物。
研究证实,诱导AZIN过表达导致细胞增殖增加,同时ODC活性和腐胺含量也随之增加[10];AZIN-1的RNA编辑显著诱导非小细胞肺癌的恶性进展[11];通过小干扰RNA下调PC3细胞AZIN的表达能够降低细胞内多胺含量,抑制细胞的增殖[12]。以二氟甲基鸟氨酸为代表的ODC特异性抑制剂,已被证明通过干扰多胺代谢抑制肿瘤生长。然而,其生物利用度较低,并且引起多胺代谢和转运的代偿性上调,使得肿瘤细胞摆脱了ODC抑制剂的生长抑制作用,这些局限性极大地限制了其临床应用[4]。以此为基础,本实验探究了AZIN-1小分子抑制剂对非小细胞肺癌A549细胞的多胺代谢、增殖、凋亡以及周期的影响。
本研究结果说明,19号药物能够下调AZIN-1与ODC的表达,且上调AZ-1的表达,降低细胞内的总多胺含量,诱导A549细胞发生G0/G1周期阻滞,促进A549细胞发生凋亡,有效抑制A549细胞的增殖,这与预期相符。
有研究证实,在A549细胞中使用两种靶向AZIN的siRNA,可以直接减少AZIN的表达,降低ODC水平和活性,以及增强AZ的活性降低细胞内多胺含量[13]。Western blot结果发现,19号药物的作用与靶向AZIN的siRNA相符。但是HPLC结果发现19号药物能够降低细胞内总多胺的含量,显著抑制Put的产生,但是能够升高Spd的含量,并且3个组均没有Spm的产生,可能与多胺的分解代谢以及转运系统有关[14-15]。尽管已经证明了19号药物通过靶向AZIN来调控肿瘤细胞内的ODC的水平,进而影响细胞增殖,但是不排除19号药物改变AZIN和AZ的表达,通过不依赖多胺水平的途径来影响细胞生长。
综上所述,19号药物能够明显干扰A549细胞的多胺代谢,有效降低多胺水平,抑制细胞增殖,促进细胞凋亡,其作用机制需进一步研究。总之,本研究表明AZIN-1的小分子抑制剂在抗非小细胞肺癌药物开发研究和临床应用方面具有潜在价值。
| [1] |
Liu W, Du Y, Wen R, et al. Drug resistance to targeted therapeutic strategies in non-small cell lung cancer[J]. Pharmacol Ther, 2020, 206: 107438. doi:10.1016/j.pharmthera.2019.107438 |
| [2] |
Nowotarski S L, Woster P M, Casero R J. Polyamines and cancer: implications for chemotherapy and chemoprevention[J]. Expert Rev Mol Med, 2013, 15: e3. doi:10.1017/erm.2013.3 |
| [3] |
Casero R J, Murray S T, Pegg A E. Polyamine metabolism and cancer: treatments, challenges and opportunities[J]. Nat Rev Cancer, 2018, 18(11): 681-95. doi:10.1038/s41568-018-0050-3 |
| [4] |
Casero R A, Frydman B, Stewart T M, et al. Significance of targeting polyamine metabolism as an antineoplastic strategy:unique targets for polyamine analogues[J]. Proc West Pharmacol Soc, 2005, 48: 24-30. |
| [5] |
Qiu S, Liu J, Xing F. Antizyme inhibitor 1:a potential carcinogenic molecule[J]. Cancer Sci, 2017, 108(2): 163-9. doi:10.1111/cas.13122 |
| [6] |
Wu H, Chen S, Hsieh J, et al. Structural basis of antizyme-mediated regulation of polyamine homeostasis[J]. Proc Natl Acad Sci U S A, 2015, 112(36): 11229-34. doi:10.1073/pnas.1508187112 |
| [7] |
Kahana C. Antizyme and antizyme inhibitor, a regulatory tango[J]. Cell Mol Life Sci, 2009, 66(15): 2479-88. doi:10.1007/s00018-009-0033-3 |
| [8] |
Ramos M B, Lambertos A, Peñafiel R. Antizyme inhibitors in polyamine metabolism and beyond:physiopathological implications[J]. Med Sci (Basel), 2018, 6(4): 89. |
| [9] |
Kahana C. Regulation of cellular polyamine levels and cellular proliferation by antizyme and antizyme inhibitor[J]. Essays Biochem, 2009, 46: 47-62. doi:10.1042/bse0460004 |
| [10] |
Silva T M, Cirenajwis H, Wallace H M, et al. A role for antizyme inhibitor in cell proliferation[J]. Amino Acids, 2015, 47(7): 1341-52. doi:10.1007/s00726-015-1957-6 |
| [11] |
Hu X, Chen J, Shi X, et al. RNA editing of AZIN1 induces the malignant progression of non-small-cell lung cancers[J]. Tumour Biol, 2017, 39(8): 1-9. |
| [12] |
金涛, 李倩, 欧洁, 等. siRNA靶向抗酶抑制剂下调前列腺癌细胞PC3中鸟氨酸脱羧酶表达[J]. 基础医学与临床, 2018, 38(4): 475-9. Jin T, Li Q, Ou J, et al. siRNA-mediated antizyme inhibitor down-regulatesthe expression of ornithine decarboxylase of prostate cancer cell PC3[J]. Basic Clin Med, 2018, 38(4): 475-9. doi:10.3969/j.issn.1001-6325.2018.04.010 |
| [13] |
Choi K S, Suh Y H, Kim W, et al. Stable siRNA-mediated silencing of antizyme inhibitor:regulation of ornithine decarboxylase activity[J]. Biochem Biophys Res Commun, 2005, 328(1): 206-12. doi:10.1016/j.bbrc.2004.11.172 |
| [14] |
周游, 孙丽丹, 杨建林, 等. 新型SMO抑制剂SI-4650对人神经胶质瘤U87MG细胞增殖、凋亡和自噬能力的影响[J]. 中国药理学通报, 2019, 35(1): 63-70. Zhou Y, Sun L D, Yang J L, et al. Effects of novel SMO inhibitor SI-4650 on proliferation, apoptosis and autophagy of human glioma U87MG cells[J]. Chin Pharmacol Bull, 2019, 35(1): 63-70. doi:10.3969/j.issn.1001-1978.2019.01.014 |
| [15] |
Wang J, Li T, Zang L, et al. Apigenin inhibits human sw620 cell growth by targeting polyamine catabolism[J]. Evid Based Complement Alternat Med, 2017, 2017: 1-12. |

