


2. 贵州省再生医学重点实验室, 贵州 贵阳 550004;
3. 基础医学院机能实验室, 贵州 贵阳 550004;
4. 临床医学院病理学教研室, 贵州 贵阳 550004
 ,
ZENG Zhi-rui1,
LEI Shan1,
SUN Yuan-mei1,
LAN Jin-zhi2,
ZHANG Jin-juan3,
YANG Yu-shi4,
XU Shu4,
CHEN Teng-xiang1
,
ZENG Zhi-rui1,
LEI Shan1,
SUN Yuan-mei1,
LAN Jin-zhi2,
ZHANG Jin-juan3,
YANG Yu-shi4,
XU Shu4,
CHEN Teng-xiang1

2. Dept of Pathology, Guizhou Medical University,Guiyang 550004, China;
3. Dept of Regenerate Research,Guiyang 550004, China;
4. Lab of Functional Experiments,Guiyang 550004, China
肝癌是常见的消化道恶性肿瘤之一,发病率仅次于胃癌,死亡率较高[1]。吉西他滨是脱氧胞苷类似物,作为部分转移或不能切除的肝癌类患者的基础一线化疗药,也是肿瘤手术切除患者的辅助化疗药[2]。五味子甲素(deoxyschizandrin)是我国传统中草药木兰科植物五味子果实提取物,木脂素类的有效成分,具有抑制肿瘤生长、抗炎、抗病毒活性等作用[3]。近年来,研究报道,五味子甲素对多种肿瘤细胞有显著的抑制作用,如乳腺癌和甲状腺癌等[4-5]。前期,我们课题组发现五味子甲素可以通过抑制β-catenin信号通路抑制胰腺癌细胞的增殖[6]。然而,五味子甲素对肝癌细胞的作用以及是否与吉西他滨存在协同作用,尚不明确。本研究探讨五味子甲素、吉西他滨及联合用药对肝癌细胞HepG2增殖、凋亡以及β-catenin/转录因子4(transcription, TCF4)信号通路的影响。
1 材料与方法 1.1 材料 1.1.1 细胞人肝癌细胞HepG2购自中国科学院上海细胞库。
1.1.2 主要试剂细胞培养基(dulbecco’s modified eagle medium, DMEM)(C11995500BT, Gibco)、FBS胎牛血清(fetal bovine serum, FBS)(16000-044, Gibco)、胰酶(25200-056, Gibco)购自购自美国Gibco公司;细胞增殖与毒性检测试剂盒(Cell Counting Kit-8, CCK8)(AR1160, Boster)、二抗山羊抗兔(BST14C25C54, Boster)及山羊抗鼠(BST13L13B50, Boster)购自武汉博士德生物公司;凋亡试剂盒(C1062L, Beyotime)购自上海碧云天生物技术有限公司;二甲基亚砜(dimethylsulfoxide,DMSO)购自北京索莱宝科技有限公司;多克隆抗体BCL2(12789-1-AP, Proteintech)、BAX(50599-2-Ig, Proteintech)、caspase-3(19677-4-AP, Proteintech)、caspase-9(10380-1-AP, Proteintech)、β-catenin(51067-2-AP, Proteintech)、TCF-4(22337-4-AP, Proteintech)及β-actin(6008-1-Ig, Proteintech)购自武汉三鹰生物技术有限公司;ECL(G2014, Servicebio)曝光液购自武汉塞维尔生物科技有限公司;五味子甲素(纯度 > 98%)(HY-N0693, MCE)购自MCE生物公司。
1.1.3 仪器细胞培养超净台(苏州净化设备有限公司);Model 310细胞恒温CO2培养箱(美国Thermo公司);Eclipse Ti-s倒置显微镜(日本Nikon公司);Novoexpress流式细胞仪(美国艾森生物公司);全波段多功能酶标仪(美国BioTek公司);凝胶成像系统(美国Bio-red公司)。
1.2 方法 1.2.1 细胞培养与药液的配制人肝癌细胞HepG2用含有10%FBS、1%青霉素及1%链霉素的DMEM培养基培养,置于5% CO2、37 ℃的培养箱中,细胞生长融合至70%~80%时,用0.25%胰酶消化传代,取生长状态良好的细胞用于实验。五味子甲素用DMSO配制为1 mmol·L-1的母液,吉西他滨用DMSO配制为5 mmol·L-1的母液;过滤除菌后,-20 ℃保存备用。
1.2.2 CCK-8法检测细胞存活取对数生长期的HepG2细胞(5×103个/孔)接种于96孔中,每孔100 μL;培养于37 ℃、5% CO2培养箱中。待细胞贴壁后,分别加入不同浓度的五味子甲素(12.5、25、50、100 μmol·L-1)、吉西他滨(3.75、6.25、12.5、25 μmol·L-1)、联合用药(五味子甲素15 μmol·L-1 +吉西他滨5 μmol·L-1)及含等体积的DMSO培养液为对照组,每组设置5个复孔。各组培养48 h后,每孔加入含10 μL CCK8试剂的培养基100 μL,继续在培养箱中避光孵育2 h后,用酶标仪在450 nm处检测OD值,每组实验重复3次。细胞增殖率/%=(试验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。用金氏公式计算五味子甲素联合吉西他滨是否具有协同作用,q=E(A+B)/(EA+(1-EA)·EB),E(A+B)为药物联合作用的抑制率,其中EA、EB分别为单独药物作用组的抑制率,q > 1.15为协同作用,q=0.85~1.15为相加作用,q < 0.85为拮抗作用;实验独立重复3次。
1.2.3 平板克隆实验检测细胞的克隆形成能力取对数生长期的HepG2细胞(2×103个/孔)接种于6孔板中,培养于37 ℃、5% CO2培养箱中,待培养过夜细胞完全贴壁后,分别加入上述CCK-8液计算出药液的IC20浓度,15 μmol·L-1五味子甲素药液、5 μmol·L-1吉西他滨药液为实验组及含等体积DMSO对照组;继续培养10 d后,弃掉培养基,用磷酸缓冲盐溶液(phosphate buffer saline, PBS)清洗3次,4%多聚甲醛固定30 min,结晶紫染色30 min, 清洗残余结晶紫染液,干燥后拍照计数。实验重复3次取平均值。
1.2.4 流式细胞仪检测细胞凋亡取对数生长期的HepG2细胞(1×108个·L-1)接种于6孔板中,培养过夜细胞完全贴壁后,分别加入上述CCK-8液计算出药液的IC20浓度,15 μmol·L-1五味子甲素药液、5 μmol·L-1吉西他滨药液为实验组及含等体积DMSO对照组。继续培养48 h后,消化离心收集细胞,加入5 μL的碘化丙啶(propidium iodide, PI)和2.5 μL的异硫氰酸荧光素(fluorescein isothiocyanate isomer, Annex V-FITC), 室温避光反应30 min后,流式细胞仪检测。
1.2.5 Western blot检测BCL2、BAX、pro-caspase3、cleaved-caspase3、pro-caspase9、cleaved-caspase9、β-catenin、TCF-4及β-actin的表达取对数生长期的HepG2细胞接种于6孔板中,待细胞生长融合度达到75%~80%时,分别加入上述CCK-8液计算出药液的IC20浓度,15 μmol·L-1五味子甲素药液、5 μmol·L-1吉西他滨药液为实验组及含等体积DMSO对照组。继续培养48 h后,试剂RIPA与苯甲基磺酰氟以100 :1比列混匀配制裂解液,冰上充分裂解10 min,4 ℃、12 000 r·min-1离心15 min后提取蛋白样品,用BCA法定量蛋白浓度,将蛋白样品与上样缓冲液混合,煮沸10 min。每孔取30 μg蛋白样品进行上样,进行聚丙烯酰胺凝胶电泳120 min,湿转法转印至PVDF膜120 min, 用5%的脱脂牛奶封闭120 min,分别加入兔源性BCL2、BAX、caspase3、caspase9、β-catenin、TCF-4和鼠源性β-actin一抗(1 :1 000),4 ℃孵育过夜,TBST清洗3次(15 min每次);分别加入相应的二抗(山羊抗兔/鼠)室温孵育120 min,TBST清洗3次(15 min每次);在暗室中滴加曝光液,曝光显影,用Image Lab软件分析目的条带。实验重复3次。
1.2.6 统计学分析采用GraphPad Prism 6.0统计软件进行数据的处理及分析,计量资料用x±s表示,组间显著性差异比较采用t检验。
2 结果 2.1 五味子甲素、吉西他滨及联合用药对HepG2细胞增殖的抑制作用CCK-8结果显示,五味子甲素浓度为12.5、25、50、100 μmol·L-1时,增长率分别为(86.5±2.9)%、(61.2±2.5)%、(17.8±3.4)%、(10.5±3.5)%;除了12.5 μmol·L-1组,其余各组与对照组相比,均是P < 0.05,具有统计学差异(Fig 1A)。吉西他滨浓度为3.75、6.25、12.5、25 μmol·L-1,增长率分别为(88.6±2.5)%、(67.3±2.5)%、(49.1±5.1)%、(38.6±2.9)%;除了3.75 μmol·L-1组,其余各组与对照组相比,均是P < 0.05,具有统计学差异(Fig 1B)。选择IC20的药物浓度探究五味子甲素与吉西他滨是否存在联合效果。结果显示,五味子甲素(15 μmol·L-1)、吉西他滨(5 μmol·L-1)和联合用药组增长率分别为(80.7±3.6)%、(75.7±3.6)%、(35.0±1.4)%,与对照组相比各组间均P < 0.05, 具有统计学意义(Fig 1C)。五味子甲素(15 μmol·L-1)联合吉西他滨(5 μmol·L-1)作用HepG2细胞48h时,q值为1.8。结果表明,五味子甲素能够协同吉西他滨,抑制肝癌细胞增殖。
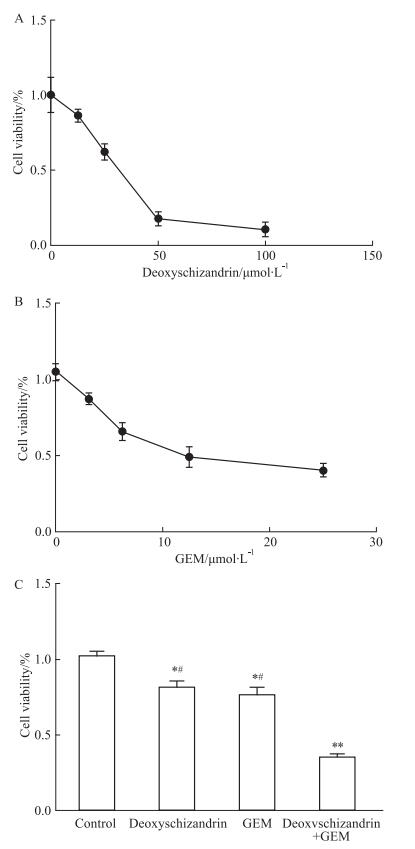
|
| Fig 1 Effect of deoxyschizandrin, GEM and combination treatment on proliferation of human hepatocellular carcinoma HepG2 cells in vitro(x±s, n=3) A: Effect of deoxyschizandrin treatment on proliferation of HepG2 cells; B: Effect of GEM treatment on proliferation of HepG2 cells. C: Effect of deoxyschizandrin, GEM and combination treatment on proliferation of HepG2 cells. *P < 0.05, **P < 0.01 vs control group, #P < 0.05 vs combination group. |
克隆平板结果(Fig 2A-B)显示,五味子甲素、吉西他滨、联合用药及对照组的细胞克隆数分别为(324±14)、(309±10)、(156±18)、(455±8)。各组与对照组相比,均有显著性差异(P < 0.05);药物联合组与各单药组相比,均有显著性差异(P < 0.05)。
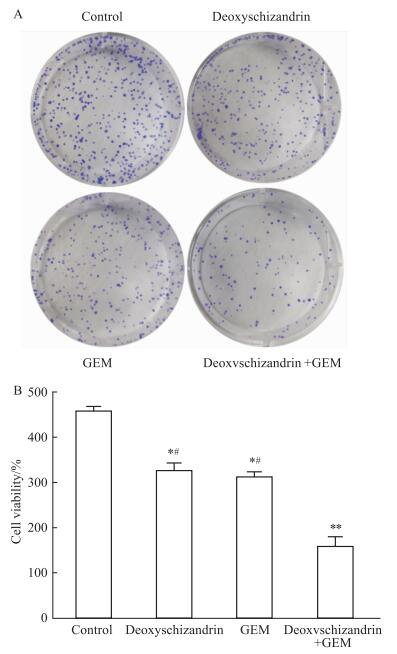
|
| Fig 2 Effect of deoxyschizandrin, GEM and combination treatment on cell colonies of human hepatocellular carcinoma HepG2 cells in vitro(x±s, n=3) A: Effect of deoxyschizandrin, GEM and combination treatment on cell colonies of HepG2 cells; B: Data analysis of A. *P < 0.05, **P < 0.01 vs control group, #P < 0.05 vs combination group. |
流式细胞术(Fig 3A-B)结果显示,对照组、五味子甲素组、吉西他滨组及联合用药组的凋亡率分别为(2.04± 0.19)%、(5.44±0.33)%、(6.17±0.20)%、(20.68±0.39)%,各组与对照组相比,均有显著性差异(P < 0.05);药物联合组与各单药组相比,均有显著性差异(P < 0.01)。
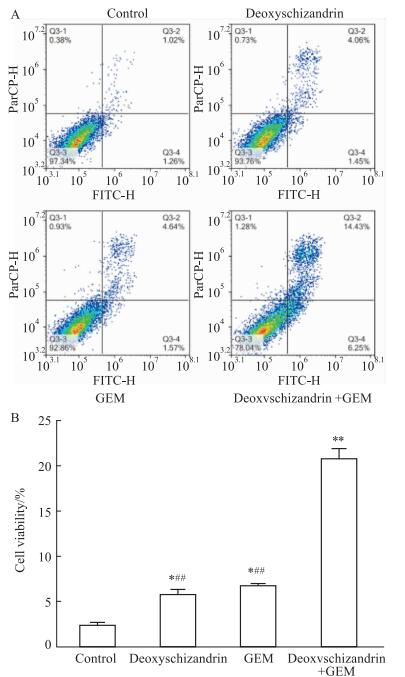
|
| Fig 3 Effect of deoxyschizandrin, GEM and combination treatment on apoptosis of human hepatocellular carcinoma HepG2 cells in vitro(x±s, n=3) A: Effect of deoxyschizandrin, GEM and combination treatment on apoptosis of HepG2 cells; B: Data analysis of A. *P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs combination group. |
Western blot蛋白印迹对凋亡相关蛋白Bcl-2、Bax、pro- caspase3、cleaved-caspase3、pro-caspase9和cleaved-caspase9进行检测。结果(Fig 4A-B)表明,与对照组相比,五味子甲素、吉西他滨及联合用药对pro-caspase3、pro-caspase9无明显影响;抗凋亡蛋白Bcl-2的表达明显减少(P < 0.05);促凋亡蛋白Bax、cleaved-caspase3、cleaved- caspase9的表达明显增多(P < 0.05)。联合用药组比单药组更为显著(P < 0.05)。进一步,应用Western blot实验检测β-catenin和TCF-4蛋白,结果(Fig 4C-D)表明,五味子甲素、吉西他滨及联合用药均明显抑制β-catenin和TCF-4蛋白的表达(P < 0.05),联合用药组比单药组更为显著(P < 0.01)。
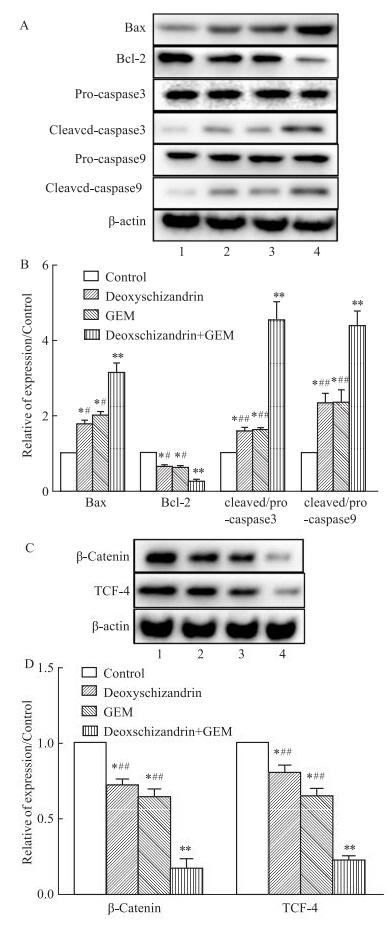
|
| Fig 4 Effect of deoxyschizandrin, GEM and combination treatment on expression levels of relative proteins in human hepatocellular carcinoma HepG2 cells(x±s, n=3) A: The protein levels of Bcl-2, Bax, pro-caspase3, cleaved-caspase3, pro-caspase9, cleaved-caspase9 in HepG2 cells treated with deoxyschizandrin, GEM, and their combinations; B: Data analysis of A. C: The protein levels of β-catenin and TCF-4 in HepG2 cells treated with deoxyschizandrin, GEM, and their combinations; D: Data analysis of C. (1:Control; 2:Deoxyschizandrin; 3:GEM; 4:Deoxschizandrin+GEM) *P < 0.05, **P < 0.01 vs control group, #P < 0.05, ##P < 0.01 vs combination group. |
肝癌是一种恶性的消化系统肿瘤,患者预后较差。尽管近几年来,肝癌诊断技术和治疗水平不断完善,但是生存率仍然没有得到较大提高。其中还有早期癌症低诊断率和化疗药物大量使用所造成的耐药及毒性等问题[7]。因此,继续积极寻找有效的肝癌治疗化疗药具有重要意义。
近年来,中药及其提取物对抗肿瘤治疗方面的作用得到了广泛的认可,其抗肿瘤机制的研究也日渐重视。五味子甲素作为木兰科植物五味子果实提取物的有效成分,不仅具有抗炎、抗病毒及免疫抑制等作用,在抗肿瘤活性方面也作用显著[3]。目前,已有研究报道,五味子甲素抑制人胰腺癌细胞、卵巢癌细胞的增殖,促进其凋亡[6-8]。吉西他滨是新一代应用于临床的抗代谢类肿瘤化疗药,具有广谱、低毒、作用机制独特等特点。吉西他滨竞争性的抑制DNA的合成,产生细胞毒性,促进细胞凋亡[9]。吉西他滨已广泛应用于胰腺癌、非小细胞肺癌、卵巢癌、乳腺癌等肿瘤的治疗中。已有研究报道,五味子甲素通过上调miR-195增强结肠癌细胞对5-氟尿嘧啶的化学敏感性[10];在非小细胞肺癌中五味子甲素可提高吉非替尼的功效[11]。与过往研究一致,本研究发现五味子甲素与吉西他滨存在联合作用,显著抑制肝癌细胞HepG2的增殖,诱导其凋亡。
细胞凋亡是由基因调控的细胞程序性死亡, 是平衡正常细胞存活和死亡的重要机制。细胞凋亡过程复杂,受多种基因的调控,以Bcl-2家族和caspase3家族为主。Bcl-2和BAX为Bcl-2家族的成员,与细胞凋亡进程的发生发展密切相关;在线粒体凋亡途径中,Bcl-2、Bax共同决定线粒体膜上电位的改变,释放相关促凋亡因子,启动caspase级联反应,诱导细胞凋亡[12-13]。与流式实验一致,我们发现五味子甲素、吉西他滨及联合用药显著增加凋亡蛋白Bax、cleaved-caspase3、cleaved-caspase9的表达,减少抗凋亡蛋白BCL2的表达。
调控Bax、Bcl-2等凋亡相关蛋白的表达是一个复杂的网路体系,β-catenin蛋白是其中重要调控因素之一,也是经典Wnt信号通路的枢纽因子。β-catenin与TCF-4形成复合物,在核内激活调控下游靶基因的转录,从而影响肿瘤的增殖、凋亡等过程[14-15]。我们前期在胰腺癌的研究中发现,五味子甲素可以显著减少β-catenin的表达及核转位[6]。在本研究中,我们发现,五味子甲素和吉西他滨均显著减少β-catenin及TCF-4的表达。联合用药作用更为显著。
综上所述,五味子甲素协同吉西他滨通过抑制β-catenin/TCF-4的表达减少肝癌细胞HepG2的增殖,诱导凋亡。五味子甲素是一种有潜力的抗肝癌药物。
| [1] |
Feng R M, Zong Y N, Cao S M, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics[J]. Cancer Commun (Lond), 2019, 39(1): 22. doi:10.1186/s40880-019-0368-6 |
| [2] |
Zheng Y, Xu D, Bu Z. Chinese version of NCCN clinical practice guidelines in oncology officially authorized by NCCN[J]. Chin J Cancer Res, 2016, 28(1): 144-5. |
| [3] |
Zhong S, Nie Y C, Gan Z Y, et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure[J]. J Ethnopharmacol, 2015, 165: 73-82. doi:10.1016/j.jep.2015.02.009 |
| [4] |
Xu X, Rajamanicham V, Xu S, et al. Schisandrin A inhibits triple negative breast cancer cells by regulating Wnt/ER stress signaling pathway[J]. Biomed Pharmacother, 2019, 115: 108922. doi:10.1016/j.biopha.2019.108922 |
| [5] |
Ding Q, Li X, Sun Y, et al. Schizandrin A inhibits proliferation, migration and invasion of thyroid cancer cell line TPC-1 by down regulation of microRNA-429[J]. Cancer Biomark, 2019, 24(4): 497-508. doi:10.3233/CBM-182222 |
| [6] |
曾智锐, 雷珊, 张金娟, 等. 五味子甲素对人胰腺癌细胞株AsPc-1增殖、凋亡的影响及其机制[J]. 山东医药, 2019, 59(12): 1-4. Zeng Z R, Lei S, Zhang J J, et al. Effects and mechanism of deoxyschizandrin on proliferation and apoptosis of human pancreatic cancer cells AsPc-1[J]. Shandong Med J, 2019, 59(12): 1-4. doi:10.3969/j.issn.1002-266X.2019.12.001 |
| [7] |
Gao Q, Wang Z C, Duan M, et al. Cell culture system for analysis of genetic heterogeneity within hepatocellular carcinomas and response to pharmacologic agents[J]. Gastroenterology, 2017, 152(1): 232-42. doi:10.1053/j.gastro.2016.09.008 |
| [8] |
Lee K, Ahn J H, Lee K T, et al. Deoxyschizandrin, isolated from schisandra berries, induces cell cycle arrest in ovarian cancer cells and inhibits the arotumoural activation of tumour-associated macrophages[J]. Nutrients, 2018, 10(1): 91-15. doi:10.3390/nu10010091 |
| [9] |
Reddy L H, Couvreur P. Novel approaches to deliver gemcitabine to cancers[J]. Curr Pharm Des, 2008, 14(11): 1124-37. doi:10.2174/138161208784246216 |
| [10] |
Kong D, Zhang D, Chu X, et al. Schizandrin A enhances chemosensitivity of colon carcinoma cells to 5-fluorouracil through up-regulation of miR-195[J]. Biomed Pharmacother, 2018, 99: 176-83. doi:10.1016/j.biopha.2018.01.035 |
| [11] |
Xian H, Feng W, Zhang J. Schizandrin A enhances the efficacy of gefitinib by suppressing IKKbeta/NF-kappaB signaling in non-small cell lung cancer[J]. Eur J Pharmacol, 2019, 855: 10-9. doi:10.1016/j.ejphar.2019.04.016 |
| [12] |
阚悦, 杨雁. 基于Cleaved caspase-9研究丹酚酸B对肝纤维化细胞凋亡的影响[J]. 中国药理学通报, 2019, 35(6): 827-32. Kan Y, Yan Y. Effect of salvianolic acid B on apoptosis of liver fibrotic cells based on cleaved caspase-9 protein[J]. Chin Pharmacol Bull, 2019, 35(6): 827-32. doi:10.3969/j.issn.1001-1978.2019.06.018 |
| [13] |
Chiang J H, Yang J S, Ma C Y, et al. Danthron, an anthraquinone derivative, induces DNA damage and caspase cascades-mediated apoptosis in SNU-1 human gastric cancer cells through mitochondrial permeability transition pores and Bax-triggered pathways[J]. Chem Res Toxicol, 2011, 24(1): 20-9. doi:10.1021/tx100248s |
| [14] |
Dai Y, Wang M, Wu H, et al. Loss of FOXN3 in colon cancer activates beta-catenin/TCF signaling and promotes the growth and migration of cancer cells[J]. Oncotarget, 2017, 8(6): 9783-93. |
| [15] |
Wei W, Chua M S, Grepper S, et al. Small molecule antagonists of Tcf4/beta-catenin complex inhibit the growth of HCC cells in vitro and in vivo[J]. Int J Cancer, 2010, 126(10): 2426-36. |