

阿尔茨海默病(Alzheimer’s disease,AD)是一种发生于中老年的神经系统变性疾病。研究报道[1] AD海马神经元有自噬功能障碍,表现为自噬体的成熟、转运及自噬溶酶体形成障碍,导致自噬体大量堆积。Aβ沉积被认为是AD的发病的核心和“始动”因素,自噬是细胞内清除Aβ的重要形式和途径。细胞内mTOR信号通路异常会导致自噬功能障碍。改善脑自噬功能障碍进而减少Aβ沉积成为AD治疗的方向,但相关药物的开发仍有限。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶的一种主要多酚成分,占茶多酚制品的40%~50%。研究表明[2-5],EGCG具有很强的抗氧化、神经元保护等功效,是抗氧化作用最强的自由基清除剂之一。因此本文以APP/PS1转基因小鼠为对象,研究了EGCG对此动物模型脑自噬功能的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物8月龄APP/PS1转基因小鼠24只,同月龄同背景C57BL/6J小鼠8只,购自中国医科大学实验动物中心,许可证号:SYXK(辽)2008-005。
1.1.2 主要试剂EGCG(纯度>95%)购于Sigma公司;mTOR多克隆抗体购于北京中杉金桥公司;兔抗ULK1抗体、兔抗P62抗体、兔抗LC3Ⅱ/LC3Ⅰ抗体购于北京博奥森生物技术有限公司;Aβ1-42ELISA试剂盒购于Invitrogen公司。
1.1.3 仪器Morris水迷宫安徽正华生物仪器设备有限公司;电泳仪、凝胶成像系统美国bio-rad公司;石蜡切片机德国Leica;紫外分光光度计德国Biophotometer。
1.2 方法 1.2.1 动物分组与处理将APP/PS1转基因小鼠随机分成3组,即模型组(transgenic,Tg)、EGCG低剂量组(Tg/EGCG-L)和EGCG高剂量组(Tg/EGCG-H),对照组(nontransgenic type,NT)为同月龄同背景C57BL/6J小鼠,每组小鼠8只。给药方法:NT组和Tg组每天给予双蒸水0.15 mL灌胃,Tg/ EGCG -L组和Tg/ EGCG -H组分别每天给予EGCG 2 mg·kg-1、6 mg·kg-1 0.15 mL灌胃,均给药4周。
1.2.2 Morris水迷宫试验进行行为学检测给药结束24 h后行Morris水迷宫实验,实验分为定位航行实验和空间探索实验两部分,实验程序参照Morris等方法进行[6],检测各组小鼠的空间学习记忆能力。
1.2.3 Western blot检测ULK1、P62、LC3Ⅱ/LC3Ⅰ的蛋白表达提取各组小鼠海马的总蛋白,BCA法测定蛋白浓度,40 μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转膜,5%牛奶封闭,一抗(ULK1,1 :500;P62,1 :500;LC3Ⅱ/LC3Ⅰ,1 :500;GAPDH,1 :5 000)4 ℃孵育过夜,辣根过氧化物酶结合的二抗常温孵育1 h。ECL显影,凝胶成像系统曝光,Image J软件分析。
1.2.4 免疫组化方法检测mTOR蛋白表达提取小鼠右半脑组织于4%多聚甲醛中固定,常规石蜡包埋制备切片,切片经二甲苯脱蜡,梯度酒精脱水。0.1 mmol·L-1柠檬酸盐缓冲液高压热修复抗原,滴加血清封闭液。一抗(mTOR多克隆抗体,1 :100)4 ℃孵育过夜。滴加生物素标记的二抗,37 ℃孵育1 h。应用DAB显色试剂盒显色。显微镜下观察染色呈现出淡棕黄色后,用ddH2O冲洗中止显色反应。用光学显微镜观察每个视野中阳性细胞表达,每组实验小鼠切片随机选取海马区3个视野,用Image-Pro Plus v6.0图像分析软件分别测定每张切片内表达阳性蛋白神经元的整合光密度值。
1.2.5 ELISA法检测海马Aβ1-42水平将各组小鼠的脑组织称重,加入8倍体积的盐酸胍裂解液研磨,室温下静置3-4 h。用反应缓冲液1 :50稀释样品,离心20 min、取上清用于可溶性Aβ1-42的测定,离心管底部沉淀再用70%甲酸溶解,离心1 h,收集上清液用于不可溶性Aβ1-42的测定。取标准品按说明书建立标准曲线。将标准品、样品各50 μL分别加入微量酶标板内,立即向每孔加入50 μL Aβ42抗体,置摇床室温孵育3h。反复洗板4次,室温孵育30 min。每孔加100 μL染液覆盖,37 ℃孵育30 min。取出酶标板,每孔加终止液100 μL,轻轻混匀,直至孔中的液体由蓝变黄。空白孔调零,30 min内在450nm波长读取光密度(OD值),根据曲线方程,求出脑组织中Aβ1-42的浓度。
1.2.6 统计学分析实验数据以均值±标准差(x±s)表示,采用SPSS13.0统计软件进行数据分析处理。组间比较采用One-Way ANOVA方法分析。
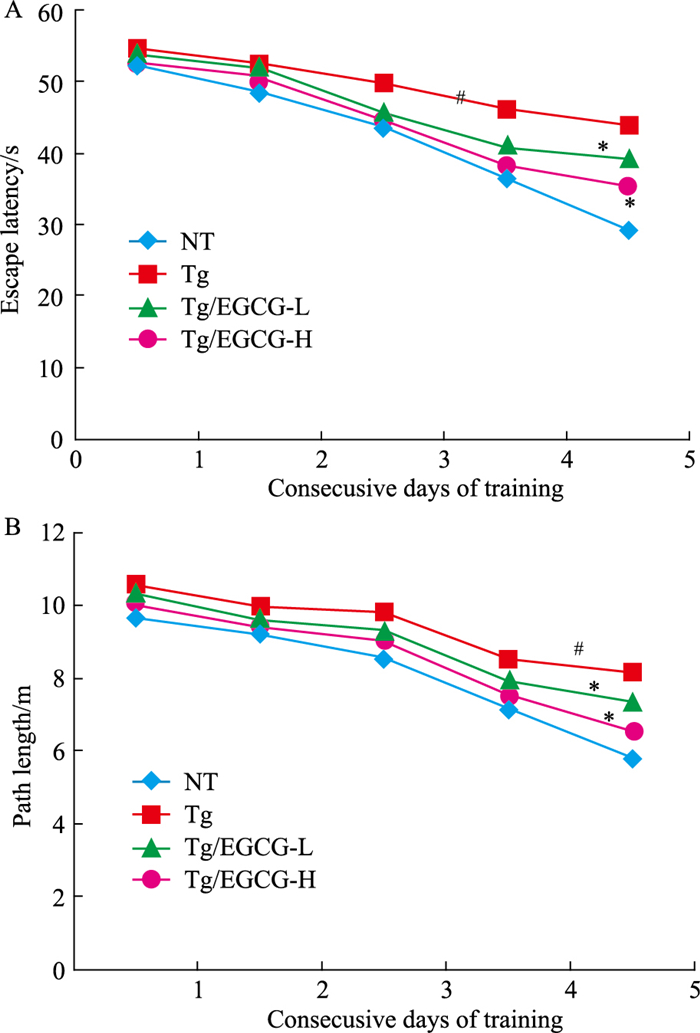
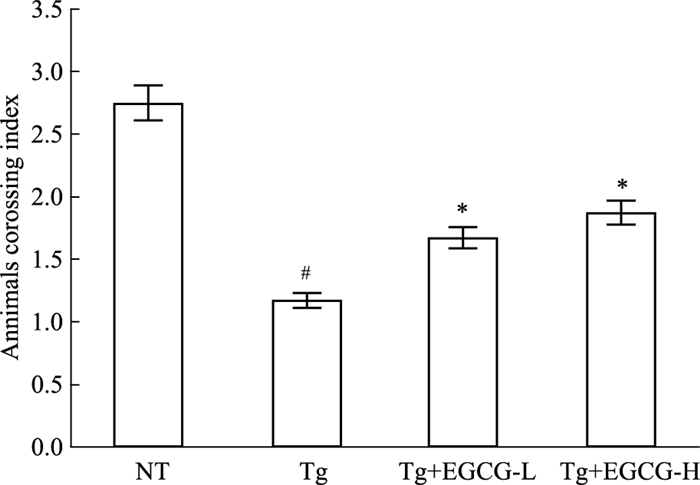
2 结果 2.1 EGCG改善APP/PS1转基因小鼠学习记忆能力各组小鼠定位航行试验(Fig 1A,1B),显示寻找平台逃避潜伏期及平均路程随着测试时间的延长逐渐缩短。Tg组小鼠逃避潜伏期和寻找平台平均路程延长(P < 0.05);经EGCG治疗后均明显缩短(P < 0.05),表明APP/PS1小鼠具有明显的空间学习障碍,EGCG可以改善其能力。空间探索试验结果(Fig 2)显示,Tg组小鼠穿梭原平台所在象限次数明显减少(P < 0.05),经EGCG治疗后次数均明显增加(P < 0.05),提示APP/PS1转基因小鼠的空间记忆再现能力减低,EGCG可改善其能力。
|
| Fig 1 Spatial learning and memory assessed by measurement of escape latency(A)and path length (B)(x±s, n=12) #P < 0.05 vs NT; *P < 0.05 vs Tg |
|
| Fig 2 Number of times entered target zone in it during 120s probe trail(x±s, n=12) #P < 0.05 vs NT; *P < 0.05 vs Tg |
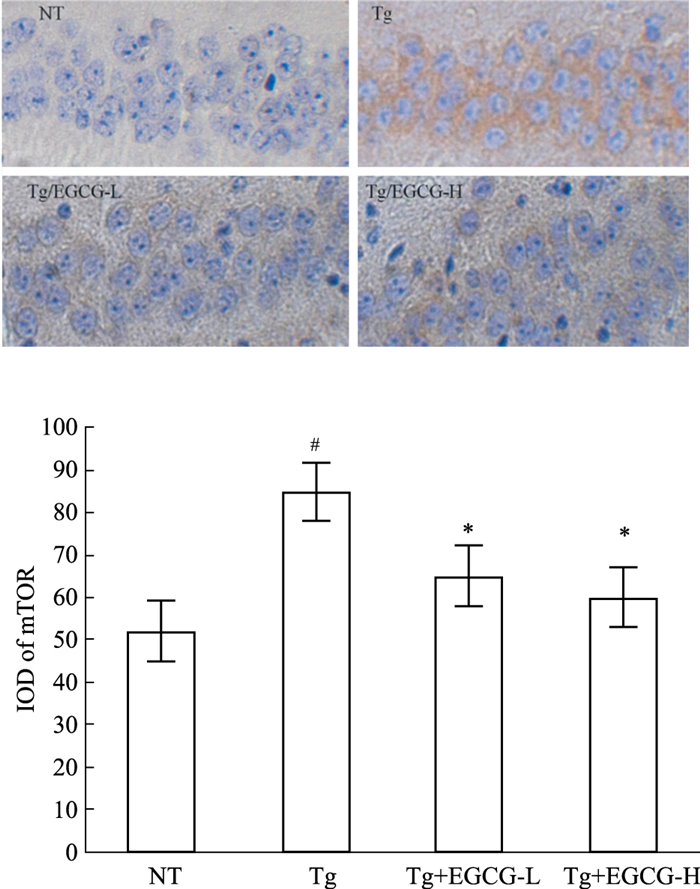
各组小鼠海马CA1区均可见胞质呈棕黄色的mTOR阳性表达细胞(Fig 3)。与NT组比较,Tg组小鼠海马mTOR蛋白表达阳性神经元增多、整合光密度值明显升高(P < 0.05),提示APP/PS1转基因小鼠存在自噬功能障碍;与Tg组比较,Tg/EGCG-L组和Tg/ EGCG -H组小鼠海马mTOR表达阳性神经元减少,mTOR蛋白表达整合光密度值降低(P < 0.05),提示APP/PS1转基因小鼠经EGCG治疗后脑自噬功能改善。
|
| Fig 3 Levels of mTOR in APP/PS1 mice reduced by EGCG treatment(×400) (x±s, n=12) #P < 0.05 vs NT; *P < 0.05 vs Tg |
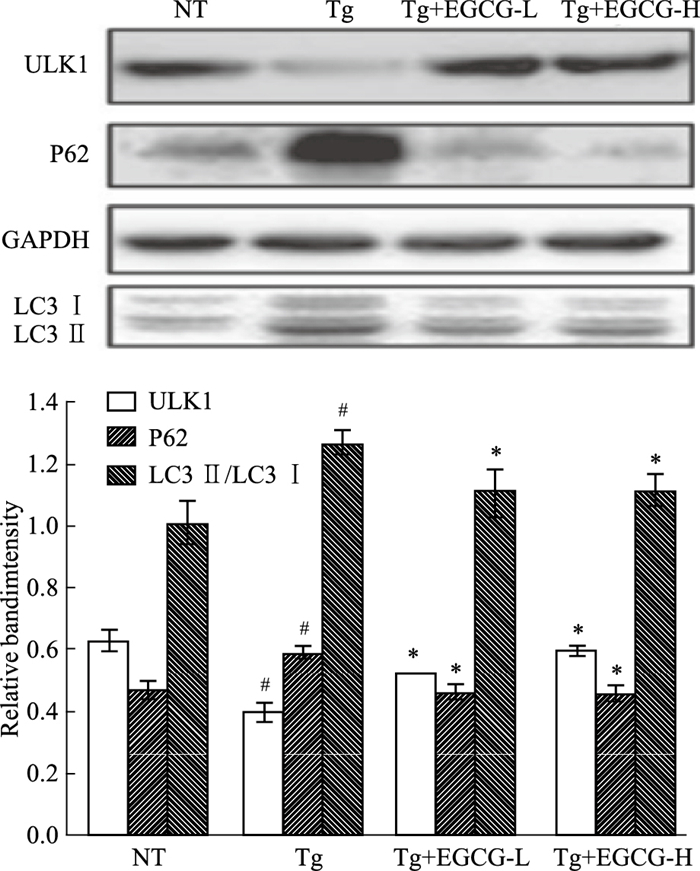
Western blot结果显示(Fig 4),与NT组比较,Tg组小鼠海马ULK1蛋白表达较明显减少、P62蛋白表达明显增加、LC3Ⅱ/ LC3Ⅰ蛋白表达明显增加(P < 0.05),提示APP/PS1转基因小鼠脑内存在自噬启动受阻、自噬活性明显下降及自噬体大量堆积等自噬功能障碍。与Tg组相比Tg/EGCG-L组和Tg/EGCG-H组小鼠海马ULK1蛋白表达明显增加、P62蛋白表达减少、LC3Ⅱ/ LC3Ⅰ蛋白表达减少(P < 0.05),提示了EGCG可以促进APP/PS1小鼠海马内的自噬启动,提高自噬活性,减少自噬体堆积,提高自噬通量,从而减轻自噬功能障碍。
|
| Fig 4 Effects of EGCG on autophagy related proteins in hippocampus of APP/PS1 mice(x±s, n=12) #P < 0.05 vs NT; *P < 0.05 vs Tg |
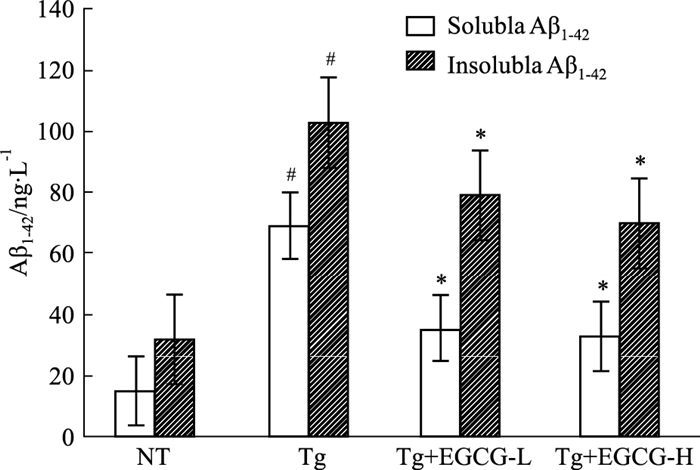
ELISA结果显示(Fig 5A、5B),Tg组小鼠海马可溶性Aβ1-42含量及不可溶性Aβ1-42含量(69.08±9.28 pg·mg-1,103.07±11.16 ng·mg-1)较NT组(15.07±5.75 pg·mg-1,32.08±7.69 ng·mg-1)明显增高(P < 0.05);Tg/EGCG-L组和Tg/EGCG-H组小鼠海马可溶性Aβ1-42含量分别为(35.26±6.07,33.28±10.27)pg·mg-1和不可溶性Aβ1-42含量(79.26±6.35,70.28±7.21)ng·mg-1,差异有统计学意义(P < 0.05)。
|
| Fig 5 Effects of EGCG on levels of Aβ1-42 in hippocampus of APP/PS1 mice(x±s,n=12) #P < 0.05 vs NT; *P < 0.05 vs Tg |
EGCG是绿茶中的一种自然多酚类化合物,研究表明[2-5],EGCG具有很强的抗氧化、自由基清除、神经元保护等作用,从而改善AD的认知功能。目前关于EGCG能否通过改善脑自噬、减少Aβ斑块沉积未见报道。
研究表明[7-8]AD存在自噬功能障碍,不能降解异常蛋白质,从而导致自噬体堆积及Aβ沉积。在mTOR信号调控下,ULK1(ubiquitin like kinase1)启动自噬,衔接蛋白P62一侧连于待降解蛋白,一侧连于自噬体膜上的微管相关蛋白1轻链3(microtubule associated protein1 light chain3,LC3)Ⅱ蛋白,然后包裹待降解蛋白和P62被选择性清除,因此P62与自噬活性负相关,LC3Ⅱ/ LC3Ⅰ代表了自噬体的堆积程度。本研究中转基因痴呆小鼠脑内ULK1的蛋白表达下降、P62的蛋白表达增加、LC3Ⅱ/ LC3Ⅰ蛋白表达增加,说明APP/PS1转基因小鼠存在自噬启动受阻、识别连接待降解自噬内容物及自噬体堆积等自噬功能障碍[7-8]。EGCG可以通过调节小鼠脑内mTOR信号通路,上调ULK1蛋白的表达激活自噬;下调P62的蛋白表达提高识别及连接待降解自噬内容物的能力;下调LC3Ⅱ/ LC3Ⅰ蛋白表达减少脑内自噬体堆积,有利于清除异常蛋白。
自噬是AD细胞内清除Aβ的重要形式。AD在老年斑出现之前,就已经有自噬体成熟、转运及降解抑制、溶酶体酶增多等自噬功能障碍,从而导致了Aβ聚集[9]。本研究表明APP/PSl转基因小鼠海马有大量Aβ沉积,给以EGCG治疗后转基因小鼠海马内Aβ沉积减少。其机制可能是EGCG通过改善自噬功能从而增加Aβ降解。
本文证实了EGCG能促进APP/PS1转基因小鼠脑自噬启动、提高自噬活性及减少自噬体堆积等改善自噬功能障碍,进而减少海马Aβ沉积,从而提高了空间学习记忆能力。
| [1] |
Ying G, Iribarren P, Zhou Y, et al. Humanin, a newly identified neuroprotective factor, uses the G protein-coupled formylpeptidem receptor-like-1 as a functional receptor[J]. J Immunol, 2004, 172(11): 7078-85. |
| [2] |
Khan N, Afaq F, Saleem M, et al. Targeting multiple signaling pathways by green tea polyphenol (-)-epigallocatechin-3-gallate[J]. Cancer Res, 2006, 66(5): 2500-5. |
| [3] |
Tsuneki H, Ishizuka M, Terasawa M, et al. Effect of green tea on blood glucose levels and serum proteomic patterns in diabetic (db/db) mice and on glucose metabolism in healthy humans[J]. BMC Pharmacol, 2004, 4: 18-21. |
| [4] |
Choi Y T, Jung C H, Lee S R, et al. The green tea polyphenol (-)-epigallocatechin gallate attenuates beta-amyloid-induced neurotoxicity in cultured hippocampal neurons[J]. Life Sci, 2001, 70(5): 603-14. |
| [5] |
Lee S R, Im K J, Suh S I, et al. Protective effect of green tea polyphenol (-)-epigallocatechin gallate and other antioxidants on lipid peroxidation in gerbil brain homogenates[J]. Phytother Res, 2003, 17(3): 206-9. |
| [6] |
Vorhees Charles V, Williams M T. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc, 2006, 1(2): 848-58. |
| [7] |
Perluigi M, Pupo G, Tramutola A, et al. Neuropathological role of PI3K/Akt/mTORaxis in Down syndrome brain[J]. Biochim Biophys Acta, 2014, 1: 842-53. |
| [8] |
钟轶, 郑晴予, 贾宁, 等. 荭草苷对APP/PS1转基因痴呆小鼠认知功能和海马自噬的影响[J]. 中国药理学通报, 2019, 35(5): 686-90. Zhong Y, Zheng Q Y, Jia N, et al. Effects of orientin on cognitive function and hippocampal autophagy in APP/PSl transgenic mice[J]. Chin Pharmacol Bull, 2019, 35(5): 686-90. |
| [9] |
Yang D, Zhu L, Ren J, et al. Dysfunction of autophagy as the pathological mechanism of motor neuron disease based on a patient-specific disease model[J]. Neurosci Bull, 2015, 31(4): 445-51. |

