

2. 郑州大学第一附属医院药学部,河南 郑州 450052
2. Dept of Pharmacy, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
肾细胞癌(renal cell carcinoma,RCC)简称肾癌,是泌尿生殖系统最常见的肿瘤之一,发病率约占成人恶性肿瘤的3%。因其早期通常没有明显症状,临床表征也各不相同,有约25%~30%的患者在确诊时已到晚期。由于肾癌对化疗和放疗均不敏感,目前以外科切除为主要治疗手段,但复发及转移仍是肿瘤手术治愈的困惑及难题[1]。相对于其他恶性肿瘤,肾癌的治疗还需要依赖全身性、个性化治疗如生物靶向治疗(biologically targeted therapy)等。因此,寻找敏感的肾癌生物标志物和特异性的治疗靶点对提高肾癌患者生存期具有重要意义。
Bmi-1基因属原癌基因,多梳基因家族(poly-comb group genes,PcG)成员之一,其编码的蛋白质产物几乎在所有的组织均有表达[2]。Bmi-1因其可修复损伤DNA、抑制某些基因转录,进而影响多种肿瘤的发生、发展及预后。研究发现[3],Bmi-1小分子抑制剂PTC-209通过抑制Bmi-1的活性,经PRC1下调CDKN2A的转录活性,从而抑制p16 INK4A和p14 ARF等下游靶点,达到阻滞肿瘤细胞周期进展,杀伤血液肿瘤细胞的作用。Liang等[4]发现Bmi-1表达增高与膀胱癌肿瘤大小、分级、分期以及淋巴转移呈正相关,抑制Bmi-1可降低膀胱癌的侵袭能力。大量文献报道Bmi-1与胰腺癌、乳腺癌以及前列腺癌的预后密切相关[5]。在肾癌,有研究者发现Bmi-1在肾癌癌周组织中高表达[6]。区景远等[7]也研究发现Bmi-1小分子抑制剂PTC-209可抑制肾癌细胞增殖,促其凋亡。
综上,目前未见有Bmi-1与肾癌的深入研究,仍需要进一步的研究明确。本研究将探讨Bmi-1沉默对人肾癌细胞株786-O、ACHN的迁移侵袭的影响,了解其相关信号通路,为探讨Bmi-1与肾癌的发生发展提供一定理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株人肾小管上皮细胞HK-2,肾癌细胞株786-O、ACHN购自中国科学院上海细胞库。人肾小管上皮细胞HK-2、肾癌细胞株786-O、ACHN为贴壁生长细胞。加入含10%胎牛血清的DMEM培养基置于37 ℃、5% CO2培养箱中培养。待细胞长满85%的视野时,用胰酶消化,离心5 min,弃上清。加入10 mL培养基,反复吹打使细胞均匀分散,接种于培养皿中备用。
1.1.2 试剂高糖DMEM培养基购自Hyclone公司(货号:SH30022.01)。SilectFectTMLipid Reagent购自美国Bio-Rad公司产品(货号:1703362)。Transwell小室购自美国康宁公司(货号:3422),Matrigel胶购自美国BD公司(货号:356234)。Bmi-1 siRNA由上海吉玛制药技术有限公司合成。Bmi-1(货号:6964)、E-cadherin(货号:3195)、Vimentin(货号:5741)、Akt(货号:4691)、p-Akt(货号:4060)抗体购自Cell Signaling Technology公司,无噬菌体低内毒素优级胎牛血清购自四季青公司(货号:11011-8611)β-actin(货号:AF0003)、胰酶(货号:C0201)、细胞裂解液(货号:P0013B)、结晶紫染色液(货号:C0121)、ECL反应液(货号:P0018M)均购自碧云天生物科技有限公司。
1.1.3 仪器细胞培养箱、生物安全柜和酶标仪(Thermo Scientific公司);倒置显微镜(Olympus公司);电泳仪、电泳槽及凝胶成像仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 siRNA沉默肾癌细胞株Bmi-1的蛋白表达待细胞处于约50%~60%融合时进行转染。按6 cm直径培养皿的标准计算,每孔加入siRNA-Ctrl或siRNA-Bmi-1,用SilectFect转染试剂进行转染,转染48 h后提取蛋白观察转染效率。si-Ctrl及si-Bmi-1序列依照何等文献报导[8]。
1.2.2 划痕实验检测沉默Bmi-1后肾癌细胞划痕愈合能力采用细胞划痕实验观察沉默Bmi-1后786-O、ACHN细胞的迁移能力。转染siRNA的细胞接种到6孔板,无血清的培养基培养过夜使细胞停止增殖。无菌枪头在6孔板内迅速划痕,并在划痕旁做标记,用无血清培养基继续培养。分别于划痕的0 h和24 h后置于倒置显微镜下拍照,测量划痕间距。划痕愈合率/%=(划痕间距0 h-划痕间距24 h)/划痕间距0 h×100%。
1.2.3 Transwell小室迁移实验检测沉默Bmi-1后肾癌细胞迁移能力收集转染siRNA的细胞,以无血清培养基制成浓度为1×107·L-1的细胞悬液,取150 μL加入小室,置于加入600 μL含高糖DMEM培养基的12孔板继续培养。24 h后,取出Transwell小室,用甲醇固定30 min后再以结晶紫染色10 min,棉签拭去Transwell小室底部未迁移的细胞,自然风干。显微镜200倍视野下随机取6个视野拍照,取平均值并统计结果。
1.2.4 Transwell小室侵袭实验检测沉默Bmi-1后肾癌细胞侵袭能力786-O、ACHN细胞转染48 h后,以无血清培养基重悬细胞加入铺有Matrigel胶的Transwell小室,置培养箱中过夜。24 h后,甲醇固定并以结晶紫染色,棉签擦拭去除小室底部膜表面上的细胞后,显微镜下随机取6个视野拍照,每组细胞重复3次实验,取平均值并统计结果。
1.2.5 Western blot检测迁移侵袭转移相关蛋白的表达细胞以PBS冲洗3遍,加入适量中性细胞裂解液提取总蛋白,蛋白定量(BCA)法测量蛋白浓度,以裂解液和5×上样缓冲液处理同组蛋白为等浓度、等体积和等质量。SDS-PAGE电泳后转膜至PVDF膜上。封闭液封闭2 h后一抗4 ℃孵育过夜。洗膜液洗膜15 min后,再以相应二抗孵育2 h,洗膜后经ECL化学发光显影。
1.2.6 统计学方法使用SPSS17.0统计软件(中文版)进行数据的统计分析,所有数据以均数±标准差(x±s)表示,两组间比较用t检验,两组以上比较用单因素方差分析。检验水准按α=0.05判定。
2 结果 2.1 Bmi-1在肾癌细胞中高表达与肾小管上皮细胞HK-2相比,786-O、ACHN两种肾癌细胞株Bmi-1的蛋白表达显著增多(P < 0.01,Fig 1)。
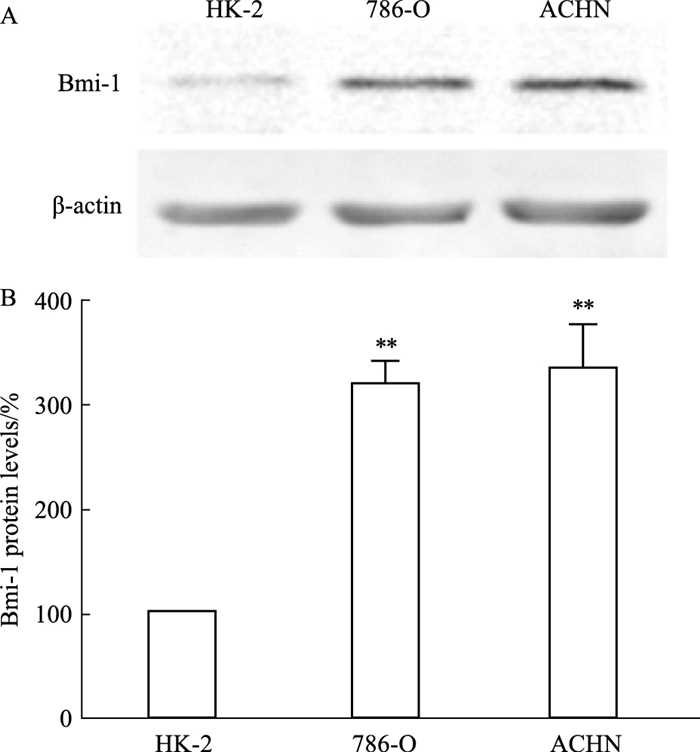
|
| Fig 1 Bmi-1 expression in human renal endothelial cells and renal cancer cells A: Protein levels of Bmi-1;B: Densitometric analysis of Bmi-1; **P < 0.01 vs HK-2 group(x±s, n=3) |
免疫印迹结果显示,与对照组相比,siRNA特异性干扰片段能使两种肾癌细胞Bmi-1蛋白表达量明显降低(P < 0.05,Fig 2)。
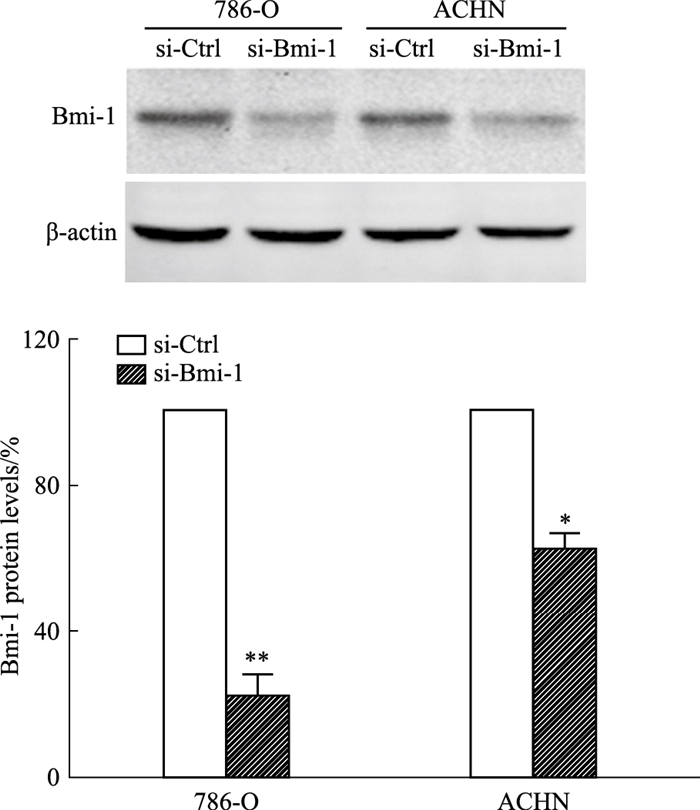
|
| Fig 2 Bmi-1 expression in renal cancer cells after knockdown of Bmi-1 *P < 0.05, **P < 0.01 vs Ctrl(x±s, n=3) |
SilectFect转染siRNA 48 h后,细胞划痕实验检测Bmi-1对细胞划痕愈合能力的影响。如图所示,0 h si-Ctrl组和si-Bmi-1组肾癌细胞的划痕距离无显著差异,24 h后si-Bmi-1组相对于si-Ctrl组细胞划痕愈合能力明显减弱(P < 0.05,Fig 3)。提示抑制Bmi-1能减弱细胞的划痕愈合能力。
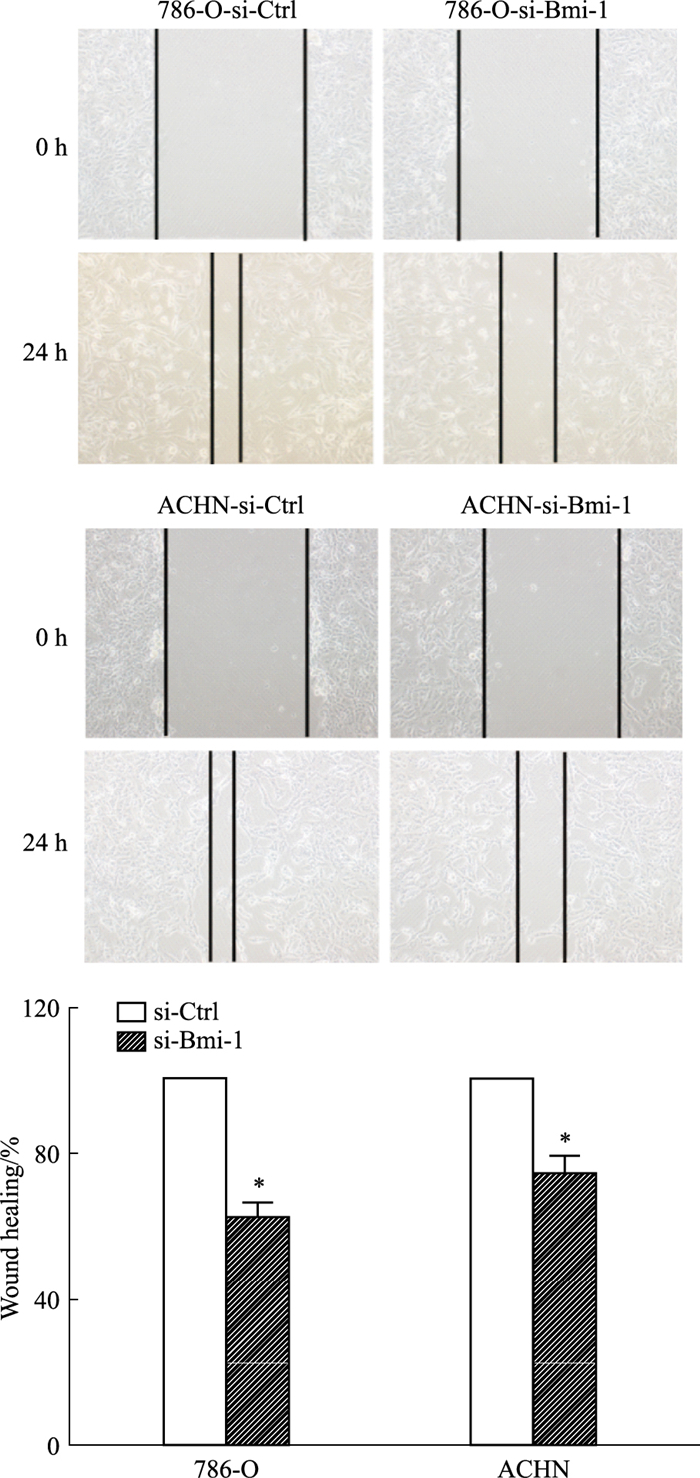
|
| Fig 3 Effect of Bmi-1 knockdown on wound healing ability of renal cancer cells *P < 0.05 vs Ctrl(x±s, n=3) |
如图 4所示,转染siRNA 48 h后,与si-Ctrl组相比,si-Bmi-1组迁移的细胞数量明显减少,细胞数量的百分比由100%下降到47.5%,差异有统计学意义(P < 0.05)。提示Bmi-1对786-O及ACHN两种细胞的迁移能力可能具有重要调节作用(Fig 4)。
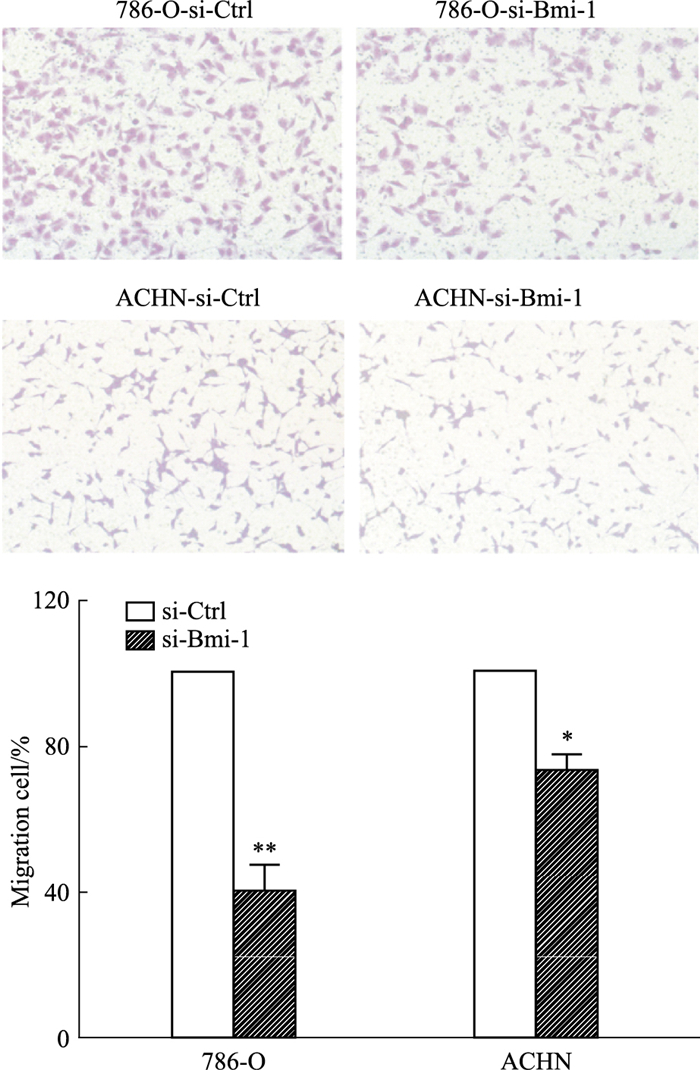
|
| Fig 4 Effect of Bmi-1 knockdown on migration ability of renal cancer cells *P < 0.05, **P < 0.01 vs Ctrl (x±s, n=3) |
实验结果显示,在沉默Bmi-1 48 h后穿膜细胞数明显减少,差异有统计学意义(P < 0.01)。提示Bmi-1对肾癌细胞的侵袭能力可能具有重要调节作用(Fig 5)。
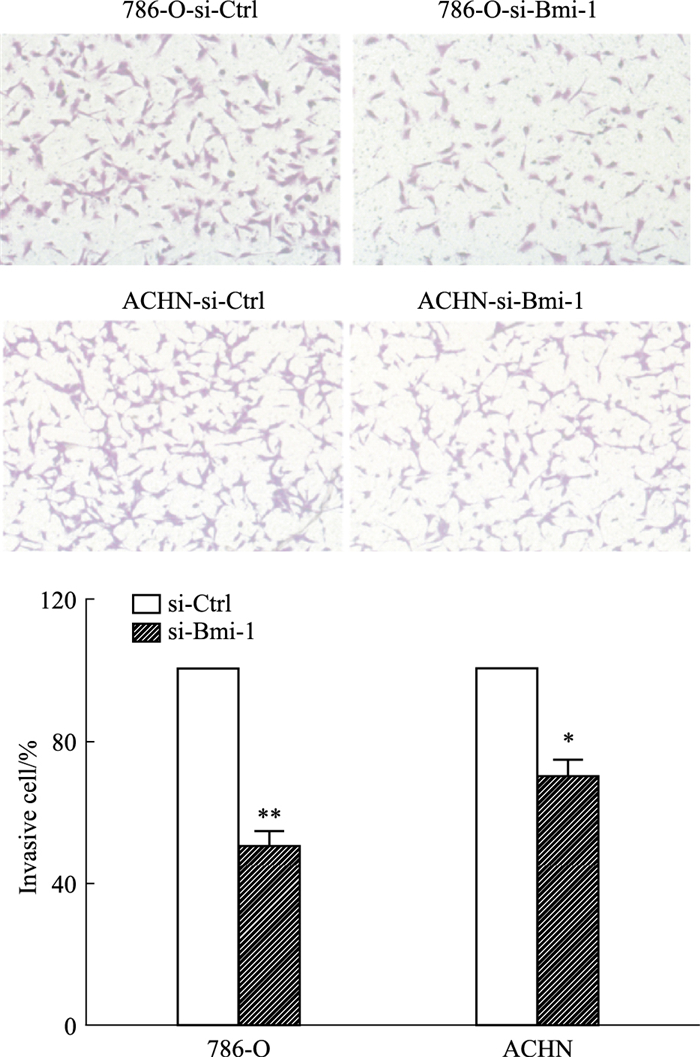
|
| Fig 5 Effect of Bmi-1 knockdown on invasion ability of renal cancer cells *P < 0.05, **P < 0.01 vs Ctrl (x±s, n=3) |
Western blot检测Bmi-1沉默后,786-O及ACHN的E-cadherin、Vimentin、Akt和p-Akt蛋白表达水平。结果发现,沉默Bmi-1后两种肾癌细胞株上皮标志物E-cadherin表达水平增加,而间质标志物Vimentin的表达水平降低,说明Bmi-1沉默后抑制了上皮-间质转化的发生。沉默Bmi-1后两种肾癌细胞株Akt蛋白表达无显著差异,而p-Akt蛋白表达水平明显降低,提示Bmi-1对肾癌细胞迁移侵袭的调控可能与Akt的活化密切相关(Fig 6)。
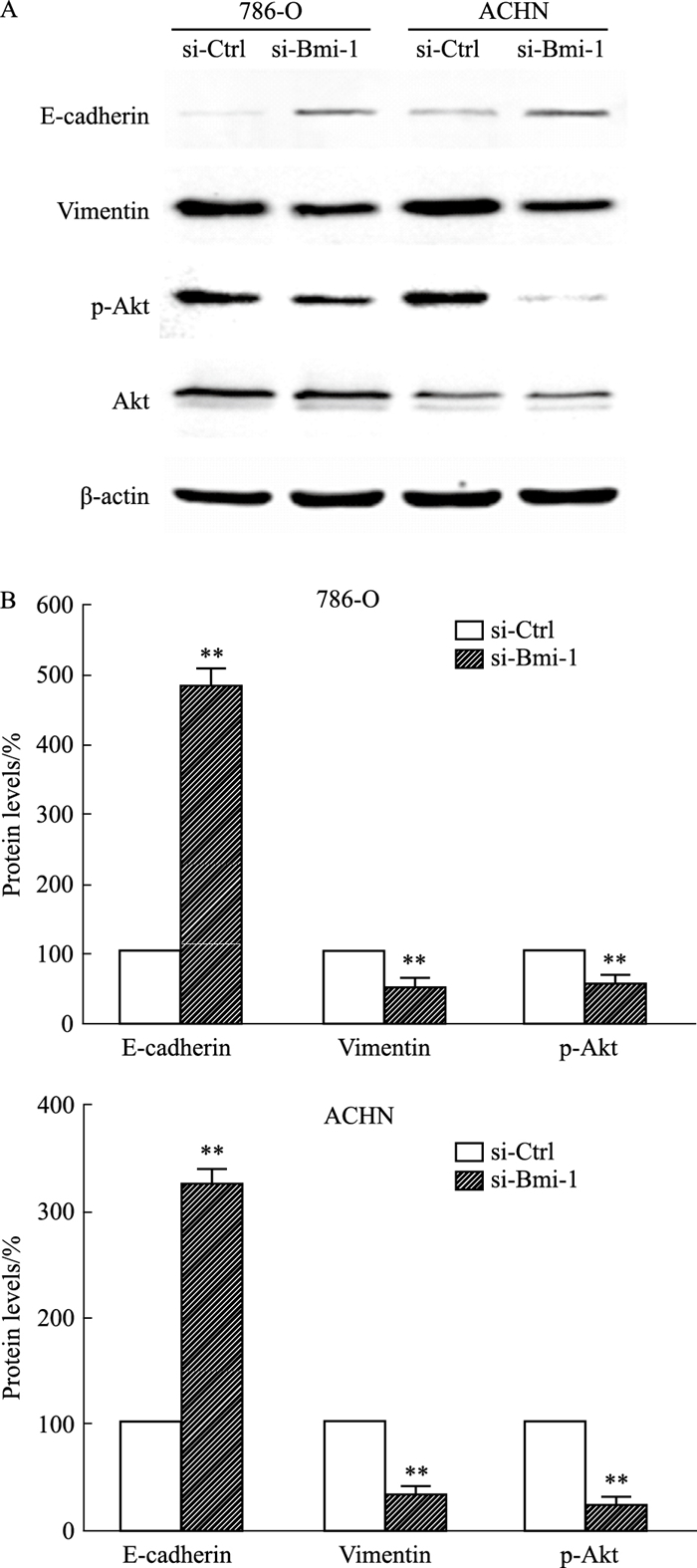
|
| Fig 6 Protein levels of E-cadherin, Vimentin and Akt detected by Western blot A:Protein levels of E-cadherin, Vimentin and Akt; B: Densitometric analysis of E-cadherin, Vimentin and Akt. **P < 0.01 vs Ctrl (x±s, n=3) |
肾癌是泌尿系统常见恶性肿瘤之一,发病率呈逐年上升趋势。肿瘤复发是当前肾癌患者治疗所担忧的重大难题,有近40%的患者在术后5年内出现肿瘤复发[9]。由于其对放化疗均不敏感,因此术后辅助以靶向药物治疗,可预防肿瘤复发转移,提高患者术后生存率。
由多种调控细胞周期、细胞增殖的转录因子组成的多梳基因家族(PcG),在维系胚胎发育、干细胞及肿瘤发生中有着举足轻重的作用[10],定位于人10号染色体短臂1区3带的Bmi-1即为PcG的成员之一。大量研究表明,Bmi-1的高表达与多种肿瘤发生、迁移和远端转移成正相关[11]。Srinivasan等[12]发现Bmi-1可促进乳腺癌患者疾病的发生和发展。Notch及其信号通路是许多重要信号通路的主要组成部分,其受体激活后可经一系列酶促反应使其移位至细胞核,与核内转录因子形成转录因子复合物,激活下游如HES1、Cyclin D1、Bcl-2等影响细胞增殖及迁移的靶基因,使其转录活性增强。
正常上皮细胞由多细胞构成,于基底膜相互黏附紧密而不移动。上皮细胞最主要的黏附结构是上皮性钙粘蛋白(E-cadherin)介导的细胞间连接结构。而间质组织多由结构松散、具有运动能力的细胞构成。任何能够干扰E-cadherin的因素均可导致细胞间黏附不稳定,发生上皮-间质转化(epithelial-mesenchymal transition,EMT)。EMT中发生的关键分子是E-cadherin表达下调,失去细胞与细胞之间的粘附、破坏基底膜及细胞外基质,恶性细胞就会进入间质而到处移动,使肿瘤细胞进入血流而发生远端转移及复发[13]。Bmi-1可能在蛋白水平直接与肿瘤浸润转移相关因子发生作用。本实验结果发现,Bmi-1基因沉默后,两种肾癌细胞株的迁移侵袭能力均显著下降。且Bmi-1表达降低后,可使E-cadherin的蛋白表达水平增高,Vimentin的表达水平降低。提示Bmi-1参与了肾癌细胞的EMT的调控。研究者发现PI3K/Akt信号通路能直接影响Snail、Slug等下游靶基因E-cadherin的转录,诱导EMT的发生[14-15]。Akt作为PI3K/Akt信号通路上重要的蛋白激酶,是否参与Bmi-1对肾癌细胞的EMT的调控,本实验结果发现,沉默Bmi-1后Akt的磷酸化水平也随之降低,并伴随上皮标志物E-cadherin表达增高,间质标志物Vimentin蛋白表达的降低。提示PI3K/Akt信号通路参与Bmi-1对肾癌细胞迁移侵袭的调控。
Bmi-1基因在泌尿系肿瘤的侵袭进展中具有非常重要的意义,其在前列腺癌等多种肿瘤中均有相关报道其与促进肿瘤发生,肿瘤转移密切相关。这就需要我们进一步深入研究,使Bmi-1有望在未来成为新的泌尿系统肿瘤标志物,对患者的泌尿系恶性肿瘤的早期诊断、治疗方案的制定、预后预测等具有临床应用和指导价值。
| [1] |
Rowe S P, Gorin M A, Solnes L B, et al. Correlation of 99m Tc-sestamibi uptake in renal masses with mitochondrial content and multi-drug resistance pump expression[J]. EJNMMI Res, 2017, 7(1): 80. |
| [2] |
温丽娟, 郑立红, 魏凤香. Bmi-1基因参与肿瘤发生机制的研究进展[J]. 国际遗传学杂志, 2017, 40(2): 89-92. Wen L J, Zheng L H, Wei F X. The research progress of BMI1's roles in tumorigenesis[J]. Int J Genet, 2017, 40(2): 89-92. |
| [3] |
Kreso A, van Galen P, Pedley N M, et al. Self-renewal as a threapeutic target in human colorectal cancer[J]. Nat Med, 2014, 20(1): 29-36. |
| [4] |
Liang W, Zhu D, Cui X, et al. Knockdown BMI1 expression inhibits proliferation and invasion in human bladder cancer T24 cells[J]. Mol Cell Biochem, 2013, 382(1-2): 283-91. |
| [5] |
李海玉. 过表达Bmi-1基因对乳腺癌细胞株BT474侵袭转移能力的影响[J]. 第三军医大学学报, 2014, 36(21): 2187-90. Li H Y. Effects of over-expression of Bmi-1 on invasion and metastasis in human mammary carcinoma cell line BT474[J]. Acta Acad Med Mil Tert, 2014, 36(21): 2187-90. |
| [6] |
Long Q, Liu L, Xia Y, et al. High peritumoral Bmi-1 expression is an independent prognosticator of poor prognosis in renal cell carcinoma[J]. Tumour Biol, 2015, 36(10): 8007-14. |
| [7] |
区景运, 谭晓军, 胡波, 等. Bmi-1小分子抑制剂PTC-209对肾癌细胞生物学行为的影响及机制[J]. 山东医药, 2019, 59(14): 27-30. Qu J Y, Tan X J, Hu B, et al. Influence and mechanism of Bmi-1 small-molecule inhibitor PTC-209 on biological behavior of renal carcinoma[J]. Shandong Med J, 2019, 59(14): 27-30. |
| [8] |
何倩婷, 汤磊乐, 孙菁菁, 等. Bmi-1对舌鳞癌侧群细胞迁移、侵袭和增殖能力的调控作用及机制探讨[J]. 中国口腔颌面外科杂志, 2018, 16(2): 102-7. He Q T, Tang L L, Sun J J, et al. Bmi-1 mediated migration, invasion and proliferation of stem cells of tongue squamous cell carcinoma[J]. China J Oral Maxillof Surg, 2018, 16(2): 102-7. |
| [9] |
Ljungberg B, Campbell S C, Choi H Y, et al. The epidemiology of renal cell carcinoma[J]. Eur Urol, 2011, 60(4): 615-21. |
| [10] |
Zhang Q, Shi J, Yuan F, et al. Higher expression of XPF is a critical factor in intrinsic chemotherapy resistance of human renal cell carcinoma[J]. Int J Cancer, 2016, 139(12): 2827-37. |
| [11] |
Peng H X, Liu X D, Luo Z Y, et al. Upregulation of the proto-oncogene Bmi-1 predicts a poor prognosis in pediatric acute lymphoblastic leukemia[J]. BMC Cancer, 2017, 17(1): 76. |
| [12] |
Srinivasan M, Bharali D J, Sudha T, et al. Downregulation of Bmi-1 in breast cancer stem cells suppresses tumor growth and proliferation[J]. Oncotarget, 2017, 8(24): 38731-42. |
| [13] |
Boyer B, Balles A M, Edme N. Induction and regulation of epithelial-mesenchymal transitions[J]. Biochem Pharmacol, 2000, 60(8): 1091-9. |
| [14] |
Moustakas A, Heldin C H. Signaling networks guiding epithelial-mesenchymal transitions during embryogenesis and cancer progression[J]. Cancer Sci, 2007, 98(10): 1512-20. |
| [15] |
孙洁, 孔界男, 刘超, 等. NVP-BEZ235抑制肝癌细胞HepG2的增殖和迁移及机制研究[J]. 中国药理学通报, 2019, 35(8): 1064-71. Sun J, Kong J N, Liu C, et al. Inhibitory effect of NVP-BEZ235 on proliferation and migration of hepatocellular carcinoma cell HepG2 and its mechanism[J]. Chin Pharmacol Bull, 2019, 35(8): 1064-71. |

