


2. 中国科学院上海药物研究所,上海 201203;
3. 上海中医药大学科技实验中心,上海 201203
唐炜(1974-),女,博士,研究员,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:tangwei@simm.ac.cn;
左建平(1960-),男,博士,研究员,博士生导师,研究方向:免疫药理学,通讯作者,E-mail : jpzuo@simm.ac.cn
 ,
QI Qing2,
YANG Xiao-qian2,
YANG Fang-ming2,3,
LIN Ze-min2,
CHEN Fu-xue1
,
QI Qing2,
YANG Xiao-qian2,
YANG Fang-ming2,3,
LIN Ze-min2,
CHEN Fu-xue1
 ,
TANG Wei2
,
TANG Wei2
 ,
ZUO Jian-ping2
,
ZUO Jian-ping2

2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Science and Technology Experimental Center, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
银屑病(psoriasis)是多因素诱导的易复发慢性炎症性自身免疫性皮肤病,影响着全世界2%~3%的人口,我国银屑病总患病率为0.123%[1-2]。其临床症状表现为表面被覆银白色鳞屑的红斑及皮肤增厚,病理变化主要包括角质细胞增殖与分化异常、棘层肥厚、真皮层毛细血管扩张和增生以及慢性炎症。目前治疗银屑病的方法主要包括药物治疗、生物治疗、物理治疗和心理治疗。
2-羟基丁酸甲酯(4-(6-aminopurine-9-yl)-2-hydroxybutyric acid methyl ester,DZ2002)是可逆型S-腺苷同型半胱氨酸水解酶(S-adenosyl-L-homocysteine hydrolase,SAHH)抑制剂。SAHH是细胞内广泛存在的水解酶,能将S-腺苷同型半胱氨酸(S-adenosyl-L-homocysteine,AdoHcy)水解为同型半胱氨酸和腺苷,当SAHH被抑制时,AdoHcy堆积,从而反馈性地抑制细胞内的转甲基反应。前期研究表明,DZ2002具有高效的体内外免疫抑制活性,不仅抑制淋巴细胞的增殖和炎症因子的表达,而且DZ2002通过调节Toll样受体(Toll-like receptors)信号介导的抗原递呈细胞反应,有效改善NZB/W F1小鼠狼疮综合征。目前,DZ2002作为治疗系统性红斑狼疮(systemic lupus erythematosus)候选新药已在开展临床研究。研究表明,银屑病患者角质细胞和CD4+ T细胞等细胞内出现高甲基化,导致与角质细胞增殖、T细胞极化等相关的蛋白表达降低,导致银屑病的发生[3]。基于DZ2002较强的免疫抑制活性,本实验室开展了DZ2002软膏治疗银屑病的疗效及作用机制研究。在咪喹莫特诱导的银屑病模型中,DZ2002明显改善咪喹莫特诱导的小鼠银屑病样皮损,同时抑制炎症因子的产生,表现出良好的疗效作用[4]。本研究旨在前期研究的基础上,探索DZ2002在盐酸普萘洛尔(Propranolol hydrochloride)诱导的豚鼠银屑病模型中的疗效及其作用机制,为候选新药DZ2002治疗银屑病外用制剂的开发提供研发基础和理论依据。
1 材料与方法 1.1 实验动物哈托莱豚鼠,♂,清洁级,体质量为(250~300) g,购自中国科学院上海实验动物中心,饲养于上海药物研究所动物房,实验动物使用许可证号:SYXK(沪)2013-0049号,温度为(22±1)℃,相对湿度为55%±5%,12 h光照,昼夜循环,动物实验严格按照动物护理机构伦理指南进行,并获得中国科学院上海药物研究所动物护理与使用委员会的批准。
1.2 细胞株HaCaT、THP1及Jurkat细胞均购自ATCC(Rockville,MD,USA)。HaCaT细胞是永生化人角质形成细胞系;THP1细胞是人外周血单核-巨噬细胞系;Jurkat细胞是人急性白血病T淋巴细胞系。HaCaT及Jurkat细胞培养于含10%胎牛血清的DMEM培养基中(含100 kU·L-1青霉素和100 mg·L-1链霉素),置于37 ℃、5% CO2恒温培养箱培养;THP1细胞培养于含10%胎牛血清的1640培养基(含100 kU·L-1青霉素和100 mg·L-1链霉素),置于37 ℃、5% CO2恒温培养箱培养。
1.3 试剂Bio-Plex ProTM Reagent Kit Ⅲ 1×96-well Flat Bottom Plate,171304090M,BIO-RAD公司;Human IL-8 ELISA MAXTM Deluxe Set,431504,Biolegend公司。DZ2002原料药物纯度>0.99,呈白色粉末状,以培养基配制成50 mmol·L-1储液存储于-30 ℃,用于细胞实验;20 mg·g-1 DZ2002软膏及软膏基质,自制,用于动物实验;卡泊三醇软膏(Calcipotriol Ointment),0.05 mg·g-1,国药准字H20113541,重庆华邦制药有限公司;盐酸普萘洛尔由江苏云阳集团药业有限公司赠予;总RNA提取试剂盒,DP419,TIANGEN公司;SYBR® Green Realtime PCR Master Mix,841200,TOYOBO公司;PrimeScriptTM RT Master Mix,RR036A,TaKaRa公司;Recombinant Human TNF-α,300-01A,PeproTech公司;Recombinant Human IFN-γ,300-02-20,PeproTech公司;Calcein AM,564061,BD Pharmingen公司;Anti-Myeloperoxidase (MPO) pAb,GB11224,武汉赛维尔生物科技有限公司。
1.4 仪器Bio-Plex 200® System,BIO-RAD公司;5810R型高速冷冻离心机(德国Eppendorf);3111型二氧化碳培养箱(美国Thermo);HFsafe-1500LC型生物安全柜(中国上海力申科学仪器有限公司);7900HT型PCR仪(德国life technologies);SpectraMAX190型酶标仪(MOLECULAR DEVICES);DM6500型正置显微镜、TCS SPS共聚焦显微镜(德国Leica)。
1.5 方法 1.5.1 豚鼠模型的建立及给药以50 g·L-1盐酸普萘洛尔搽剂涂抹于豚鼠耳朵背部,20 μL/耳,每天2次,连续造模5周,建立豚鼠银屑病模型。将模型豚鼠随机分为Vehicle组、Calcipotriol组和DZ2002组,另以正常豚鼠作为Normal组,每组10只。从造模第4周开始给药,按组别分别将卡泊三醇软膏、20 mg·g-1 DZ2002软膏或软膏基质涂抹于豚鼠耳部,每组涂抹剂量均为每次50 mg,每天2次,连续给药2周。实验终点将豚鼠安乐死,取耳朵用于后续实验。
1.5.2 组织病理学观察采用HE染色,在光学显微镜下观察豚鼠耳部皮肤的病理改变。在10×20视野下观察并摄图,对选中视野进行病理学Baker评价及表皮厚度的测量。Baker评分评价标准:Munro微脓肿-2.0分;角化过度-0.5分;角化不全-1.0分;颗粒层变薄或消失-1.0分;棘层肥厚-1.0分;表皮突延长或起伏-0.5分(轻)、1.0分(中)、1.5分(重);真皮层细胞浸润-0.5分(轻)、1.0分(中)、2.0分(重);乳突上顶-0.5分;毛细血管扩张-0.5分。
1.5.3 免疫组化实验将豚鼠耳朵皮肤石蜡标本脱蜡,脱水,抗原修复,封闭,MPO抗体孵育,二抗孵育,DAB显色,苏木精复染,在光学显微镜下观察豚鼠皮肤细胞浸润。用光镜在10×20视野下观察并摄图。
1.5.4 HaCaT角质细胞的诱导及给药HaCaT角质细胞以4×105个/孔接种于6孔板,共接种2块6孔板,贴壁过夜。设立对照组、模型组及给药组,均为双复孔:对照组为空白培养基,模型组以TNF-α(10 μg·L-1)和IFN-γ(10 μg·L-1)共刺激,给药组在模型组基础上加入100 μmol·L-1 DZ2002干预,于37 ℃,5% CO2恒温培养箱中培养。其中一块6孔板培养6 h,去掉上清,每孔加入1 mL裂解液RZ,反复吹打让细胞充分裂解,后期用于RT-PCR分析;另一块6孔板培养24 h,收取细胞培养上清,用于ELISA和luminex多因子检测。实验独立重复3次。
1.5.5 RT-PCR按总RNA提取试剂盒说明书提取上述所得RNA。提取完成后测浓度、定量。在10 μL体系下,于qPCR仪中进行扩增,检测IL-8和CXCL9的基因表达水平。IL-8引物序列:F:5′-TT TTGCCAAGGAGTGCTAAAGA-3′,R:5′-AACCCTCTG CACCCAGTTTTC-3′;CXCL9引物序列:F:5′-CCAG TAGTGAGAAAGGGTCGC-3′,R:5′-AGGGCTTGGGG CAAATTGTT-3′;GAPDH引物序列:F:5′-GGAGC GAGATCCCTCCAAAAT-3′,R:5′-GGCTGTTGTCATA CTTCTCATGG-3′。实验独立重复3次。
1.5.6 ELISA趋化因子水平的检测分别采用ELISA法检测细胞上清中趋化因子IL-8和luminex多因子检测技术检测细胞上清中趋化因子CXCL9的水平,根据试剂盒说明书所示的操作方法进行检测。
1.5.7 细胞趋化试验HaCaT角质细胞以4×105个/孔接种于6孔板,贴壁过夜。设立对照组,模型组及给药组:对照组为空白培养基,模型组以TNF-α(10 μg·L-1)和IFN-γ(10 μg·L-1)共刺激,给药组在模型组基础上加入100 μmol·L-1 DZ2002干预。于37 ℃,5% CO2恒温培养箱中培养24 h,收集各组上清用于趋化实验。以Calcein AM标记THP1细胞和Jurkat细胞。在Transwell板的下室分别加入600 μL/孔的各组条件上清,上室加入1×105个细胞,于恒温培养箱中培养2 h,分别进行THP1和Jurkat细胞的趋化实验。实验终点,在荧光显微镜下拍照,再收集下室中液体进行细胞计数。实验独立重复3次。
1.5.8 统计学处理采用GraphPad Prism 5.0统计软件进行处理,计量资料均以x±s表示,组间比较采用单因素方差分析。
2 结果 2.1 DZ2002软膏改善盐酸普萘洛尔诱导的豚鼠银屑病模型以50 g·L-1盐酸普萘洛尔搽剂建立豚鼠银屑病模型,观察DZ2002软膏对该银屑病模型的治疗作用。造模后豚鼠耳部出现明显的红斑、鳞屑及增厚,以20 mg·g-1 DZ2002软膏干预后,皮损明显减轻;HE染色结果显示,Normal组豚鼠耳背部皮肤角质层菲薄、颗粒层约1~3层、棘层较薄,表皮与真皮交界处平整;Vehicle组可见角化过度、角化不全、棘层肥厚、炎性细胞浸润、Munro微脓肿、颗粒层变薄或消失,表皮突向下延伸等病理特征。20 mg·g-1 DZ2002软膏干预能明显改善豚鼠耳部皮肤病理表现。相较于Vehicle组,DZ2002组豚鼠耳部皮肤Baker评分(P < 0.01)及表皮厚度(P < 0.01)均明显降低,见Fig 1。
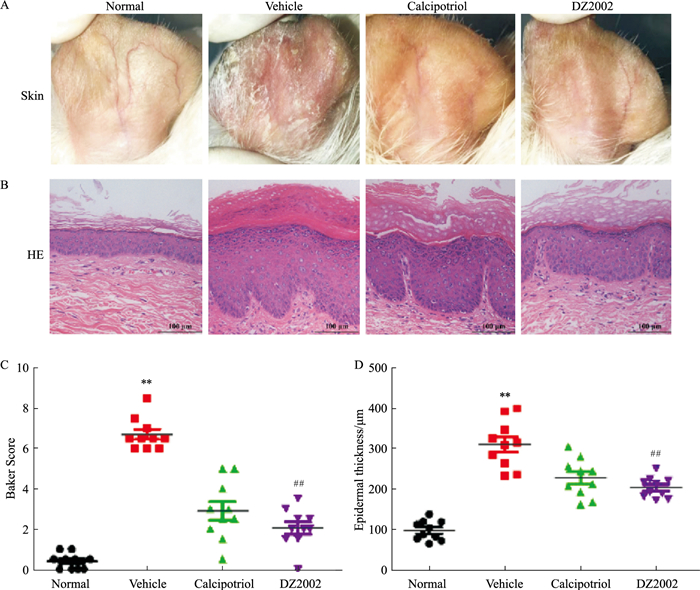
|
| Fig 1 Effect of DZ2002 cream on guinea pig model of psoriasis(x±s, n=10) A: Ear appearance of guinea pigs in each group; B: Representative HE staining(×200) of the ear skin in each group, bar=100 μm; C: Bakerscores of the lesions; D: Epidermal thickness was evaluated. **P < 0.01 vs normal; ##P < 0.01 vs vehicle. |
炎性细胞浸润是银屑病的病理改变之一,因此,通过免疫组化方法检测豚鼠耳部皮肤中MPO的表达。Vehicle组豚鼠耳部皮肤真皮层和表皮层MPO的表达增加,而DZ2002软膏干预后,豚鼠耳部皮肤MPO表达明显减少,见Fig 2。
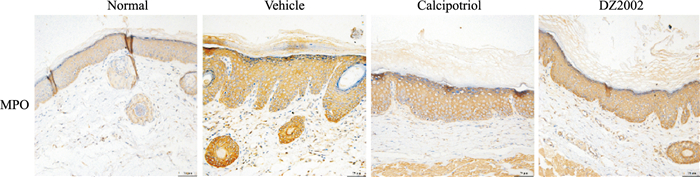
|
| Fig 2 Infiltration of neutrophils in guinea pig ear skin reduced by DZ2002 cream(×200, n=3) MPO expressions in ear skin tissues of guinea pig by immunohistochemical staining. bar=75 μm. |
活化的角质细胞能分泌趋化因子诱导炎性细胞浸润到银屑病皮损部位,因而我们以TNF-α/IFN-γ诱导HaCaT角质细胞的活化为模型,检测DZ2002对角质细胞分泌趋化因子的影响。TNF-α/IFN-γ能够诱导HaCaT表达趋化因子IL-8和CXCL9,而DZ2002体外给药能降低IL-8(P < 0.01)和CXCL9(P < 0.05)的mRNA表达及蛋白质分泌,与模型组比较差异有显著性,见Fig 3。DZ2002能轻度减少趋化因子CXCL1、CXCL2、IP-10的分泌,但对趋化因子CXCL11和CCL2的分泌无明显影响。
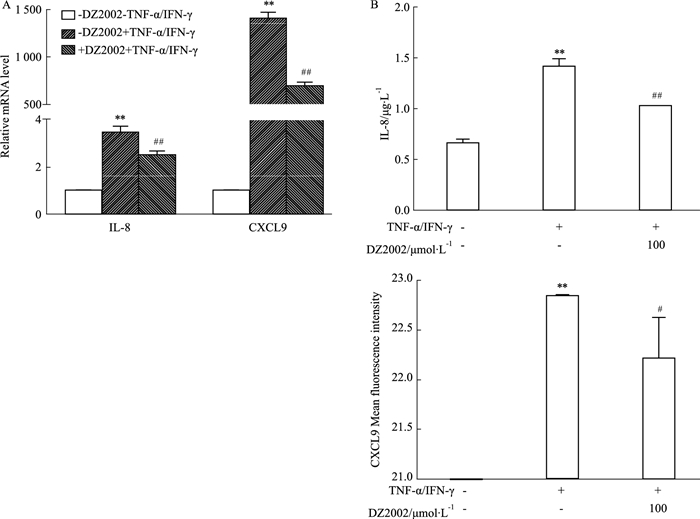
|
| Fig 3 Expression of chemokines IL-8 and CXCL9 in TNF-α/IFN-γ-treated HaCaT cells inhibited by DZ2002(x±s, n=3) A: HaCaT cells were pre-incubated with medium or DZ2002 for 1 h and then stimulated with TNF-α(10 μg·L-1)/IFN-γ(10 μg·L-1) or not for 6 h. Total RNA was extracted, and mRNA levels were measured by RT-PCR; B: HaCaT cells were pre-incubated with medium or DZ2002 for 1 h and then stimulated with TNF-α(10 μg·L-1)/IFN-γ(10 μg·L-1) or not for 24 h. Protein levels of IL-8 and CXCL9 in supernatants were detected by ELISA or Luminex x-MAP technology. **P < 0.01 vs cells; #P < 0.05, ##P < 0.01 vs TNF-α/IFN-γ-treated cells. |
由于DZ2002能够抑制趋化因子的表达,故而采用上述相同条件下培养24 h的条件上清进行趋化试验,观察DZ2002对细胞趋化运动的影响。DZ2002干预后的HaCaT细胞上清中,人单核-巨噬细胞THP1与人T淋巴细胞Jurkat细胞迁移的数量较模型组明显降低(THP1:P < 0.01;Jurkat:P < 0.01), 见Fig 4。
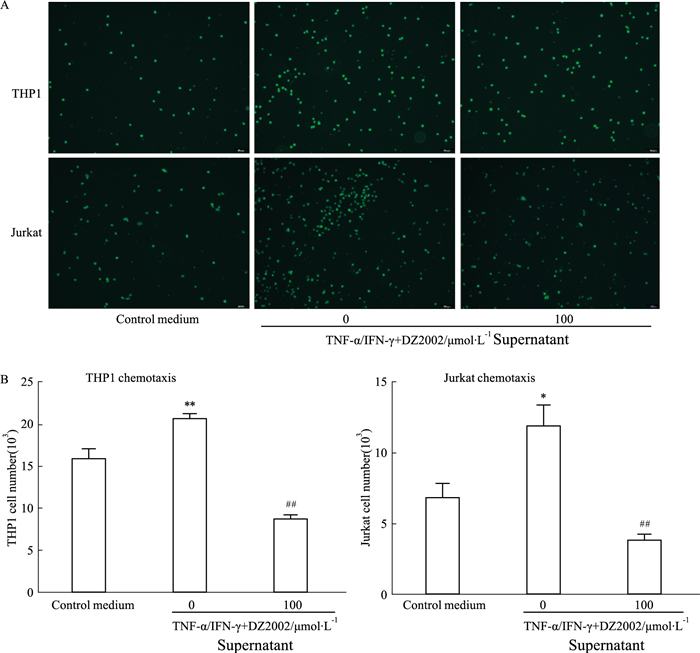
|
| Fig 4 Migration of THP1 and Jurkat cells inhibited by DZ2002(x±s, n=3) A: Fluorescence images of THP1 and Jurkat cells in chemotaxis assays, bar = 100 μm; B: The numbers of the migrated cells were detected. *P < 0.05, **P < 0.01 vs control medium; ##P < 0.01 vs TNF-α/IFN-γ-treated cells supernatant. |
银屑病是浸润免疫细胞和活化角质形成细胞之间异常相互作用的结果,是免疫介导的皮肤炎症[5]。银屑病患者皮肤常伴有银白色鳞屑覆盖的红斑、增厚等皮损,表皮出现明显的棘层增生、角化过度、角化不全、表皮突向下延伸等,真皮层有明显的血管增生和扩张、乳突上顶等病理改变[6]。研究表明将50 g·L-1盐酸普萘洛尔涂抹于豚鼠皮肤,引起豚鼠皮肤出现角化异常、棘层肥厚等类似人银屑病的病理改变,豚鼠银屑病模型已经成为研究银屑病药物治疗的经典模型之一。在此,以豚鼠银屑病模型为研究对象,探索DZ2002对豚鼠银屑病模型的治疗作用及机制。以50 g·L-1盐酸普萘洛尔造模后,豚鼠皮肤出现典型的银屑病症状及组织病理学改变,DZ2002涂抹后,皮损及角化异常、细胞浸润等病理改变均得到明显改善。
当皮肤损伤、感染或发生炎症时,活化的角质细胞分泌炎症性趋化因子招募中性粒细胞、单核细胞、T细胞等免疫细胞浸润到炎症部位[7-8],在银屑病患者皮损区检测到趋化因子IL-8和CXCL9的高表达以及T细胞等炎性细胞浸润[9]。浸润的炎性细胞分泌炎性因子促进角质细胞的过度增殖、异常分化、分泌趋化因子,进一步诱导表皮和血管增生、炎性细胞浸润,形成炎性反馈循环,加重银屑病[5]。这说明角质细胞异常活化、趋化因子及炎性细胞对银屑病发生发展是至关重要的。同时临床研究表明,应用IL-8单克隆抗体乳膏可以安全、有效地治疗寻常型银屑病[10];美国食品药品监督管理局批准的上市药物如infliximab和secukinumab通过迅速下调趋化因子的表达、减少细胞浸润从而改善银屑病[11-12]。在豚鼠银屑病模型中,我们观察到表皮及真皮层均出现明显的炎性细胞浸润,DZ2002能明显减少豚鼠皮肤炎性细胞的浸润。在银屑病皮损组织中,浸润的细胞涉及固有免疫系统和适应性免疫系统,而中性粒细胞和角质细胞之间的相互作用能维持或加重银屑病症状[13];通过皮内注射IL-23诱导银屑病样小鼠皮肤炎症,被发现在皮肤炎症部位单核-巨噬细胞的浸润明显增多,并在人银屑病皮肤皮损区也发现巨噬细胞和适应性免疫系统的Th1、Th17等多种T细胞亚群的明显增加[14-15]。为了进一步探索DZ2002的作用机制,应用人的角质细胞系HaCaT模型,研究发现DZ2002不仅明显下调活化的HaCaT细胞表达IL-8和CXCL9,而且能抑制人巨噬细胞系THP1细胞和人T淋巴细胞系Jurkat细胞的趋化运动。
本研究的结果表明:DZ2002软膏能有效抑制豚鼠银屑病模型的皮肤角质细胞的活化,减少炎性细胞浸润,减轻局部炎症反应,对银屑病具有良好的治疗作用。本研究进一步拓展了SAHH抑制剂DZ2002临床应用的适应症,为研发新型抗银屑病药物提供研发基础。
( 致谢: 本实验在中国科学院上海药物研究所免疫药理研究室和抗炎免疫药理研究室完成,衷心感谢给予本实验帮助的所有老师和同学。)
| [1] |
钟淇滨, 祝曙光, 陆少君, 等. 和厚朴酚对咪喹莫特诱导小鼠银屑病的干预作用[J]. 中国药理学通报, 2018, 34(5): 626-31. Zhong Q B, Zhu S G, Lu S J, et al. Anti-psoriatic effects of honokiol in imiquimod induced mouse model[J]. Chin Pharmacol Bull, 2018, 34(5): 626-31. |
| [2] |
姜群群, 刘玲玲, 康玲, 等. 银屑病中西医研究进展[J]. 中医临床研究, 2017, 9(25): 144-8. Jiang Q Q, Liu L L, Kang L, et al. A review on treating psoriasis in the integrative medicine[J]. CJCM, 2017, 9(25): 144-8. |
| [3] |
李思, 岳育阳, 程毅, 等. 银屑病的甲基化相关研究进展[J]. 实用皮肤病学杂志, 2018, 11(5): 297-9. Li S, Yue Y Y, Cheng Y, et al. The methylation related research progress in psoriasis[J]. J Pract Dermatol, 2018, 11(5): 297-9. |
| [4] |
Lin Z M, Ma M, Li H, et al. Topical administration of reversible SAHH inhibitor ameliorates imiquimod-induced psoriasis-like skin lesions in mice via suppression of TNF-α/IFN-γ-induced inflammatory response in keratinocytes and T cell-derived IL-17[J]. Pharmacol Res, 2018, 129: 443-52. |
| [5] |
Srivastava A, Nikamo P, Lohcharoenkal W, et al. MicroRNA-146a suppresses IL-17-mediated skin inflammation and is genetically associated with psoriasis[J]. J Allergy Clin Immunol, 2017, 139(2): 550-61. |
| [6] |
Boehncke W H, Schön M P. Psoriasis[J]. Lancet, 2015, 386(9997): 983-94. |
| [7] |
Moos S, Mohebiany A N, Waisman A, et al. Imiquimod-induced psoriasis in mice depends on the IL-17 signaling of keratinocytes[J]. J Invest Dermatol, 2019, 139(5): 1110-7. |
| [8] |
Lei E B, Fu X J, Lu E T, et al. Effect of estradiol on chemokine receptor CXCR2 expression in rats:implications for atherosclerosis[J]. Acta Pharmacol Sin, 2003, 24(7): 670-4. |
| [9] |
Johnston A, Arnadottir S, Gudjonsson J E, et al. Obesity in psoriasis: leptin and resistin as mediators of cutaneous inflammation[J]. Br J Dermatol, 2008, 159(2): 342-50. |
| [10] |
庞传超, 张明, 张德春, 等. 抗人IL-8单克隆抗体乳膏治疗寻常型银屑病临床疗效观察[J]. 中国免疫学杂志, 2002, 18(4): 284-6. Pang C C, Zhang M, Zhang D C, et al. Study on IL-8 monoclonal antibody cream in the treatment of psoriasis vulgaris[J]. Chin J Immunol, 2002, 18(4): 284-6. |
| [11] |
Brunner P M, Koszik F, Reininger B, et al. Infliximab induces downregulation of the IL-12/IL-23 axis in 6-sulfo-LacNac (slan)+ dendritic cells and macrophages[J]. J Allergy Clin Immunol, 2013, 132(5): 1184-93.e8. |
| [12] |
Reich K, Papp K A, Matheson R T, et al. Evidence that a neutrophil-keratinocyte crosstalk is an early target of IL-17A inhibition in psoriasis[J]. Exp Dermatol, 2015, 24(7): 529-35. |
| [13] |
Katayama H. Development of psoriasis by continuous neutrophil infiltration into the epidermis[J]. Exp Dermatol, 2018, 27(10): 1084-91. |
| [14] |
Wang Y, Edelmayer R, Wetter J, et al. Monocytes/Macrophages play a pathogenic role in IL-23 mediated psoriasis-like skin inflammation[J]. Sci Rep, 2019, 9(1): 5310. |
| [15] |
Zhou F, Zhu Z, Gao J, et al. NFKB1 mediates Th1/Th17 activation in the pathogenesis of psoriasis[J]. Cell Immunol, 2018, 331: 16-21. |