

2. 福建中医药大学附属康复医院神经康复科,福建 福州 350003;
3. 福建省康复技术重点实验室,福建 福州 350003;
4. 福建中医药大学附属康复医院药学部,福建 福州 350003
 ,
YANG Jing-da1,
WEI Wei2,3,
SHEN Ju-lian1,
LU Lu1,
LYU Xin-ru1,
XIAO Jian-ping3,4,
XUE Xie-hua2,3
,
YANG Jing-da1,
WEI Wei2,3,
SHEN Ju-lian1,
LU Lu1,
LYU Xin-ru1,
XIAO Jian-ping3,4,
XUE Xie-hua2,3

2. Dept of Neurorehabilitation, the Affiliated Rehabilitation Hospital of Fujian University of Traditional Chinese Medicine, Fuhzou 350003, China;
3. Fujian Key Lab of Rehabilitation Technology, Fuzhou 350003, China;
4. Dept of Pharmacy, the Affiliated Rehabilitation Hospital of Fujian University of Traditional Chinese Medicine, Fuzhou 350003, China
动脉粥样硬化(atherosclerosis,AS)是一种与血脂代谢异常相关的慢性炎症性疾病,异常代谢的血脂遭巨噬细胞吞噬在炎症因子的介导下侵入血管内膜产生一系列病理生理过程,诱导血管纤维帽的生成,最终形成动脉粥样斑块[1],因而调节血脂代谢在AS的防治中起着重要作用[2]。研究发现胆固醇逆转运(reverse cholesterol transport,RCT)作为血脂代谢的主要途径在稳定异常血脂代谢方面发挥重要作用,是抗AS的潜在治疗靶点。RCT是指将体内异常代谢的血脂转运到肝脏代谢进而排出体外的过程,其中肝X受体α(liver X receptor α,LXRα)、ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1,ABCA1)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)起着重要的作用[3]。二甲双胍作为临床广泛治疗2型糖尿病的药物,除了可以降低血糖外,还能减轻体重、改善血脂和增强内皮功能[4],近来研究提示二甲双胍具有抑制AS进展的作用[5],因此,我们推测二甲双胍可能通过LXRα-ABCA1途径调节RCT、改善血脂代谢而起到抗AS的作用。本研究采用高脂饮食喂养ApoE-/-小鼠建立AS模型,探讨二甲双胍对AS的影响以及对RCT的分子调控作用,为二甲双胍抗AS提供实验依据。
1 材料 1.1 实验动物SPF级ApoE-/-小鼠18只(8周龄,♂),购于南京大学-南京生物医药研究院,动物许可证号为SCXK(苏)2015-001,置于福建中医药大学实验动物中心SPF级实验室喂养,实验过程均按国际动物保护和使用指南的规定。
1.2 药物与试剂盐酸二甲双胍片(格华止)购自福建中医药大学附属康复医院药剂科(中美上海施贵宝制药有限公司,批号H20023370),用0.9%生理盐水溶解成浓度为26 g·L-1的二甲双胍溶液。油红O染料,血清T-CHO、TG、LDL-C、HDL-C检测试剂盒(南京建成生物技术有限公司),苏木素染料,伊红染料(Solarbio公司),乳脂致动脉粥样硬化饲料(21%脂肪,0.15%胆固醇,江苏美迪森生物医药有限公司,MD12015)。鼠单抗LXRα antibody(英国,Abcam,ab41902)、鼠单抗ABCA1 antibody(英国,Abcam,ab18180),鼠单抗GAPDH antibody(Proteintech,60004-1-Ig)、羊抗小鼠IgG(Proteintech,SA00001-1)、羊抗兔IgG(Proteintech,SA00001-2)。
1.3 仪器小动物超声影像系统(型号:Vevo 2100,加拿大),冰冻切片机(LEICA CM1950,德国),多功能酶标仪(TECAN,infinite M200),普通光学显微镜(LEICA,德国),超低温高速离心机(Thermo Fisher Scientific)。
2 方法 2.1 分组小鼠适应性喂养1周,剪鼠尾提取DNA鉴定基因型,鉴定为ApoE-/-的小鼠,予普通饮食喂养至12周龄,随机分为对照组(NC组)、模型组(Model组)、二甲双胍组(Met组),每组6只。模型组与二甲双胍组饲喂致AS饮食6周,建立AS小鼠模型。对照组持续饲喂普通饮食。每周固定时间称取小鼠体质量。
2.2 药物干预及取材参考Ma等[6]研究,二甲双胍灌胃量为260 mg·kg-1,Model组给予相同体积的0.9%生理盐水灌胃,Met组给予二甲双胍溶液灌胃。每天干预1次,持续灌胃6周。干预过程中每周称量各组小鼠体质量,干预末期超声检测小鼠腹主动脉管壁厚度,干预完成后进行取材,取材前禁食12 h不禁水。
2.3 小动物超声血管壁厚度测量1%~2%异氟烷气体麻醉后,脱毛膏清理腹部的毛发,将小鼠仰卧位固定于操作台上,同步记录小鼠心电及呼吸的频率,调整气麻剂量使心率维持在300~400次/min。涂抹耦合剂,调整超声探头位置,探头方向与小鼠长轴垂直,在腹部找到腹主动脉横断面后,缓慢转动探头使其与腹主动脉走向一致。连续采集10 s的动态图像,使用图像分析系统测量管壁厚度,每个图像随机选取3个部位进行测量。
2.4 血清血脂水平检测摘除眼球取血,室温静置2 h,血液出现分层且有无色透明液体析出时,将血样置于超低温高速离心机,4 ℃ 3 000 r·min-1离心10 min,吸取上层血清。按照总胆固醇(T-CHO)测定试剂盒说明书的要求加血清及标准品到96微孔板中,37 ℃孵育10 min,在波长510 nm处测定各孔的吸光度数值,按照说明书提供的公式计算血清中TC的浓度,每个样本重复3次计算平均值。同样的方法检测血清TG、LDL、HDL浓度。
2.5 组织病理学观察取肝脏于预冷的生理盐水溶液中漂洗干净,左叶修剪成1 cm×0.5 cm大小放入预冷的多聚甲醛中固定,梯度蔗糖脱水后行OCT包埋。剥离出胸腹主动脉,取腹主动脉包埋。冰冻切片机将组织切成厚度为15 μm的切片,PBS洗5 min 3次后,行苏木精伊红及油红O染色。在光学显微镜下随机选取视野并采集图像。
2.6 免疫蛋白印迹检测肝脏LXRα、ABCA1蛋白表达组织中加入适量的裂解液,超声研磨离心后提取蛋白上清液。BCA法检测蛋白上清浓度,100 ℃水浴变性。配置不同浓度比例的分离胶和浓缩胶,加样完成后进行电泳,根据Marker位置切取分子量对应的条带进行转膜。之后用BSA封闭特异性位点,将膜分别与一抗GAPDH、LXRα、ABCA1中4 ℃过夜,二抗常温摇床1 h后ECL显影。分析计算目的蛋白表达。
2.7 统计学方法实验数据使用SPSS 20.0软件统计,数据使用x±s表示,组间比较采用ANOVA单因素方差分析。
3 结果 3.1 体质量如Fig 1所示,在高脂饮食前各组小鼠体质量无差异,在Model和Met组饲喂6周高脂饮食后,体质量均较NC组明显升高。药物干预后,Met组体质量逐渐降低,与Model组比较具有统计学意义(P < 0.01)。
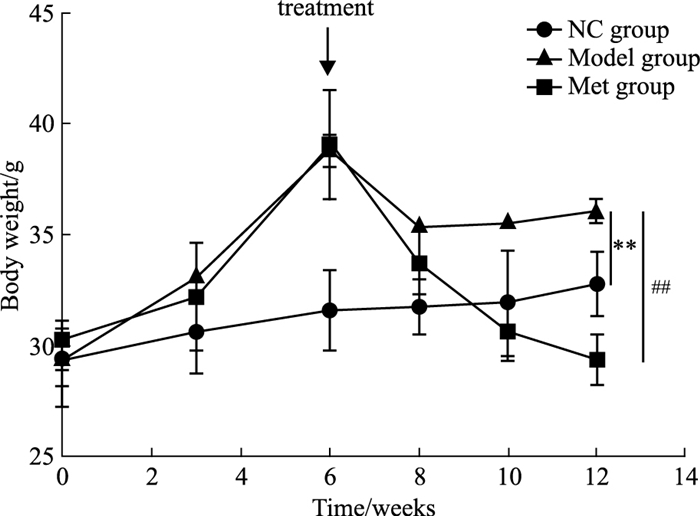
|
| Fig 1 ApoE-/- mouse body weight change(x±s, n=6) **P < 0.01 vs NC group; ##P < 0.01 vs Model group |
实验鼠取材前进行小动物超声检测腹主动脉血管壁厚度,结果见Fig 2、Tab 1,发现Model组小鼠的腹主动脉管壁厚度较NC组增厚(P < 0.01),二甲双胍干预后,腹主动脉管壁厚度变薄(P < 0.01)。
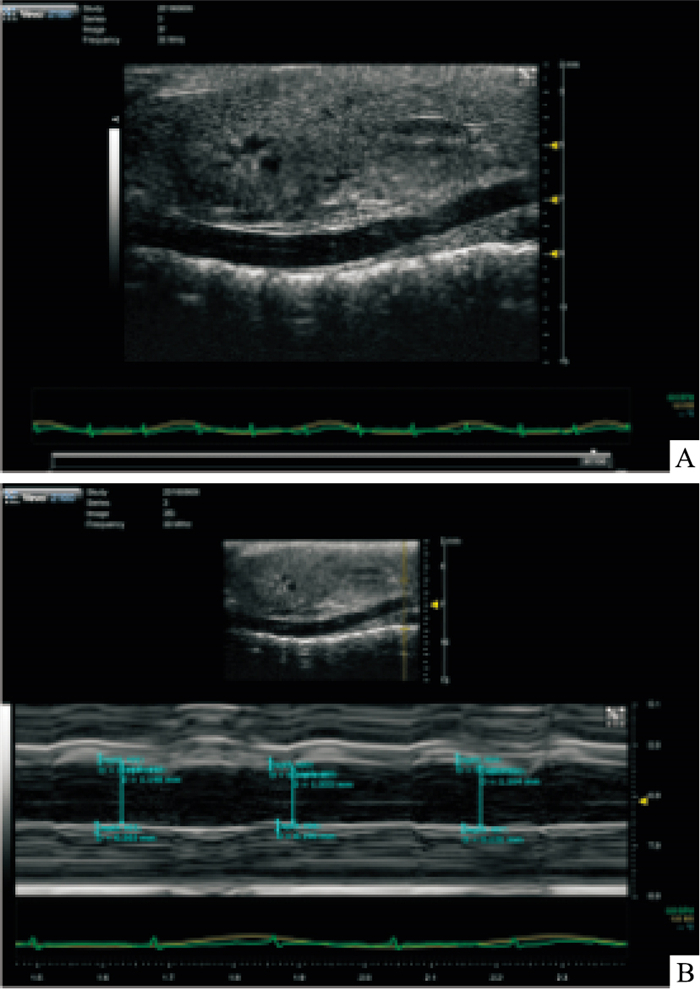
|
| Fig 2 Longitudinal section schematic of animal ultrasound abdominal aorta A:B-Mode; B:M-Mode |
| Group | Proximal part/mm | Distal end/mm |
| NC | 0.15±0.03 | 0.14±0.04 |
| Model | 0.21±0.02** | 0.22±0.03** |
| Met | 0.16±0.02## | 0.13±0.01## |
| **P < 0.01 vs NC; ##P < 0.01 vs model | ||
如Tab 2所示,与NC组比较,Model组的TC、TG、LDL水平升高(P < 0.01),HDL水平降低(P < 0.01);与Model组相比,Met组的TC、TG、LDL水平均有降低(P < 0.01),HDL水平升高(P < 0.05)。
| Group | TC/mmol·L-1 | TG/mmol·L-1 | LDL/mmol·L-1 | HDL/mmol·L-1 |
| NC | 34.86±7.03 | 1.02±0.23 | 9.17±1.66 | 2.52±0.62 |
| Model | 59.87±14.66** | 1.80±0.44** | 15.94±1.89** | 1.51±0.38** |
| Met | 28.36±9.28## | 1.22±0.15## | 10.35±0.73## | 2.13±0.30# |
| **P < 0.01 vs NC; #P < 0.05, ##P < 0.01 vs model | ||||
肝脏HE染色和油红O染色结果表明(Fig 3),NC组肝脏组织结构较为清晰,无脂肪变性,肝细胞排列紧密、规则,呈放射状环绕在中央静脉周围;Model组肝小叶结构不明显,肝细胞排列紊乱,细胞水肿,油红O染色可见肝细胞内大量脂滴;Met组肝细胞排列稍有紊乱,肝组织轻度脂肪变性,可见细小脂滴。
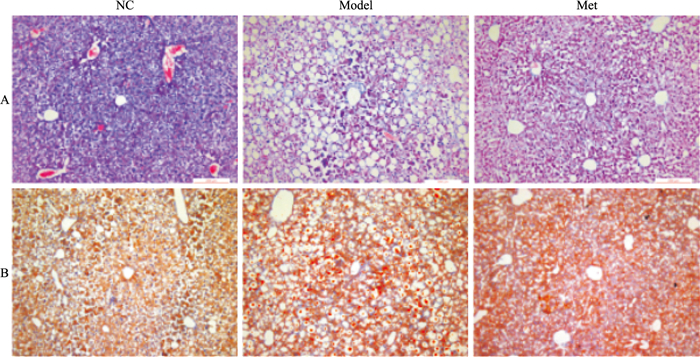
|
| Fig 3 Liver histopathological staining(×100) A: HE staining of liver tissues in ApoE-/- mice; B: Red O staining of liver tissues in ApoE-/- mice |
腹主动脉HE染色结果显示(Fig 4),NC组主动脉内膜结构平整且薄,Model组管壁增厚,主动脉内膜不平整,斑块向血管腔内突出,Met组管壁较Model组变薄,且内膜光滑。
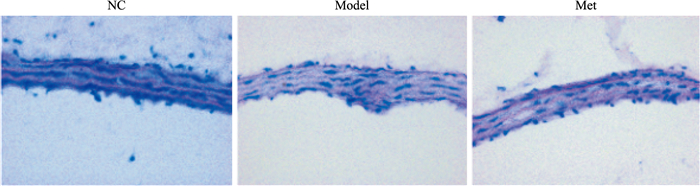
|
| Fig 4 HE staining of abdominal aorta in ApoE-/- mice(×400) |
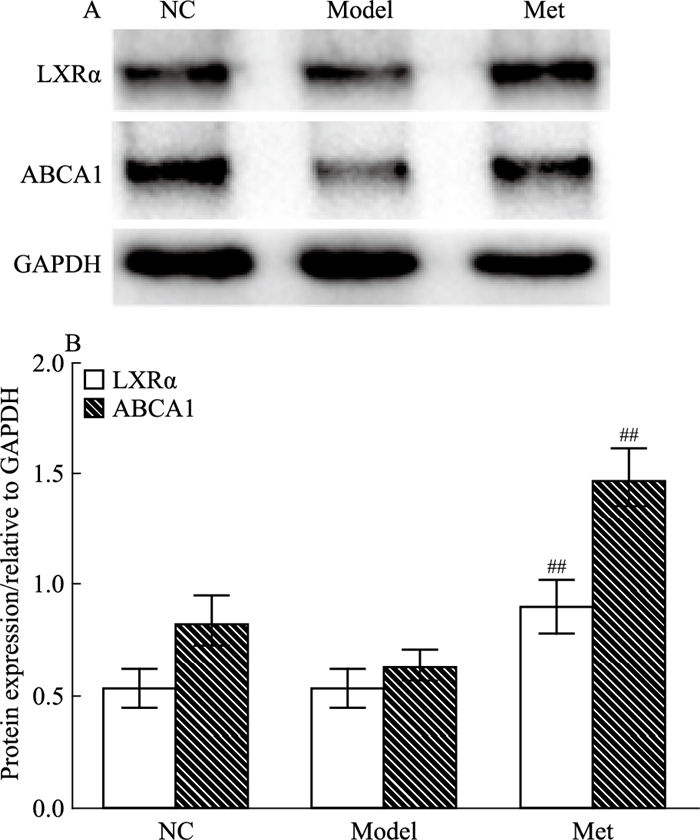
肝脏免疫蛋白印迹结果显示,Model组LXRα、ABCA1蛋白表达较NC组降低,二甲双胍干预后,肝脏胆固醇逆向转运蛋白LXRα、ABCA1表达增加,差异具有统计学意义(P < 0.01),提示二甲双胍能够改善肝脏脂质逆转运能力。见Fig 5。
|
| Fig 5 Expression of LXRα and ABCA1 protein in liver tissues in ApoE-/- mice(x±s, n=3) ##P < 0.01 vs Model group; B: Protein expression of LXRα and ABCA1(relative to GAPDH) |
AS是一类累及全身大小动脉的慢性炎症性病变,是所有心脑血管疾病的病变基础,由于异常升高的血脂被清道夫受体识别及摄取,导致巨噬细胞内胆固醇异常聚集,促进泡沫细胞的形成,纤维斑块形成,最终导致AS[7]。ApoE-/-小鼠是较成熟的动脉粥样硬化动物模型[8]。我们的研究也证实了异常升高的血脂与AS严重程度正相关,AS模型组小鼠血中TC、TG、LDL明显升高且腹主动脉粥样斑块的形成程度较对照组严重。二甲双胍作为一种从法国丁香中提取的胍衍生物,已被用作人类降糖药物60多年,除此之外,二甲双胍还可以用于治疗癌症、肥胖症、非酒精性脂肪肝病、多囊卵巢综合征和代谢综合征等相关疾病[4]。近来研究表明,二甲双胍应用于抗AS方面的治疗,具有调节血脂代谢和抗炎等作用[9-10],但对肝脏RCT的分子机制影响未见报道。本实验研究发现,高脂饮食喂养ApoE-/-小鼠血中TC、TG、LDL明显升高,且腹主动脉粥样斑块的形成程度较对照组严重,但二甲双胍干预后小鼠血中TC、TG、LDL及腹主动脉粥样斑块的程度改善明显,提示二甲双胍有明显的降血脂及抗AS作用。有研究报道二甲双胍降血脂及抗AS作用可能是通过抑制HDLC糖基化,增加HDLC与胆固醇结合,促进RCT实现的[11]。RCT过程是一种内源性机制,胆固醇从肝外组织向肝脏转运,通过胆汁排泄到粪便中,并维持胆固醇稳态[12]。动物与人的研究中均表明,RCT受损可导致AS加速,反之,RCT加强可预防或减轻AS[13]。因此,增强胆固醇逆向转运,对清除血液和外周组织过多的胆固醇,减轻甚至逆转AS至关重要。本实验通过HE染色和油红O染色评价肝脏的脂质累及的严重程度,证实了AS模型组小鼠高脂饮食喂养后肝脏脂质沉积明显严重于普通饮食喂养的对照组小鼠,且模型组外周血HDLC水平明显低于对照组,二甲双胍干预后ApoE-/-小鼠肝脏脂质沉积程度明显改善并且外周血中HDLC水平明显升高,推测二甲双胍通过升高HDLC启动RCT从而改善肝脏脂质沉积。
在RCT过程中,胆固醇流出主要由细胞表面转运蛋白ABCA1介导,并受LXR转录诱导的[3]。LXR和ABCA1是调节胆固醇体内平衡的重要因子,LXR通过上调ABCA1、磷脂转运蛋白、载脂蛋白等介导肝脏细胞胆固醇外流,将胆固醇转化为胆汁酸并加快其在肠道的吸收[14]。LXR具有α、β两种亚型,LXRα在肝脏中表达最高并在肝脏中形成LXRα-ABCA1通路参与RCT及抗AS过程,越来越多的证据表明LXRα调节脂质代谢和炎症,在抗AS中发挥重要作用[15]。研究显示LXRα的活性增强,促进斑块巨噬细胞及肝脏中ABCA1介导的胆固醇逆转运,起到抑制AS的作用[16]。激活LXRs发现血浆HDL及肝脏内ABCA1显著升高,预防AS的进一步进展,表明LXRs-ABCA1介导的肝脏RCT可能是一种抗AS的潜在治疗靶点[17-18]。本实验通过二甲双胍干预后检测ApoE-/-小鼠肝脏的LXRα、ABCA1表达情况,结果显示二甲双胍干预后的小鼠肝脏LXRα、ABCA1表达明显高于模型组。结合肝脏脂质沉积及血中TC、TG、LDL、HDL水平,我们实验明确了二甲双胍可以通过促进肝脏LXRɑ、ABCA1的表达增强HDL介导的RCT,增强肝脏清除体内TC、TG、LDL能力,减轻肝脏脂质沉积,从而延缓及治疗动脉粥样硬化。
综上所述,本研究证实了二甲双胍能够通过促进肝脏LXRɑ、ABCA1的表达增强HDL介导的RCT,减轻肝脏脂肪病变,降低血清血脂水平,从而延缓动脉粥样硬化病变,为二甲双胍降血脂及抗AS提供理论依据。
| [1] |
Gister A, Hansson G K. The immunology of atherosclerosis[J]. Nat Rev Nephrol, 2017, 13(6): 368-80. |
| [2] |
Zhou X, Ren Q, Wang B, et al. Alisol A 24-Acetate Isolated from the alismatis rhizoma improves hepatic lipid deposition in hyperlipidemic mice by ABCA1 ABCG1 pathway[J]. J Nanosci Nanotechnol, 2019, 19(9): 5496-502. |
| [3] |
Khera A V, Rader D J. Future therapeutic directions in reverse cholesterol transport[J]. Curr Atheroscler Rep, 2010, 12(1): 73-81. |
| [4] |
Zhou J, Massey S. Metformin: An old drug with new applications[J]. Int J Mol Sci, 2018, 19(10): 2863-77. |
| [5] |
张娜, 白剑, 花颖, 等. 二甲双胍体外抑制低密度脂蛋白氧化的实验研究[J]. 医学研究生学报, 2012, 25(5): 458-61. Zhang N, Bai J, Hua Y, et al. Metformin inhibits the oxidation of low density lipoprotein in vitro[J]. J Med Postgra, 2012, 25(5): 458-61. |
| [6] |
Ma A, Wang J, Yang L, et al. AMPK activation enhances the anti-atherogenic effects of high-density lipoproteins in apoE-/- mice[J]. J Lipid Res, 2017, 58(8): 1536-47. |
| [7] |
Wang Y, Ding W X, Li T. Cholesterol and bile acid-mediated regulation of autophagy in fatty liver diseases and atherosclerosis[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2018, 1863(7): 726-33. |
| [8] |
Emini V B, Perrotta P, Gra D M, et al. Animal models of atherosclerosis[J]. Eur J Pharmacol, 2017, 816(12): 3-13. |
| [9] |
Xiaopeng Z, Hongmei Y, Mingfeng X, et al. Metformin attenuates triglyceride accumulation in HepG2 cells through decreasing stearyl-coenzyme A desaturase 1 expression[J]. Lipids Health Dis, 2018, 17(1): 114-22. |
| [10] |
曾晓会, 卓俊城, 谢凯枫, 等. 二甲双胍治疗Ⅱ型糖尿病大鼠的代谢组学研究[J]. 中国药理学通报, 2019, 35(9): 1212-20. Zeng X H, Zhuo J C, Xie K F, et al. Metabonomic study of metformin in type Ⅱ diabetic rats[J]. Chin Pharmacol Bull, 2019, 35(9): 1212-20. |
| [11] |
朱海波. 小分子药物调控胆固醇逆向转运机制的研究进展[J]. 中国动脉硬化杂志, 2019, 27(2): 93-100. Zhu H B. Advances in mechanism of small molecule drugs in regulating reverse cholesterol transport[J]. Chin J Arterioscler, 2019, 27(2): 93-100. |
| [12] |
Attie A D, Kastelein J P, Hayden M R. Pivotal role of ABCA1 in reverse cholesterol transport influencing HLD levels and susceptibility to atherosclerosis[J]. J Lipid Res, 2001, 42(11): 1717-26. |
| [13] |
Rohatgi A. Reverse cholesterol transport and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2019, 39(1): 2-4. |
| [14] |
Shuyuan G, Luxiao L, Huiyong Y. Cholesterol homeostasis and liver X receptor(LXR) in atherosclerosis[J]. Cardiovasc Hematol Disord Drug Targets, 2018, 18(1): 27-33. |
| [15] |
Calkin A C, Tontonoz P. Liver X receptor signaling pathways and atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2010, 30(8): 1513-8. |
| [16] |
Naik S U, Wang P X, Silva P J S D, et al. Pharmacological activation of liver X receptors promotes reverse cholesterol transport in vivo[J]. Circulation, 2006, 113(1): 90-7. |
| [17] |
Brunham L R, Kruit J K, Pape T D, et al. Tissue-specific induction of intestinal ABCA1 expression with a liver X receptor agonist raises plasma HDL cholesterol levels[J]. Circ Res, 2006, 99(7): 672-4. |
| [18] |
Hong C, Tontonoz P. Liver X receptors in lipid metabolism: opportunities for drug discovery[J]. Nat Rev Drug Discov, 2014, 13(6): 433-44. |