

2. 重庆医科大学药理学教研室, 重庆 400016;
3. 重庆医药高等专科学校药学院, 重庆 401331
 ,
RAO Jiang-yan1,2,
WANG Yu-chun1,2,
XIANG Fei1,2,
XU Lu3,
TIAN Xiao-cui1,2,
DONG Zhi1,2
,
RAO Jiang-yan1,2,
WANG Yu-chun1,2,
XIANG Fei1,2,
XU Lu3,
TIAN Xiao-cui1,2,
DONG Zhi1,2

2. Dept of Pharmacology, Pharmacy School of Chongqing Medical University, Chongqing 400016, China;
3. Dept of Pharmacy, Chongqing Medical and Pharmceutical College, Chongqing 401331, China
脑卒中的发病率和死亡率居世界第二位,在中国每年有超过200万的新病例,是致残率最高的疾病[1-2]。缺血性脑卒中的常见原因是颈内或颅内血管阻塞,大脑血液供应不足,导致急性缺糖缺氧,引起严重的神经系统功能障碍[3]。中风不仅会导致灰质损伤,还会引起深层的白质损伤,大脑白质主要由深穿支动脉供血, 很容易发生缺血性损伤,常常比灰质受到更严重的损伤,这是导致脑卒中发生率升高和神经功能不良的危险因素[4]。迄今为止,组织型纤溶酶原激活物(tPA)是FDA批准用于缺血性中风的有效的治疗剂。然而,其严重的不良反应和有限的治疗时间窗,使其仅适用于所有中风患者的4%~7%[5]。β-石竹烯(β-caryophyllene,BCP),是一种双环倍半萜型化合物,研究表明,BCP通过调节多种途径,发挥抗氧化、抗炎、抗凋亡和保护血脑屏障,它对脑缺血具有神经保护作用[6-7]。虽然BCP目前在脑缺血/再灌注(cerebral ischemia-reperfusion,CIR)损伤模型中有较多的研究,但其作用的具体分子机制还不十分清楚,关于CIR白质损伤(white matter injury,WMI)的研究也很少,本实验采用线栓法建立小鼠CIR损伤模型,给予BCP预处理,观察BCP对CIR损伤后小鼠白质的影响。
1 材料与方法 1.1 实验药品、试剂β-石竹烯(纯度>80%),(W225207),2,3,5-氯化三苯基四氮唑(TTC),(T8877)购自Sigma公司;mbp(10458-1-AP)、NF(60189-1-lg)、Bcl-2(12789-1-AP)、Bax(50599-2-lg)和caspase-3 (19677-1-AP)等抗体均购自Proteintech公司。
1.2 实验仪器电泳仪(北京六一生物科技有限公司),成像仪(BIO-RAD),正置荧光显微镜(Nikon),高速低温离心机(Thermo公司),电热鼓风干燥箱(天津市泰斯特仪器有限公司)。
1.3 实验方法 1.3.1 实验动物与分组SPF级♂C57BL/6小鼠75只,体质量为(20±2)g,购自重庆医科大学实验动物中心(许可证号: SCXK渝2018-0003),将C57BL/6小鼠随机分为正常对照组(Control)、模型组(CIR)、BCP治疗组(36、72、144 mg·kg-1),BCP用10%蓖麻油和生理盐水配制,以0.01 mL·g-1连续灌胃给药d 1~5,Control组和CIR组给相同溶剂。
1.3.2 建立小鼠脑缺血/再灌注模型采用线栓法制作小鼠大脑MCAO模型。通过腹腔注射4%的戊巴比妥钠将小鼠麻醉,在手术台上以仰卧位固定,沿颈部正中切开皮肤,找到右颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)分支,并结扎ECA、CCA,用动脉夹暂时阻断ICA血流,在CCA剪一切口,从切口插入直径为(18.5±0.5) mm线栓至ICA,感到阻力时停止,固定线栓, 缺血1 h后,将线栓拔出使血流恢复,缝合伤口,再灌注24 h后,进行后续实验。
1.3.3 神经行为学评分再灌注24 h后,使用Longa等5分制评分对小鼠进行神经行为学评分。
1.3.4 脑梗死体积测定再灌注24 h后,将小鼠麻醉取脑,于-20 ℃放置30 min,作2 mm厚度的连续切片,于2%的TTC染液中,37 ℃水浴避光染色15 min,反面继续染色15 min,4%多聚甲醛固定过夜,拍照。运用Image J软件分析脑小鼠脑梗死体积。
1.3.5 脑含水量测定再灌注24 h后,取出受伤侧脑组织称量其湿重后,放入120 ℃的烘箱内干燥48 h至恒重,即为干重。脑水含量(BWC) =(湿重-干重)/湿重×100%。
1.3.6 Western blot法检测mbp、NF、Bcl-2、Bax和caspase-3蛋白的表达再灌注24 h,小鼠麻醉以取脑,分离受损侧白质,蛋白裂解液提取蛋白(RIPA-PMSF-磷酸酶抑制剂=100 :1 :2),电泳分离,切胶,转膜,5%的胎牛血清蛋白(BSA)封闭4 h,然后加入相应的一抗,抗体稀释比例均为1 :1 000~2 000,4 ℃冰箱孵育过夜,TBST洗膜(3×5 min),再分别二抗孵育40 min,三抗孵育30 min,洗膜后,采用增强化学发光液(ECL)显影成像。应用Image Lab软件进行图像分析,β-actin作为内参。
1.3.7 HE染色再灌注24 h后,小鼠麻醉后仰卧固定,先用200 mL PBS心脏灌注15 min,然后用4%多聚甲醛(约60 mL)灌注固定至小鼠全身僵硬,断头取脑,继续在4%多聚甲醛中固定过夜,石蜡包埋,切片(厚5 μm)。按照HE染色试剂盒说明书染色,于200倍视野下观察胼胝体髓鞘的病理改变情况。
1.3.8 透射电镜再灌注24 h后,麻醉取脑,在胼胝体区取1 mm3大小组织块,2.5%的戊二醛4℃固定,于重庆医科大学生科院电镜室进行后面步骤,并采集图片。
1.3.9 LFB染色再灌注24 h后,按1.3.7项下操作进行灌注、外固定,用梯度乙醇脱水,二甲苯透明,浸蜡,包埋,切片(5 μm),根据LFB染色试剂盒说明书染色,计算髓鞘染色光密度值(OD)。
1.4 统计学处理采用SPSS 17.0统计软件进行数据分析,结果用x ± s表示,多组间比较采用单因素方差分析(One-way ANOVA)。
2 结果 2.1 BCP降低CIR小鼠脑梗死体积,减轻神经功能缺损和脑含水量与正常对照组相比,缺血1 h,再灌注24 h后,小鼠缺血侧脑组织出现大面积梗死,肢体有明显的偏瘫,神经行为学评分升高,脑组织严重水肿;与模型组相比,BCP组可减少小鼠脑梗死体积,降低神经行为学评分,减轻脑组织水肿(Fig 1A、B、C、D)。结果表明,BCP能够减轻小鼠缺血/再灌注后损伤,其中中等剂量(72 mg·kg-1)效果最好,呈现出剂量依赖性保护作用。

|
| Fig 1 Effects of BCP on cerebral infarction volume, neurobehavioral and cerebral edema in CIR mice A: TTC-stained brain sections; B: The quatitative diagram of A diagram(x ± s, n=4); C: Neurologic deficit score (x ± s, n=12); D: The quatitative diagram of the moisture content of mice brain(x ± s, n=4). **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs CIR |
与正常对照相比,模型组小鼠的脑白质出现明显的病理学改变:肉眼可见明显的脑水肿,镜下可见胼胝体白质疏松,纤维排列疏松凌乱,有空泡样改变。而BCP组CIR小鼠脑白质的病理学改变较轻,神经纤维排列紧密,胼胝体空泡面积明显较少(Fig 2A, 2B)。

|
| Fig 2 Effect of BCP on pathological changes of white matter in CIR mice (x ± s, n=5) A: HE staining of brain sections (×200); B: The quatitative diagram of the area of vacuoles in the corpus callosum. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs CIR |
如Fig 3所示,正常对照组中,胼胝体的髓鞘结构致密,染色深,呈板状排列;模型组神经纤维出现脱髓鞘现象,髓鞘着色明显变浅,厚度变薄,髓鞘板层疏松、剥脱,髓鞘板层断裂为小碎片或空泡,轴索内细胞器肿胀。给予BCP治疗后,能够明显减轻上述髓鞘的退行性改变。

|
| Fig 3 Effect of BCP on ultrastructure of corpus callosum myelin sheath in CIR mice (8000×100 kV) Black arrows showed damaged corpus callosum |
正常对照组中,小鼠胼胝体LFB着色较深,髓鞘排列整齐致密,无水肿、分层。模型组LFB着色较浅,髓鞘排列疏松、有部分崩解,呈空泡状。经BCP治疗之后,髓鞘损伤减轻,LFB染色加深,LFB染色的光密度值较模型组升高(Fig 4A, 4B)。
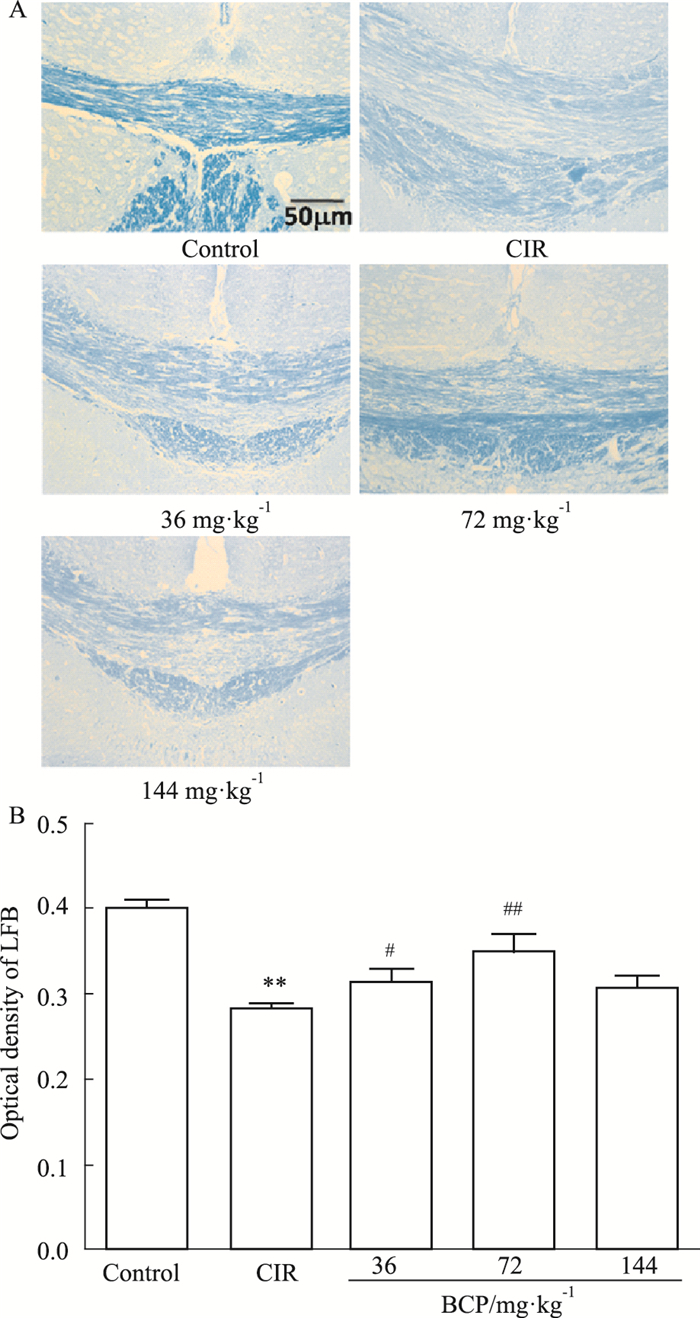
|
| Fig 4 Effect of BCP on injury of corpus callosum myelin sheath in CIR mice by LFB staining (×200, x ± s, n=3) **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs CIR |
Western blot结果显示:CIR后,小鼠脑白质中mbp、NF和Bcl-2蛋白表达明显减少,BCP治疗后,可明显提高mbp、NF和Bcl-2蛋白的表达水平。而CIR后,Bax和caspase-3表达增多,BCP组则减少其在白质中的表达,其中72 mg·kg-1剂量组变化最明显(Fig 5)。
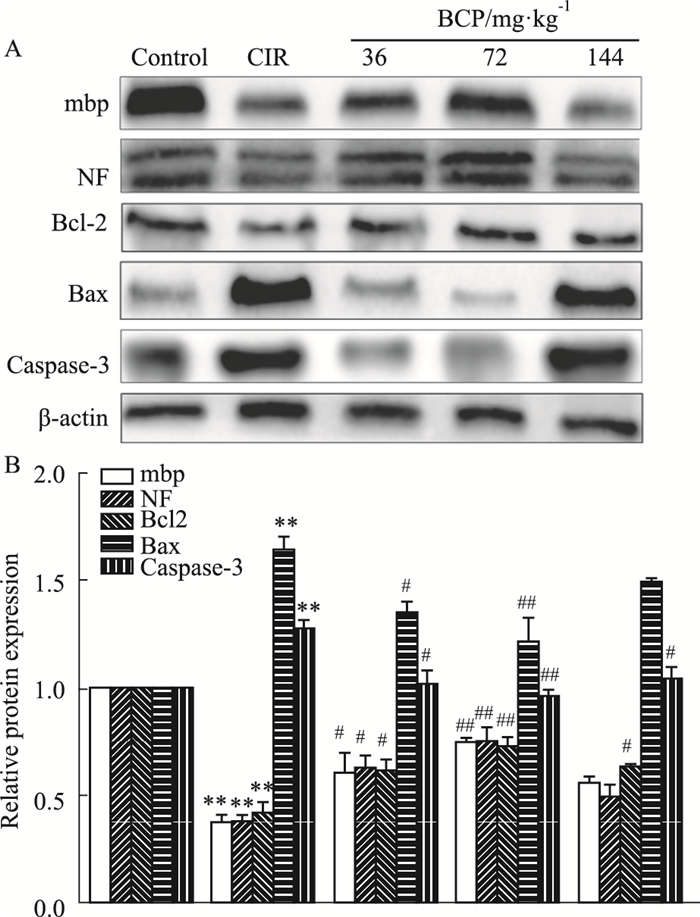
|
| Fig 5 Effect of BCP on expression of mbp, NF and caspase-3 apoptosis-related proteins in CIR mice (x ± s, n=5) **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs CIR |
灰质(gray matter,GM)和白质(white matter,WM)是中枢神经系统重要的两个组成部分,大约各占人类大脑的一半[8],WM由密集的有髓鞘和无髓鞘轴索束组成,这些轴索束来自中枢神经系统的各种投射神经元[9]。研究表明,WMI能够引发传导束变性,引起运动、感觉等神经活动的联络中断而导致神经功能的障碍[10-11]。胼胝体使大脑的两个半球能够快速交流,但它也是皮质下白质卒中或血管性痴呆的主要损伤部位[9]。本实验着重研究BCP对CIR小鼠胼胝体髓鞘损伤的影响作用。
白质的主要组成细胞是神经胶质细胞,其中少突胶质细胞(oligodendrocyte,OLG)是形成髓鞘的主要成分,成熟的OLG是合成髓磷脂构成髓鞘的主要成分,它的突起包绕轴突形成髓鞘[12]。髓鞘碱性蛋白(myelin basic protein,mbp),由成熟的少突胶质细胞分泌,是髓鞘相关性蛋白的主要成分,约占30%,对髓鞘的致密性起作用,集中分布在有髓纤维,是成熟少突胶质细胞功能活动的标记物[13]。在CIR发生时,OLG受损伤可导致mbp甲基化障碍,引起髓鞘整体结构的稳定性下降,髓鞘结构的致密性受到损伤进而导致髓鞘脱失,使神经轴突的营养及保护减弱甚至消失,进一步引发了轴索变性[14]。本研究选择mbp作为髓鞘损伤的标志,Western blot结果显示,CIR后mbp的表达明显减少,说明有脑白质髓鞘损伤,而给予BCP治疗后,mbp的表达上升,结果表明BCP对CIR后小鼠白质损伤具有保护作用。
此外,CIR后小鼠白质抗凋亡蛋白Bcl-2表达明显减少,促凋亡蛋白Bax、caspase-3表达升高,而BCP则促进Bcl-2表达,降低Bax、caspase-3表达,提示BCP对脑白质的保护作用可能与Bax/Bcl-2凋亡机制有关,但具体的作用机制还需要进一步的探讨。本实验BCP共设置了3个浓度梯度,分别为36、72、144 mg·kg-1,实验结果显示,BCP 72 mg·kg-1为最佳剂量组,36 mg·kg-1与144 mg·kg-1剂量效果不明确,总体上36 mg·kg-1较144 mg·kg-1效果好,可能原因是144 mg·kg-1用药剂量过大,配药所用溶剂选用的是蓖麻油,会对小鼠胃肠道产生刺激,实验过程中体重减轻,对缺血/再灌损伤的耐受下降。
综上所述,BCP能够改善CIR小鼠脑白质上述病理学变化,对其起到保护作用,可能与抑制Bax/Bcl-2凋亡通路有关。尽管缺血性白质疾病具有较高发病率和重要临床意义,但相对较少的努力投入到病理机制或寻找缺血性白质疾病的治疗靶点的研究上[15]。因此,有必要进一步探讨BCP对CIR小鼠脑白质的作用机制,对治疗脑缺血/再灌注导致的白质损伤具有重要意义。
| [1] |
Spence JD. Recent advances in preventing stroke recurrence[J]. F1000 Res, 2017, 6: 1017. doi:10.12688/f1000research.11597.1 |
| [2] |
Wu S, Wu B, Liu M, et al. Stroke in China: advances and challenges in epidemiology, prevention, and management[J]. Lancet Neurol, 2019, 18(4): 394-405. doi:10.1016/S1474-4422(18)30500-3 |
| [3] |
张小琴, 苗学蒸, 周丽英, 等. 红景天苷对局灶性脑缺血/再灌注大鼠轴突再生及Akt/GSK-3β/CRMP-2表达的影响[J]. 中国药理学通报, 2017, 33(9): 1320-4. Zhang X Q, Miao X Z, Zhou L Y, et al. Salidroside regulates Akt/GSK-3β/CRMP-2 expression and axonal regeneration in MCAO rats[J]. Chin Pharmacol Bull, 2017, 33(9): 1320-4. doi:10.3969/j.issn.1001-1978.2017.09.025 |
| [4] |
Cheng X, Wang H, Liu C, et al. Dl-3-n-butylphthalide promotes remyelination process in cerebral white matter in rats subjected to ischemic stroke[J]. Brain Res, 2019, 15(1717): 167-75. |
| [5] |
Yang M, Lv Y, Tian X, et al. Neuroprotective effect of beta-caryophyllene on cerebral ischemia-reperfusion injury via regulation of necroptotic neuronal death and inflammation: In Vivo and in Vitro[J]. Front Neurosci, 2017, 11: 583. doi:10.3389/fnins.2017.00583 |
| [6] |
杨梅, 安瑞娣, 李明航, 等. β-石竹烯通过作用于HMGB1/TLR4/NF-κB通路减轻小鼠局灶性脑缺血/再灌注损伤[J]. 中国免疫学杂志, 2017, 33(7): 1009-13. Yang M, An R D, Li M H, et al. β-caryophyllene mitigates cerebral ischemia/reperfusion injury in mice by inhibiting HMGB1/TLR4/NF-κB pathway[J]. Chin J Immun, 2017, 33(7): 1009-13. doi:10.3969/j.issn.1000-484X.2017.07.011 |
| [7] |
曹光秀, 李然然, 刘洁, 等. β-石竹烯通过抗氧化作用减轻局灶性脑缺血/再灌注大鼠大脑皮质损伤[J]. 中药药理与临床, 2016, 32(1): 56-60. Cao G X, Li R R, Liu J, et al. β-caryophyllene protects cerebral cortical neurons against cerebral ischemia and reperfusion in rats by improving antioxidant activities[J]. Pharmacol Clin Chin Mater Clin Med, 2016, 32(1): 56-60. |
| [8] |
Fern R, Matute C. Glutamate receptors and white matter stroke[J]. Neurosci Lett, 2019, 694: 86-92. doi:10.1016/j.neulet.2018.11.031 |
| [9] |
Marin M A, Carmichael S T. Mechanisms of demyelination and remyelination in the young and aged brain following white matter stroke[J]. Neurobiol Dis, 2018, 126: 5-12. |
| [10] |
Tao C, Hu X, Li H, et al. White matter injury after intracerebral hemorrhage: pathophysiology and therapeutic strategies[J]. Front Hum Neurosci, 2017, 11: 422. doi:10.3389/fnhum.2017.00422 |
| [11] |
Guimaraes J S, Freire M A, Lima R R, et al. Mechanisms of secondary degeneration in the central nervous system during acute neural disorders and white matter damage[J]. Rev Neurol, 2009, 48(6): 304-10. |
| [12] |
van Tilborg E, de Theije C, van Hal M, et al. Origin and dynamics of oligodendrocytes in the developing brain: Implications for perinatal white matter injury[J]. Glia, 2018, 66(2): 221-38. doi:10.1002/glia.23256 |
| [13] |
蔡其燕.梓醇对慢性脑缺血大鼠脑白质保护作用的实验研究[D].第三军医大学, 2011. Cai Q Y. Protective effects of catalpol against white matter lesions in the rat brain after chronic cerebral hypoperfusion[D].Third military medical University, 2011. http://d.wanfangdata.com.cn/Thesis/D160317 |
| [14] |
梁燕.法舒地尔对大鼠脑缺血/再灌注后脑白质保护作用的研究[D].郑州大学, 2011. Liang Y. Protective of Fasudil in white matter of rats following acute cerebral ischemia-reperfusion[D]. Zhengzhou University, 2011. http://d.wanfangdata.com.cn/Thesis/Y1929104 |
| [15] |
段建钢.针刺对缺血性脑卒中大鼠受损脑髓鞘神经保护作用的研究[D].四川大学, 2007. Duan J G. Study on neuroprotective effect of acupuncture on injured cerebral myelin in ischemic stroke rats [D]. Sichuan University, 2007. http://d.wanfangdata.com.cn/Thesis/Y1194640 |