


2. 湖北中医药大学 中药资源与中药复方教育部重点实验室 老年病中药新产品湖北省协同创新中心,湖北 武汉 430065
2. Hubei Collaborative Innovation Center for New Products of Geriatric Chinese Medicine, Key Lab of Chinese Medicine Resource and Compound Prescription, Ministry of Education, Hubei University of Chinese Medicine, Wuhan 430065, China
肝细胞癌(hepatocellular carcinoma,HCC)约占原发性肝癌的90%,是全球最常见的恶性肿瘤之一,具有预后不良、容易复发和死亡率高等特点。全球每年新患HCC人数约为75万人,其中50%发生于中国,严重危害着我国人民的生命健康[1]。但是,目前临床上现行的标准化治疗手段,如索拉菲尼等,仅能延长患者生命3~4个月[2]。因此,寻找新的治疗思路对于肝细胞癌患者具有重要的意义。
原癌基因c-Myc是一种转录子,能通过调控细胞生长、分化等大量基因的表达,促进肿瘤的恶性转化和发展。研究显示,在人类肝细胞癌样本中常常伴随着c-Myc的过表达和异常扩增[3],并且在小鼠肝细胞癌模型中c-Myc的表达与肝细胞癌的发展呈正相关[4]。因此,c-Myc可以作为肝细胞癌靶向治疗的候选基因之一。蛋白激酶B(proteinkinase B,Akt)/哺乳动物雷帕霉素复合物1(mTOR complex 1,mTORC1)是肿瘤细胞内重要的信号转导通路之一,在肺癌、肝癌[5, 6]等肿瘤的发生、发展中起重要作用,能够调节细胞生长、增殖、促进细胞周期进展以及参与血管形成等多种功能。
塞来昔布是环氧化酶-2的选择性抑制剂,临床上常用的一种非甾体抗炎药。近年来,多项研究表明塞来昔布可以抑制多种肿瘤的发展,如乳腺癌、非小细胞肺癌等、口腔癌等[7-9]。但目前关于塞来昔布对肝细胞癌的作用及其机制研究还较少。Krysan等[10]和Xia等[11]报道,塞来昔布可以通过调节对前列腺素E2或Wnt/β-catenin通路影响其下游基因c-Myc的表达。Kucab等[12]的研究发现,塞来昔布可以通过抑制Akt的磷酸化, 破坏Akt信号通路。以上结果提示塞来昔布对c-Myc和Akt通路具有一定的作用,但其是否能够通过c-Myc及Akt/mTORC1信号通路影响肝细胞癌的发展尚未有报道。本研究采用尾静脉高压注射法在小鼠体内过表达c-Myc建立肝细胞癌模型,观察塞来昔布对小鼠肝细胞癌发展的作用及其机制。
1 材料 1.1 仪器小鼠固定架(Braintree Scientific INC);低速离心机(德国艾本德);恒温摇床(Thermo Scientific);纯水仪(EASY pure UF 07421, Millipore);显微镜(日本OLYMPUS BX53);图像采集系统(日本OLYMPUS);酶标仪(美国Bio Rad公司);电泳仪(美国Bio Rad公司);漩涡混合器(美国Scientific Industries公司);转膜仪(美国Bio Rad公司)。
1.2 药品与试剂c-Myc质粒(CHENXIN实验室构建);Top10感受态细胞(北京康为世纪生物科技有限公司03690);质粒大提试剂盒(美国OMEGA D6926);免疫组化试剂盒(北京康为世纪生物科技有限公司20422);p-Akt T308抗体(#13038)、p-Akt S473抗体(#4060)、p-4EBP1(#2855)均购自CST公司;c-Myc抗体(10828-1-AP);β-actin(HRP-6008)及二抗(SA00001-2)购自武汉三鹰生物技术有限公司;塞来昔布(辉瑞制药有限公司J20140072);PVDF膜(美国Millipore公司R9EA33171)。
1.3 实验动物SPF级野生型FVB/N小鼠28只,♀,6~7周龄,体质量(18~20) g, 购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0002。
2 方法 2.1 c-Myc诱导小鼠肝细胞癌模型的制备按照质粒提取试剂盒步骤提取c-Myc基因质粒及编码Sleeping Beauty转座酶的质粒SB。将c-Myc基因质粒与SB质粒按25 :1的稀释比例,稀释到0.9%氯化钠溶液中,涡旋混匀,过0.22 μm微孔滤膜,将配置好的质粒经小鼠尾静脉迅速(5~9 s)注射入小鼠体内。
2.2 实验动物分组和给药适应性饲养1周后,将小鼠随机分为4组,分别为正常组(WT),c-Myc模型组,塞来昔布低、高剂量组,每组7只。模型组和给药组按“2.1项”下方法进行小鼠高压尾静脉注射c-Myc质粒,正常组高压尾静脉注射生理盐水作为对照。各组药物溶液均以水为溶剂配制,现配现用,用前摇匀。造模3 d后塞来昔布低、高剂量组每天灌胃塞来昔布一次,给药剂量分别为150 mg·kg-1(c-Myc-Cele-L)、300 mg·kg-1(c-Myc-Cele-H);正常组和c-Myc模型组灌胃等体积空白溶剂,连续给药6周。
2.3 样本收集实验小鼠在最后一次给药3 h后,以颈椎脱臼法处死小鼠,解剖,取出完整肝脏组织;拍照并记录肝重,计算肝脏指数(肝脏指数=肝重/体重);取部分肝组织用多聚甲醛(4%)固定供组织病理分析;剩余肝脏组织-80 ℃保存。
2.4 苏木精-伊红(HE)检测将在多聚甲醛中固定24 h后的肝组织转移至75%的酒精中,经自动组织脱水机脱水、透明处理,在石蜡包埋机中浸蜡、包埋,进行厚5 μm切片,37 ℃水浴展开、捞片、沥干、常规HE染色,在显微镜下观察各组小鼠组织病理学变化。
2.5 IHC检测将包埋后的小鼠肝脏组织切成5 μm厚度切片,按免疫组化试剂盒操作步骤,检测Ki67蛋白表达情况。
2.6 Western Blot检测取出-80 ℃冻存的肝脏组织适量,加入RIPA裂解液和蛋白酶抑制剂,超声破碎后置于冰上充分裂解15 min,4 ℃、12 000 r·min-1离心15 min,然后吸取上清,采用BCA法测蛋白浓度。以等量总蛋白上样、电泳、转膜、封闭,置于c-Myc、p-Akt T308、p-Akt S473、p-4EBP1(稀释比例1 :1 000)或β-actin(稀释比例1 :10 000)单克隆抗体溶液中4 ℃孵育过夜,TBST洗膜10 min×3,相应二抗(稀释比例1 :8 000)室温孵育1 h,TBST洗膜10 min×3,ECL显色后,成像系统进行曝光。用Image J 1.8.0软件进行分析,以目标蛋白与内参(β-actin)灰度值的比值进行评价。
2.7 统计学分析采用Graphpad Prism 5.0(Graph Pad, San Diego, USA)软件分析数据,所有数据均以x ± s形式表示。两组间的计量资料的统计学分析采用非配对的t检验。
3 结果 3.1 塞来昔布对c-Myc诱导小鼠肝细胞癌模型肝脏形态学、肝重、肝脏指数的影响各组小鼠肝脏形态学变化,如Fig 1A所示。WT组小鼠肝脏外观呈现鲜红色,表面光滑质地均匀;c-Myc诱导小鼠肝脏体积明显增大,肝脏组织出现大量白色结节;与c-Myc诱导小鼠相比,c-Myc-Cele-L和c-Myc-Cele-H小鼠肝脏体积明显减小,肝脏组织白色结节变少。
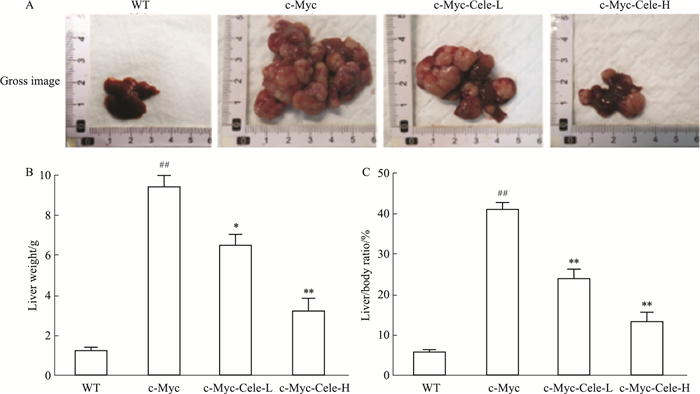
|
| Fig 1 Effects of celecoxib on liver gross image (A), hepatic weight (B) and liver index (C) in mice(x ± s, n=7) ##P < 0.01 vs WT, *P < 0.05, **P < 0.01 vs c-Myc |
如Fig 1B、C所示,与WT相比,c-Myc模型组小鼠肝重和肝脏指数均明显增高(P < 0.01);与c-Myc模型组相比,c-Myc-Cele-L和c-Myc-Cele-H小鼠肝脏重量和脏器指数均明显降低(P < 0.05, P < 0.01),并且呈现一定的剂量效应关系。
3.2 塞来昔布对c-Myc诱导小鼠肝细胞癌模型肝脏组织的病理学影响Fig 2的HE染色结果显示,WT小组小鼠组织结构清晰,细胞核清晰且均匀分布,胞浆丰富;c-Myc模型组小鼠肝脏组织结构被破坏,细胞核排列紧密且分布散乱(多核、固缩),几乎不见胞质;c-Myc-Cele-L和c-Myc-Cele-H小鼠肝脏组织病变减轻,细胞结构较清晰,细胞核变小、多核细胞明显减少,肝细胞内充满少量胞质,且c-Myc-Cele-H组肿瘤病变区域外可见正常组织区域。
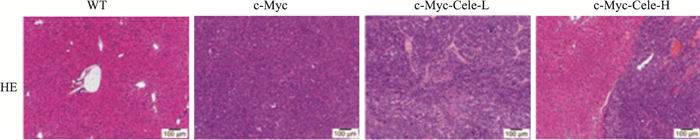
|
| Fig 2 Effect of celecoxib on pathological changes of liver tissues(scale bar=100 μm) |
Ki67在多种恶性肿瘤中呈过表达现象。其与细胞有丝分裂密切相关,是评价肿瘤细胞是否异常增殖的有效指标。Fig 3的Ki67免疫组化染色结果显示,与WT比较,c-Myc模型组可见大量细胞核Ki67阳性染色;与c-Myc模型组相比,c-Myc-Cele-L和c-Myc-Cele-H组Ki67阳性染色明显减少,并且呈现一定的剂量效应关系。
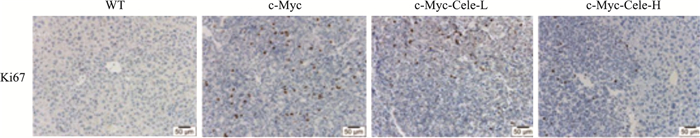
|
| Fig 3 Effect of celecoxib on distribution of Ki67 by immunohistochemistry(scale bar=50 μm) |
在c-Myc诱导小鼠肝细胞癌模型中,c-Myc对肝细胞癌的发生和发展具有重要影响,因此我们检测了小鼠肝脏中c-Myc的表达。如Fig 4所示,c-Myc组小鼠肝脏组织中c-Myc蛋白表达与WT组比较明显增高(P < 0.01, P < 0.01);与c-Myc组小鼠相比,塞来昔布干预后(c-Myc-Cele-L和c-Myc-Cele-H)小鼠肝脏组织中c-Myc表达量明显降低(P < 0.05, P < 0.01)。
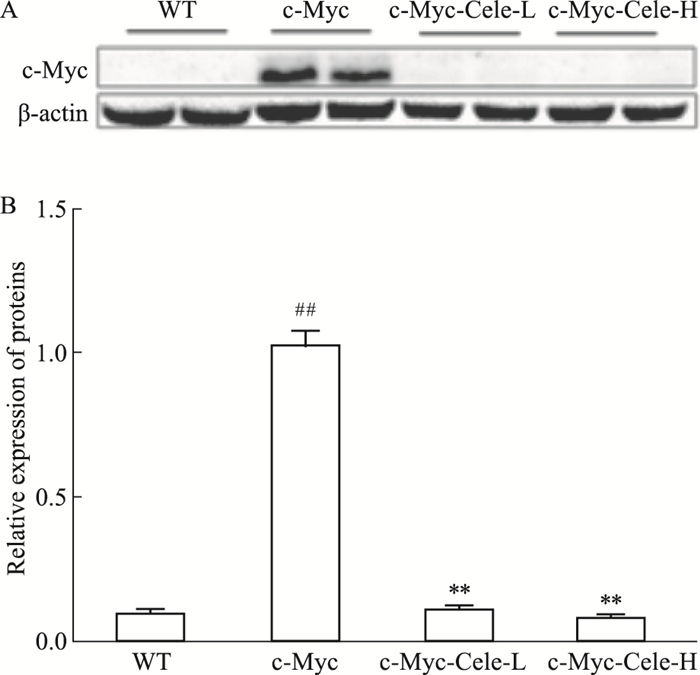
|
| Fig 4 Effect of celecoxib on expression of c-Myc protein in mouse liver tissues(x ± s, n=7) ##P < 0.01 vs WT; **P < 0.01 vs c-Myc |
如Fig 5所示,与WT相比,c-Myc组小鼠肝脏组织中p-Akt T308、p-Akt S473、p-4EBP1蛋白表达明显增高(P < 0.05);与c-Myc组相比,塞来昔布干预后(c-Myc-Cele-L和c-Myc-Cele-H)小鼠肝脏组织中上述蛋白表达量均明显降低(P < 0.01)。
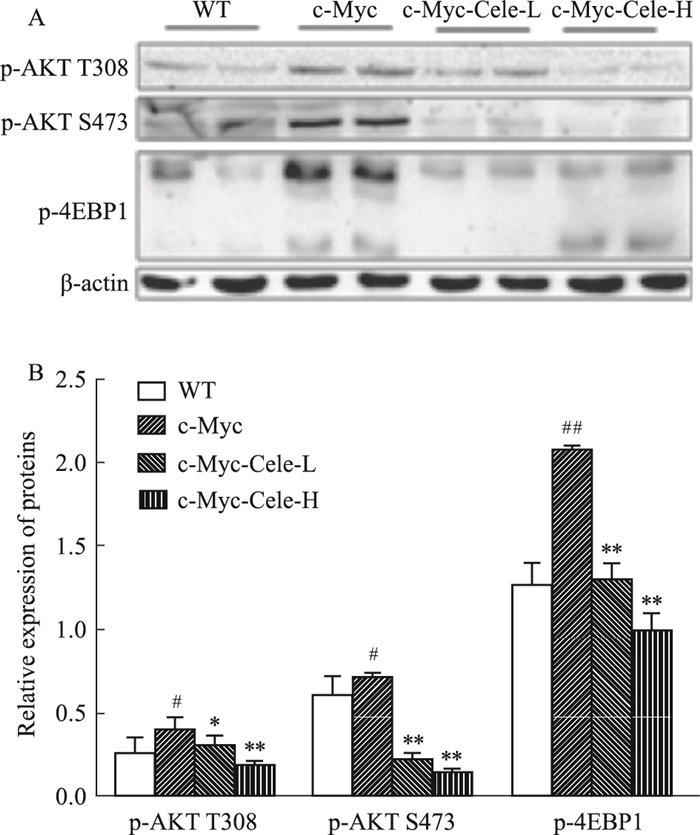
|
| Fig 5 Effect of celecoxib on expression of p-Akt T308, p-Akt S473 and p-4EBP1 in mouse liver tissues(x ± s, n=7) #P < 0.05, ##P < 0.01 vs WT, *P < 0.05, **P < 0.01 vs c-Myc |
HCC是一种高致死率的肿瘤,其发病率逐渐上升,目前仍缺乏有效的治疗方法。因此,迫切需要寻找新的治疗手段来治疗肝细胞癌。塞来昔布临床上主要用于缓解骨关节炎、类风湿关节炎以及成人急性疼痛等,近年来研究显示其具有强大的抗肿瘤活性。Liu等[13]发现,塞来昔布能够抑制IL-6/IL-6受体诱导的人肝细胞癌的JAK2/STAT3磷酸化。Tang等[14]研究表明,塞来昔布可以通过阻滞细胞周期抑制肝细胞癌的发展。但塞来昔布对肝细胞癌的作用及其机制仍有待进一步研究。本研究采用高压尾静转染技术在小鼠体内过表达c-Myc,能激活Akt/mTORC1信号通路,并在6~7周迅速形成肝细胞癌模型[15]。该造模方法具有成模率高、造模周期短等特点,并已广泛运用于多种肝脏疾病的研究。结果表明,塞来昔布干预能够明显的减少c-Myc诱导小鼠的肝重和肝脏指数。说明塞来昔布能够延缓c-Myc诱导小鼠肝细胞癌发展。
为进一步明确塞来昔布对c-Myc诱导小鼠肝细胞癌的作用,我们通过HE和IHC检测塞来昔布对小鼠肝细胞癌的影响。结果显示,在HE染色中,c-Myc诱导小鼠肝脏组织病变明显,细胞核排列紧密且分布散乱(多核、固缩),几乎不见胞质;塞来昔布干预后上述现象明显改善,且高剂量组肿瘤病变区域外可见正常组织区域。IHC实验中,c-Myc诱导小鼠肝脏组织肿瘤区增殖标记物Ki67表达水平明显升高,塞来昔布干预后Ki67表达水平下降。提示塞来昔布可能通过抑制c-Myc诱导小鼠肝细胞癌的增殖来延缓肝细胞癌的发展,但其抑制小鼠肝细胞癌异常增殖的作用机制并不清楚。
肿瘤细胞的异常增殖不仅受细胞生长信号的影响,它还通过影响细胞生长周期和细胞凋亡等方式来避免细胞进入最终的分化过程。c-Myc是一种多功能核磷蛋白,属于碱性螺旋环螺旋亮氨酸拉链家族, 通过调控细胞的生长等影响肝细胞癌的发生与发展。研究表明,抑制c-Myc的表达可抑制肝细胞癌细胞系(HCC-9204、HepG2等)的增殖。Akt在细胞的存活和凋亡中起着重要作用,p-Akt T308、p-Akt S473是Akt的活性形式。Akt的活化可以激活其主要下游靶点mTORC1。mTORC1是细胞生长、代谢和生存的主要调节因子。mTORC1的激活可以磷酸化真核细胞翻译起始子4E结合蛋白1(e IF4E-binding protein 1,4EBP1),从而调节蛋白合成,影响肿瘤异常增殖。本研究Western blot结果显示,c-Myc诱导小鼠肝脏中c-Myc、p-Akt T308、p-Akt S473、p-4EBP1蛋白的表达量明显升高,说明c-Myc以及Akt/mTORC1信号通路在肝细胞癌模型中被激活,与文献报道一致。塞来昔布可以抑制该模型小鼠肝脏组织中c-Myc、p-Akt T308、p-Akt S473、p-4EBP1蛋白的表达水平。以上结果说明,塞来昔布可能通过调控c-Myc和Akt/mTORC1信号通路来抑制小鼠肝细胞癌的增殖。
综上所述,塞来昔布能通过抑制c-Myc诱导的小鼠肝细胞癌的增殖来延缓肝细胞癌的发展,其作用机制可能与塞来昔布能调控c-Myc和Akt/mTORC1信号通路有关。本研究通过c-Myc诱导的小鼠肝细胞癌模型阐明了塞来昔布对肝细胞癌新的作用机制,为肝细胞癌的预防与治疗提供了新的思路。
| [1] |
Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. doi:10.3322/caac.21262 |
| [2] |
Cheng A L, Kang Y K, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. doi:10.1016/S1470-2045(08)70285-7 |
| [3] |
Shachaf C M, Kopelman A M, Arvanitis C, et al. MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular cancer[J]. Nature, 2004, 431(7012): 1112. doi:10.1038/nature03043 |
| [4] |
Yuen M F, Wu P C, Lai V C, et al. Expression of c-Myc, c-Fos, and c-jun in hepatocellular carcinoma[J]. Cancer, 2015, 91(1): 106-12. |
| [5] |
Pellegrino R, Calvisi D F, Neumann O, et al. EEF1A2 inactivates p53 via PI3K/Akt/mTOR-dependent stabilization of MDM4 in hepatocellular carcinoma[J]. Hepatology, 2014, 59(5): 1886. doi:10.1002/hep.26954 |
| [6] |
王坦, 张艳群, 曾永联, 等. 白藜芦醇抑制人肝癌SMMC-7721细胞增殖并降低mTOR蛋白磷酸化水平[J]. 中国药理学通报, 2017, 33(9): 1309-14. Wang T, Zhang Y Q, Zeng Y L, et al. Resveratrol inhibits proliferation and decreases mTOR protein phosphorylation in human hepatoma SMMC-7721 cells[J]. Chin Pharmacol Bull, 2017, 33(9): 1309-14. doi:10.3969/j.issn.1001-1978.2017.09.023 |
| [7] |
Zhang H, Li Z, Wang K. Combining sorafenib with celecoxib synergistically inhibits tumor growth of non-small cell lung cancer cells in vitro and in vivo[J]. Oncol Rep, 2014, 31(4): 1954-60. doi:10.3892/or.2014.3026 |
| [8] |
Chiang S L, Velmurugan B K, Chung C M. Preventive effect of celecoxib use against cancer progression and occurrence of oral squamous cell carcinoma[J]. Sci Rep, 2017, 7(1): 6235. doi:10.1038/s41598-017-06673-3 |
| [9] |
Wang G, Li J, Zhang L, et al. Celecoxib induced apoptosis against different breast cancer cell lines by down-regulated NF-kappaB pathway[J]. Biochem Biophys Res Commun, 2017, 490(3): 969-76. doi:10.1016/j.bbrc.2017.06.148 |
| [10] |
Krysan K, Kusko R, Grogan T, et al. PGE2-driven expression of c-Myc and oncomiR-17-92 contributes to apoptosis resistance in NSCLC[J]. Mol Cancer Res, 2014, 12(5): 765-74. doi:10.1158/1541-7786.MCR-13-0377 |
| [11] |
Xia J J, Pei L B, Zhuang J P, et al. Celecoxib inhibits beta-catenin-dependent survival of the human osteosarcoma MG-63 cell line[J]. J Int Med Res, 2010, 38(4): 1294-304. doi:10.1177/147323001003800411 |
| [12] |
Kucab J E, Lee C, Chen C S, et al. Celecoxib analogues disrupt Akt signaling, which is commonly activated in primary breast tumours[J]. Breast Cancer Res, 2005, 7(5): R79-807. |
| [13] |
Liu Y, Liu A, Li H, et al. Celecoxib inhibits interleukin-6/interleukin-6 receptor-induced JAK2/STAT3 phosphorylation in human hepatocellular carcinoma cells[J]. Cancer Prev Res (Phila), 2011, 4(8): 1296-305. doi:10.1158/1940-6207.CAPR-10-0317 |
| [14] |
Tang T, Poon R, Guan X, et al. Celecoxib suppresses the HCC development via the cell cycle arrest[J]. Cancer Res, 2005, 65. |
| [15] |
Liu P, Ge M, Hu J, et al. A functional mTORC1 signaling is indispensable for c-Myc driven hepatocarcinogenesis[J]. Hepatology, 2017, 66(1): 167. |

