

2. 衡阳市中医医院肾病科, 湖南 衡阳 421001;
3. 中医方证研究转化医学湖南省重点实验室, 湖南 长沙 410208
田雪飞(1973-), 男, 博士, 教授, 博士生导师; 研究方向:中西医结合防治肿瘤, 通信作者, E-mail:003640@hnucm.edu.cn
 ,
LI Zheng-yang1,
REN Ting1,
TONG Qiao-zhen1,
HUANG Zheng-de1,
HUANG Xin-yan2
,
LI Zheng-yang1,
REN Ting1,
TONG Qiao-zhen1,
HUANG Zheng-de1,
HUANG Xin-yan2
 ,
TIAN Xue-fei1,3
,
TIAN Xue-fei1,3

2. Nephropathy Dept, Hengyang Hospital of Traditional Chinese Medicine, Hengyang, Hunan 421001, China);
3. Hunan Key Lab of TCM Prescription and Syndromes Translational Medicine, Changsha 410208, China
《中国心血管病报告2017》指出,预计到2030年以后,冠心病有可能成为人类死亡的首位原因,严重危害人类的健康,因此,积极有效地防治冠心病尤为重要[1]。冠心病的主要症状是心绞痛,主要是由心肌缺血、缺氧引起的发作性胸痛或胸部不适。心肌缺血再灌注损伤的分子机制是非常复杂的,包括氧化应激、细胞内Ca2+超载、再灌注后生理PH的不稳定、线粒体通透性增加导致的炎症加重等等都可以引发缺血再灌注损伤(ischemia/reperfusion injury, IRI)[2]。
微小RNA(microRNA,miRNA)广泛参与调控多种细胞功能,是一类高度保守的长度约为18~25个核苷酸的单链非编码RNA,通过多种机制(如mRNA切割和翻译抑制)参与功能基因的转录后调控[3-4]。其中,miRNA-21(miR-21)表现出抗凋亡作用,在心、肾等组织中的抗凋亡作用更为明显[5]。最新研究发现,miR-21在缓解心肌梗死[6]、心肌缺血再灌注[7, 8]等多种心血管疾病中发挥积极作用。目前miR-21联合中医药治疗心肌IRI的报道较少。本研究将通过在心肌细胞中转染miR-21促进其表达,并与加味丹参饮含药血清共孵育,以进一步研究加味丹参饮对心肌细胞的保护机制。
1 材料与方法 1.1 研究对象H9C2心肌细胞购于中国科学院细胞库;SD大鼠,♂,8~10周,体质量(200±20)g,40只,湖南中医药大学实验动物中心提供,许可证号:SCXK(湘)2016-0002。
1.2 试剂和药物胰酶,DMEM,胎牛血清,青霉素链霉素双抗,均购于GIBCO;加味丹参饮(Jia Wei Dan Shen Yin, JWDSY),购于湖南中医药大学第一附属医院药剂科;MTT(货号:PAB180013)购自bioswamp公司;大鼠心肌肌钙蛋白I(cTNI)检测试剂盒(货号:RA20647)购自bioswamp公司;AnnexinV-PE/7 AAD凋亡检测试剂盒(货号:559763)购自BD公司;PTEN兔单克隆抗体、Akt兔单克隆抗体均购于Abcam公司;反转录试剂盒、荧光定量试剂盒,购于东洋纺生物科技有限公司;pGC-FU-micro RNA-21-GFP载体购于上海吉凯基因化学有限公司;感染试剂Polyethylenimine(PEI)购自Polysciences;TRIzol提取总RNA试剂购于Invitrogen;感受态细胞购于北京庄盟。
1.3 仪器多功能酶标仪(瑞士Tecan公司产品);荧光定量PCR仪(美国Applied Biosystems公司产品);凝胶成像仪(美国Amersham Imager公司产品);电子显微镜(德国蔡司公司);二氧化碳培养箱(美国赛默飞世尔公司)。
1.4 实验方法 1.4.1 慢病毒表达载体构建采用直接合成的方法获得目的基因序列(TGTACCACCTTGTCGGGTAGCTTATCAGACTGATGTTGACTGTTGAATCTCAT-G GCAACAGCAGTCGATGGGCTGTCTGACATTTTGG-TATC),上下游分别加酶切位点Xba I、BamH I。将载体经双酶切后,在T4 DNA连接酶作用下,与双链DNA oligo于4 ℃ 12 h连接反应制备克隆连接液,转化stlb3感受态细胞后进行阳性克隆PCR鉴定。
1.4.2 病毒包装稳定转染细胞293T细胞密度为5×108 cells/孔,接种于D60 mm培养皿中,37 ℃、5% CO2培养箱内培养。质粒与PEI转染试剂1 :3且加入200 μL培养基(DMEM+10%FBS,无双抗)混合均匀,室温下温育10 min。期间293T细胞换液(DMEM+10% FBS,无双抗),再取200 μL培养基(DMEM+10%FBS,无双抗)与上述质粒混合物混匀,将质粒混合液滴入293T细胞的培养液中,混匀,于37 ℃、5% CO2细胞培养箱中培养。培养8 h后倒去含有感染混合物的培养基,换入正常培养基(DMEM+10% FBS+1%双抗)于37 ℃、5% CO2培养箱内继续培养,48 h和72 h收集感染后293T细胞上清液,0.45 μm滤器过滤上清液即病毒,收集好的病毒感染H9C2细胞。
1.4.3 H9C2心肌细胞IRI模型的建立H9C2心肌细胞于不含抗生素及血清的DMEM培养基中培养,置于37℃,CO2-O2-N2(3 :2 :95)缺氧环境细胞培养箱中培养10 h,然后再于O2-CO2(95 :5)有氧正常环境培养箱中培养2 h,随后将细胞取出进行后续实验。
1.4.4 含药血清的制备取40只SD大鼠随机分为空白组和药物组,分别灌胃用以制备空白血清和药物血清。药物组用加味丹参饮灌胃获得含药血清,5.94 g·kg-1,每日2次,连续灌胃3 d。空白组用等量生理盐水灌胃获得空白血清。均于最后1次给药后1 h,无菌条件下,真空采血管腹主动脉取血,分离血清冷冻备用。
1.4.5 实验分组(1) 空白组(Control):正常H9C2心肌细胞。(2)模型组(Model group):经IRI造模后的H9C2心肌细胞,与空白血清共孵育24 h。(3)miR-21组(miR-21 group):将pGC-FU-micro RNA-21-GFP慢病毒载体转染入H9C2心肌细胞后进行IRI造模,加入空白血清共孵育24 h。(4)JWDSY组(JWDSY group):将pGC-FU-micro RNA-21-GFP慢病毒载体转染入H9C2心肌细胞后进行IRI造模,加入加味丹参饮含药血清共孵育24 h。
1.4.6 检测方法电镜观察细胞超微结构的影响各组细胞于室温下以PBS清洗2~3次,4 ℃ 2 000 r·min-1离心15 min手机细胞。用2.5%戊二醛溶液固定4 h;PBS清洗,用1%锇酸溶液处理2 h;细胞移至EP管中,PBS清洗,乙醇梯度脱水,再以丙酮、环氧树脂812包埋剂处理,半薄切片定位、超薄切片(厚度约60 nm),经饱和醋酸铀溶液避光染色、水洗、烘干后再用枸橼酸铅避光染色,双蒸水洗去多余铅液,滤纸吸干后,于透射电子显微镜下观察心肌细胞超微结构并拍照。
ELISA检测心肌损伤指标取各组大鼠腹主动脉血,装入离心管,离心机3 000 r·min-1离心15 min后,取血清置于1.5 mL离心管中。采用ELISA法检测cTnI水平。
流式细胞术检测心肌细胞凋亡各组细胞用不含EDTA的胰蛋白酶消化各组细胞并得到单细胞悬液,PBS洗2次后,收集(1~5)×105个细胞,加入500 μL结合缓冲液悬浮细胞,之后分别加入5 μL annexinV-FITC及5 μL PI混匀,室温避光反应5~15 min,流式细胞术检测细胞凋亡,具体操作步骤按说明书进行。
蛋白免疫印迹实验检测PTEN、P-Akt蛋白的表达量细胞蛋白提取后,经BCA蛋白浓度测定试剂盒测定蛋白浓度,凝胶电泳分离后将蛋白转移到SDS-PAGE膜上,5%脱脂奶粉封闭,进行一抗过夜孵育,再用辣根过氧化物酶偶联抗兔IgG进行二抗孵育,ECL发光液进行显影分析。
1.5 统计学处理统计学分析采用SPSS 17.0统计软件进行数据处理,所得结果表示为x±s,两组间比较采用独立样本t检验,多组间比较采用One-way ANOVA(方差)分析。
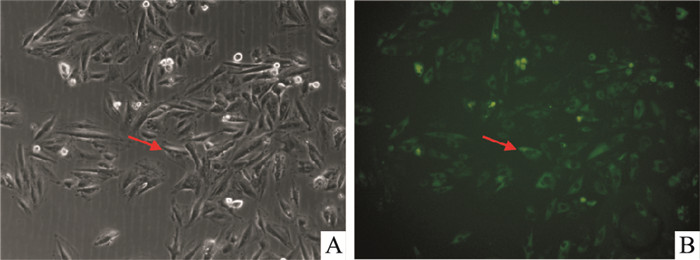
2 结果 2.1 慢病毒感染H9C2细胞在荧光显微镜下观察转染48后荧光表达情况,可以观察到绿色荧光,慢病毒载体成功转染H9C2细胞。见Fig 1。
|
| Fig 1 Green fluorescent signal of H9C2 cells infected by lentivirus(×40) (H9C2 cells had adhered to the wall, and their morphology changed from round to columnar, spindle and polygonal. The expression of green fluorescence was obvious under fluorescence inversion microscope.) |
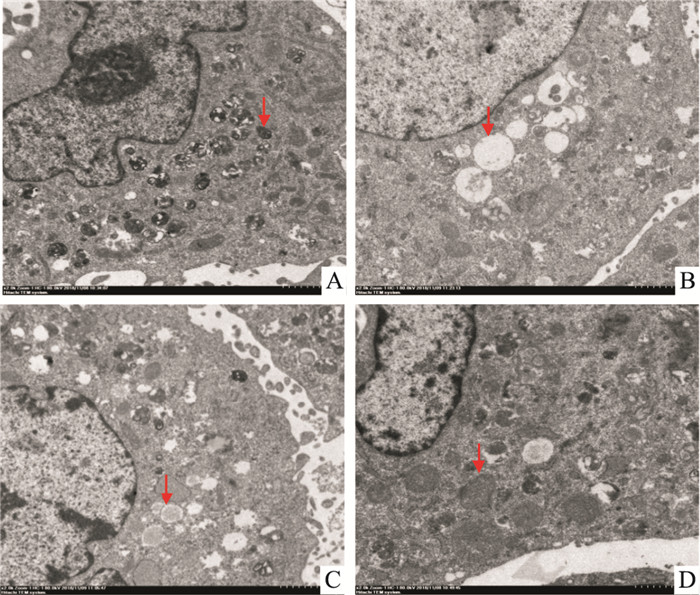
Fig 2透射电镜观察结果显示,空白组正常H9C2细胞的超微结构清晰,细胞膜完整,线粒体包膜完整,细胞结构正常。模型组细胞有明显损伤表现,造模成功,线粒体肿胀,空泡化,边界模糊不清;miR-21组与模型组比较,细胞损伤有所减轻,JWDSY组损伤减轻的程度更为明显,部分线粒体肿胀,细胞膜完整,大部分线粒体结构清晰,空泡化程度明显减轻,提示miR-21联合加味丹参饮对细胞IRI有明显的保护作用。
|
| Fig 2 Effect of JWDSY combined with miR-21 on ultrastructure of myocardial cells(×50 000) A. Cell ultrastructure was clear; B. Mitochondrial swelling, vacuolation, blurred boundary; C. Mitochondrial swelling was reduced; D. Ultrastructure was clear, and the degree of vacuolation was significantly reduced. |
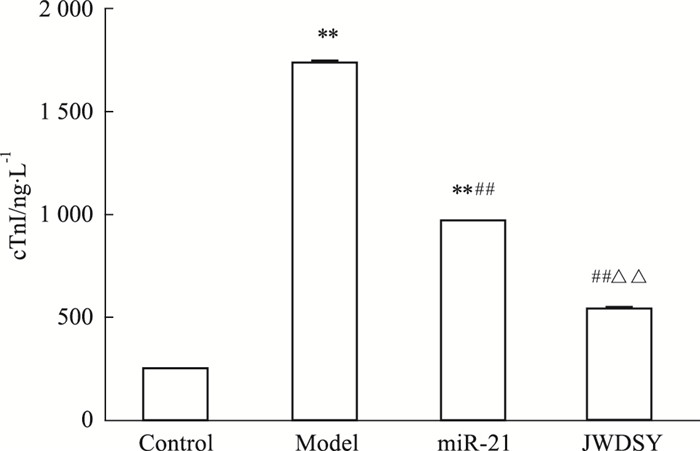
ELISA法检测各组细胞cTnI表达,结果显示,与空白组比较,模型组细胞中cTnI升高,差异有统计学意义(P<0.01);与模型组比较,miR-21组和JWDSY组中细胞cTnI水平均降低,差异均有统计学意义(P<0.01),且JWDSY组cTnI降低更为明显。各组cTnI水平检测结果见Fig 3。
|
| Fig 3 Effect of miR-21 combined with JWDSY on expression of cTnI in cardiomyocytes(x±s, n=3) **P < 0.01 vs control; ##P < 0.01 vs model; △△P < 0.01 vs miR-21 |
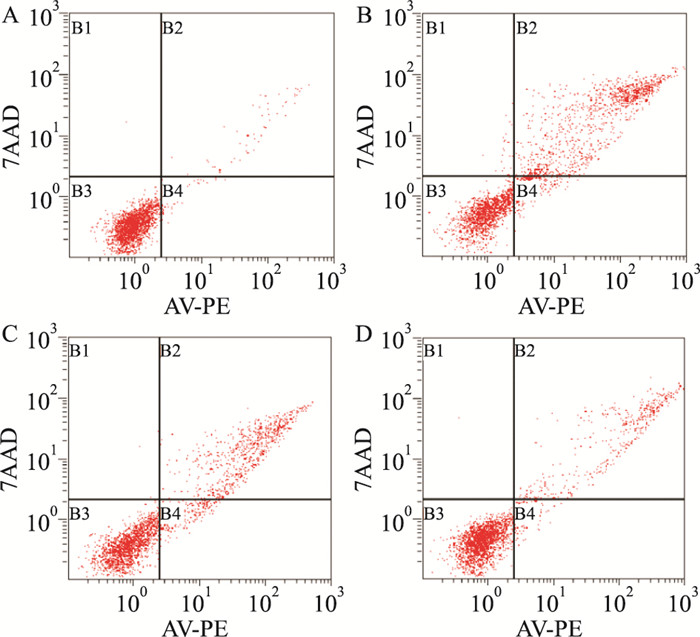
根据流式细胞凋亡检测结果显示,与空白组比较,模型组细胞凋亡率明显升高,差异有统计学意义(P<0.05);与模型组比较,miR-21组和JWDSY组细胞凋亡率均下降,差异有统计学意义(P<0.05),且JWDSY组下降程度更为明显。各组细胞的凋亡情况见Fig 4,凋亡率检测结果见Tab 1。
|
| Fig 4 Effect of miR-21 combined with JWDSY on apoptosis of myocardial cells (x±s, n=3) |
| Group | Apoptotic rate/% |
| Control | 2.56±0.13 |
| Model | 36.79±2.16* |
| miRNA-21 | 26.43±1.10*# |
| JWDSY | 14.65±1.07△#* |
| *P<0.05 vs control; #P<0.05 vs model; △P<0.05 vs miR-21 | |
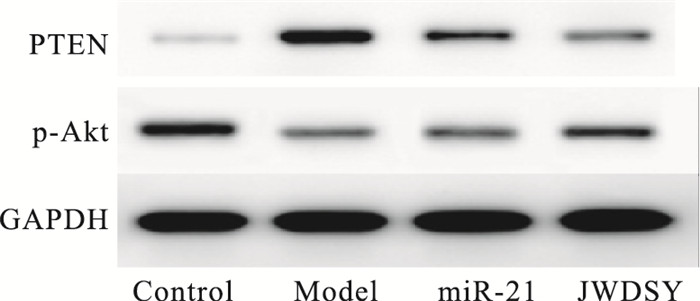
经Western blot分析,IRI处理后H9C2细胞的PTEN蛋白表达增强,P-Akt蛋白表达减弱,miR-21组恢复这种异常表达,进而加入含药血清的JWDSY组,又进一步降低了PTEN的表达,同时升高了P-Akt的表达。差异具有统计学意义(P<0.05),见Fig 5,Tab 2。
|
| Fig 5 Effect of miR-21 combined with JWDSY on expression of PTEN and P-Akt(x±s, n=3) |
| Group | PTEN/GAPDH | p-Akt/GAPDH |
| Control | 0.221±0.017 | 0.625±0.033 |
| Model | 0.662±0.031* | 0.343±0.027* |
| miRNA-21 | 0.461±0.023# | 0.390±0.015# |
| JWDSY | 0.338±0.019△ | 0.511±0.021△ |
| *P<0.05 vs control; #P<0.05 vs model; △P<0.05 vs miR-21 | ||
缺血性心肌病随着发病率逐年上升,如何有效防治一直是研究的热点,中医药对本病的防治有一定优势。加味丹参饮是湖南省名中医黄政德治疗缺血性心肌病的经验方,由清代陈念祖《时方歌括》中的丹参饮化裁而来。临床观察结果表明,加味丹参饮对冠心病心绞痛疗效显著,可以迅速缓解心前区疼痛的症状[9]。实验表明加味丹参饮对IRI大鼠心肌有明显的延迟保护作用[10];其含药血清可通过增强细胞自噬对IRI心肌细胞发挥保护作用[11-12]。
MicroRNA广泛参与了体内多种生理、病理过程,可影响各类心血管疾病的发生、发展,如心肌肥大、心肌纤维化、心肌梗死等[13]。miR-21在心血管系统中高度表达,若其过表达可减轻缺血缺氧所导致的心肌细胞凋亡和损伤,是缓解心肌损伤以及治疗缺血性心脏病等心血管疾病的重要干预靶点[14]。本研究即是探讨加味丹参饮结合miR-21在调控PTEN/Akt信号通路对大鼠心肌细胞的影响。
本研究结果表明,通过转染过表达miR-21,可以抑制心肌细胞的凋亡,减轻细胞线粒体的损伤,对心肌有保护作用。其机制通过Western blot分析发现,IRI组PTEN表达升高,P-Akt表达减少。早期的研究结果表明[15],激活PI3K/Akt信号通路对缺血性心肌细胞有保护作用,可以抑制心肌细胞的凋亡。miR-21是PTEN的调控基因,当miR-21升高时,PTEN降低,可以激活PI3K/Akt信号通路保护心肌细胞。因此,相对于模型组,在miR-21组中线粒体损伤程度减轻,心肌细胞损伤指标cTnI漏出减少,PTEN降低,P-Akt表达增多,心肌细胞凋亡有所减轻,而在miR-21过表达且加入了加味丹参饮含药血清干预时,电镜观察可见细胞空泡化明显减少,PTEN进一步降低,P-Akt表达显著升高,心肌细胞凋亡减轻更为明显。
综上所述,外源性miR-21与加味丹参饮联用时,可以有效保护IRI心肌细胞,其机制可以是通过抑制PTEN表达从而激活PI3K/Akt信号通路有关。然而,若要将治疗性MicroRNA快速转运至患者心肌细胞,药物递送方式会受到很多因素的限制,目前尚不能在临床治疗中广泛应用。因此,探索如何将MicroRNA运送至患者心肌细胞,发挥保护心肌的作用,是防治缺血性心肌病的新思路。
| [1] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2018, 33(1): 1-8. Chen W W, Gao R L, Liu L S, et al. Summary of China Cardiovascular Disease Report 2017[J]. Chin Circ J, 2018, 33(1): 1-8. |
| [2] |
Jaime González-Montero, Roberto Brito, Abraham IJ Gajardo, et al. Myocardial reperfusion injury and oxidative stress:Therapeutic opportunities[J]. World J Cardiol, 2018, 10(9): 74-86. doi:10.4330/wjc.v10.i9.74 |
| [3] |
Niu Y W, Wang G H, Yan G Y, et al. Integrating random walk and binary regression to identify novel miRNA-disease association[J]. BMC Bioinformatics, 2019, 20: 59. doi:10.1186/s12859-019-2640-9 |
| [4] |
Gracjan Michlewski, Javier F. Post-transcriptional control of miRNA biogenesis[J]. RNA, 2019, 25(1): 1-16. doi:10.1261/rna.068692.118 |
| [5] |
Song N N, Zhang T, Xu X L, et al. miR-21 protects against ischemia/reperfusion-induced acute kidney injury by preventing epithelial cell apoptosis and inhibiting dendritic cell maturation[J]. Front Physiol, 2018, 9: 790. doi:10.3389/fphys.2018.00790 |
| [6] |
Yang L S, Wang B, Zhou Q Q, et al. MicroRNA-21 prevents excessive inflammation and cardiac dysfunction after myocardial infarction through targeting KBTBD7[J]. Cell Death Dis, 2018, 9(7): 769. doi:10.1038/s41419-018-0805-5 |
| [7] |
Huang S, Lin Y L, Liang Z B, et al. Erythropoietin helix B surface peptide modulates miR-21/Atg12 axis to alleviates cardiomyocyte hypoxia-reoxygenation injury[J]. Am J Transl Res, 2019, 11(4): 2422-30. |
| [8] |
Shen H, Yao Z F, Zhao W P, et al. miR-21 enhances the protective effect of loperamide on rat cardiomyocytes against hypoxia/reoxygenation, reactive oxygen species production and apoptosis via regulating Akap8 and Bard1 expression[J]. Exp Ther Med, 2019, 17(2): 1312-20. |
| [9] |
吴若霞, 黄政德, 谢雪姣, 等. 黄政德教授治疗冠心病心绞痛临床经验[J]. 湖南中医药大学学报, 2015, 35(4): 33-5. Wu R X, Huang Z D, Xie X J, et al. Professor Huang Zhengde's clinical experience in treating coronary heart disease and angina[J]. J Hunan Univ Tradit Chin Med, 2015, 35(4): 33-5. |
| [10] |
任婷, 饶春梅, 成细华, 等. 加味丹参饮对大鼠心肌缺血再灌注损伤SSAT活性的影响[J]. 中国中医药信息杂志, 2017, 24(7): 62-5. Ren T, Rao C M, Cheng X H, et al. Effects of Jiawei Danshen Yin on SSAT activity in rats with myocardial ischemia-reperfusion injury[J]. Chin J Inf Tradit Chin Med, 2017, 24(7): 62-5. doi:10.3969/j.issn.1005-5304.2017.07.015 |
| [11] |
吴若霞, 汪云鑫, 陈辉, 等. 加味丹参饮含药血清诱导BMSCs移植IRI大鼠对心肌bFGF的影响[J]. 中国实验方剂学杂志, 2013, 19(13): 238-42. Wu R X, Wang Y X, Chen H, et al. Effects of BMSCs transplantation into IRI rats induced by Jiawei Danshen Yin containing serum[J]. Chin J Exp Tradit Med Form, 2013, 19(13): 238-42. |
| [12] |
饶春梅, 成细华, 任婷, 等. 加味丹参饮含药血清对缺氧/复氧H9C2心肌细胞自噬相关蛋白LC3Ⅱ及Beclin1表达的影响[J]. 中医杂志, 2017, 58(12): 10438. Rao C M, Cheng X H, Ren T, et al. Effect of serum containing Jiawei Danshen Yin on expression of autophagy-related protein LC3II and Beclin1 in hypoxic/reoxygenated H9C2 cardiomyocytes[J]. J Tradit Chin Med, 2017, 58(12): 1043-8. |
| [13] |
秦润禾, 陶辉, 倪世豪, 等. microRNA-200b下调DNMT3A的表达对SD大鼠心肌纤维化抑制作用的机制研究[J]. 中国药理学通报, 2018, 34(10): 1465-70. Qin R H, Tao H, Ni S H, et al. The mechanism of down-regulation of DNMT3A expression on myocardial fibrosis in SD rats[J]. Chin Pharmacol Bull, 2018, 34(10): 1465-70. doi:10.3969/j.issn.1001-1978.2018.10.027 |
| [14] |
郭显, 史承勇, 王文生, 等. 微RNA-21通过激活沉默信息调控因子1信号通路缓解多柔比星心肌毒性[J]. 第二军医大学学报, 2019, 40(4): 386-93. Guo X, Shi C Y, Wang W S, et al. MicroRNA-21 alleviates doxorubicin myocardial toxicity by activating silent information regulator 1 signaling pathway[J]. Acad J Second Military Med Univ, 2019, 40(4): 386-93. |
| [15] |
吴若霞, 李鑫辉, 廖菁, 等. 柴胡疏肝散联合BMSCs移植对AMI大鼠心肌细胞PI3K/Akt、GSK-3β信号通路的影响[J]. 中医药导报, 2015, 21(15): 15-8, 22. Wu R X, Li X H, Liao J, et al. Effects of Chaihu Shugan San combined with BMSCs transplantation on PI3K/Akt and GSK-3beta signaling pathways in myocardial cells of AMI rats[J]. Guid J Tradit Chin Med Pharm, 2015, 21(15): 15-8, 22. |