


岑慧裕(1996-), 女, 本科生, 研究方向:分子靶标与临床药理学, 共同第一作者, E-mail:13682290501@163.com。
乳腺癌是女性最常见的恶性肿瘤,也是女性癌症相关死亡的第二大原因[1]。乳腺癌的标准治疗方法是手术切除、放疗和辅助化疗。阿霉素(doxorubicin, DOX)常作为一线化疗药物用于治疗乳腺癌[2]。目前,尽管开发出了疗效高、毒性小的化疗药物,但化疗耐药性仍是预后不良的主要原因。因此,了解阿霉素耐药的分子机制可能会改善临床治疗效果。在众多机制研究中,治疗诱导的自噬是抗肿瘤治疗的新机制[3]。
自噬是一个进化上保守的过程,其特征是通过细胞的降解和循环来形成新的细胞[4]。越来越多的证据表明,自噬有助于肿瘤化疗耐药的形成和各种压力下的癌细胞存活[3]。最近,自噬抑制剂被用来提高癌症对化疗的敏感性[3]。因此,自噬抑制剂联合治疗可能有助于提高乳腺癌细胞对化疗的敏感性。据报道,miRNAs可通过自噬调节化疗和放疗[3]。
MicroRNAs (miRNAs)是一类新的小分子非编码内源性RNAs,其长度为19~25个核苷酸[5]。miRNAs可以通过切割、破坏靶向mRNAs的稳定性或阻止其翻译,转录后负性调节靶基因的表达[5]。miR-142-3p最初在造血细胞中被鉴定,并作为T细胞急性淋巴细胞白血病的致癌标志物[6]。此外,miR-142-3p被广泛报道作为肿瘤抑制因子,参与到肿瘤发生、生长、侵袭等病理过程[7]。
高迁移率族蛋白1(high-mobility group box 1, HMGB1)是一种非组蛋白核DNA结合蛋白,属于高迁移率族蛋白超家族。HMGB1参与了DNA的组织和调节基因转录,在炎症、细胞分化和肿瘤细胞迁移等多种细胞过程中发挥作用[8]。同时,抑制HMGB1的表达可以破坏端粒稳态,抑制DNA损伤的修复,从而提高乳腺癌细胞的敏感性[8]。因此,HMGB1可能是促进乳腺癌化疗敏感性的关键基因。为了探讨miR-142-3p在自噬和促进乳腺癌化疗敏感性中的调节作用,我们研究了miR-142-3p在提高人乳腺癌细胞系MCF-7细胞化疗敏感性中的作用以及miR-142-3p与HMGB1之间的关系,本文将重点探讨miR-142-3p通过靶向HMGB1参与乳腺癌化疗敏感性调控的分子机制。
1 材料与方法 1.1 材料 1.1.1 细胞人乳腺癌细胞系MCF-7,购自中国科学院细胞库。
1.1.2 试剂阿霉素(货号:HZB1357)购于华中海威基因科技有限公司;DMEM培养基(货号:12491-015)、胎牛血清(货号:10099)购于美国Gibco公司;胰蛋白酶(货号:T2601)、青-链霉素溶液(货号:ZS507)、MTT(货号:M2128)、DMSO(货号:D2650)购自美国Sigma公司;GAPDH抗体(货号:TA-08)、抗兔二抗(货号:ZDR-5118)、抗鼠二抗(货号:ZDR-5117)购自北京中杉金桥;HMGB1抗体(货号:ABM24D3)、Atg5抗体(货号:EPR1755)购自Abcam公司;LC3抗体(货号:L8918)购自Sigma公司;Lipofectamine 2000(货号:11668027)、Trizol(货号:10296010)购自美国Invitrogen公司;荧光素酶报告试剂盒(货号:KA3714)购自美国Promege公司;Annexin V-FITC细胞凋亡检测试剂盒(货号:C1067S)购自碧云天生物公司, Quantitect®逆转录试剂盒(货号:204145)购自德国Qiagen公司。
1.1.3 仪器低温高速离心机(德国Hettich公司);垂直电泳槽、转膜仪(美国Bio-Rad公司);超净工作台(苏州仪器厂);CO2培养箱(Thermo);-80℃冰箱(Thermo Fisher Scientific Inc);酶标仪(美国加利福尼亚州森尼维尔市分子设备公司);Agilent StrataGene Mx3000P QPCR(Agilent Technologies);流式细胞仪(Becton Dickinson-Facsort)。
1.2 方法 1.2.1 细胞系以亲本MCF-7细胞(人乳腺癌细胞系)为材料,通过加入浓度逐渐升高的DOX处理细胞,建立阿霉素耐药的MCF-7细胞系MCF/DOX。所有细胞均用含有10% FBS和1%青-链霉素的DMEM,在5% CO2、37 ℃恒温培养箱中培养。MCF-7/DOX细胞在含1.0 mg·L-1 DOX培养液中培养,以维持MCF-7/DOX细胞耐药性。
1.2.2 MTT法用MTT法测定细胞存活率和细胞毒性。按照说明书操作。酶标仪测量490 nm处的吸光度值(OD值)。未经DOX处理的细胞作为对照。按公式:细胞存活率/%=OD处理/OD对照×100%, 求出各组的存活率,重复3次。计算并评价细胞存活率。
1.2.3 细胞凋亡测定采用Annexin V-FITC/PI双染联合流式细胞仪检测细胞凋亡情况。用胰蛋白酶消化1 μmol·L-1 DOX处理48 h后的各组细胞,收集细胞悬液并用PBS洗涤两次。每组加入5 μL Annexin V-FITC,4 ℃下避光孵育10 min,加入10 μL PI孵育10 min后,采用流式细胞仪读取各组凋亡率。
1.2.4 生物信息学预测和双荧光素酶报告分析在荧光素酶报告实验中,为了研究miR-142-3p是否调控HMGB1的表达,用QPCR方法从人类基因组DNA中扩增出含有miR-142-3p结合序列的HMGB1基因的3′UTR片段的野生型(WT)及其突变体(MT)并构建空白对照组(NC)。并将其插入PGL3荧光素酶载体中萤火虫荧光素酶基因的3′UTR中。然后通过Lipofectamine 2000将WT或MT-pgl3-HMGB1-3′UTR与miR-NC、miR-142-3p、anti-miR-NC或anti-miR-142-3p联合转染细胞。24 h后收集细胞,按照双荧光素酶报告分析试剂盒说明书,测定各组细胞中的荧光值。
1.2.5 细胞转染miR-142-3p mimics和相应阴性对照miRNA control、si-HMGB1、pcDNA-HMGB1和相应阴性对照(si-NC, pcDNA)的siRNA购自上海吉玛公司。将细胞接种到12孔板中,在5% CO2、37 ℃培养箱中培养24 h。随后,根据说明书使用Lipofectamine 2000对细胞进行转染,然后在5% CO2、37 ℃培养箱中孵育6 h。随后,用含有10% FBS的DMEM更换掉每孔中的培养基并孵育48 h。通过QPCR和Western blot测定转染率。
1.2.6 实时荧光定量PCR(QPCR)用TRIzol试剂提取总RNA。用Quantitect®逆转录试剂盒将500 ng的总RNA逆转录成cDNA。QPCR中使用的引物序列如下。取2 μL cDNA于实时荧光定量PCR仪按SYBR Green PCR Master Mix说明书进行QPCR,反应条件:95 ℃激活5 min,95 ℃ 15 s、60 ℃ 30 s,72 ℃ 1 min共50个循环。
| Name | Sequence(5′-3′) |
| HMGB1 Forward | GCTGACAAGGCTCGTTATGAA |
| HMGB1 Reverse | CCTTTGATTTTGGGGCGGTA |
| miR-142-3p Forward | TGCGGTGTAGTGTTTCCTACTT |
| miR-142-3p Reverse | CCAGTGCAGGGTCCGAGGT |
| GAPDH Forward | CCCTCAACGACCACTTTGTC |
| GAPDH Reverse | AGGGGAGATTCAGTGTGGTG |
用RIPA提取细胞总蛋白质,BCA液测定总蛋白质浓度,取等量的各组蛋白上样, 使用SDS-PAGE凝胶,在100 V恒压下电泳,250 mA恒流转膜,5%脱脂奶粉封闭1 h,一抗HMGB1(1 :5 000)、Agt5(1 :5 000)、LC3(1 :1 000)和GAPDH(1 :10 000)4 ℃孵育过夜,二抗孵育1 h,HRP化学发光液显色。
1.2.8 统计学分析采用SPSS12.0统计软件分析,实验数据用x±s表示,配对资料采用T检验。
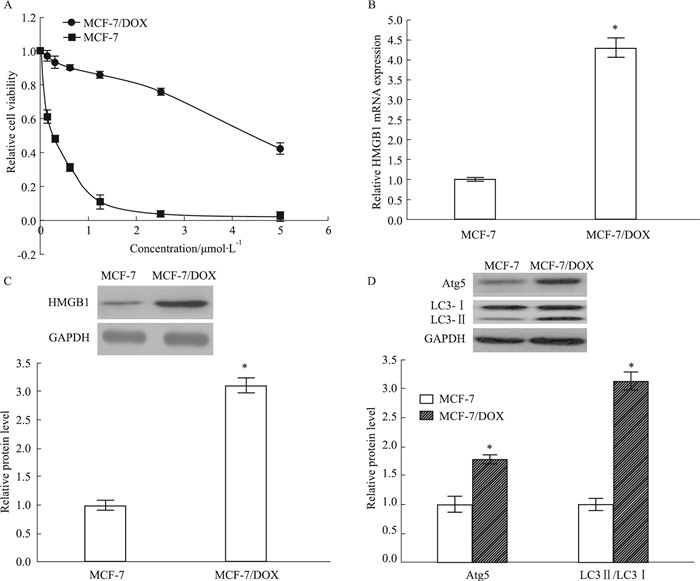
2 结果 2.1 MCF-7和MCF-7/DOX细胞的特性验证用不同浓度的DOX(0.1625、0.3125、0.625、1.25、2.5、5 μmol·L-1)处理MCF-7和MCF-7/DOX细胞48 h。Fig 1A的MTT结果显示, 与MCF-7/DOX细胞相比,MCF-7细胞对DOX的敏感性更高(P<0.05)。此外,用western blot和QPCR分别检测MCF-7和MCF-7/DOX细胞中HMGB1和自噬相关蛋白(Atg5、LC3-Ⅰ和LC3-Ⅱ)的水平,与MCF-7细胞相比,HMGB1在MCF-7/DOX细胞中的表达更高(P<0.05)(Fig 1B和C)。同时,MCF-7/DOX细胞中的自噬相关蛋白Atg5和LC3-Ⅰ转化产生的LC3-Ⅱ积累更明显(P<0.05)(Fig 1D)。综上所述,HMGB1和自噬可能与乳腺癌细胞耐药性的产生有关。
|
| Fig 1 Levels of HMGB1 and autophagy-related proteins in MCF-7/DOX and MCF-7 (x±s, n=3) A:Cell survival rates were detected by MTT assay in MCF-7 and MCF-7/DOX treated with various concentrations (0.1625, 0.3125, 0.625, 1.25, 2.5, 5 μmol· L-1) of DOX for 48 hours; B, C and D:The levels of HMGB1 and autophagy-related proteins (Atg5, LC3-Ⅰ and LC3-Ⅱ). (D) MCF-7 and MCF-7/DOX cells were detected by Western blot and QPCR, respectively. *P < 0.05 vs MCF-7 cells. |
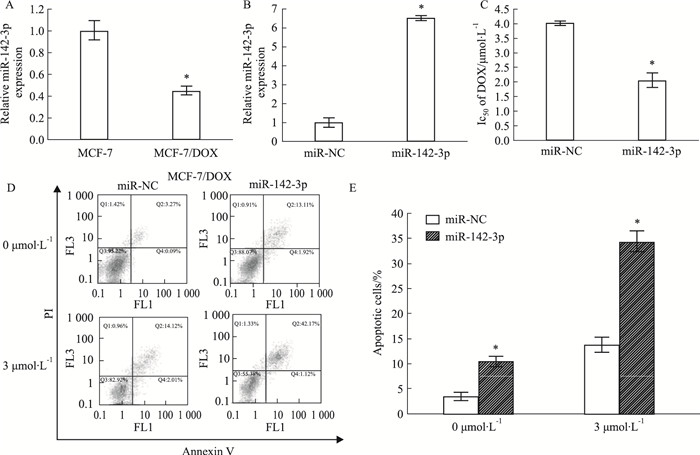
为了研究miR-142-3p在乳腺癌化疗耐药中的作用,我们用QPCR检测了MCF-7和MCF-7/DOX细胞中miR-142-3p的表达水平。Fig 2A的QPCR结果显示,与MCF-7细胞相比,MCF-7/DOX细胞中的miR-142-3p表达明显降低(P<0.05)。随后,我们用miR-142-3p mimics提高miR-142-3p在MCF-7/DOX细胞中的表达(Fig 2B)。此外,miR-142-3p mimics还可以提高MCF-7/DOX细胞对阿霉素的敏感性并且增强凋亡细胞比率(Fig 2C和D)(P<0.05)。上述结果表明,miR-142-3p的过表达可以提高MCF-7/DOX细胞对药物的敏感性。
|
| Fig 2 Effect of miR-142-3p on MCF-7 and MCF-7/DOX cells (x±s, n=3) A:QPCR analysis of the relative miR-142-3p expression in parental MCF-7 and DOX-resistant MCF-7/DOX cells. *P < 0.05 vs MCF-7 cells. B:QPCR analysis of relative miR-142-3p expression in MCF-7/DOX cells transfected with miR-142-3p mimic. *P < 0.05 vs miR-NC in MCF-7/DOX cells. C:MTT assay was applied to determine the IC50 value in miR-NC or miR-142-3P transfected MCF-7/DOX cells after treatment with different doses of DOX (0.1625, 0.3125, 0.625, 1.25, 2.5, and 5 μmol·L-1) for 48 h. *P < 0.05 vs miR-NC in MCF-7/DOX cells. D:Transfected MCF-7/DOX cells were treated with or without DOX for 48h, followed by the assessment of apoptotic rate by flow cytometry, respectively. *P < 0.05 vs miR-NC in MCF-7/DOX cells. E. The statitics of apoptotic cells. *P < 0.05 vs miR-NC in MCF-7/DOX cells. |
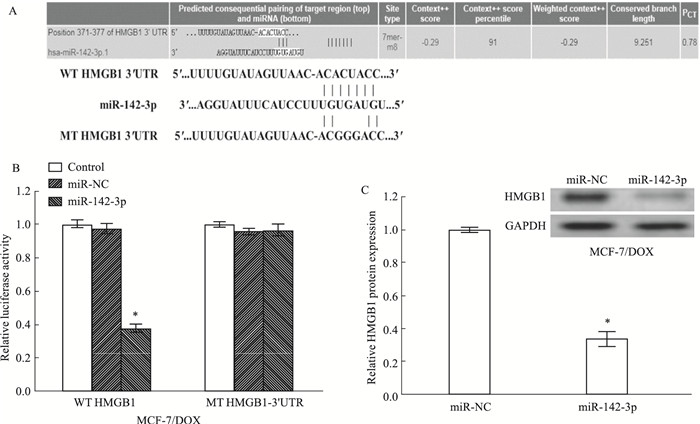
通过生物信息学分析结果显示,miR-142-3p可能靶向调控HMGB1(Fig 3A)。为了确定miR-142-3p是否可以直接靶向HMGB1,我们在MCF-7/DOX细胞中开展双荧光素酶报告基因实验。结果发现:在MCF-7/DOX细胞中,与Scramble组相比,miR-142-3p mimics能够抑制野生型PGL3-WT-HMGB1荧光素酶活性(P<0.05)。而当结合位点突变后miR-142-3p mimics对突变型pGL3-MT-HMGB1荧光素酶活性无抑制效果(Fig 3B)(P<0.05)。随后用Western blot检测HMGB1的蛋白水平,如Fig 3C所示,miR-142-3p mimics可降低HMGB1的表达(P<0.05)。这说明HMGB1和miR-142-3p在乳腺癌细胞中表达呈负相关。
|
| Fig 3 HMGB1 expression inhibitedby miR-142-3p via binding to its 3'UTR(x±s, n=3) A:Diagram of putative miR-142-3p binding sequence in HMGB1 3′UTR and its mutant in luciferase reporter assay. B:Luciferase reporter assay was performed to measure luciferase activity in MCF-7/DOX cells, respectively. C:Western blot analysis of HMGB1 protein levels in MCF-7/DOX cells. *P < 0.05 vs miR-NC in MCF-7/DOX cells. |
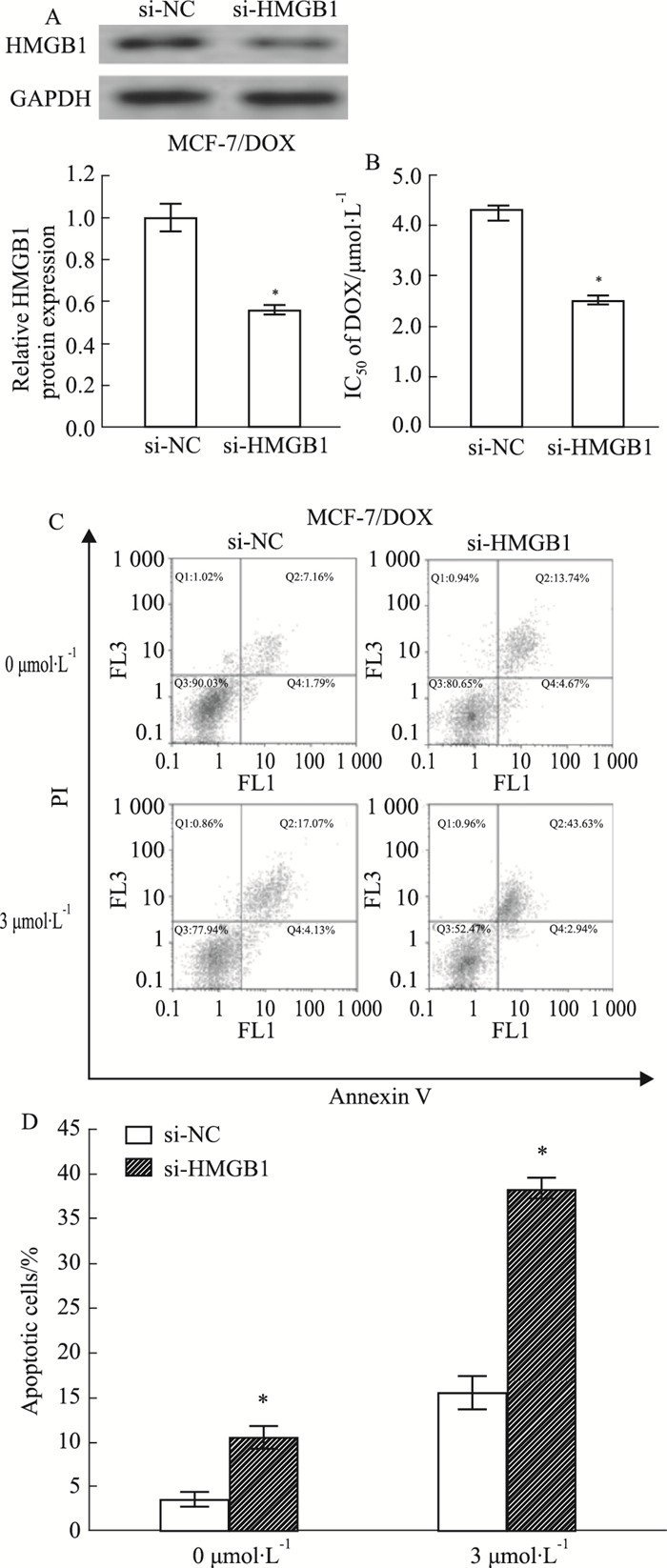
我们通过沉默MCF-7/DOX细胞中的HMGB1的表达来研究HMGB1的潜在机制(Fig 4A)。如Fig 4B和C所示,下调HMGB1可提高MCF-7/DOX细胞对阿霉素的敏感性并且增强凋亡细胞比率(P<0.05)。
|
| Fig 4 Sensitivity of breast cancer cells to DOX enhanced by silencing HMGB1 (x±s, n=3) A:Western blot analysis of HMGB1 protein level in transfected MCF-7/DOX cells. B:MTT assay was applied to determine the cell viability and DOX. IC50 value in si-NC-or si-HMGB1-transfected MCF-7/DOX cells after treatment with different doses of DOX (0.1625, 0.3125, 0.625, 1.25, 2.5, and 5 μmol· L-1) for 48 h. C:Flow cytometry analysis of apoptosis in si-NC or si-HMGB1-transfected MCF-7/DOX cells with or without DOX treatment.*P < 0.05 vs si-NC in MCF-7/DOX cells.D. The statitics of apoptotic cells. *P < 0.05 vs si-NC in MCF-7/DOX cells. |
为了研究miR-142-3p与HMGB1相互作用调节药物敏感性的机制,分别用miR-NC、miR-142-3p或miR-142-3p +pcDNA-HMGB1转染MCF-7/DOX细胞。结果表明,HMGB1的过表达则大大削弱了MCF-7/DOX细胞中miR-142-3p产生的阿霉素敏感性(Fig 5A)(P<0.05)。此外,HMGB1的过表达逆转了MCF-7/DOX细胞中的miR-142-3p对凋亡的促进作用(Fig 5B)(P<0.05)。这些结果表明,通过靶向HMGB1,miR-142-3p提高了乳腺癌细胞对阿霉素的敏感性。用Western blot检测乳腺癌细胞自噬相关蛋白水平的表达,miR-142-3p的过表达显著降低了MCF-7/DOX细胞中自噬相关蛋白Atg5和LC3-Ⅱ/ LC3-Ⅰ的水平,而HMGB1的过表达有效地恢复了miR-142-3p导致的自噬相关蛋白水平的降低(Fig 5C)(P<0.05)。综上所述,通过靶向HMGB1抑制自噬,miR-142-3p提高了乳腺癌细胞对化疗药物的敏感性。
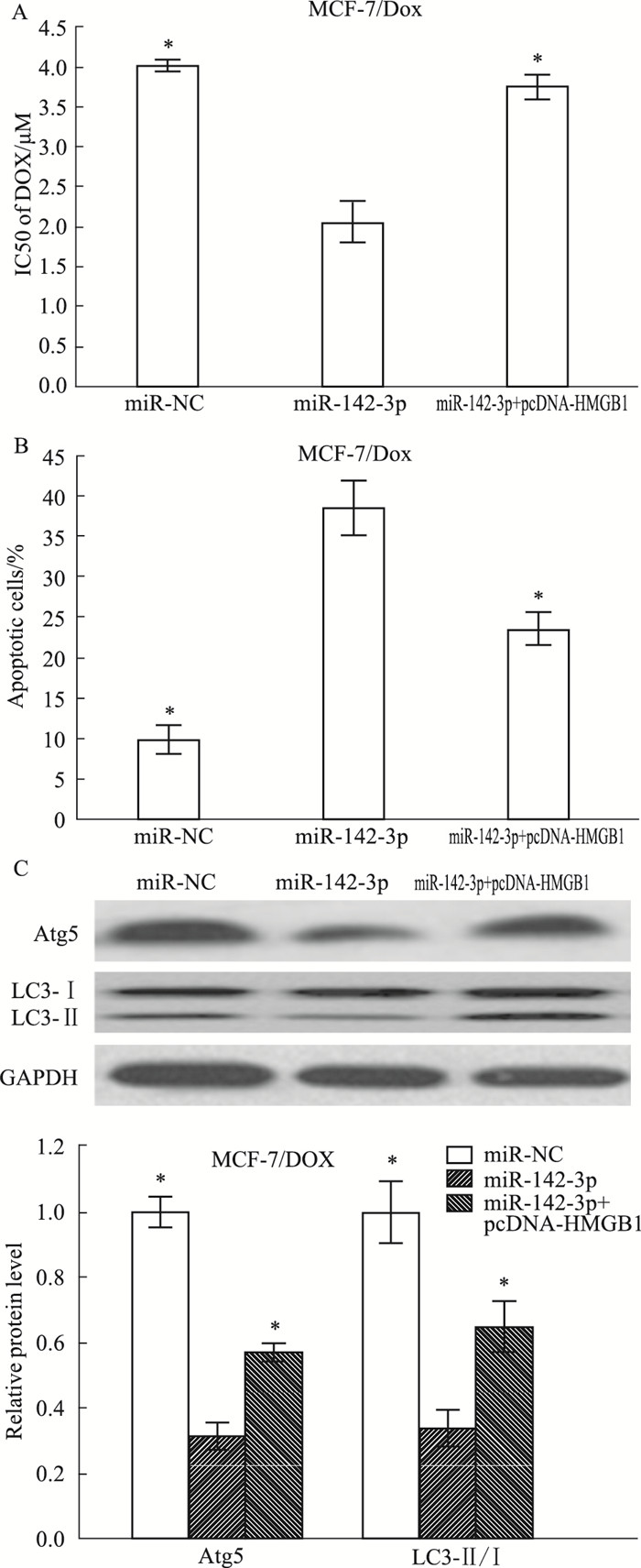
|
| Fig 5 Drug sensitivity of breast cancer cells enhancedby miR-142-3p upregulationthrough suppressing autophagy by targeting HMGB1(x±s, n=3) A:Transfected MCF-7/DOX cells were treated with different doses of DOX (0.1625, 0.3125, 0.625, 1.25, 2.5, and 5 μmol· L-1) for 48 h, respectively, then MTT assay was used to determine the cell viability and IC50 value. B:Transfected MCF-7/DOX cells were treated with 3 μmol· L-1 DOX for 48 h, respectively, followed by the detection of apoptotic rate by flow cytometry. C:The level of autophagy related proteins Atg5, LC3-Ⅰ and LC3-Ⅱ in MCF-7/DOX cells transfected with miR-NC, miR-142-3p, or miR-142-3p +pcDNA-HMGB1 were detected by Western blot. *P < 0.05 vs miR-142-3p in MCF-7/DOX cells. |
阿霉素是治疗各种癌症最常用的抗癌药物之一。然而,阿霉素产生耐药性是临床上常见的事件。研究表明,耐药性的发展与癌细胞中的miRNAs表达改变密切相关[9]。miRNAs被广泛认为是细胞凋亡、细胞周期进展、生长、增殖和癌症耐药性的关键调节因子[5]。在乳腺癌治疗中,一系列的miRNAs参与了化疗敏感性的调节,如miR-186-5p[10]和miR-129-5p[11]。miR-142-3P参与多种恶性肿瘤细胞的增殖和转移。例如,miR-142-3p的过度表达可以抑制骨肉瘤细胞[12]、宫颈癌[13]和结肠癌[14]的增殖。在本研究中,我们发现,miR-142-3p的过表达可增加MCF-7细胞对阿霉素的敏感性。
HMGB1作为一种自噬和凋亡调节因子,可以调节炎症、细胞分化、细胞迁移和肿瘤的发生和发展[12]。在非小细胞肺癌[13]、心肌细胞[14]中发现HMGB1是miR-142-3p的直接作用靶点。随后,我们进一步揭示了miR-142-3p增强乳腺癌细胞对阿霉素敏感性的作用机制。通过生物信息学和荧光素酶报告实验,我们发现HMGB1是miR-142-3p的直接作用靶点,HMGB1在许多类型的肿瘤中过表达,包括乳腺癌[15]。我们发现与亲本MCF-7细胞相比,在MCF-7/DOX细胞中HMGB1的mRNA和蛋白质水平都有很高的表达。此外,沉默HMGB1增强了阿霉素敏感性,并促进了阿霉素诱导的MCF-7/DOX细胞凋亡。同时,在MCF-7/DOX细胞中,HMGB1过表达后则大大削弱了miR-142-3p产生的阿霉素敏感性。上述结果表明,miR-142-3p通过靶向HMGB1增强了耐药细胞系对阿霉素的敏感性。
自噬是细胞自我消化的过程,通过降解和再利用细胞中那些不需要的或功能失调的成分来维持细胞的稳态[4]。自噬在肿瘤发育中起着双重作用。自噬可以清除突变或错误折叠的蛋白质,并在肿瘤形成初期减轻细胞应激,起到抑制作用;另一方面,自噬使肿瘤细胞在应激条件下形成药物化疗的屏障[3]。因此,我们推测抑制自噬可克服耐药性,有利于癌症治疗。我们的结果表明,阿霉素可导致自噬活性增加,miR-142-3p的过度表达通过抑制自噬显著提高了阿霉素诱导细胞凋亡的能力。miR-142-3p/HMGB1参与乳腺癌细胞的增殖和凋亡过程,为提高乳腺癌对药物的敏感性提供了新的靶点,具有一定应用价值。
| [1] |
Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. Cancer J Clin, 2014, 64: 9-29. doi:10.3322/caac.21208 |
| [2] |
Sharifi S, Barar J, Hejazi, et al. Doxorubicin changes Bax/BclxLRatio, Caspase-8 and 9 in Breast cancer cells[J]. Adv Pharm Bull, 2015, 5: 351-9. doi:10.15171/apb.2015.049 |
| [3] |
Sun Q, Liu T, Yuan Y, et al. MiR-200c inhibits autophagy and enhances radiosensitivity in breast cancer cells by targeting UBQLN1[J]. Int J Cancer, 2015, 136: 1003-12. doi:10.1002/ijc.29065 |
| [4] |
Buyuklu M, Kandemir F M, Ozkaraca M, et al. Protective effect of curcumin against contrast induced nephropathy in rat kidney:What is happening to oxidative stress, inflammation, autophagy and apoptosis[J]. Eur Rev Med Pharmacol Sci, 2014, 18: 461-70. |
| [5] |
Flynt A S, Lai E C. Biological principles of microRNA-mediated regulation:shared themes amid diversity[J]. Nat Rev Genet, 2008, 9(11): 831-42. doi:10.1038/nrg2455 |
| [6] |
Lv M, Zhang X, Jia H, et al. An oncogenic role of miR-142-3p in human T-cell acute lymphoblastic leukemia (T-ALL) by targeting glucocorticoid receptor-alpha and cAMP/PKA pathways[J]. Leukemia, 2012, 26(4): 769-77. doi:10.1038/leu.2011.273 |
| [7] |
Wang X S, Gong J N, Yu J, et al. MicroRNA-29a and microRNA-142-3p are regulators of myeloid dierentiation and acute myeloid leukemia[J]. Blood, 2012, 119(21): 4992-5004. doi:10.1182/blood-2011-10-385716 |
| [8] |
Amornsupak K, Insawang T, Thuwajit P, et al. Cancer-associated fibroblasts induce high mobility group box 1 and contribute to resistance to doxorubicin in breast cancer cells[J]. BMC Cancer, 2014, 14: 955. doi:10.1186/1471-2407-14-955 |
| [9] |
Zheng T, Wang J, Chen X, et al. Role of microRNA in anticancer drug resistance[J]. Int J Cancer, 2010, 126(1): 2-10. |
| [10] |
孙玉国, 王照岩, 杨玉玲, 等. MiR-186-5p通过靶向调控RAB2A在乳腺癌细胞阿霉素耐药性中的逆转作用机制[J]. 中国药理学通报, 2018, 34(12): 1668-73. Sun Y, Wang Z, Yang Y, et al. MiR-186-5p regulates the reversal mechanism of RAB2A in adriamycin resistance of breast cancer cells by targeting[J]. Chin Pharmacol Bull, 2018, 34(12): 1668-73. doi:10.3969/j.issn.1001-1978.2018.12.009 |
| [11] |
Lu X D, Ma J J, Chu J H, et al. MiR-129-5p sensitizes the response of Her-2 positive breast cancer to Trastuzumab by reducing Rps6[J]. Cell Physiol Biochem, 2017, 44: 2346-56. doi:10.1159/000486122 |
| [12] |
Yang Y Q, Qi J, Xu J Q, et al. Micro RNA-142-3p, a novel target of tumor suppressor menin, inhibits osteosarcoma cell proliferation by down-regulation of FASN[J]. Tumour Biol, 2014, 35: 10287-93. doi:10.1007/s13277-014-2316-z |
| [13] |
Xiao P, Liu W L. miR-142-3p functions as a potential tumor suppressor directly targeting HMGB1 in non-small-cell lung carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(9): 10800-07. |
| [14] |
Wang Y, Ouyang M, Wang Q, et al. MicroRNA-142-3p inhibits hypoxia/reoxygenation-induced apoptosis and fibrosis of cardiomyocytes by targeting high mobility group box 1[J]. Int J Mol Med, 2016, 38(5): 1377-86. doi:10.3892/ijmm.2016.2756 |
| [15] |
Flohr A M, Rogalla P, Meiboom M, et al. Variation of HMGB1 expression in breast cancer[J]. Anticancer Res, 2001, 21(6A): 3881-5. |

