

2. 合肥工业大学食品与生物工程学院, 安徽 合肥 230009;
3. 安徽医科大学药学院, 肝病研究所, 安徽 合肥 230032
王华(1978-), 男, 教授, 博士生导师, 研究方向:酒精性肝病、炎症与肿瘤, 通讯作者, E-mail:wanghua@ahmu.edu.cn
2. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China;
3. College of Pharmacy, Institute of Liver Diseases, Anhui Medical University, Hefei 230032, China
癌症是全世界疾病死亡的主要原因之一,尽管最近在治疗方面取得了极大的研究进展,但它仍然是对健康的最大威胁之一。机体因免疫耐受,不能进行正常的免疫应答,从而促进肿瘤的发生。免疫疗法是利用患者自身免疫系统对抗癌症或其他免疫性疾病的治疗。癌症治疗的常用策略是化疗、放疗和外科治疗。与化疗和放疗相比,免疫疗法可以利用宿主的免疫系统,杀死肿瘤细胞,长期抑制肿瘤生长和复发。但免疫疗法需要反复大剂量注射,治疗反应的个体差异大、免疫应答效率低。因此免疫治疗多与其他治疗联合应用,产生协同作用。与单一治疗相比,联合治疗能极大促进抗原释放并具有持久的疗效。免疫治疗与其他治疗联合应用将成为极具潜力的新治疗策略。然而,肿瘤生长的明显特征之一是生成杂乱而无功能特性的血管[1],使得药物不能顺畅地通过血流到达肿瘤部位。只有小部分静脉给药的药物可以到达实质靶标,而剩余的循环药物可能损害正常组织。因此药物的输送变得复杂,导致疗效有限。
为了克服上述缺点,新的给药材料和给药途径急需改善。水凝胶作为肿瘤局部和持续药物输送载体引起了人们的关注,因其在原位肿瘤药物输送方面具有独特的优势,与全身药物输送系统相比,具有良好的注射能力和微创的给药方法。可以在肿瘤部位同时输送多种抗癌药物,保持相对较高药物浓度并减少全身毒性副作用。该文对近几年水凝胶免疫治疗与其他治疗的联合应用进行了综述,并对其发展进行展望。
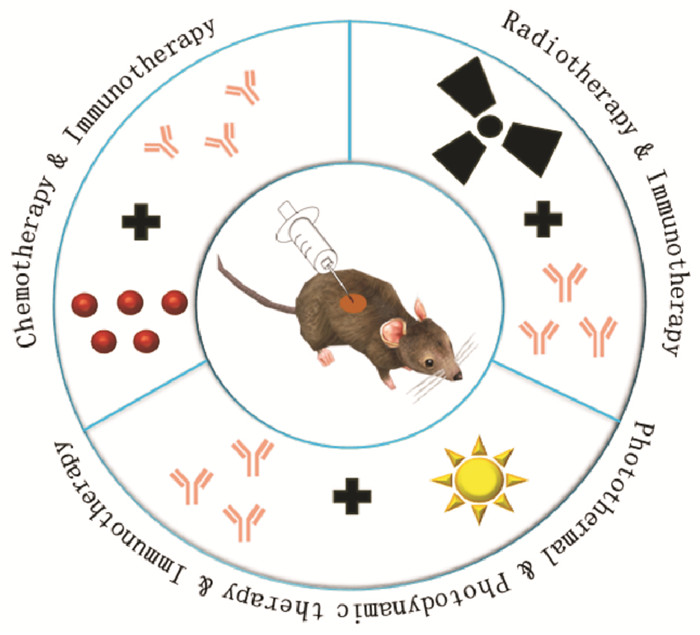
|
| Fig 1 Schematic illustration of hydrogels as unique platforms for immunotherapeutics-based combination antitumor therapy The combination strategies contain immunochemotherapy, immunoradiotherapy, immunophotothermal therapy and immunophotodynamic therapy. |
水凝胶是亲水性网状高分子,能够保留大量的水,并且不溶于水,表面光滑抗菌,是一种理想的生物材料。它具有多孔结构,可将药物包裹其中,增强药物疗效,降低不良反应[2]。多种天然材料可合成水凝胶,如透明质酸、纤维蛋白、壳聚糖、海藻酸盐和明胶,具有良好的生物相容性,明确的化学结构等特点。水凝胶定位在注射针可以到达的任何地方,与手术植入相比,是一种更简单且侵入性更小的手术。避免了组织损伤和炎性伤口反应相关的并发症[3]。它可以移动和流动,在形成持久植入物之前可用于任何可用空间,因此广泛应用于医学生物领域。它可以作为运输载体包裹药物和细胞,促进伤口愈合,制造各种类型的功能性组织结构以及用于医疗器械领域。
2 水凝胶的应用 2.1 用于化疗与免疫治疗联合治疗化疗和免疫治疗的协同作用增强了化疗的抗肿瘤作用,这种联合治疗引起了人们的极大关注[4]。越来越多的证据表明,一定剂量的化疗药物,如紫杉醇、阿霉素和顺铂,能激活宿主免疫[5],因此化疗的抗肿瘤作用不仅介导细胞毒性作用,还调节肿瘤免疫,包括增强肿瘤抗原表达、抑制调节性细胞和诱导免疫原性细胞死亡。虽然化疗可以有效地治疗某些类型的癌症,但由于化疗的缺点:如高频率注射、代谢速度快、药物利用率低、副作用严重等,所以治疗往往伴随着严重的副作用和生活质量的下降。为了增强免疫治疗的效果,扩大现有化疗的疗效,探索免疫治疗与化学治疗的联合治疗是十分必要的。
2.1.1 免疫检查点抑制剂癌细胞利用免疫检查点(immune checkpoint blockade,ICB)引起T细胞功能障碍,导致免疫逃避,在多种类型实体瘤的癌症患者中免疫检查点阻断显著延长了患者的生存期[6],然而仍有一些问题亟待解决,例如只有少数患者对于免疫检查点阻断治疗起效[7],免疫检查点抑制后可引起正常器官的副作用[8],并且一些化疗药物在单一治疗时活性不大,但与免疫治疗结合会增强抗癌作用。因此研究旨在增强肿瘤免疫原性表型、增加ICB反应和避免严重副作用。
Wang等[9]制备了一种H2O2可降解的聚乙烯醇(polyvinylalcohol,PVA)水凝胶,包裹吉西他滨(gemcitabine,GEM)和抗PD-L1阻断抗体(anti-PD-L1 blocking antibody,aPDL1),活性氧(reactive oxygen species,ROS)水凝胶在H2O2溶液中快速释放出GEM和aPDL1,大多数GEM在1 d内释放,而aPDL1显示更持久的释放,水凝胶引起的活性氧消耗可能有助于肿瘤部位的T细胞募集以及阻断M2巨噬细胞分化。因此,该水凝胶不仅可以控制药物释放,还可以充当活性氧的清除剂以提高治疗功效,增强免疫原性肿瘤表型,抑制切除后肿瘤复发。同样,在Yu等[10]的研究中,合成一种载有抗PD-L1阻断抗体和右旋-1-甲基色氨酸(dextro-1-methyl tryptophan,D-1MT)的活性氧多肽温敏水凝胶,在低温条件下与药物结合后注射到体内,通过体温形成凝胶,形成一个药物缓释系统,并通过清除肿瘤部位的活性氧来改善T细胞的数量,减轻免疫抑制性肿瘤微环境。D-1MT是吲哚胺-2,3-双加氧酶(indoleamine-2, 3-dioxygenase,IDO)抑制剂,IDO限制T细胞活化和通过犬尿氨酸途径催化色氨酸降解诱导肿瘤免疫耐受。因此联合aPD-1和D-1MT可以增强黑色素瘤的治疗功效。Ruan等[11]设计了能够响应肿瘤微环境内的酸性pH和活性氧的双生物响应性凝胶,首先将抗PD1抗体加载到pH敏感性碳酸钙纳米颗粒(calcium carbonate nanoparticles,CaCO3NPs)中,将其与泽布拉林一起包封在ROS响应性水凝胶中。增强抗原呈递细胞捕获肿瘤抗原,有效诱导全身抗肿瘤免疫应答。CD47抗体一直被喻为肿瘤免疫领域的“明日之星”。Chen等[12]将预载有抗CD47抗体(anti-CD47 antibody,aCD47)的碳酸钙纳米颗粒包封在纤维蛋白凝胶中并清除手术伤口中的H+,CaCO3纳米粒子可以在酸性肿瘤微环境中逐渐溶解和释放包封的aCD47,从而促进M1型巨噬细胞的激活,通过阻断CD47和信号调节蛋白-α相互作用以及诱导巨噬细胞对癌细胞的吞噬作用,同时减少aCD47全身给药相关的毒性作用。
将免疫检查点抑制剂封装到水凝胶,不仅可以提高免疫治疗反应,还可以增强靶向效应,水凝胶载体以较低有效的剂量将免疫活性成分和化疗药物直接递送到靶点位置。
2.1.2 免疫细胞和细胞因子 2.1.2.1 免疫细胞免疫细胞包括T细胞、自然杀伤细胞(natural killer cell,NK)和树突细胞(dendritic cell,DC),免疫细胞在肿瘤监测中起着重要作用。化疗药物和细胞因子的持续释放有助于长期的抗肿瘤治疗。由于树突细胞是调节T细胞免疫的关键因素,因此树突细胞在肿瘤疫苗和过继转移治疗中的应用日益广泛。然而,用于癌症免疫疗法的DC疫苗源自外周血细胞,通过离体的肿瘤特异性抗原分离和激活再次输注回患者体内。但大多数的移植DC很快死亡,只有少数可以回到淋巴组织中[13],为了解决这个问题,Yang等[14]将树突细胞、肿瘤抗原和抗PD-1抗体包封到肽纳米纤维水凝胶中,形成了一个疫苗结节。经皮下注射后,疫苗结节维持了树突细胞的活性和生物学功能,并刺激抗原特异性效应T细胞的活化。抗PD-1抗体联合应用进一步增强抗肿瘤CD8+ T细胞免疫应答。同样Song等[15]合成由肿瘤细胞裂解物,TLR3激动剂,和多肽水凝胶组成的疫苗制剂可促进树突细胞的成熟,提高了抗肿瘤活性。除了靶向树突细胞的肿瘤疫苗,针对M1巨噬细胞作用的水凝胶疫苗同样会产生有效的免疫治疗。M1巨噬细胞可显著导致体内肿瘤消退。但是其产生急性炎症反应导致小鼠死亡。并且直接注射方法使免疫细胞不能保存在肿瘤部位。Guerra等[16]用水凝胶包埋M1巨噬细胞上调白细胞介素-6,硝酸盐和肿瘤坏死因子α,促进半胱氨酸蛋白酶诱导肿瘤细胞凋亡。M1水凝胶与对照组相比,显著降低肝癌细胞的存活率。癌症治疗的主要目的是根除原发性肿瘤,控制转移,预防肿瘤复发。Jin等[17]开发了一种载有阿霉素的蜂毒肽-RADA32复合肽水凝胶(melittin-RADA32-DOX,MRD),使用单剂量注射MRD水凝胶,抑制原发性黑色素瘤肿瘤的生长,同时激活自然杀伤细胞和引流淋巴结的树突状细胞,特异性消耗M2样肿瘤相关巨噬细胞,并产生活性细胞毒性T细胞,MRD水凝胶的多剂量注射消除了50%的原发性肿瘤,并且在根除原发肿瘤后达到完全缓解。Luo等[18]制备的D-四肽水凝胶可以有效刺激CD8+ T细胞,增强了肿瘤疫苗免疫原性。由于肿瘤抗原的低表达和突变,免疫细胞通常不能识别肿瘤细胞并将其呈递给效应细胞。通过利用水凝胶包裹免疫细胞可以克服肿瘤的低免疫原性和低抗原致敏性,实现持久的全身免疫。
2.1.2.2 细胞因子细胞因子作为免疫系统的重要组成部分之一,在肿瘤抑制中起着关键作用,它能刺激免疫细胞增殖和分泌炎症细胞因子杀死癌细胞。
白细胞介素-2(interleukin-2,IL-2)是调节T细胞、B细胞和自然杀伤细胞增殖和分化的重要细胞因子。Song等[19]设计了由壳聚糖、两种带相反电荷的壳聚糖衍生物构成的纳米凝胶,用红细胞膜包裹纳米凝胶,形成“纳米海绵”。用于递送IL-2而不降低生物活性。纳米凝胶提高了药物渗透性,诱导钙网蛋白暴露,从而激活树突细胞吞噬作用,抑制调节细胞,增强抗肿瘤免疫。Wu等[20]制备了包裹白细胞介素-15(interleukin-15,IL-15)与顺铂(cisplatin,CDDP)共传递聚乙二醇温敏水凝胶,在大鼠皮下注射后3周内彻底降解,具有良好的生物相容性。单次注射含有IL-15/CDDP的水凝胶后,诱导CD8+ T细胞和NK细胞增多,双药物水凝胶显示出协同抗癌效果。因此,研究结果表明细胞因子联合化疗是抗肿瘤免疫治疗的一个重要发展方向。水凝胶可作为一种生物支架,将细胞因子释放到周围环境。有效控制药物释放,减少高剂量药物的毒副作用。尽管目前的研究较少, 但是提出了创新性的解决办法解决传统免疫疗法中的局限问题, 具有巨大的发展潜力。
2.2 用于免疫治疗和放疗联合治疗利用放射性同位素破坏肿瘤的放射治疗已广泛应用于临床癌症治疗,放疗可诱导癌细胞的免疫原性,免疫治疗联合放疗不仅可提高放疗局部疗效,同时也增强了远位的抗肿瘤效应。放射性同位素会对正常组织产生显著的毒性作用,为了降低副作用,采用水凝胶作为药物输送平台用于放疗与免疫治疗联合治疗。
Chao等[21]用海藻酸钠、过氧化氢酶(catalase,CAT)和CpG寡核苷酸合成一种原位水凝胶,在注射时,可溶性多糖海藻酸钠可与内源性Ca2+交联迅速转化为水凝胶,将131I-Cat固定在肿瘤内。将放射性同位素标记的酶与免疫佐剂一起局部捕获在肿瘤内,从而使得放疗增强了局部肿瘤杀伤效力。在局部放疗与细胞毒性T淋巴细胞相关蛋白-4检查点阻断联合治疗后,协同消除远处转移性肿瘤,并且增强治疗小鼠长期免疫记忆效应。上述研究表明,利用水凝胶运载药物辅助放疗,可以减少放疗对机体的损害。
2.3 用于光热疗法,光动力疗法与免疫疗法联合治疗光热疗法是一种新兴的无创和远程可控治疗方式,可以利用光热剂迅速将光转换为局部热量,并通过提高肿瘤区域的温度来使肿瘤消退。光热疗法比化疗和放疗更有显着的优势,它具有优越的局部效应和较少的全身副作用。光热治疗作为单一疗法,肿瘤组织热量分布不均匀,一般不能完全治疗肿瘤。因此,利用光热治疗与免疫治疗联合应用可以大幅提高肿瘤疫苗效力,提高免疫疗法的疗效。
Ye等[22]制备了经手术去除肿瘤细胞膜的黑磷量子点纳米囊泡(black phosphorus quantum dot nanovesicles,BPQD-CCNVs),并将其装入含有粒细胞-巨噬细胞集落刺激因子和脂多糖(lipopolysaccharide,LPS)的温敏水凝胶中。BPQD是一种具有光热转换和良好生物降解性能的光热材料。近红外辐射和LPS刺激DC的活化,结合PD-1抗体可显著消除残留和转移的癌细胞。从患者切除的肿瘤形成基于癌细胞膜的疫苗,可提供丰富的自体肿瘤抗原,保护BPQD免于体外降解。因此,该治疗策略对癌症的个性化治疗产生深远的影响。早期非转移性实体瘤主要治疗方式是外科手术切除。然而,残留的微小肿瘤或循环肿瘤细胞在术后数月或数年内可能导致肿瘤复发和转移。Wang等[23]设计了一种癌症疫苗(personalized cancer vaccine,PVAX)用于术后免疫治疗。PVAX是通过用水凝胶基质包裹JQ1和吲哚菁绿。808 nm近红外激光照射激活PVAX,促进树突状细胞成熟,诱导细胞毒性T淋巴细胞转化,显著抑制肿瘤复发。PVAX同时增强患者特异性免疫应答和阻断PD-L1依赖性免疫逃避有效预防术后肿瘤复发和转移。Wang等[24]设计了一种用于巨噬细胞免疫调节的3D细胞外基质光响应透明质酸水凝胶纳米复合物,该水凝胶可以激活巨噬细胞的αvβ3整合素,并且αvβ3整合素激活可以增强抗炎M2巨噬细胞极化。光响应水凝胶在不同波长的照射下实现按需释放治疗剂量,启动肿瘤特异性免疫应答,引起了持久的免疫记忆效应,并且不会对正常器官造成病理损伤。
光动力疗法(photodynamic therapy, PDT)通过光敏剂在光照下产生ROS来杀死肿瘤细胞,是一种肿瘤局部治疗方法。光动力治疗后的免疫反应不足以有效消除遗留在体内的癌细胞。为了引发强大的抗肿瘤免疫反应,通常需要联合免疫治疗增强免疫原性。
Meng等[25]设计了一种光触发原位凝胶系统,由Ce6光敏剂,过氧化氢酶,聚乙二醇双丙烯酸酯与纳米颗粒免疫佐剂组成,将混合物溶液局部注射到肿瘤中并用660 nm红光照射肿瘤,肿瘤内源性H2O2分解产生O2缓解肿瘤缺氧,从而提高PDT功效。进一步与抗细胞毒性T淋巴细胞相关蛋白-4检查点阻断联合治疗,不仅有效抑制远处肿瘤的生长,而且对再次复发的肿瘤提供长期免疫记忆保护。因此,通过注射光触发原位凝胶系统可以极大增强免疫疗法。
3 展望免疫治疗和生物材料的联合应用克服了限制癌症免疫治疗的临床障碍。目前生物材料研发和癌症免疫治疗领域都以惊人的速度发展,每年都出现新的材料和临床试验。尽管联合治疗方法增强了治疗效果,但也观察到许多副作用或毒性作用。因此,在水凝胶载药平台的设计中应仔细考虑精确剂量,治疗顺序和给药途径。这需要不断完善水凝胶药物载体技术,以研制获得更多、更好的新型材料用于肿瘤的临床治疗。水凝胶作为载药平台是可以定制的,以更精确的方式增加效应免疫细胞的活性,以满足各种药物或细胞疗法的化学或生物需求。随着水凝胶的深入研究,免疫治疗和其他联合治疗的不断完善,水凝胶将成为一种极具潜力的药物载体。
| [1] |
王蔚, 余苏云, 吴佳伟, 等. 肿瘤血管生成抑制剂的治疗局限和策略[J]. 中国药理学通报, 2017, 33(11): 1489-92. Wang W, Yu S Y, Wu J W, et al. Therapeutic limitations and strategies of angiogenesis inhibitors[J]. Chin Pharmacol Bull, 2017, 33(11): 1489-92. doi:10.3969/j.issn.1001-1978.2017.11.003 |
| [2] |
Zhang Y S, Khademhosseini A. Advances in engineering hydrogels[J]. Science, 2017, 356(6337): eaaf3627. doi:10.1126/science.aaf3627 |
| [3] |
Koshy S T, Ferrante T C, Lewin S A, et al. Injectable, porous, and cell-responsive gelatin cryogels[J]. Biomaterials, 2014, 35(8): 2477-87. doi:10.1016/j.biomaterials.2013.11.044 |
| [4] |
Shen S, Li H J, Chen K G, et al. Spatial targeting of tumor-associated macrophages and tumor cells with a pH-sensitive cluster nanocarrier for cancer chemoimmunotherapy[J]. Nano Lett, 2017, 17(6): 3822-9. doi:10.1021/acs.nanolett.7b01193 |
| [5] |
Lang T, Liu Y, Zheng Z, et al. Cocktail strategy based on spatio-temporally controlled nano device improves therapy of breast cancer[J]. Adv Mater, 2019, 31(5): e1806202. doi:10.1002/adma.201806202 |
| [6] |
Antoni R, Jedd D W. Cancer immunotherapy using checkpoint blockade[J]. Science, 2018, 359(6382): 1350-5. doi:10.1126/science.aar4060 |
| [7] |
Milling L, Zhang Y, Irvine D J. Delivering safer immunotherapies for cancer[J]. Adv Drug Deliv Rev, 2017, 114: 79-101. doi:10.1016/j.addr.2017.05.011 |
| [8] |
Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination[J]. Nat Rev Clin Oncol, 2016, 13(8): 473-86. doi:10.1038/nrclinonc.2016.58 |
| [9] |
Wang C, Wang J, Zhang X, et al. in situ formed reactive oxygen species-responsive scaffold with gemcitabineand checkpoint inhibitor for combination therapy[J]. Sci Transl Med, 2018, 10(429): eaan3682. doi:10.1126/scitranslmed.aan3682 |
| [10] |
Yu S, Wang C, Yu J, et al. Injectable bioresponsive gel depot for enhanced immune checkpoint blockade[J]. Adv Mater, 2018, 30(28): e1801527. doi:10.1002/adma.201801527 |
| [11] |
Ruan H, Hu Q, Wen D, et al. A dual-bioresponsive drug-delivery depot for combination of epigenetic modulation and immune checkpoint blockade[J]. Adv Mater, 2019, 31(17): e1806957. doi:10.1002/adma.201806957 |
| [12] |
Chen Q, Wang C, Zhang X, et al. In situ sprayed bioresponsive immunotherapeutic gel for post-surgical cancer treatment[J]. Nat Nanotechnol, 2019, 4(1): 89-97. |
| [13] |
Steinman R M, Banchereau J. Taking dendritic cells into medicine[J]. Nature, 2007, 449(7161): 419-26. doi:10.1038/nature06175 |
| [14] |
Yang P, Song H, Qin Y, et al. Engineering dendritic-cell-based vaccines and pd-1 blockade in self-assembled peptide nanofibrous hydrogel to amplify antitumor t-cell immunity[J]. Nano Lett, 2018, 18(7): 4377-85. doi:10.1021/acs.nanolett.8b01406 |
| [15] |
Song H, Huang P, Niu J, et al. Injectable polypeptide hydrogel for dual-delivery of antigen and TLR3 agonist to modulate dendritic cells in vivo and enhance potent cytotoxic T-lymphocyte response against melanoma[J]. Biomaterials, 2018, 159: 119-29. doi:10.1016/j.biomaterials.2018.01.004 |
| [16] |
Guerra A D, Yeung O W H, Qi X, et al. The anti-tumor effects of m1 macrophage-loaded poly (ethylene glycol) and gelatin-based hydrogels on hepatocellular carcinoma[J]. Theranostics, 2017, 7(15): 3732-44. doi:10.7150/thno.20251 |
| [17] |
Jin H, Wan C, Zou Z, et al. Tumor ablation and therapeutic immunity induction by an injectable peptide hydrogel[J]. ACS Nano, 2018, 12(4): 3295-310. doi:10.1021/acsnano.7b08148 |
| [18] |
Luo Z, Wu Q, Yang C, et al. A powerful cd8(+) t-cell stimulating d-tetra-peptide hydrogel as a very promising vaccine adjuvant[J]. Adv Mater, 2017, 29(5): 1601776. doi:10.1002/adma.201601776 |
| [19] |
Song Q, Yin Y, Shang L, et al. Tumor microenvironment responsive nanogel for the combinatorial antitumor effect of chemotherapy and immunotherapy[J]. Nano Lett, 2017, 17(10): 6366-75. doi:10.1021/acs.nanolett.7b03186 |
| [20] |
Wu X, Wu Y, Ye H, et al. Interleukin-15 and cisplatin co-encapsulated thermosensitive polypeptide hydrogels for combined immuno-chemotherapy[J]. J Control Release, 2017, 255: 81-93. doi:10.1016/j.jconrel.2017.04.011 |
| [21] |
Chao Y, Xu L, Liang C, et al. Combined local immunostimulatory radioisotope therapy and systemic immune checkpoint blockade imparts potent antitumour responses[J]. Nature Biomedical Engineering, 2018, 2(8): 611-21. doi:10.1038/s41551-018-0262-6 |
| [22] |
Ye X, Liang X, Chen Q, et al. Surgical tumor-derived personalized photothermal vaccine formulation for cancer immunotherapy[J]. ACS Nano, 2019, 13(3): 2956-68. doi:10.1021/acsnano.8b07371 |
| [23] |
Wang T, Wang D, Yu H, et al. A cancer vaccine-mediated postoperative immunotherapy for recurrent and metastatic tumors[J]. Nat Commun, 2018, 9(1): 1532. doi:10.1038/s41467-018-03915-4 |
| [24] |
Wang H, Morales R T, Cui X, et al. A photoresponsive hyaluronan hydrogel nanocomposite for dynamic macrophage immunomodulation[J]. Adv Healthc Mater, 2019, 8(4): e1801234. |
| [25] |
Meng Z, Zhou X, Xu J, et al. Light-triggered in situ gelation to enable robust photodynamic-immunotherapy by repeated stimulations[J]. Adv Mater, 2019, 31(24): e1900927. |

