

2. 医学科研实验中心,陕西 咸阳 712046
2. Medical Experiment Center, Shaanxi University of Chinese Medicine, Xianyang Shaanxi 712046, China
重症急性胰腺炎(severe acute pancreatitis,SAP)往往伴有多器官损伤[1-2],其中,肝损伤是SAP病情发展过程中较早出现的胰外损伤之一,其损伤程度直接影响SAP的病情进展和预后,是患者并发多器官功能障碍后死亡的主要原因[2]。柴芩承气汤(chaiqinchengqi decoction,CQCQD)可视为大柴胡汤与大承气汤的合方或衍生方,是近年来临床治疗急性胰腺炎的有效方药之一[3]。课题组前期实验观察到CQCQD对于大鼠SAP并发的肝损伤同样具有明显的保护作用,这可能与抑制肝组织氧化应激,减少单核巨噬细胞活化,降低白细胞介素6(interleukin 6,IL-6)和单核细胞趋化蛋白1等炎性因子的表达有关[4]。然而,柴芩承气汤抑制肝内炎性因子表达的分子通路尚不明确。已有研究表明,SAP发生后,肝脏内Toll样受体4(Toll-like receptor 4,TLR4)能够特异性识别细胞外抗原识别信号,并将刺激信号转导入细胞内,活化核因子κB(nuclear factor κB,NF-κB)。作为调控多种细胞因子产生的重要转录因子,NF-κB可介导多种炎性因子的合成和释放,进而参与SAP病程中肝功能障碍的形成[5-6]。
为了明确CQCQD在不同动物种属中的治疗效果,以及CQCQD是否通过抑制TLR4/NF-κB通路活化来发挥其肝内抗炎作用,本实验通过给予SAP小鼠CQCQD灌胃治疗,观察其对SAP并发肝损伤的保护作用,以及对TLR4/NF-κB p65通路活性的影响,进一步探讨CQCQD治疗SAP肝损伤的作用机制。
1 材料 1.1 药物CQCQD(购自陕西中医药大学附属医院):柴胡10 g、黄芩10 g、丹参10 g、川芎10 g、栀子10 g、枳实10 g、厚朴10 g、生大黄15 g(后下)、芒硝10 g(烊化),生药量共95 g,前7味药加水400 mL浸泡1 h,煎沸后文火继续煎煮20 min,再加入生大黄煎5 min,然后加水300 mL煎煮第2次,最后将汤液浓缩至95 mL,加入芒硝烊化,形成CQCQD浓缩液(生药量浓度为1 kg·L-1),分装后置4 ℃保存备用[4]。
1.2 试剂L-精氨酸(L-Arg,Sigma);血清淀粉酶、脂肪酶、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)检测试剂盒,均购自南京建成生物;IL-6 ELISA试剂盒(上海桥杜生物);血清内毒素检测试剂盒(GenScript);抗TLR4抗体(博奥森);抗IL-6抗体(Santa Cruz);抗p-NF-κB p65抗体(Cell Signaling);抗GAPDH抗体(博士德);RNA提取试剂盒、反转录试剂盒、实时定量PCR试剂盒(TaKaRa)。
1.3 仪器正置数码显微镜(德国Zeiss A1);酶标仪(美国Bio-Tek ELX808IU);蛋白质电泳及转膜系统(美国Bio-Rad);PCR仪(美国ABI 7500)。
2 方法 2.1 实验动物分组与造模36只昆明小鼠,6~8周龄,体质量(25~30) g,购自空军军医大学动物实验中心,许可证书0001249。小鼠在室温(20~24) ℃环境饲养,造模前12 h禁食,不禁水,随机分为3组:对照组(Control)、重症急性胰腺炎模型组(SAP)和CQCQD治疗组(SAP+CQCQD),每组12只。模型组和治疗组小鼠给予20% L-Arg(3.3 g·kg-1,2次,间隔1 h)腹腔注射,建立SAP模型[7]。20% L-Arg第2次注射后30 min,治疗组小鼠给予柴芩承气汤浓缩液灌胃(19 g·kg-1·d-1,按成人体质量60 kg计算,等效剂量为成人用量的12.33倍)[8],每日分2次给药,连续给药3 d。模型组小鼠给予同等剂量生理盐水灌胃。
2.2 取材与检测指标第1次L-Arg腹腔注射后72 h麻醉小鼠,下腔静脉取全血,分离血清。取胰腺(称重)及肝脏组织,部分组织固定于中性甲醛溶液,用于组织病理学检测。部分组织低温保存于-80 ℃冰箱,用于Western blot及PCR检测。
2.2.1 胰腺湿重比胰腺湿重比=胰腺重量(g)/体质量(g)。
2.2.2 组织病理学检测取胰腺及肝脏组织,常规石蜡切片(2 μm),HE染色后观察组织病理学改变。
2.2.3 生物化学指标检测检测血清淀粉酶、脂肪酶、ALT、AST活性,以及血清IL-6水平、血清内毒素含量,均按照试剂盒说明书进行操作。
2.2.4 免疫组化检测肝脏组织TLR4、p-NF-κB p65表达变化取肝脏组织,常规石蜡切片。脱蜡,再水,柠檬酸缓冲液高温抗原修复15 min,3% H2O2室温孵育15 min(避光),5%血清室温封闭1 h,分别加入抗TLR4抗体(1 :500)、抗p-NF-κB p65抗体(1 :200)4 ℃过夜,二抗室温孵育1 h,SABC室温反应30 min,DAB显色,苏木精复染,脱水、透明后封片。
2.2.5 Western blot检测肝脏组织提取肝脏组织总蛋白。SDS-PAGE电泳分离蛋白,转膜,5%牛奶或BSA室温封闭1 h,分别加入抗TLR4、p-NF-κB p65、NF-κB p65抗体(1 :1 000),以及抗GAPDH抗体(1 :500),4 ℃过夜,二抗室温孵育1 h,ECL化学发光法显影。
2.2.6 实时荧光定量PCR检测肝组织IL-6、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、巨噬细胞炎性蛋白1α(macrophage inflammatory protein 1α, MIP-1α)mRNA表达变化提取肝脏组织总RNA,反转录成cDNA,以cDNA为模板进行扩增,检测mRNA表达量(cyclophilin为内参基因)。引物序列如下:IL-6正义链5′-GAAGTAGGGAAGGCCGTGG-3′,反义链5′-CTCTGCAAGAGACTTCCATCCAGT-3′。TNF-α正义链5′-CATCTTCTCAAAATTCGAGTGACAA-3′,反义链5′-TGGGAGTAGACAAGGTACAACCC-3′。MIP-1α正义链5′-TGCCCTTGCTGTTCTTCTCT-3′,反义链5′-TTCTTGGACCCAGGTCTCTTT-3′。cyclophilin正义链5′-ATGGTCAACCCCACCGTG-3′,反义链5′-TTCTGCTGTCTTTGGAACTTTGTC-3′。
2.3 统计学方法使用SPSS 21.0统计软件进行分析,实验数据以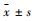
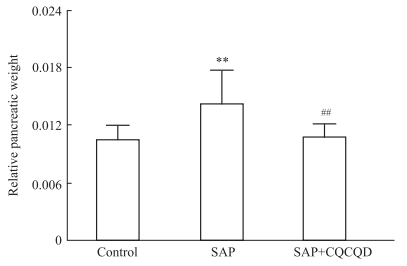
与Control组比较,SAP组小鼠的胰腺湿重比明显升高,CQCQD治疗能够降低SAP小鼠的胰腺湿重比,变化程度约25%。提示SAP炎症早期胰腺水肿明显,CQCQD干预降低了SAP小鼠的胰腺水肿程度。见Fig 1。
|
Fig 1 Relative pancreatic weight of mice during SAP decreased by CQCQD treatment (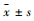 |
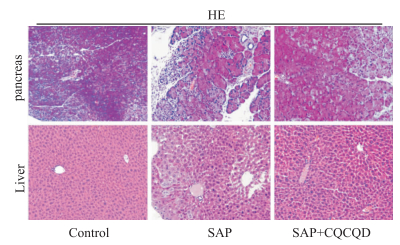
如Fig 2所示,Control组小鼠胰腺细胞结构清晰,未见炎性细胞浸润。SAP组小鼠胰腺组织明显水肿,细胞结构模糊不清,可见大片凝固性坏死,间质内有大量炎性细胞浸润及出血。CQCQD治疗后,胰腺组织水肿程度减轻,片状坏死区域减少。腺泡细胞轻度肿胀,仍可见不完整的腺泡结构,中性及巨噬细胞细胞浸润减少。Control组小鼠肝小叶结构清晰,肝细胞形态大小一致。无胞质空泡形成,无出血、坏死及炎性细胞浸润。SAP组小鼠出现肝细胞水肿,边界模糊,胞质空泡形成及炎性细胞浸润,且部分肝细胞坏死,肝脏毛细血管明显充血。给予CQCQD之后,肝组织水肿、坏死及炎性细胞浸润较SAP组小鼠均有不同程度的减轻。
|
| Fig 2 Pancreatic and liver injury of mice during SAP alleviated by CQCQD treatment (HE×100) |
Tab 1结果显示,与Control组比较,无论是反映胰腺功能的血清淀粉酶和脂肪酶含量,还是反映肝脏功能的血清ALT和AST含量,在SAP组小鼠中均出现明显升高,提示L-Arg注射诱发小鼠胰腺及肝脏功能受损,而CQCQD干预则能够不同程度地降低上述血清生化指标在SAP小鼠中的活性。
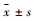
| Group | Amylase/U·L-1 | Lipase/U·L-1 | ALT/U·L-1 | AST/U·L-1 |
| Control | 6893.57±368.78 | 703.17±10.85 | 24.35±3.19 | 21.85±2.34 |
| SAP | 8266.67±625.03** | 724.13±12.47** | 30.82±5.28** | 25.61±2.64** |
| SAP+CQCQD | 7328.41±438.18## | 708.62±12.01# | 26.02±3.48# | 22.66±3.14# |
| **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs SAP | ||||
SAP组小鼠血清内毒素含量较Control组小鼠明显增加,CQCQD干预则能够减少SAP小鼠血清内毒素含量(Fig 3)。
|
Fig 3 Endotoxin in serum of mice during SAP reduced by CQCQD treatment (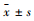 |
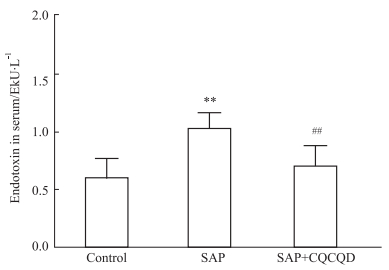
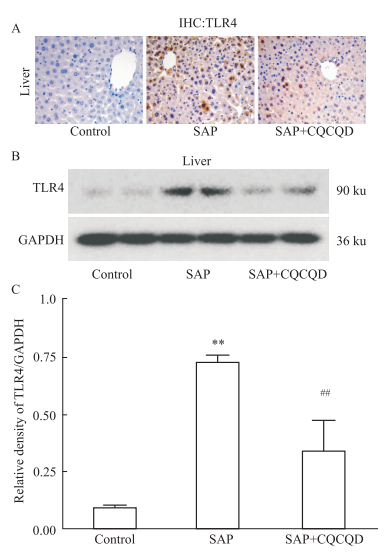
免疫组化显示,Control组小鼠肝组织内TLR4无表达,诱发SAP后,肝组织内TLR4的表达明显增强,其主要分布于受损的肝组织区域,肝细胞和炎症细胞均可见TLR4表达。CQCQD干预则可降低肝组织内TLR4的表达,镜下仅可见少数阳性染色的细胞。Western blot结果显示,类似于免疫组化的TLR4表达变化(Fig 4)。
|
Fig 4 Expression of TLR4 in liver of mice with SAP inhibited by CQCQD treatment (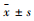 |
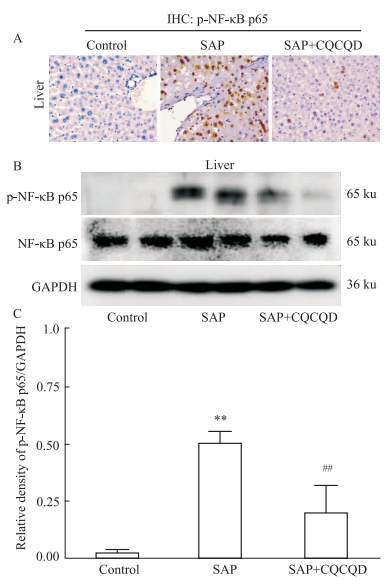
Fig 5的免疫组化显示,Control组小鼠肝组织内未见p-NF-κB p65阳性细胞,SAP组小鼠肝组织内p-NF-κB p65表达则明显增加,阳染细胞数明显增多,且胞核与胞质内均可见其表达。CQCQD干预能够明显减少肝组织内p-NF-κB p65阳性细胞数。Western blot结果显示类似的p-NF-κB p65表达变化。
|
Fig 5 Expression of p-NF-κB p65 in liver of mice with SAP inhibited by CQCQD treatment (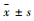 |
与Control组比较,SAP组炎性因子表达明显增加,表现为血清IL-6含量,肝组织内IL-6、TNF-α、MIP-1α mRNA水平均明显升高。CQCQD干预则能够降低血清IL-6,以及肝组织内IL-6、TNF-α、MIP-1α mRNA水平(Fig 6)。

|
Fig 6 Cytokines and chemokines of mice during SAP reduced by CQCQD treatment (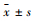 |
中医将急性胰腺炎纳入“胰瘅”“脾心痛”“腹痛”“结胸”等范畴,认为该病乃气机郁滞、中焦宣泄不利、腑气不通所致。根据“六腑以通为用”的中医理论,采用通里攻下治疗急性胰腺炎已取得共识。柴芩承气汤是通里攻下法代表方药之一[3],方中柴胡疏肝解郁退热、黄芩清热燥湿解毒、枳实破气消积散痞、厚朴燥湿下气除满、大黄泻下攻积、凉血解毒,芒硝润燥软坚、泻下通便。诸药同用具有清热解毒、活血化瘀、通里攻下的功效。临床实验表明[9],早期应用CQCQD能够减轻急性胰腺炎病人的临床症状,降低器官损伤程度,缩短入院治疗时间。动物实验也发现,CQCQD不仅能够减轻SAP发生时胰腺的损伤,而且对并发的肺脏[10]及肝脏[4]损伤也具有不同程度的保护作用。
课题组前期采用逆行胆管注射去氧胆酸钠复制大鼠SAP模型,发现CQCQD干预可以缓解SAP并发的肝损伤,其机制与抑制肝组织内氧化应激,降低肝组织炎性因子的水平有关[4]。为了排除造模方法和动物种属的依赖效应,本实验选用L-Arg腹腔注射诱发小鼠的SAP模型,该方法操作简单,L-Arg的用量与SAP的胰腺损伤呈正相关,易于控制SAP的病变程度,模型稳定[11]。此外,去氧胆酸钠造模法所致模型动物12 h死亡率较高,多选择在造模后4 h或者8 h处死动物,由于造模时间短、仅能给予1~2次CQCQD治疗。相比之下,L-Arg造模法在72 h处死动物,允许持续进行CQCQD的干预,更有利于观察中药汤剂的治疗效果。
本研究结果显示:模型组小鼠血清淀粉酶、脂肪酶、ALT和AST水平明显升高,胰腺与肝脏均出现不同程度的损伤。进一步检测炎性因子水平,发现小鼠血清内IL-6明显升高,肝组织内IL-6、TNF-α、MIP-1α mRNA的水平也明显高于对照组。柴芩承气汤干预后,小鼠胰腺和肝组织损伤明显缓解,表现为肝组织淤血水肿及肝细胞坏死程度的减轻,血清ALT、AST水平的降低,以及肝脏内炎性因子表达的减少。
我们的研究还发现,模型组小鼠血清内毒素含量明显升高。已有研究认为[5],SAP时易并发肠道功能紊乱、导致肠腔细菌增殖、肠黏膜屏障功能障碍、肠道细菌和内毒素易位、经肠腔吸收入血。作为肠道回流的首个脏器,肝脏遭受大量内毒素侵袭,将直接刺激肝组织中TLR4的表达。作为一种模式识别受体,TLR4广泛分布于包括肝细胞在内的多种细胞,是革兰阴性菌脂多糖胞内信号转导的主要受体,二者结合后,可活化细胞内NF-κB信号通路,进而诱导包括TNF-α、IL-6等炎性因子的合成和释放,引起组织的炎症反应[12]。已有研究发现[13],SAP发生时,肝组织内TLR4蛋白表达明显上调,NF-κB活性增加,且与肝损伤程度呈正相关;抑制TLR4的表达则能够减轻SAP动物的胰腺和肝组织损伤,提高生存率。因此,TLR4/NF-κB通路的活化已经被认为是调控SAP并发肝功能障碍的一个重要环节[14]。本研究发现,SAP组小鼠肝组织内TLR4蛋白表达明显上调,其主要分布于受损的肝组织区域,而且肝细胞和炎症细胞均可见TLR4表达。此外,p-NF-κB p65在SAP组小鼠肝组织中的表达明显升高,而非磷酸化NF-κB p65的表达无明显改变,说明NF-κB通路被激活。CQCQD干预后可见血清内毒素含量降低,肝脏内TLR4表达明显下降,NF-κB的活化程度受到抑制,肝脏内炎性因子IL-6、TNF-α、MIP-1α水平也明显下调。已有的临床实验显示,CQCQD可促进肠蠕动以改善肠道运动功能,因此认为CQCQD可能通过排除胃肠积滞,减轻肠道内毒素易位[15],抑制TLR4/NF-κB通路活化及其下游炎症因子的释放,进而发挥防治SAP并发肝损伤的作用。
| [1] |
陈彩云, 许秋霞, 张吟, 等. 水飞蓟素对急性胰腺炎大鼠急性肺损伤及MAPK/NF-κB信号通路的影响[J]. 中国药理学通报, 2019, 35(2): 192-7. Chen C Y, Xu Q X, Zhang Y, et al. Effect of silymarin on acute lung injury and MAPK/NF-κB signaling pathway in rats with acute pancreatitis[J]. Chin Pharmacol Bull, 2019, 35(2): 192-7. |
| [2] |
Lv P, Fan L J, Li H Y, et al. Protective effect of thalidomide on liver injury in rats with acute pancreatitis via inhibition of oxidative stress[J]. Ann Clin Lab Sci, 2015, 45(5): 508-14. |
| [3] |
李红, 刘俊保, 姜艳梅. 柴芩承气汤治疗重症急性胰腺炎[J]. 中医学报, 2018, 33(12): 2454-7. Li H, Liu J B, Jiang Y M. Chaiqinchengqi decoction in treatment of severe acute pancreatitis[J]. Acta Chin Med, 2018, 33(12): 2454-7. |
| [4] |
党琳, 张晓芹, 刘芳, 等. 柴芩承气汤对重症急性胰腺炎并发肝损伤大鼠的治疗作用及其机制[J]. 中国应用生理学杂志, 2017, 33(6): 550-4. Dang L, Zhang X Q, Liu F, et al. Therapeutic effects of chaiqinchengqi decoction on severe acute pancreatitis complicated liver damage in rats and its mechanisms[J]. Chin J Appl Physiol, 2017, 33(6): 550-4. |
| [5] |
陈炳合, 李文星, 范晓彬, 等. 肠源性内毒素水平与肝脏Toll样受体4表达在大鼠重症急性胰腺炎肝损伤中变化[J]. 中国普通外科杂志, 2013, 22(7): 911-5. Chen B H, Li W X, Fan X B, et al. Alterations of intestinal endotoxin level and liver expression of Toll-like receptor 4 in rats with liver injury caused by severe acute pancreatitis[J]. Chin J Gen Surg, 2013, 22(7): 911-5. |
| [6] |
Zhang X, Zhu C, Wu D, et al. Possible role of toll-like receptor 4 in acute pancreatitis[J]. Pancreas, 2010, 39(6): 819-24. |
| [7] |
Biczo G, Vegh E T, Shalbueva N, et al. Mitochondrial dysfunction, through impaired autophagy, leads to endoplasmic reticulum stress, deregulated lipid metabolism, and pancreatitis in animal models[J]. Gastroenterology, 2018, 154(3): 689-703. |
| [8] |
黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-72. Huang J H, Huang X H, Chen Z Y, et al. Dose conversion among different animals and healthy volunteers in pharmacological study[J]. Chin J Clin Pharmacol Ther, 2004, 9(9): 1069-72. |
| [9] |
Wang L, Li Y, Ma Q, et al. Chaiqinchengqi decoction decreases IL-6 levels in patients with acute pancreatitis[J]. J Zhejiang Univ Sci B, 2011, 12(12): 1034-40. |
| [10] |
Wu W, Luo R, Lin Z, et al. Key molecular mechanisms of chaiqinchengqi decoction in alleviating the pulmonary albumin leakage caused by endotoxemia in severe acute pancreatitis rats[J]. Evid Based Complement Alternat Med, 2016, 2016: 3265368. |
| [11] |
Su K H, Cuthbertson C, Christophi C. Review of experimental animal models of acute pancreatitis[J]. HPB (Oxford), 2006, 8(4): 264-86. |
| [12] |
Kuzmich N N, Sivak K V, Chubarev V N, et al. TLR4 signaling pathway modulators as potential therapeutics in inflammation and sepsis[J]. Vaccines (Basel), 2017, 5(4): 34. |
| [13] |
Pan L F, Yu L, Wang L M, et al. Augmenter of liver regeneration (Alr) regulates acute pancreatitis via inhibiting HMGB1/TLR4/NF-κB signaling pathway[J]. Am J Transl Res, 2018, 10(2): 402-10. |
| [14] |
Wang Q, Zhang X, Lei S, et al. RNA sequence analysis reveals pathways and candidate genes associated with liver injury in a rat pancreatitis model[J]. Pancreatology, 2018, 18(7): 753-63. |
| [15] |
朱林, 陈亚忠. 早期肠内营养联合柴芩承气汤治疗重症急性胰腺炎的临床观察[J]. 世界中医药, 2017, 12(12): 3020-2. Zhu L, Chen Y Z. Clinical observation on early enteral nutrition combined with chaiqinchengqi decoction in the treatment of severe acute pancreatitis[J]. World Chin Med, 2017, 12(12): 3020-2. |

