

2. 中国人民解放军南部战区总医院药学部,广东 广州 510010
2. Dept of Pharmacy, General Hospital of Southern Theater Command, Guangzhou 510010, China
鱼藤素是一种天然黄酮类化合物,在肿瘤发生、转移、凋亡和血管生成的综合信号通路中,在肿瘤细胞凋亡和恶性转移过程中发挥着关键的作用。鱼藤素对肺癌、乳腺癌、肝癌、淋巴癌及骨髓瘤等多种肿瘤具有化学防治作用[1-4],揭示了鱼藤素对多种肿瘤有潜在的预防和治疗作用。但是有研究表明在高剂量的鱼藤素浓度下可能会产生毒副作用,能够减弱阳性神经元酪氨酸羟化酶的活性,从而引发帕金森样综合症[5],这阻碍鱼藤素成为潜在的抗肿瘤药物。
氧化应激对正常细胞的生长起调控作用,在肿瘤细胞代谢中也能产生重大的影响[6]。氧化应激是由自由基在体内产生的一种负面作用,并被认为是导致衰老和疾病的重要因素[7-8]。由于活性氧的反应性,高浓度的活性氧(reactive oxygen species,ROS)可导致细胞死亡或氧化应激,即破坏促氧化和抗氧化水平之间的平衡,并且ROS能够氧化各种细胞成分,导致细胞氧化破坏[9]。神经元细胞膜中的不饱和脂肪酸含量高,耗氧量高,抗氧化防御能力弱,因此,氧化应激极易对神经系统造成损伤,造成神经细胞受损和神经元的丢失,从而演变为神经退变性疾病[10-11]。
MAPK/ERK信号通路调控多种细胞活动,包括增殖、分化、存活和死亡。MAPK/ERK信号通路的失调与许多人类疾病的发展密切相关,其中包括阿尔采末病(Alzheimer’s disease,AD)、帕金森病(Parkinson's disease,PD)和各种肿瘤[12]。有相关研究表明MAPK/ERK信号通路对于神经细胞功能的调节起到十分重要的作用[13]。
本研究通过测定氧化应激相关指标和MAPK/ERK信号通路相关蛋白表达,探究鱼藤素致神经毒性的潜在相关机制。
1 材料 1.1 细胞株人神经瘤细胞株SH-SY5Y, 由人民解放军南部战区总医院医学实验科提供
1.2 试剂鱼藤素(美国sigma公司,批号:D0817,HPLC级)、二甲基亚砜(美国sigma公司,批号:RNBD6895);活性氧ROS检测试剂盒(批号:S0033),LDH乳酸脱氢酶测试试剂盒(批号:A020-1),总SOD活性检测试剂盒(批号:S0101),脂质氧化(MDA)检测试剂盒(批号:S0131),谷胱甘肽过氧化物酶检测试剂盒(批号:S0056),Western blot及IP细胞裂解液(批号:P0013),100 mmol·L-1PMSF(批号:ST506),BCA蛋白定量试剂盒(批号:P0012),SDS-PAGE蛋白上样缓冲液(5×)(弗德生物公司,批号:FD002),SDS-PAGE凝胶快速配制试剂盒(批号:P0012AC),均购自碧云天公司;蛋白Maker(美国Thermo公司,批号:26616),山羊抗兔IgG H & L (HRP) (天津三箭,批号:LK2001);p-ERK1/2 Rabbit mAb(批号:4370),ERK1/2 Rabbit mAb(批号:4695)均购自Cell signaling technology;Anti-MEK1 + MEK2抗体(批号:ab178876),Anti-MEK1 + MEK2 (phospho S218 + S222)(批号:ab194754),Anti-CREB抗体(批号:ab32515),均购自abcam;EGF Antibody(批号:DF2225),GAPDH Antibody(批号:AF7021),均购自affinity。
1.3 仪器3111水套式CO2细胞培养箱(美国Thermo公司),G41054-F000型台式离心机(KUBOTA公司),IX7型倒置荧光显微镜(日本OLYMPUS公司),HWS28型恒温水浴锅(上海精宏实验设备有限公司),Multiscan-GO型全波长酶标仪,RRESCO 17型低温高速离心机(美国Thermo公司),BD LSRFortessa流式细胞仪(美国BD公司),ACY-1002-U型超纯水机(美国Aquapro公司),PowerPac电泳仪、Sub-Cell电泳槽、Tans-Blot Turbo Transfer System转膜仪(美国伯乐Bio-Rad),MiniChemi Ⅲ化学发光成像仪(北京赛智创业科技有限公司)。
2 方法 2.1 鱼藤素的配制100 mmol·L-1鱼藤素母液配制:将50 mg鱼藤素完全溶解于1.27 mL的DMSO溶液中,并于-20 ℃低温避光保存,实验组中不同浓度的鱼藤素用新鲜培养基稀释,现配现用。
2.2 细胞培养从液氮罐中取出神经母细胞瘤(SH-SY5Y)细胞,迅速37 ℃水浴复苏,并在超净工作台将细胞转移至离心管中,加入适量含10%胎牛血清的高糖DMEM培养基,以1 000 r·min-1转速离心5 min,去掉上层旧液后加入新鲜培养基,于37 ℃、5% CO2恒温培养箱培养,取对数生长期细胞进行后续实验。
2.3 CCK-8法检测细胞增殖毒性取对数生长细胞,以5×107·L-1的密度接种于96孔板中,每孔接种细胞液100 μL,每组5个复孔,放入37 ℃、5% CO2恒温培养箱培养,使细胞贴壁生长。次日去除旧培养基,以浓度为1.56 μmol·L-1,3.13 μmol·L-1,6.25 μmol·L-1,12.5 μmol·L-1,25 μmol·L-1,50 μmol·L-1,100 μmol·L-1的鱼藤素作用于SH-SY5Y细胞24 h、48 h、72 h后,将培养基与CCK-8试剂按9 :1比例配制的混合液以每孔100 μL加入,在培养箱中孵育2 h,在450 nm波长处,酶标仪测定吸光度OD值。细胞存活率/%=[(OD实验组-OD空白组)/(OD对照组-OD空白组)] ×100%。实验平行重复3次,后续计算得到其细胞存活率。
2.4 细胞比色法测定LDH、MDA、SOD、GPx活力根据细胞中乳酸脱氢酶(lactate dehydrogenase,LDH)催化乳酸生成丙酮酸二硝基苯肼化合物,产物与显色剂反应生成的化合物在碱性溶液中呈棕红色,通过比色法可测得细胞上清液中LDH的含量。根据细胞中的LDH漏出量,可判断细胞的受损程度。取对数生长期细胞,以1×108·L-1的密度,按每孔2 mL进行接种,均匀分布。在恒温培养箱中培养24 h,使细胞贴壁。根据CCK-8法测定的结果设置低、中、高浓度实验组如下:A组:对照组;B组:12.5 μmol·L-1鱼藤素;C组:25 μmol·L-1鱼藤素;D组:50 μmol·L-1鱼藤素。药物处理细胞后,取细胞培养上清液,按照LDH试剂盒操作说明进行检测和计算。
丙二醛(malondialdehyde,MDA)和硫代巴比妥酸(thiobarbituric acid,TBA)反应产生红色的三甲川产物,在532 nm处有最大吸收峰。通过TBA法可测定样本中的MDA含量,从而检测细胞脂质氧化水平。谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)可以清除活细胞内过氧化物,在保护细胞免受自由基损伤过程中起着关键作用。GPx可以催化谷胱甘肽(glutathione,GSH)产生氧化型谷胱甘肽(oxidized glutathione,GSSG),而谷胱甘肽还原酶可以利用还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)催化GSSG产生GSH,通过检测NADPH的减少量就可以计算出谷胱甘肽过氧化物酶的活力水平。WST-8和黄嘌呤氧化酶(xanthine oxidase,XO)催化产生的超氧化物阴离子(O2-)反应产生水溶性的甲臜染料,此反应可被SOD所抑制,因此SOD的活性与甲臜染料的生成量成负相关,从而通过对WST-8产物的比色分析即可计算SOD的酶活力。取对数生长期细胞,以1×108·L-1的密度,按每孔2 mL进行接种,均匀分布。在恒温培养箱中培养24 h,使细胞贴壁。实验分组同“LDH的测定”,药物作用24 h后,用PBS缓冲液洗涤2次。取适量的细胞裂解液适当吹打裂解细胞15~20 min,裂解完毕后,将裂解液收集于EP管中,12 000 r·min-1转速下离心10 min,取上清液,按照SOD、MDA、GPx试剂盒操作说明进行相应的检测和计算。
2.5 流式细胞术法检测细胞ROS水平取对数生长期细胞,以1×108·L-1的密度,按每孔2 mL进行接种,均匀分布。在恒温培养箱中培养24 h,使细胞贴壁。实验分组同“2.4”,药物作用24 h后收集细胞,1 000 r·min-1转速下离心5 min,去除上清液。用无血清的培养基按1 000 :1的比例将10 mmol·L-1的DCFH-DA母液,每个样品用1 mL稀释液悬浮细胞,在37 ℃避光敷育30 min。期间每隔5 min振荡1次,离心后,PBS洗涤并重悬细胞。用流式细胞仪检测各组细胞ROS水平。
2.6 Western blot检测细胞中EGF、ERK、CREB蛋白的表达取对数生长期的SH-SY5Y细胞,每孔均匀接种2 mL密度为1×108·L-1的细胞,于培养箱培养24 h贴壁后,实验分组同“2.4”,药物处理24 h后,除去旧培养基,加入2 mL PBS缓冲液洗涤2次,加入100 μL配置好的细胞裂解液(每1 mL的细胞裂解液中含10 μL PMSF,现配现用),在冰上裂解30 min,期间间隔5 min吹打细胞,细胞刮收集蛋白裂解液,并置于提前预冷至4 ℃的离心机中,12 000 r·min-1转速下离心20 min。离心完毕,将上清液吸出,通过BCA法测定蛋白浓度,按体积4 :1加入5×loading buffer,于沸水中煮沸5 min,使蛋白充分变性,保存于-20 ℃冰箱中。采用12% SDS-PAGE胶跑电泳,用PVDF膜进行转膜,用5%的脱脂奶粉配置的TBST封闭液室温封闭1 h,TBST缓冲液洗膜3次,每次10 min,然后加稀释1 000倍的一抗4 ℃孵育过夜,一抗孵育完毕,回收孵育盒中的一抗,加入1×TBST缓冲液洗膜3次,每次10 min。加入相应稀释5 000倍的二抗孵育1 h,用1×TBST缓冲液洗膜3次,每次10 min,最后ECL显像液显影,得出蛋白条带灰度后,使用Image Jx软件分析蛋白条带的灰度值,以GAPDH为内参,以目的条带光密度值和GAPDH光密度值的比值即为目的蛋白的相对表达水平。
2.7 统计学分析所有数据采用x±s方式表示,采用SPSS 22.0进行统计分析。采用单因素方差分析(One way ANOVA)进行组间比较分析,若方差齐性,则采用LSD法进行组间比较,若方差不齐,则采用Dunnett’s T3法进行多重比较, 同时采用GraphPad Prism 7.0软件作图。
3 结果 3.1 鱼藤素对SH-SY5Y细胞增殖的影响浓度为1.56、3.13、6.25、12.5、25、50、100 μmol·L-1的鱼藤素作用SH-SY5Y细胞24 h、48 h、72 h后,测得其细胞存活率如下图如Fig 1所示。随着药物作用浓度的增加和作用时间的延长,SH-SY5Y细胞的存活率均下降(P < 0.05)。鱼藤素作用于SH-SY5Y细胞24 h、48 h、72 h的IC50值分别为28.25±1.67、19.36±1.44、11.50±0.89 μmol·L-1。结果表明,鱼藤素对SH-SY5Y细胞的增殖有抑制作用并呈浓度和时间依赖性。
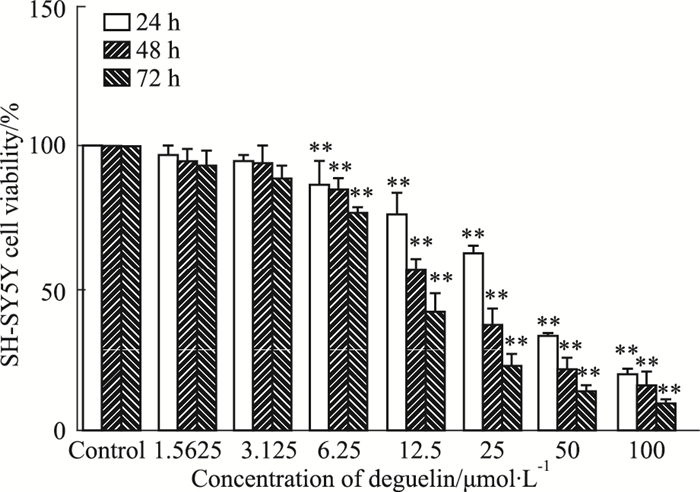
|
| Fig 1 Effects of different concentrations of deguelin on inhibitory rate of SH-SY5Y cells treated for 24, 48 and 72 h (x±s, n=3) **P < 0.01 vs control group |
细胞上清液中LDH水平反映了细胞的受损程度。0、12.5、25、50 μmol·L-1鱼藤素作用于SH-SY5Y细胞24 h后,测得SH-SY5Y细胞的LDH漏出量,结果如Fig 2所示。结果表明,高于25 μmol·L-1的鱼藤素作用SH-SY5Y细胞后,LDH漏出量明显增加,并呈现浓度依赖性。
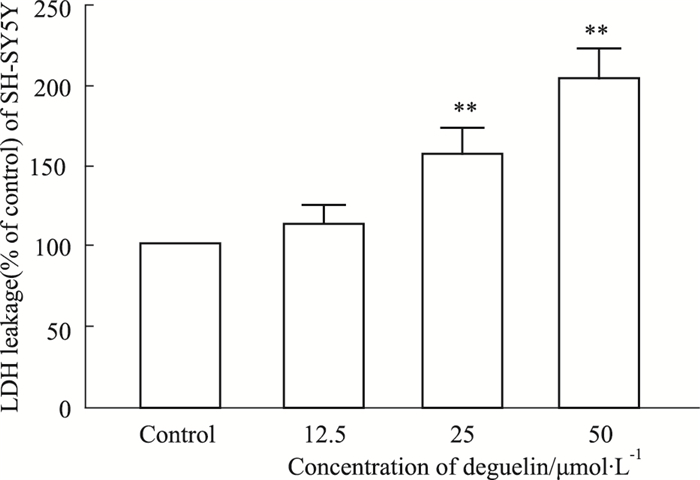
|
| Fig 2 The LDH leakage (% of control) of SH-SY5Y cells treated with different concentrations of deguelin for 24 h (x±s, n=3) **P < 0.01 vs control group |
0、12.5、25、50 μmol·L-1鱼藤素作用于SH-SY5Y细胞24 h后,测得SH-SY5Y细胞的ROS水平,结果如Fig 3和Tab 1所示。与对照组相比,12.5、25、50μmol·L-1鱼藤素处理后的细胞内的ROS水平明显增加,对照组中的ROS水平为1102.4±105.6,而随着鱼藤素给药浓度的增加,ROS水平增加,12.5 μmol·L-1、25 μmol·L-1、50 μmol·L-1鱼藤素作用后测得ROS分别为1891.6±92.71、2828.3±76.49、4605.0±141.6,结果表示ROS水平的变化呈浓度依赖性,同时说明鱼藤素对SH-SY5Y细胞造成的损伤可能与ROS产生有关。
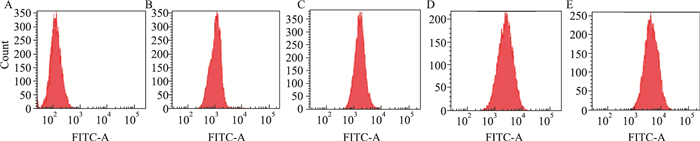
|
| Fig 3 Determination of ROS of SH-SY5Y cells after deguelin treatment for 24 h (x±s, n=3) |
| Deguelin/μmol·L-1 | ROS intensity |
| Blank | 137.2±10.6 |
| 0 | 1102.4±105.6 |
| 12.5 | 1891.6±92.71** |
| 25 | 2828.3±76.49** |
| 50 | 4605.0±141.6** |
| A: Blank group; B: Control group; C: 12.5 μmol·L-1 deguelin treated group; D: 25 μmol·L-1 deguelin treated group; E: 50 μmol·L-1 deguelin treated group. ** P < 0.01 vs control group | |
0、12.5、25、50 μmol·L-1鱼藤素作用于SH-SY5Y细胞24 h后,测定细胞中SOD和Gpx的活力以及MDA含量,结果如Fig 4所示,与对照组相比,随着鱼藤素作用浓度的增加,SH-SY5Y细胞内SOD和GPx活力出现逐步降低的趋势;MDA含量明显升高。鱼藤素对SH-SY5Y细胞的损伤伴随着氧化应激相关指标的变化,说明氧化应激与其神经毒性密切相关。
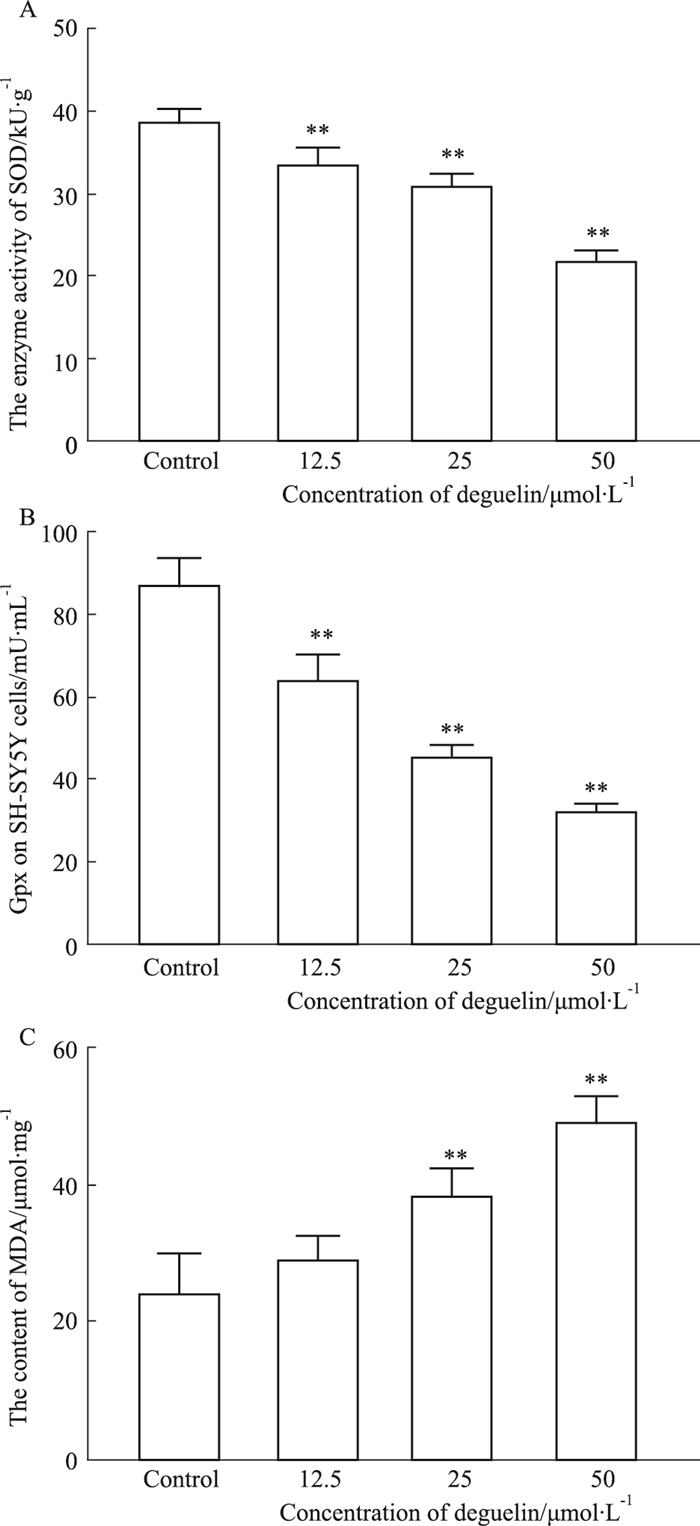
|
| Fig 4 SOD(A), Gpx(B) and MDA(C) activities of SH-SY5Y cells treated with different concentrations of deguelin for 24 h (x±s, n=3) **P < 0.01 vs control group |
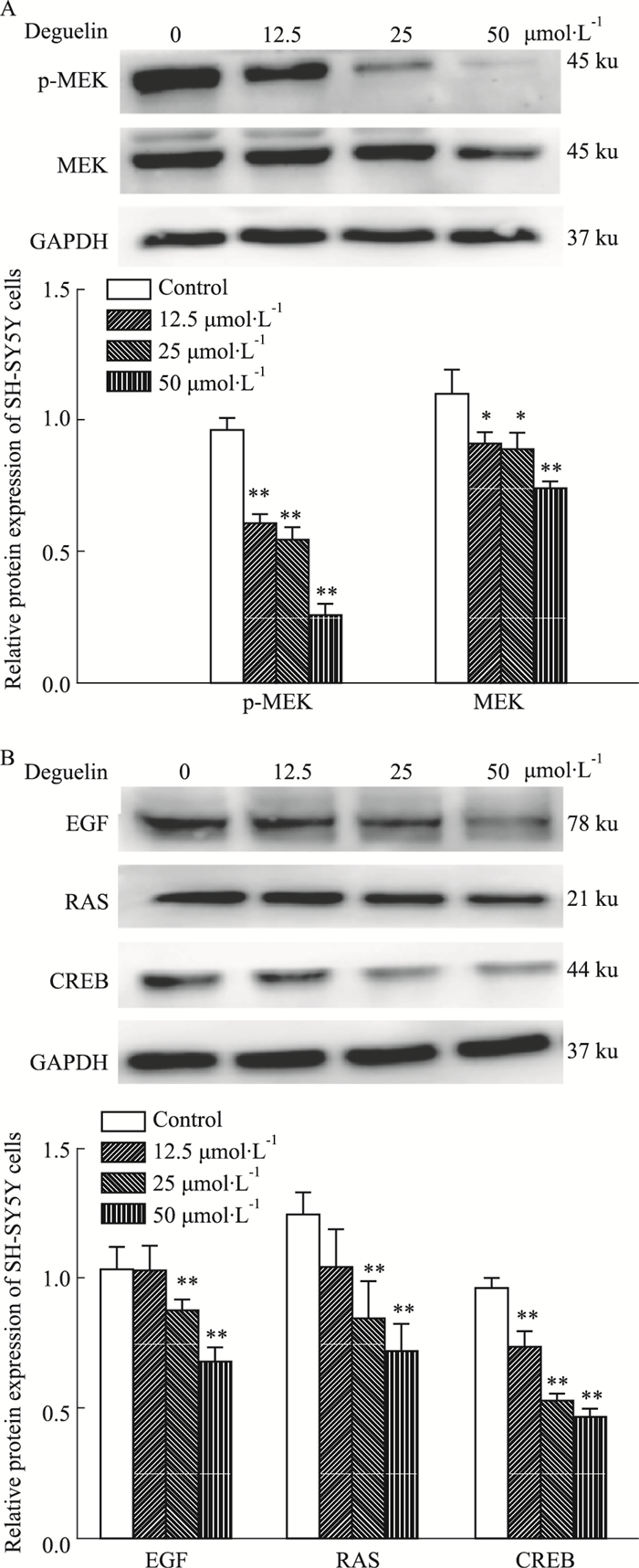
0、12.5、25、50 μmol·L-1浓度的鱼藤素作用于SH-SY5Y细胞24 h后测定细胞内MEK、EGF、RAS、CREB蛋白表达水平,结果如Fig 5所示。与对照组相比,各个浓度的鱼藤素组能够下调P-MEK、MEK和CREB蛋白蛋白的表达(P < 0.05)。25.0 μmol·L-1及其以上浓度的鱼藤素能够下调EGF和RAS蛋白的表达(P < 0.01)。
|
| Fig 5 Expression levels of p-MEK, MEK(A) and EGF, RAS, CREB(B) in SH-SY5Y cells treated with different concentrations of deguelin for 24 h (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
许多研究表明,鱼藤素具有潜在的抗肿瘤活性,但是给予大鼠治疗剂量的鱼藤素后,大鼠出现了帕金森样综合症[5]。中枢神经系统退行性疾病的发生与氧化应激密切相关。氧化应激被认为是衰老和各种神经障碍的关键因子,酶催化的各种氧化还原反应在氧化磷酸化过程中发生[10]。当机体发生氧化应激时,其体内脂质氧化水平会提高,同时清除自由基能力会下降,促进了神经细胞的凋亡[14]。SOD和Gpx能够清除活细胞内过氧化物,ROS、MDA是与脂质氧化水平密切相关的标志物,测定细胞中抗氧化酶的活力和细胞脂质氧化水平,可以探究细胞的损伤情况。本研究采用的神经母细胞瘤SH-SY5Y细胞系具有合成多巴胺和去甲肾上腺素能力,被广泛用于神经系统疾病发病机制的研究[15]。实验结果发现,鱼藤素干预后,细胞内氧化应激水平提升,并随着鱼藤素浓度的增加愈发明显,说明鱼藤素使SH-SY5Y细胞发生氧化应激,致使细胞抵御外界损伤能力减弱。
采用蛋白免疫印迹实验探究MAPK/ERK通路中的EGF、RAS、CREB、p-MEK和MEK蛋白表达水平,发现随着鱼藤素浓度的增加,对蛋白表达均有不同程度的抑制。结果说明,MAPK/ERK通路可能在鱼藤素致SH-SY5Y细胞毒性中可能起关键作用。后续需要通过基因沉默技术与靶向抑制剂进行深入的探究其是否为鱼藤素产生神经毒性的靶向信号通路。
综上所述,鱼藤素致SH-SY5Y细胞神经毒性的机制可能是降低细胞内抗氧化酶SOD和Gpx的活力,增加丙二醛MDA和活性氧ROS的生成,导致细胞不饱和脂肪酸过氧化。其中可能通过下调MAPK/ERK通路的相关蛋白表达使细胞活性受损,这为进一步研究鱼藤素的结构改造与降低鱼藤素毒性提供依据。
( 致谢: 本实验在南部战区总医院医学实验科完成,特别感谢医学实验科各实验室老师的指导和帮助 )
| [1] |
Kang W, Zheng X, Wang P, Guo S. Deguelin exerts anticancer activity of human gastric cancer MGC-803 and MKN-45 cells in vitro[J]. Int J Mol Med, 2018, 41(6): 3157-66. |
| [2] |
Hsiao Y, Fan M, Huang A, et al. Deguelin impairs cell adhesion, migration and invasion of human lung cancer cells through the NF-κB signaling pathways[J]. Am J Chin Med, 2018, 46(1): 209-29. |
| [3] |
Wu W, Hai Y, Chen L, et al. Deguelin-induced blockade of PI3K/protein kinase B/MAP kinase signaling in zebrafish and breast cancer cell lines is mediated by down-regulation of fibroblast growth factor receptor 4 activity[J]. Pharmacol Res Perspect, 2016, 4(2): e00212. doi:10.1002/prp2.212 |
| [4] |
白美玲, 刘星亮, 张林西, 等. 鱼藤素对食管癌EC-109细胞增殖的抑制作用及部分机制[J]. 中国药理学通报, 2016, 32(8): 1181-2. Bai M L, Liu X L, Zhang L X, et al. Inhibitory effect of deguelin on esophageal cancer EC109 cells and its mechanism[J]. Chin Pharmacol Bull, 2016, 32(8): 1181-2. doi:10.3969/j.issn.1001-1978.2016.08.029 |
| [5] |
Caboni P, Sherer T B, Zhang N, et al. Rotenone, deguelin, their metabolites, and the rat model of Parkinson's disease[J]. Chem Res Toxicol, 2004, 17(11): 1540-8. doi:10.1021/tx049867r |
| [6] |
Zhao Y, Hu X, Liu Y, et al. ROS signaling under metabolic stress:cross-talk between AMPK and AKT pathway[J]. Mol Cancer, 2017, 16(1): 79. |
| [7] |
Davalli P, Mitic T, Caporali A, et al. ROS, cell senescence, and novel molecular mechanisms in aging and age-related diseases[J]. Oxid Med Cell Longev, 2016, 2016: 3565127. |
| [8] |
Santos A L, Sinha S, Lindner A B. The good, the bad, and the ugly of ROS:new insights on aging and aging-related ddiseases from eukaryotic and prokaryotic model organisms[J]. Oxid Med Cell Longev, 2018, 2018: 1941285. |
| [9] |
Dat J, Vandenabeele S, Vranova E, et al. Dual action of the active oxygen species during plant stress responses[J]. Cell Mol Life Sci, 2000, 57(5): 779-95. doi:10.1007/s000180050041 |
| [10] |
Singh A, Kukreti R, Saso L, et al. Oxidative stress: a key modulator in neurodegenerative diseases[J]. Molecules, 2019, 24(8): pii: E1583. doi:10.3390/molecules24081583 |
| [11] |
Islam M T. Oxidative stress and mitochondrial dysfunction-linked neurodegenerative disorders[J]. Neurol Res, 2017, 39(1): 73-82. |
| [12] |
Kim E K, Choi E J. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochim Biophys Acta, 2010, 1802(4): 396-405. doi:10.1016/j.bbadis.2009.12.009 |
| [13] |
Subramaniam S, Unsicker K. Extracellular signal-regulated kinase as an inducer of non-apoptotic neuronal death[J]. Neuroscience, 2006, 138(4): 1055-65. doi:10.1016/j.neuroscience.2005.12.013 |
| [14] |
彭琳, 唐小海, 严伟, 等. 果胶阿霉素对大鼠心脏毒性的研究[J]. 中国药理学通报, 2016, 32(8): 1075-80. Peng L, Tang X H, Yan W, et al. Study of pectin-adriamycin conjugate to cardiac toxicity in rats[J]. Chin Pharmacol Bull, 2016, 32(8): 1075-80. doi:10.3969/j.issn.1001-1978.2016.08.009 |
| [15] |
Xicoy H, Wieringa B, Martens G J. The SH-SY5Y cell line in Parkinson's disease research:a systematic review[J]. Mol Neurodegener, 2017, 12(1): 10. doi:10.1186/s13024-017-0149-0 |

