

心律失常是临床常见疾病, 极大影响患者的生活质量和生命安全。因此抗心律失常药物的研发是目前医疗事业重要的任务之一[1]。合适的抗心律失常模型是药物研发的重要前提, 整体动物的心律失常模型, 与临床疾病发生、发展的相似性较高且重复性较好, 但其传统的检测手段多存在技术要求高、劳动太过密集等不足。体外心律失常模型已被较多研究者重视, 建立新型、准确的体外心律失常检测手段对于抗心律失常药物的研发已亟不可待。实时细胞分析RTCA Cardio系统能对细胞状态进行实时、准确、敏感的监测, 观察心肌搏动频率、幅度和波动节律不规则性等指标的变化[2]。心肌细胞具有自发性节律性离子交换、同步搏动等特点, 且排除了机体神经、体液等各种复杂因素的干扰, 是离体心律失常模型较为理想的选择[3]。乌头碱可导致室性快速性心律失常[4]。因此, 本实验以乌头碱为工具药, 结合整体动物实验, 利用RTCA Cardio技术检测乌头碱对心肌细胞的影响, 建立体外心律失常评价技术, 为抗心律失常药物的评价及研发提供方法学依据。
1 材料 1.1 实验动物♂ SD大鼠, 体质量(200±20 g), 由北京华阜康实验动物中心提供, 合格证号:SCXK(京)2009-0004;天津中医药大学实验动物中心饲养; 1~2 d SD大鼠:中国人民解放军军事医学科学院卫生学环境医学研究所实验动物中心, 许可证号:scxk(军)2009-003。
1.2 主要试剂及材料乌头碱:成都曼思特生物科技有限公司生产, 批号MUST-13012802;胎牛血清:Gibco公司, 批号1227693。DMEM高糖培养基:Hyclone公司, 批号NYL1023;胰蛋白酶:Gibco公司, 批号1371058;二型胶原酶:Gibco公司, 批号1102392;DMSO:北京索莱宝科技有限公司, 批号8023271。
1.3 实验仪器八导生理记录仪(MP-100, 美国BIOPAC); 酶标仪(Multiskan Ascent, Thermo Labsystems, 美国); CO2恒温培养箱(Thermo Scientific Cytoperm公司); 倒置相差显微镜(德国XD-101 98010);96孔电极板(美国罗氏公司产品); Milli-Q纯水系统(Millipore); 实时无标记心肌细胞分析系统(RTCA Cardio美国罗氏公司)。
2 方法 2.1 在体动物实验观察乌头碱诱发心律失常实验选取♂ SD大鼠体重(200±20) g, 质量分数20%的乌拉坦0.06 mL·kg-1麻醉, 仰位固定, 针形电极, 插入四肢皮下, 连续记录标准肢体Ⅱ导联ECG。待心电图稳定5 min后, 快速(10 s内)舌下静脉注射乌头碱50 mg·g-1[5], 随后记录1 h心电图、统计心率、RR间期及心律失常类型。
2.2 RTCA Cardio系统E-Plate Cardio 96细胞接种密度的筛选取新生1~2 d的大鼠乳鼠, 无菌操作取出心脏心尖部, 放入预冷的DMEM中, 冲洗后剪去血管和心房组织, DMEM漂洗3次, 将心尖转移到D-Hank’s中, 用眼科剪剪成约1 mm3的小块, 加入消化酶溶液(质量分数0.07%的Trypsin和质量分数0.05%的Collagenase Type Ⅱ in D-Hanks) 37 ℃水浴震荡消化20 min, 收集上清液过200目细胞筛, 收集细胞悬液, 800 r·min-1离心5 min, 用DMEM培养基(添加10% FBS、10万U·L-1青霉素和100 mg·L-1链霉素, pH7.2)重悬细胞, 将细胞悬液收集到培养瓶中进行差速贴壁2次, 每次60 min, 将差速贴壁后的心肌细胞悬液接种于质量分数0.1%的明胶溶液包被E-Plate Cardio 96板中培养。心肌细胞浓度梯度初步设为5.00×103、2.00×104及1.00×105个/孔, 实时记录72 h后, 脱机分析不同原代心肌细胞浓度梯度CI值的均值和偏差选择最佳心肌细胞接种密度。
2.3 基于RTCA Cardio系统评价乌头碱诱发心律失常原代培养心肌细胞按2.00×104个/孔的细胞数接种, 当搏动稳定后开始加药, 乌头碱浓度梯度为0 μmol·L-1、2 μmol·L-1、4 μmol·L-1、8 μmol·L-1。设置仪器监测步骤为:Step 1, 每隔1 min监测一次, 循环10次; Step 2, 每隔1 h监测一次, 循环48次; Step 3, 每隔15 min监测一次, 循环8次; Step 4, 每隔1 min监测一次, 循环10次(加药前); Step 5, 每隔1 min监测一次, 循环60次(加药后); Step 6, 每隔5 min监测一次, 循环12次; Step 7, 每隔15 min监测一次, 循环100次。接种24 h后, 将预先温育的细胞培养基(10% FBS DMEM), 沿孔壁在每孔中加入150 μL培养基; d 3加药前换液185 μL/孔, 在仪器上平衡2 h后加药, 继续监测。监测结束后, 脱机使用RTCA Cardio系统自带数据分析模块, 分析细胞搏动情况、CI值曲线、Normalized beating rate(搏动频率)、Normalized amplitude(搏动幅度)以及Beating Rhythm Irregularity(节律不规则性)。
2.4 统计学分析所有数据均以(x±s)表示, 采用SPSS 17.0统计软件对各组进行配对t检验, 判断其显著性。
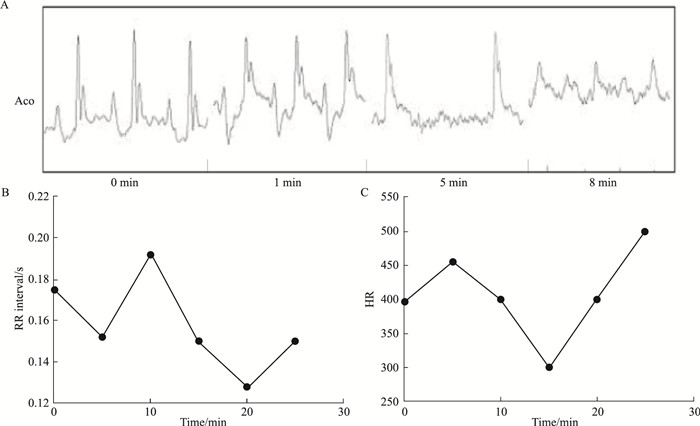
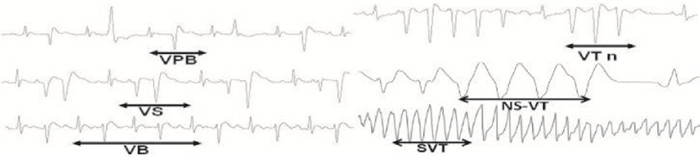
3 结果 3.1 乌头碱诱发实验大鼠心律失常的实验结果造模前心电图为正常窦性心律, 舌下静脉注射乌头碱1 min后, 发生明显的室性心律失常。注射乌头碱后5 min, 尤其以出现较严重的非持续性室性心动过速(VT n), 待注射乌头碱后8 min时, 出现持续性室速, 有的甚至发生室颤(Fig 1A)。当静脉注射乌头碱10 min后, RR间期明显缩短(Fig 1B); 15 min后, 观察到心率显著上升, 这种状态能维持10~15 min(Fig 1C)。静脉注射乌头碱后出现室性心律失常。按顺序发生的心律失常类型依次是VPB、VS、VTn、VB、NS-VT、SVT(Fig 2)。
|
| Fig 1 ECG, RR interval and heart rate results of arrhythmia induced by aconitine A: ECG of arrhythmia induced by aconitine; B: Effect of aconitine on RR interval; C: Effect of aconitine on heart rate, n=8 |
|
| Fig 2 Six types of arrhythmias induced by aconitine VS, ventricular ejection; VPB, ventricular premature beat; VB, ventricular binary rhythm; VTn, paroxysmal ventricular tachycardia; NS-VT, non-persistent ventricular tachycardia; SVT, persistent ventricular tachycardia |
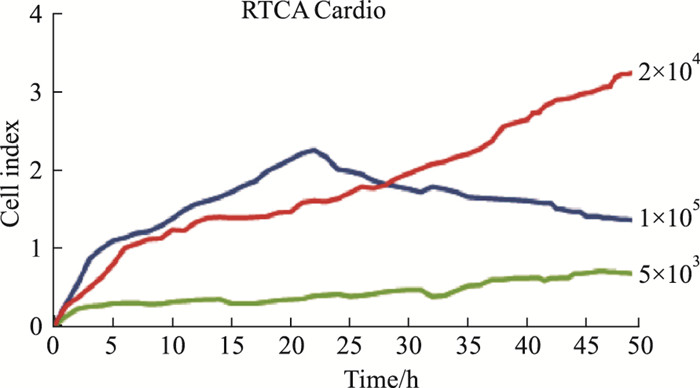
如Fig 3所示, RTCA Cardio系统监测细胞接种密度, 若接种密度偏小, CI值过小, 则不能形成细胞搏动同步化; 若接种密度过大, CI值以先缓慢增长, 随后很快下降的趋势(由于细胞接种过多, 前期细胞有增长, 但很慢, 后期细胞铺满孔底, 生长状态不佳, CI值逐渐下降)因此, 通过E-Plate Cardio 96的最佳接种密度筛选, 以2.00×104个/孔接种最优。
|
| Fig 3 Screening suitable cell inoculation density by RTCA Cardio system: CI value curve of different density primary cardiac myocytes |
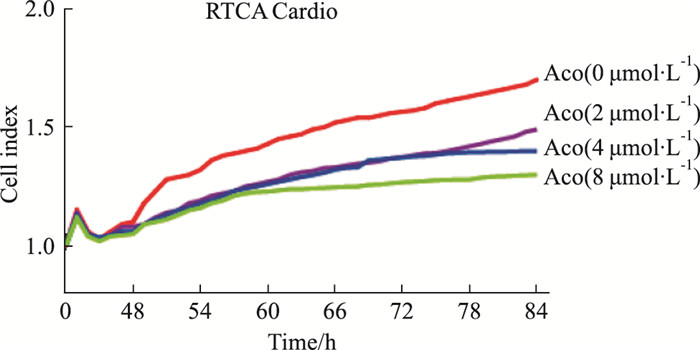
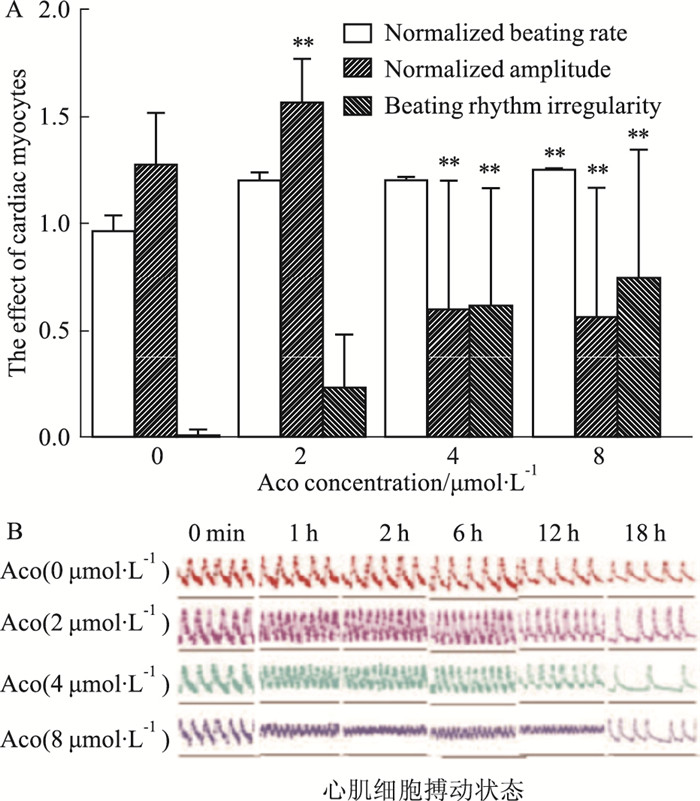
通过RTCA Cardio系统E-Plate Cardio 96细胞接种密度的筛选, 选用2.00×104个/孔接种到96孔电极板中, 培养。当搏动稳定后开始加药, 乌头碱浓度梯度为0 μmol·L-1、2 μmol·L-1、4 μmol·L-1、8 μmol·L-1, RTCA Cardio系统监测结果如Fig 4-1、4-2所示, 乌头碱不同浓度对心肌细胞CI值的影响, 呈一定的量效关系, 随剂量的增加, 其对原代心肌细胞的抑制作用增强(如Fig 4-1); 不同浓度乌头碱(Aco)均能明显增加心肌细胞的搏动频率、抑制心肌细胞的搏动幅度、增加心肌细胞不规则搏动以及引起细胞搏动波形的异常(Fig 4-2), 且均呈一定的量效关系。提示RTCA Cardio系统可以检测乌头碱诱导的心肌细胞心律失常现象。
|
| Fig 4-1 Effect of Aco on CI value of cardiac myocytes by RTCA Cardio system |
|
| Fig 4-2 Effects of Aco on normal cardiac myocytes analyzed by RTCA Cardio system A: The effect of Aco on normalized beating rate, normalized amplitude and beating rhythm irregularity of cardiac myocytes; B:Aco on beating state of cardiac myocytes. **P < 0.01 vs normal group |
心律失常是临床上心血管疾病中最常见的一种疾病, 其发病率和病死率均较高, 大约占自然死亡人数的11%, 严重影响人类健康[6]。所以寻求一个从根本上辨析和评价心律失常疾病的途径极为重要。建立适当的模型, 不仅能为该疾病的发病机制和病理生理改变的研究奠定基础, 而且能推进临床诊断和各种治疗方法的进步。由于心律失常的本质是心脏激动的起源或传导异常所致的心律或心率改变, 传统上使用膜片钳技术虽然也可以通过场点位的结果来检测动态信号改变, 但是它是劳动密集型技术, 要求技术高, 得出的结论却很少[7-8]。实时细胞电子分析技术RTCA是一种建立在阻抗基础上的瞬时细胞电感应连续记录系统, 是药物临床前早期筛选的一个重要工具, 能将心肌细胞对引起心律失常的药物的响应用特征性的搏动图谱呈现, 进而检测时间分辨率。同时, 通过动态监测保证了心肌细胞瞬时响应及长时效应的获取。Filomain等[9]采用xCELLigenCeRTCACardio系统监测iPS-CM, 发现具有潜在致心律失常的药物。李光等[10]基于RTCA技术监控H/R(缺氧/复氧)条件对H9c2心肌细胞的损伤作用, 为心肌缺血再灌注损伤模型严格把控。赵琪等[11]基于人胚胎干细实时细胞分析技术对HESC-CM进行长时间实时动态监测, 准确预测了非离子通道药物潜在的心脏毒性。
现代研究发现, 乌头碱可引起心律失常表现, 其机制目前认为与激活并使心肌细胞的钠通道开放, 加速了心肌细胞中的钠离子内流, 促使细胞膜去极化, 加速起搏点的自律性, 或者诱发异位节律点, 缩短心肌不应期有关[12]。且心肌细胞属于末端分化细胞, 由于其无分裂增殖能力的特点, 很难构建稳定、具有心肌细胞功能的细胞系, 因此一般使用原代培养的方法[13]。体外培养的心肌细跑, 具有心肌细胞结构和功能上的某些特点, 如自发性节律性离子交换、同步搏动等, 并且排除了机体神经、体液等各种复杂因素干扰[14]。刘义等[15]应用培养心肌细胞的慢反应心肌细胞的电生理特性, 作为防治心律失常药物研究的模型。
本实验先在整体动物水平上验证乌头碱具有引发心律失常的作用, 然后在体外细胞水平上利用RTCA Cardio系统评价乌头碱对心肌细胞造成的心律失常现象, 发现乌头碱对心肌细胞的作用呈一定的量效关系, 随着剂量的增加, 其对原代心肌细胞的抑制作用增强, 当浓度8 μmol·L-1时, 效果最明显, 且能增加心肌细胞的搏动频率、抑制心肌细胞的搏动幅度、增加心肌细胞不规则搏动, 以及引起细胞搏动波形的异常。证实了RTCA Cardio系统可以建立实验全过程的实时细胞质量控制, 可以检测到各种微小或者显著性的细胞CI值和搏动情况的变化, 是一项成熟稳定的体外心律失常评价技术, 为抗心律失常药物的研发提供了方法学参考。
( 致谢: 本实验在天津中医药大学, 天津市中药药理学重点实验室完成。)
| [1] |
万军.复方GC提取物抗心律失常的药效学及机理研究[D].成都中医药大学, 2008. Wan J. Pharmacodynamics and mechanism of compound GC extract against arrhythmia [D]. Chengdu University of Traditional Chinese Medicine, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10633-2009028264.htm |
| [2] |
王淑颜, 汪溪洁, 靳康, 等. 运用实时细胞分析系统监测原代乳鼠心肌细胞的生长及搏动评价抗心律失常药物[J]. 中国药理学与毒理学杂志, 2014, 28(06): 837-43. Wang S Y, Wang X J, Jin K, et al. Use real-time cell analysis system to monitor the growth and pulsation of primary suckling rat cardiomyocytes and evaluate antiarrhythmic drugs[J]. Chin J Pharmacol Toxicol, 2014, 28(06): 837-43. doi:10.3867/j.issn.1000-3002.2014.06.004 |
| [3] |
俞洋洋.抗心力衰竭体外模型的建立及中药化合物筛选[D].北京中医药大学, 2016. Yu Y Y. Establishment of an in vitro model of anti-heart failure and screening of Chinese medicine compounds [D]. Beijing University of Traditional Chinese Medicine, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10026-1016069844.htm |
| [4] |
张舒涵, 李晋奇. 乌头碱心脏毒性作用机制的研究进展[J]. 中西医结合心脑血管病杂志, 2018, 16(10): 1366-70. Zhang S H, Li J Q. Advances in the mechanism of cardiotoxicity of aconitine[J]. Chin J Integrat Med Cardio/cerebrovasc Dis, 2018, 16(10): 1366-70. doi:10.12102/j.issn.1672-1349.2018.10.015 |
| [5] |
于晓明.快律宁胶囊抗快速心律失常的离体药效学实验研究[D].山东中医药大学, 2012. Yu X M. In vitro pharmacodynamic study of Quilunning Capsule against tachyarrhythmia [D]. Shandong University of Traditional Chinese Medicine, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10441-1012469811.htm |
| [6] |
惠汝太, 滕思勇. 心脏电生理学新概念[J]. 中国循环杂志, 2002, 17(2): 87-9. Hui R T, Teng S Y. New concept of cardiac electrophysiology[J]. Chin J Circulat, 2002, 17(2): 87-9. doi:10.3321/j.issn:1000-3614.2002.02.003 |
| [7] |
吴洁颖.基于RTCA实时动态心肌细胞功能检测的药物心脏安全性研究[A].中国毒理学会、广东省疾病预防控制中心.中国毒理学会第六届全国毒理学大会论文摘要[C]. Wu J Y. Study on drug-induced cardiac safety based on RTCA real-time dynamic cardiomyocyte function detection[A]. Chinese Toxicology Society, Guangdong Disease Prevention and Control Center. Abstract of theses of the Sixth National Toxicology Congress of Chinese Toxicology Society[C]. |
| [8] |
钱薇, 邹丽, 王秀秀, 等. 探讨多离子通道阻断的抗心律失常中药研究[J]. 中西医结合心血管病电子杂志, 2018, 6(24): 21. Qian W, Zou L, Wang X X, et al. Study on Chinese herbal medicine against arrhythmia by blocking multi-ion channels[J]. Cardiovasc Dis J Integrat Tradit Chin West Med, 2018, 6(24): 21. doi:10.3969/j.issn.2095-6681.2018.24.012 |
| [9] |
Filomain N, Tomo S, Kurt P, et al. In vitro model for assessing arrhythmogenic properties of drugs based on high-resolution impedance measurements[J]. Cell Physiol Biochem, 2012, 29: 819-832. doi:10.1159/000188069 |
| [10] |
李光, 吴堃, 李宜航, 等. 基于实时阻抗细胞分析技术评价H9c2心肌细胞缺氧/复氧损伤模型及三七皂苷R1的干预作用[J]. 中国药理学通报, 2019, 35(03): 436-40. Li G, Wu K, Li Y H, et al. Evaluation of hypoxia/reoxygenation injury model of H9c2 myocardial cells and intervention of notoginsenoside R1 based on real-time impedance cell analysis[J]. Chin Pharmacol Bull, 2019, 35(03): 436-40. doi:10.3969/j.issn.1001-1978.2019.03.027 |
| [11] |
赵琪, 汪溪洁, 王淑颜, 等. 基于人胚胎干细胞的实时细胞系统评价心脏毒性方法的建立[J]. 中国药理学通报, 2016, 32(01): 138-43. Zhao Q, Wang X J, Wang S Y, et al. Establishment of a real-time cytotoxicity assessment method based on human embryonic stem cells[J]. Chin Pharmacol Bull, 2016, 32(01): 138-43. doi:10.3969/j.issn.1001-1978.2016.01.029 |
| [12] |
徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 第1版. 人民卫生出版, 1982: 1173. Xu S Y, Bian R L, Chen X. Pharmacological experimental Methodology[M]. 1st Edition. People's Health Publishing House, 1982: 1173. |
| [13] |
李黎, 张兴, 申秀萍, 等. 体外心肌毒性代谢组学样品预处理及UPLC/Q-TOF-MS条件优化[J]. 药物评价研究, 2016, 39(04): 564-71. Li L, Zhang X, Shen X P, et al. Pretreatment of metabolomic samples of myocardial toxicity in vitro and optimization of UPLC/Q-TOF-MS conditions[J]. Drug Evaluat Res, 2016, 39(04): 564-71. |
| [14] |
孙凤杰, 佟德民, 卢小炎, 等. 体外培养胎鼠心肌细胞方法的优化[J]. 细胞与分子免疫学杂志, 2017, 33(11): 1534-8. Sun F J, Tong D M, Lu X Y, et al. Optimization of the method of culturing fetal rat cardiomyocytes in vitro[J]. Chin J Cell Mol Immunol, 2017, 33(11): 1534-8. |
| [15] |
刘义, 刘婉珠, 王维信. 乙胺噻嗪对培养乳鼠心肌细胞电生理特性的影响[J]. 中国药理学通报, 2002, 18(3): 334-7. Liu Y, Liu W Z, Wang W X. Effects of ethylaminothiazide on electrophysiological characteristics of cultured neonatal rat cardiomyocytes[J]. Chin Pharmacol Bull, 2002, 18(3): 334-7. doi:10.3321/j.issn:1001-1978.2002.03.029 |

