


肾病综合征(nephrotic syndrome, NS)临床表现为大量蛋白尿(成人尿蛋白排出量>3.5 g·d-1)、高度水肿、低蛋白血症(血浆白蛋白<30 g·L-1)以及高脂血症, 水肿是其特征表现[1]。目前主要通过激素给药治疗, 通过抑制机体免疫炎症反应来改变肾小球基底膜通透性而发挥利尿作用。虽取得一定疗效, 但许多患者产生了不同程度的耐受, 或因不良反应严重被迫停药, 最终发展到晚期肾衰[2]。因此, 深入研究中药防治NS的机制, 开发安全有效的治疗药物具有重要的社会意义及经济意义。阿霉素(adramycin, ADR)是临床常用的抗恶性肿瘤药物, 然而, ADR也具有广泛的细胞毒性[3]。ADR可使膜结构发生变化, 而此变化经常会造成肾小球滤过膜产生膜电位异常, 肾小球滤过屏障缺损, 最终导致肾小球滤过膜通透性改变, 肾小管对水液重吸收异常, 引起细胞损伤死亡。内髓集合管细胞(inner medullary collecting duct cell, IMCD)是哺乳动物肾小管的最后一段, 连续传代几乎没有表型, 保持了IMCD特殊的功能性, 对水和酸碱平衡稳态的维持具有重要作用, 因此广泛应用于水液平衡等研究领域。
水通道蛋白-2 (aquaporin 2, AQP2)是调节体内水稳态的重要蛋白质, 也是肾脏集合管水代谢调节的主要蛋白, 存在于细胞顶端质膜及细胞内小泡, 细胞顶端质膜的AQP2含量决定着集合管细胞的通透性, 在水的重吸收和排泄方面起到重要的调节作用[4-5]。环磷酸腺苷(cyclc-AMP, cAMP)-蛋白激酶A(protein kinase A, PKA)-cAMP反应元件结合蛋白(cAMP-responsive element binding protein, CREB)通路是细胞内水液平衡信号转导的主要途径, 水通道蛋白家族中大都含有PKA磷酸化的同源序列, 并且受到磷酸化作用的直接调节, 它们的异常表达与cAMP-PKA信号通路的激活具有重要关联。课题组前期在进行当归芍药散(Danggui-Shaoyao-San, DSS)对大鼠慢性应激抑郁模型、肝硬化腹水模型以及NS模型的实验研究, 发现DSS对AQP2有明显的调控作用[6-8]。因此, 本研究从细胞水平出发, 观察ADR对IMCD3细胞增殖的影响, 研究DSS提取液对IMCD3细胞AQP2的作用, 并进一步探讨DSS提取液是否可通过提高Na+, K+-ATP酶活性, 调节cAMP-PKA-CREB通路, 达到对IMCD3细胞的保护。
1 材料与方法 1.1 细胞株IMCD3细胞, 购自上海赛齐生物科技有限公司。
1.2 药液制备DSS处方药材, 购自安徽普仁中药饮片有限公司, 并经安徽中医药大学金传山教授鉴定, 均符合2015版《中国药典》。按处方比例(当归:芍药:川芎:白术:茯苓:泽泻=3 :16 :8 :4 :4 :8)称取药材, 加入10倍量的75%乙醇回流提取1.5 h, 收集滤液; 残渣再加8倍量75%乙醇回流提取1.5 h, 合并两次滤液, 使用旋转蒸发仪浓缩。制备生药浓度为1.72 kg·L-1的DSS药液。取DSS提取液12 000 r·min-1离心15 min, 转移至事先灭菌好的超净工作台, 取上清液过0.22 μm微孔滤膜, 分装于10 mL离心管中, -20 ℃保存备用。
1.3 试剂ADR(注射用盐酸多柔比星, 浙江海正药业股份, 批号:19002011);H-89(美国MCE公司, 批号:HY-15979);胎牛血清(德国Serana公司, 批号:S-FBS-SA-015);胰酶消化液(碧云天生物技术研究所, 批号:C0201);高糖DMEM培养基(美国HyClone公司, 批号:AC10254368);MTT(美国Amersco公司, 批号:CT0025);二甲亚砜(DMSO, 德国Sigma公司, 批号:D5879);逆转录试剂盒(美国Thermo Scientific公司, 批号00287813); Na+, K+-ATP酶检测试剂盒(美国Cell Signaling公司, 批号:3010);cAMP检测试剂盒(武汉Elabscience公司, 批号:E-EL-0056c); 抗体AQP2(美国Cell Signaling公司, 批号:3487S)、PKA(美国Cell Signaling公司, 批号:5842)、CREB(美国Cell Signaling公司, 批号:9197T)。
1.4 仪器细胞培养箱(日本Sanyo公司); 多功能酶标仪(美国MD公司); Mx3000P实时荧光定量聚合酶链式反应仪(Agilent公司); EPS300电泳仪(上海天能科技有限公司)。
2 方法 2.1 细胞培养将IMCD3细胞置于5% CO2细胞培养箱中37 ℃培养, 每2 d更换1次培养基, 当生长至80%时, 用胰蛋白酶消化液消化收集细胞, 以1 :2传代培养。
2.2 MTT法测定IMCD3细胞增殖情况取对数生长期、生长良好的IMCD3细胞种板, 每孔加入含浓度为1×10-7、1×10-8、1×10-9、1×10-10、1×10-11 mol·L-1 ADR的无糖培养基和空白培养基150 μL, 培养24 h后, 加入MTT稀释液, 酶联免疫检测仪检测各孔的吸光值, 筛选出最适ADR浓度。后将实验分为空白组、模型组、DSS提取液组(浓度分别为0.2、0.4、0.6、0.8、1.6、3.2、6.4、12.8 g·L-1)。细胞生长至对数期后, 按照细胞密度为2×107·L-1接种于96孔培养板内培养, 检测各孔吸光度值, 并筛选出合适的DSS提取液浓度。
2.3 Western blot检测ADR诱导IMCD3细胞蛋白表达接种密度为1×108·L-1的IMCD3细胞, 加入DMEM高糖培养基(含10% FBS)3 mL, 培养24 h贴壁后, 弃完全培养基, 加入上述不同浓度的ADR溶液300 μL。待药物作用24 h后, 加入裂解液约400 μL, 于4 ℃、10 000 r·min-1离心10 min, 将上清液转移至另一支预冷的EP管中, BCA法测定蛋白含量后, 将剩余蛋白样品按照1 :4的比例加入5×SDS上样缓冲液。SDS-PAGE凝胶电泳、转膜。用配制的封闭液37 ℃封闭2 h后, 加一抗(1 :1 000), 4 ℃过夜。洗膜, 并加入辣根过氧化物酶标记的二抗, 37 ℃孵育2 h。化学发光、显影、定影, Bio-Rad凝胶图像处理系统分析, 计算灰度值, 测定AQP2蛋白表达。另将细胞分为空白组、模型组、DSS提取液低、中、高剂量组(0.8、1.6、3.2 g·L-1)和H-89抑制剂组。待药物作用24 h后, 按上述步骤检测PKA、CREB、AQP2蛋白表达。
2.4 ELISA法检测细胞cAMP水平变化实验分为空白组、模型组、DSS提取液低、中、高剂量组、H-89抑制剂组。将细胞接种于6孔板中, 并加入新鲜的完全培养基。24 h后观察细胞状态。待IMCD3细胞长至80%左右时, 倒掉完全培养基, 加入不含血清的高糖DMEM培养24 h, 在细胞同步化后, 按上述组加入不同药物干预, 收集各组细胞的上清液, 3 000 r·min-1离心15 min, 取上清并标记, -20 ℃分装保存备用。根据cAMP试剂盒使用说明书测定IMCD3细胞上清液cAMP含量。
2.5 细胞Na+, K+-ATP酶活性检测实验分为6组, 分别为空白组、模型组、DSS提取液低、中、高剂量组、H-89抑制剂组。24 h后, 将IMCD3细胞消化后, 加入10 mL离心管离心, 弃上清液, 留下细胞沉淀, 每管细胞加入300 μL生理盐水重悬细胞, 采用超声粉碎器对细胞进行粉碎, 粉碎后, 采用BCA试剂盒检测离心管内蛋白含量, 再将细胞匀浆液稀释成不同浓度进行预试, 根据预试结果决定取样浓度(预试结果将绝对吸光度值控制在0.2左右)。根据Na+, K+-ATP酶试剂盒酶促反应步骤, 测定IMCD3细胞Na+, K+-ATP酶活性。
2.6 Real-time PCR检测细胞PKA、CREB、AQP2 mRNA表达实验分为空白组、模型组、DSS提取液低、中、高剂量组、H-89抑制剂组。使用TRIzol总RNA提取试剂分别提取IMCD3细胞中总RNA, 在紫外检测仪上检测所提取RNA样品的260 nm和280 nm处吸光度A, 根据其值确定RNA的纯度和浓度, A260/A280>1.8, 逆转录得到cDNA后扩增目的基因。逆转录反应操作按照试剂盒说明进行, 以β-actin为内参, 基因引物序列见Tab 1。
| Primer | Primer sequence(5′-3′) |
| PKA | Forward F-CAGAATACAGCCCAGTTG |
| Reverse R-ACGGGAAGTTGACGG | |
| CREB | Forward F-CCAGCCACAGATTGC |
| Reverse R-GGATTTCCCTTCGTTT | |
| AQP2 | Forward F- GCCACGCTCCTTTTC |
| Reverse R-TGCCAATGCCCAGAC | |
| β-actin | Forward F-GTGCGACGAAGACGA |
| Reverse R-CGATGGATGGGAACA |
各实验重复3次。数据采用统计学软件SPSS 22进行分析, 结果以x±s表示, 组间比较采用ANOVA分析。方差齐性, 使用LSD法进行比较。
3 结果 3.1 ADR对IMCD3细胞增殖的影响ADR浓度在1×10-7 mol·L-1以上, 细胞基本死亡, 可见对细胞呈不同程度的抑制(P<0.01);当其浓度降低为1×10-9、1×10-10、1×10-11 mol·L-1时, OD值增高, 对细胞生长呈现不同程度的促进(P<0.01)。见Fig 1。
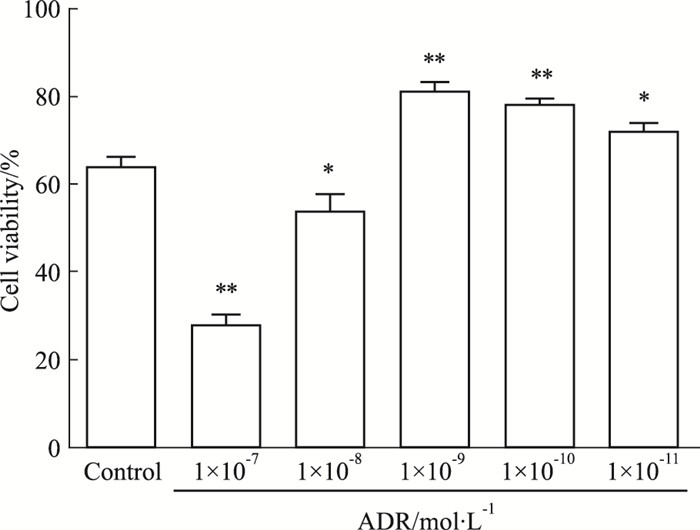
|
| Fig 1 Effect of different concentrations of ADR on cell viability of IMCD3 cells(x±s, n=3) *P < 0.05, **P < 0.01 vs control |
如Fig 2所示, ADR浓度为1×10-8 mol·L-1时, 可明显下调AQP2蛋白表达; 浓度为1×10-10、1×10-11 mol·L-1时, AQP2蛋白表达均有不同程度的升高, 差异具有显著性(P<0.01)。
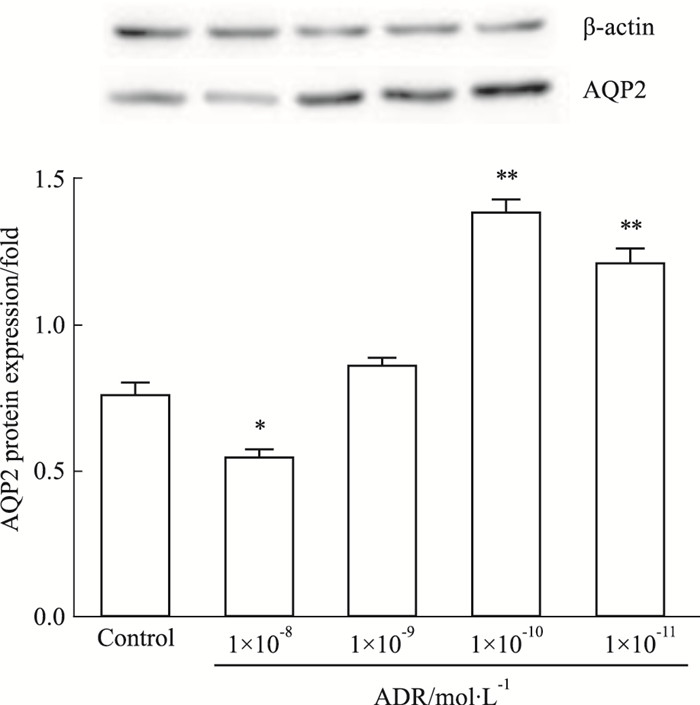
|
| Fig 2 Effect of different concentrations of ADR on AQP2 protein expression of IMCD3 cells(x±s, n=3) *P < 0.05, **P < 0.01 vs control |
如Fig 3所示, 与正常组相比, 模型组OD值明显降低; DSS提取液(0.2、0.4、0.6、0.8 g·L-1)作用后, 对ADR损伤的IMCD3细胞生长增殖无明显影响, DSS提取液(1.6、3.2 g·L-1)对ADR损伤的IMCD3细胞生长增殖具有明显的促进作用(P<0.05), 而6.4 g·L-1以上浓度则对IMCD3细胞生长增殖具有不同程度的抑制作用(P<0.05, P<0.01)。
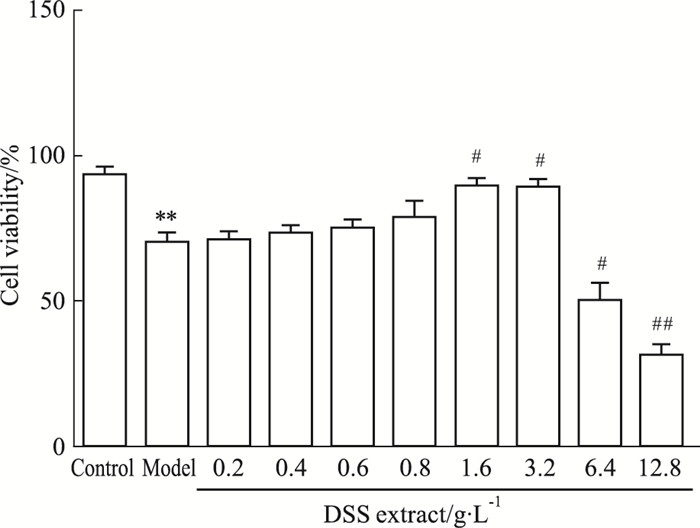
|
| Fig 3 Effect of DSS extract on IMCD3 cells viability at different concentrations(x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
如Fig 4所示, 与正常组相比, 模型组cAMP含量明显降低(P<0.01);与模型组比较, DSS提取液各剂量组cAMP含量均有不同程度的提高, 其中中剂量最为明显, H-89抑制剂组较模型组比较无明显变化。
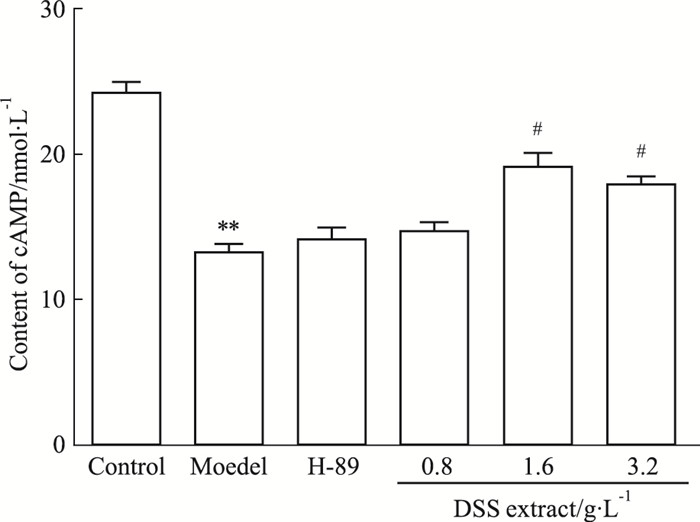
|
| Fig 4 Effect of DSS extract on cAMP content in IMCD3 cells(x±s, n=3) **P < 0.01 vs control; #P < 0.05 vs model |
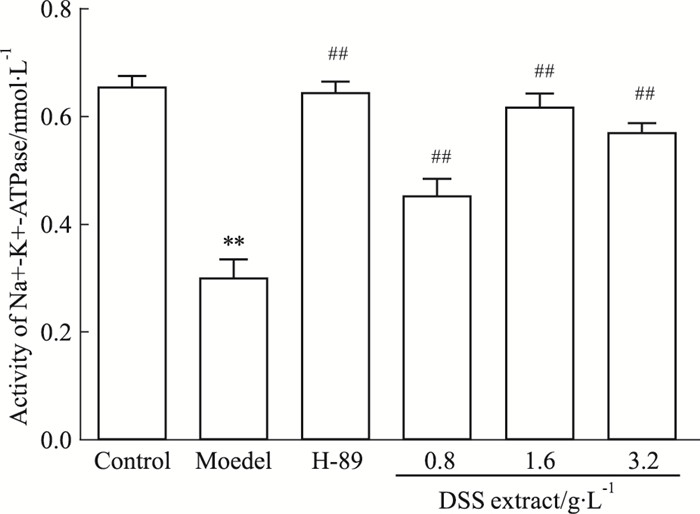
如Fig 5所示, 与正常组比较, 模型组Na+, K+-ATP酶活性明显降低(P<0.01);较模型组比, DSS提取液高、中、低剂量组均能提高Na+, K+-ATP酶活性, 且中剂量对Na+, K+-ATP酶活性的提高最为明显(P<0.01)。
|
| Fig 5 Effect of DSS extract on ADR-induced Na+, K+-ATPase activity in IMCD3 cells(x±s, n=3) **P < 0.01 vs control; ##P < 0.01 vs model |
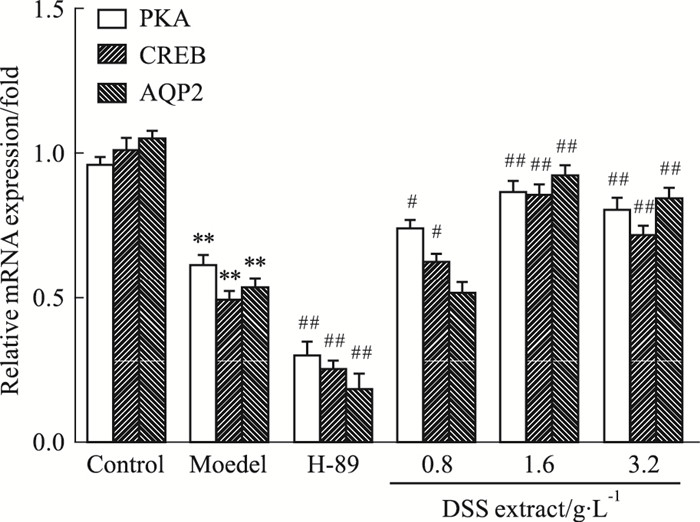
如Fig 6所示, 与正常组相比, 模型组细胞PKA、CREB、AQP2 mRNA表达均明显降低(P<0.01);与模型组比较, 当DSS提取液中、高剂量组均可上调PKA、CREB、AQP2 mRNA表达水平(P<0.01), 但低剂量组上调AQP2 mRNA不明显。
|
| Fig 6 Effect of DSS extract on ADR-induced PKA, CREB, AQP2 mRNA expression in IMCD3 cells(x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
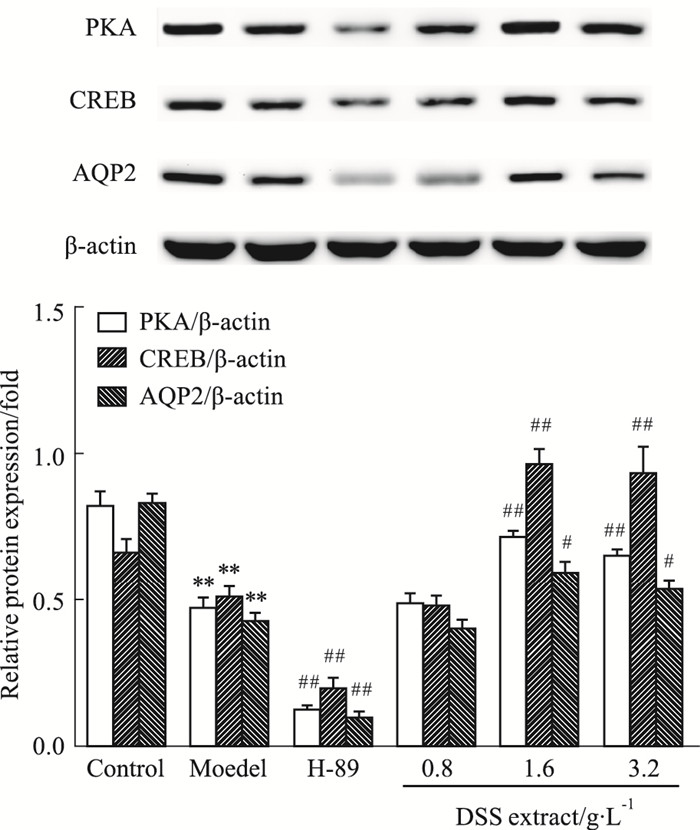
如Fig 7所示, 与正常组相比, 模型组细胞PKA、CREB、AQP2蛋白表达水平明显降低(P<0.01);DSS提取液作用后, 中、高剂量组均能明显上调PKA、CREB、AQP2蛋白表达(P<0.05, P<0.01), 而低剂量组PKA、CREB、AQP2蛋白表达无明显增加。H-89抑制剂组可明显下调IMCD3细胞PKA、CREB、AQP2蛋白的表达。
|
| Fig 7 Effect of DSS extract on ADR-induced PKA, CREB and AQP2 protein expression in IMCD3 cells(x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
ADR肾病大鼠模型肾脏病理学改变及临床表现与人类肾脏疾病基本相似, 在肾病领域的研究已被广泛应用。肾集合管上皮细胞在NS中扮演着非常关键的角色, 能吸收水、尿素、HCO3-、Na+, 也能分泌H+、NH4+、Cl-、K+, 对水和酸碱平衡稳态的维持有着重要作用。本研究首先采用ADR诱导IMCD3细胞损伤, 结果表明, 当ADR浓度为1×10-9、1×10-10、1×10-11 mol·L-1时, 对细胞生长呈现不同程度的促进, 有研究推测可能为“毒物兴奋效应”, 即药物可以在低剂量下刺激细胞生长, 而高剂量浓度则抑制细胞生长, 但就笔者而言, 猜测可能由于细胞代偿生长所致的应激反应, 其具体机制仍有待研究。而浓度为1×10-8 mol·L-1的ADR下调IMCD3细胞AQP2表达, 浓度为1×10-8 mol·L-1以上则上调IMCD3细胞AQP2表达。故本探究最终采用了ADR浓度为1×10-8 mol·L-1对IMCD3细胞进行诱导损伤。
NS总属本虚标实, 患者多水肿严重, 常伴有瘀血。DSS作为中医经典活血利水方剂, 最早记载于东汉张仲景所著的《金匮要略》, 是由当归、芍药、川芎、茯苓、白术、泽泻六味药组成, 养血敛阴、活血行血, 健脾化湿、燥湿利水。六药合用治疗NS, 则标本兼顾, 共奏活血利水之功效。现代药理学研究发现, DSS具有抗抑郁, 抗炎, 抗血小板聚集和抗氧化等作用[9]。近年来越来越多的研究表明, 单萜糖苷类、苯酞类、三萜类等是DSS的典型成分。该方中当归、芍药、川芎主要成分为当归多糖、白芍总苷、阿魏酸及川芎嗪可增加肾血流量, 改善肾小球系膜细胞增殖, 对肾脏具有一定的保护作用[10-11]; 而白术、茯苓、泽泻的主要成分为白术内酯Ⅰ、茯苓多糖、泽泻醇等能够促进水钠排泄, 增加血清白蛋白, 降低总胆固醇和甘油三酯的含量, 减轻NS时水钠潴留及高脂血症。
Na+, K+-ATP酶是一种镶嵌在细胞膜中的蛋白质, 其通过膜内和膜外的膜电位差及细胞膜渗透压, 依赖ATP水解供能, 改变膜内外Na+及K+含量。研究发现, 在各种肾脏疾病中Na+, K+-ATP酶功能有所下降[12]。cAMP是由ATP发生缩合反应脱掉自身两个磷酸形成的, 当机体受到外界刺激后, 体内激素刺激细胞促使细胞生成cAMP, 进而参与细胞内不同的生理活动及能量代谢转换。PKA由两个调节亚基(R)和两个催化亚基(C)组成, 在特定条件刺激下R亚基可与机体的cAMP特异性结合, 参与体内水液平衡的调节。CRE是一段由约30 bp的DNA片段构成的cAMP应答序列, 该原件的激活对水液平衡的调节有着至关重要的影响。
本实验采用浓度为1×10-8 mol·L-1的ADR进行IMCD3细胞损伤后, 以Na+, K+-ATP酶活性、PKA、CREB和AQP2为DSS提取液的调控对象。实验结果显示, 当给予DSS提取液作用后, IMCD3细胞中Na+, K+-ATP酶活性明显增强, 同时cAMP合成增加且PKA、CREB、AQP2蛋白表达上调。提示DSS提取液可通过激活cAMP-PKA-CREB信号通路, 同时也可激活通路上游Na+, K+-ATP酶, 直接或间接调控AQP2分子, 实现对ADR诱导的IMCD3细胞保护作用, 维持细胞水液平衡。其中, H-89作为PKA抑制剂, 该组与模型组Na+, K+-ATP酶活性存在明显差异, 推测可能由于Na+, K+-ATP酶的短时调节作用, 导致结果差异较大。本研究从分子水平探究了DSS提取液对ADR诱导损伤的IMCD3细胞调控的信号通路, 为DSS提取液对IMCD3细胞水液平衡调节的挖掘提出了可能的作用靶点, 更为DSS治疗NS的临床合理应用提供了又一有效依据。
| [1] |
Charlesworth J A, Gracey D M, Pussell B A. Adult nephrotic syndrome: non-specific strategies for treatment[J]. Nephrology(Carlton), 2008, 13(1): 45-50. |
| [2] |
Saito T. Treatment and prognosis of idiopathic membranous nephropathy in guidelines for nephrotic syndrome[J]. Nihon Jinzo Gakkai shi, 2011, 53(5): 708-12. |
| [3] |
何林峰, 王可欣, 雷蕾, 等. 阿霉素减轻坐骨神经慢性缩窄性损伤大鼠的神经病理性疼痛及其机制[J]. 中国药理学通报, 2018, 34(1): 33-8. He L F, Wang K X, Lei L, et al. Effects of doxorubicin on neuropathic pain in chronic sciatic nerve constriction injury rats and its underlying mechanism[J]. Chin Pharmacol Bull, 2018, 34(1): 33-8. |
| [4] |
Kim M G, Lee Y J, Choi E S, et al. Wiryeongtang regulates hypertonicity-induced expression of aquaporin-2 water channels in IMCD-3 cells[J]. Mol Med Rep, 2017, 15(5): 2665-72. |
| [5] |
Jun D W, Park J H, Park Y S, et al. The role of nitric oxide in the expression of renal aquaporin 2 in a cirrhotic ratmodel: does an AVP-independent mechanism exist for the regulation of AQP2 expression[J]. Dig Dis Sci, 2010, 55(5): 1296-304. |
| [6] |
杨明月, 岳晓莉, 周敏, 等. 基于电解质研究当归芍药散对肾病综合征大鼠作用[J]. 辽宁中医药大学学报, 2017, 19(1): 39-41. Yang M Y, Yue X L, Zhou M, et al. Protective effects of Danggui Shaoyao San on rats with nephritic syndrome based on the research of electrolyte[J]. J Liaoning Univ Tradit Chin Med, 2017, 19(1): 39-41. |
| [7] |
王成业, 许钒, 王满媛, 等. 当归芍药散对肝硬化腹水大鼠的干预作用研究[J]. 中国中药杂志, 2013, 38(6): 871-4. Wang C Y, Xu F, Wang M Y, et al. Study on intervention effect of Danggui-Shaoyao-San on rats with cirrhotic ascites[J]. Chin J Chin Mat Med, 2013, 38(6): 871-4. |
| [8] |
Xu F, Peng D, Tao C, et al. Anti-depression effects of Danggui-Shaoyao-San, a fixed combination of traditional Chinese medicine, on depression model in mice and rats[J]. Phytomedicine, 2011, 18(3): 1130-6. |
| [9] |
Wang Y, Li G, Zhou Y, et al. The difference between blood-associated and water-associated herbs of Danggui-Shaoyao San in theory of TCM, based on serum pharmacochemistry[J]. Biomed Chromatogr, BMC, 2016, 30(4): 579-87. |
| [10] |
刘超然, 邵云侠, 徐兴欣, 等. 芍药苷对AGEs刺激下RAW264.7巨噬细胞TLR2/4通路的影响[J]. 中国药理学通报, 2017, 33(5): 675-80. Liu C R, Shao Y X, Xu X X, et al. Effect of paeoniflorin on TLR2/4 pathway in AGEs-induced RAW264.7 macrophages[J]. Chin Pharmacol Bull, 2017, 33(5): 675-80. |
| [11] |
李娇, 郭静, 李敏, 等. 川芎嗪对补体旁路激活致内皮细胞炎症反应的干预作用[J]. 中国药理学通报, 2019, 35(1): 90-5. Li J, Guo J, Li M, et al. Intervention effect of tetramethylpyrazine on inflammatory response of endothelial cells induced by activated complement alternative pathway[J]. Chin Pharmacol Bull, 2019, 35(1): 90-5. |
| [12] |
Wang J, Ullah S H, Li M, et al. DR region specific antibody ameliorated but ouabain worsened renal injury in nephrectomized rats through regulating Na, K-ATPase mediated signaling pathways[J]. Aging (Albany NY), 2019, 11(4): 1151-62. |

