

2. 湖南省中药饮片标准化及功能工程技术研究中心, 湖南 长沙 410208;
3. 中国医学科学院药物研究所, 北京协和医学院药物研究所, 北京 100050;
4. 湖南中医药大学中西结合学院, 湖南 长沙 410208
2. Center for Standardization and Functional Engineering of Traditional Chinese Medicine in Hunan Province, Changsha 410208, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China;
4. College of Integrated Traditional Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
补阳还五汤出自《医林改错》[1], 作为治疗中风后半身不遂的经典方剂, 受到诸多医家的追捧。考虑到方剂的局限性, 本课题组遵循补阳还五汤之方义, 基于益气祛瘀生新法, 秉承“瘀血不去, 新血不生”和“不破不立, 瘀祛新生”的观念, 结合临床经验, 以黄芪、川芎、地龙入药, 并采用现代中药制备工艺提取, 制备补阳还五汤类方, 并已通过动物实验建立了补阳还五汤类方发挥抗脑缺血功效的药物比例和剂量[2-3]。
脑缺血损伤的原发性和继发性分子机制十分复杂, 凋亡作为缺血性神经元死亡的一种主要途径, 其调控网络也日渐清晰。细胞周期素依赖性蛋白激酶5(cyclin-dependent kinase 5, CDK5)是一种主要在神经元内表达的脯氨酸限定的丝/苏氨酸蛋白激酶, 在调控神经元分化、皮质的形成、神经元细胞的迁移和神经轴突的生长过程中, 起着至关重要的作用, 具有潜在的调控神经元凋亡功能[4-6]。近年研究表明[7], 大鼠脑缺血后, 神经细胞的损伤与CDK5的上调关系密切。故本课题组前期以大鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)模型为研究对象, 考察了补阳还五汤类方对模型大鼠海马组织CDK5的调控作用[8]。本实验拟以细胞模型, 进一步验证补阳还五汤类方对CDK5及其凋亡因子的调控。氧化应激是脑缺血进程中重要的病理生理反应, 它是指体内氧化与抗氧化作用失衡, 自由基在体内大量产生, 引起细胞毒性反应, 从而导致组织损伤的过程。本实验即以此为基础, 观察补阳还五汤类方对脑缺血体外氧化应激细胞模型的影响, 从CDK5信号转导途径对脑缺血损伤后神经元凋亡机制展开研究。
1 材料 1.1 药物补阳还五汤处方由黄芪120 g、当归6 g、赤芍4.5 g、川芎3 g、红花3 g、桃仁3 g、地龙3 g组成。补阳还五汤类方由黄芪、川芎、地龙按10 :3 :2的比例配伍组成, 参照前期研究[2], 先将两方药物提取制备成干浸膏。使用前, 采用无菌水配制成10 g·L-1的母液, 经0.25 μm滤膜过滤除菌, 使用时用无菌PBS稀释至合适浓度。根据前期研究结果[3], 本实验以1.0 g·L-1的补阳还五汤及其类方对细胞预处理2 h后, 考察药物对氧化应激模型细胞中相关蛋白的影响。
1.2 细胞大鼠肾上腺嗜铬细胞瘤细胞系(PC12细胞), 高分化, 购自长沙赢润生物技术有限公司。PC12细胞是从大鼠肾上腺髓质瘤中分离得到的一种交感样前体细胞株, 它与神经细胞在发生学上均来源于神经嵴, 在形态结构、生理生化功能上有类似神经元的表达和突触, 为国内外研究脑缺血所致的神经元损伤的理想替代模型[9]。将PC12细胞培养于培养瓶中, 采用DEME高糖培养基培养, 培养基含10%胎牛血清, 100 kU·L-1青霉素, 100 mg·L-1链霉素。37 ℃、5% CO2的细胞培养箱中温育, 待细胞贴壁融合至90%时, 用0.25%的胰蛋白酶消化, 加入培养基充分吹打至单细胞悬液, 传代或接种至合适的培养板中, 继续温育48 h用于实验。
1.3 试剂DEME高糖培养基(HyClone); D-Hanks(Solarbio); 胎牛血清(Gibco); MTT(美国Sigma公司); 二甲基亚砜(DMSO, BIOSHARP); 神经生长因子(nerve growth factor, NGF)(华美生物YP015779RA); 大鼠谷胱甘肽(glutathione, GSH) ELISA试剂盒(华美生物, E12144r); 大鼠L-乳酸脱氢酶(L-lactate dehydrogenase, L-LDH) ELISA试剂盒(华美生物, E11324r); 活性氧簇(reactive oxygen species, ROS)检测试剂盒(普利莱, C1300);抗体CDK5(ab115812)、Tau(ab64193)、Bax(ab77566)、Bcl-2(ab32124), 均购自Abcam公司; 羊抗鼠IgG-Dylight549(GAR002)、羊抗兔IgG-FITC(GAR001), 均购自联科生物; 超纯RNA提取试剂盒(康为世纪, CW0597, 含DnaseI); 逆转录第一链cDNA合成试剂盒(Fermentas, K1622);其他试剂均为分析纯。
1.4 仪器Galaxy 170R CO2培养箱(德国Eppendorf公司); Primo Vert倒置显微镜、Axio Scope.A1荧光正置显微图像分析系统(ZEISS); Varioskan Flash多功能酶标仪(Thermo Scientific); FACSVantage SE(Diva)流式细胞仪(BD); 7300 Real-time PCR检测仪(美国ABI公司)。
2 方法 2.1 PC12氧化应激细胞模型的建立 2.1.1 NGF诱导PC12向神经细胞分化将PC12细胞接种于96孔板中, 待细胞生长至对数生长期, 分别用含NGF终浓度为1、2.5、5、7.5、10 μg·L-1的培养液继续培养, 并于12、24、48 h用显微镜观察细胞分化情况。
2.1.2 H2O2致PC12细胞损伤模型的建立由于H2O2的不稳定性, 为保证造模的成功, 先根据前期研究[7], 确定H2O2致损模型所需的浓度范围和时间, 再将PC12细胞以1×104的密度接种于96孔板中。NGF诱导分化后, 分别用含H2O2终浓度为0.1、0.3、0.5、0.75、1.0 mmol·L-1的培养液继续培养, 在损伤后2 h显微镜下实时观察PC12细胞形态, 以确定最佳损伤浓度。
2.2 ELISA法检测L-LDH和GSH的含量将生长好的PC12细胞以1×104/孔接种于96孔板中, 待细胞生长至对数生长期, 替换为无血清培养基, 将细胞分成正常对照组、模型组(仅H2O2处理)、补阳还五汤组和补阳还五汤类方组, 每组设6个复孔。待细胞与药物作用2 h后, 再加入0.3 mmol·L-1 H2O2继续置于细胞培养箱孵育2 h, 收集各组细胞上清液, 用L-LDH试剂盒检测其含量。细胞经胰蛋白酶消化后, 用100 μL PBS收集, 冰上超声裂解后, 12 000 r·min-1离心10 min, 取上清, 用GSH试剂盒检测其含量。
2.3 流式细胞术检测ROS的含量将生长好的PC12细胞以1×106/孔接种于6孔板中, 待细胞生长至对数生长期, 替换为无血清培养基, 将细胞分成空白组(正常细胞不做任何处理)、正常对照组(正常细胞加入DCFH-DA探针)、H2O2模型组、补阳还五汤组和补阳还五汤类方组。当药物与细胞作用2 h后, 加入0.3 mmol·L-1 H2O2处理2 h, 弃去培养基, 用预温的PBS轻轻漂洗3次, 加入终浓度为5 μmol·L-1的DCFH-DA荧光探针, 避光, 于37 ℃孵育30 min, 取出用预温的PBS漂洗、胰蛋白酶消化细胞后, 收集细胞悬浮液, PBS洗涤后制备细胞单悬液, 上流式细胞仪检测ROS的含量。
2.4 免疫荧光法检测CDK5、Tau蛋白在PC12细胞胞内的表达以Dylight549红色荧光标记CDK5、FITC绿色荧光标记Tau, 对胞内抗原定位, 并根据荧光量进行半定量分析。将经多聚赖氨酸包被的玻片消毒后, 置于6孔板中, 将生长好的PC12细胞以1×105/孔接种于6孔板中, 分为无一抗对照(H2O2处理→双二抗)、阴性对照组(正常细胞不做任何处理)、正常对照组(正常细胞加双一抗→双二抗)、模型组(H2O2处理→双一抗→双二抗)、补阳还五汤和补阳还五汤类方干预组(药物处理→H2O2处理→双一抗→双二抗)。待细胞爬片融合至80%, 分别用药物处理2 h后再用0.3 mmol·L-1的H2O2处理2 h, 将6孔板从细胞培养箱中取出, 按以下步骤处理:①用预温的PBS轻轻漂洗3次, 每次5 min; ② 4%的多聚甲醛室温固定20~30 min, PBS漂洗后, 用0.25% TritonX-100透化10 min; ③ 5% BSA封闭30 min后, 加入稀释后的CDK5/Tau双一抗混合液或Bcl-2/Bax双一抗混合液, 湿盒内4 ℃反应过夜; ④ PBS漂洗后, 再加入Dylight549和FITC标记的二抗混合液, 室温避光孵育1 h; ⑤PBS漂洗后封片, 荧光显微镜观察, 分别选择绿色荧光通道和红色荧光通道。
2.5 qPCR检测PC12细胞内凋亡因子caspase-3、Bax、Bcl-2 mRNA水平将生长好的PC12细胞接种于细胞培养皿中, 待细胞生长至对数生长期, 替换为无血清培养基同步化12 h, 将细胞分成正常对照组、模型组(H2O2处理)、补阳还五汤和补阳还五汤类方干预组。当药物与细胞作用2 h后, 加入0.3 mmol·L-1 H2O2处理2 h, 弃去培养基, 收集细胞, 采用RNA提取试剂盒提取组织RNA, 按反应程序42 ℃, 60 min; 70 ℃, 5 min; 4 ℃, 5 min逆转录合成cDNA, 用特定引物(引物序列见Tab 1)对各目的基因反转录后进行PCR扩增, 反应程序为:95 ℃, 10 min; 95 ℃, 15 s; 60 ℃, 30 s; 72 ℃, 30 s; 40个循环。结果采用2-ΔΔCt计算目的基因的相对表达量[10]。
| Gene(rat) | Primer sequence | Product length/bp |
| Caspase-3 | F: 5′-TCCTTCAGTGGTGGACATGA-3′ | |
| R: 5′-TCAACAATTTGAGGCTGCTG-3′ | 139 | |
| Bcl-2 | F: 5′-GGGATGCCTTTGTGGAACTA-3′ | |
| R: 5′-CTCACTTGTGGCCCAGGTAT-3′ | 138 | |
| Bax | F: 5′-CGAGCTGATCAGAACCATCA-3′ | |
| R: 5′-CTCAGCCCATCTTCTTCCAG-3′ | 191 | |
| GAPDH | F: 5′-AGACAGCCGCATCTTCTTGT-3′ | |
| R: 5′-TGATGGCAACAATGTCCACT-3′ | 142 |
细胞免疫荧光图片采用ImageJ软件进行荧光半定量分析, 流式细胞仪分析结果采用FlowJo软件分析。采用SPSS 17.0统计软件进行数据分析, 所有实验数据均经过方差齐性检验和正态性检验, 计量资料用x±s表示。组间比较用方差分析, 两两比较用LSD法。
3 结果 3.1 H2O2致PC12细胞损伤建立氧化应激细胞模型采用NGF诱导PC12向神经元分化。Fig 1结果显示, 各浓度的NGF均可诱导PC12细胞向神经元分化, 5 μg·L-1的NGF在24 h即可诱导PC12细胞分化, 并随着作用时间的延长分化越为明显, 突触伸长至胞体的2~3倍, 说明PC12细胞诱导后可获得类似神经元的表达和突触, 能够作为研究神经元分化及功能的替代模型。本实验以5 μg·L-1的NGF与PC12细胞作用24 h, 诱导其分化。
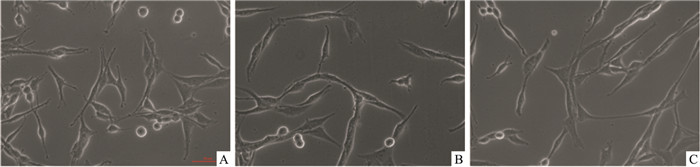
|
| Fig 1 Differentiation of PC12 to nervous induced by NGF for different time at concentration of 5 μg·L-1(×400) A: 12 h; B: 24 h; C: 48 h. |
将不同浓度的H2O2与PC12细胞共同培育2 h后, 如Fig 2所示, 0.1 mmol·L-1的H2O2对细胞损伤非常小, 仅有少量细胞变圆, 随着浓度的升高, 细胞发生聚集、脱落, 呈弥漫状, 当损伤浓度升高至1.0 mmol·L-1, 镜下视野几乎无细胞存活, 推测H2O2致PC12细胞损伤存在浓度依赖性。本实验以0.3 mmol·L-1的H2O2与PC12细胞共同作用2 h制备氧化应激细胞模型。
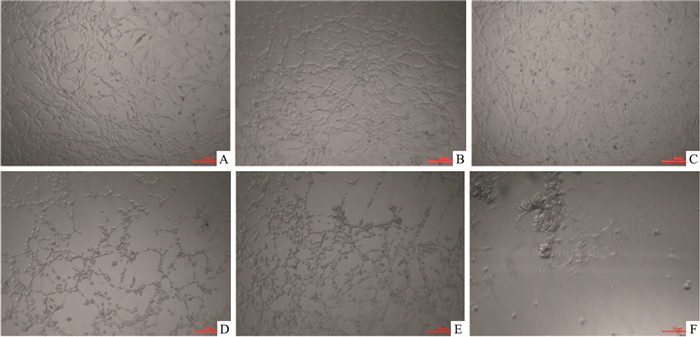
|
| Fig 2 PC12 cell morphology after treated with H2O2 for 2 h at different concentrations(×100) A: Control; B: 0.1 mmol·L-1 H2O2; C:0.3 mmol·L-1 H2O2; D: 0.5 mmol·L-1 H2O2; E:0.75 mmol·L-1 H2O2; F:10 mmol·L-1 H2O2. |
由Tab 2可见, 模型组细胞培养上清液中L-LDH的含量明显高于正常对照组(P<0.01);补阳还五汤类方与补阳还五汤作用细胞2 h后, 均能明显降低L-LDH活力(P<0.05), 抑制H2O2对PC12的损伤作用。正常PC12细胞中, GSH含量较高, 与模型细胞中GSH的含量呈现明显差异(P<0.01);补阳还五汤类方与补阳还五汤均能一定程度对抗H2O2的过氧化损伤(P<0.01), 使胞内GSH保持在正常水平, 对PC12细胞发挥保护作用。
| Group | L-LDH/IU·L-1 | GSH/g·L-1 |
| Normal | -0.10±0.31** | 70.86±2.30** |
| Model | 3.19±0.41 | 38.99±3.33 |
| Buyang Huanwu decoction | 1.26±0.38* | 83.95±5.75** |
| The recipe of Buyang Huanwu decoction | 1.56±0.22* | 79.62±7.34** |
| *P<0.05, **P<0.01 vs model | ||
如Fig 3所示, 正常对照组中仅有5.81%的细胞被胞内的ROS氧化成有荧光的DCF, 经H2O2处理后的模型细胞, 具有绿色荧光阳性信号的细胞占42.7%, 提示胞内ROS含量明显增高, H2O2诱导的氧化应激模型可模拟脑缺血损伤过程, 使氧化系统失衡, 从而导致细胞损伤和死亡。补阳还五汤及其类方干预组中, 具有阳性信号的细胞比例较模型组相比明显降低, 分别为12.4%和11.2%, 提示两方能一定程度抑制胞内ROS的异常升高。
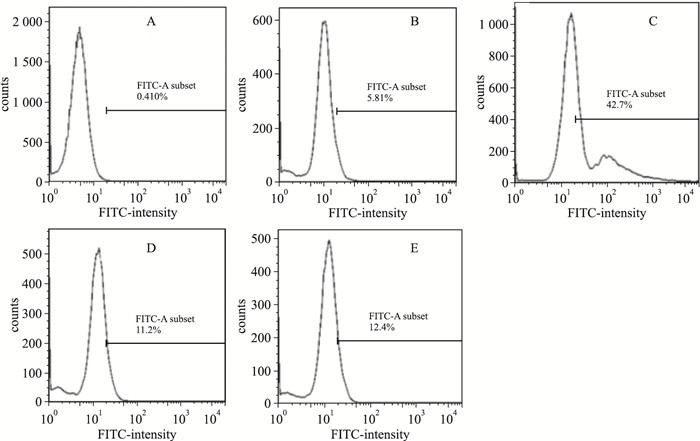
|
| Fig 3 Content of intracellular ROS in various groups examined by FCM A: Blank control; B: Normal control; C: Model group; D: Buyang Huanwu decoction group; E: The recipe of Buyang Huanwu decoction group. |
如Fig 4所示, 正常对照组细胞经CDK5和Tau双一抗、双二抗处理后, 细胞质内可见少量较弱的荧光颗粒, 提示正常的PC12内仅有少量CDK5、Tau蛋白的表达; 当PC12细胞经H2O2处理后, 模型组的胞质中可见大量较强的荧光颗粒, 且在细胞间的胞丝(突触)中亦可见荧光颗粒, 提示H2O2诱导的氧化应激模型细胞质中表达了大量的CDK5、Tau; 补阳还五汤类方和补阳还五汤干预组的细胞中荧光强度均出现一定程度的下降(P<0.05), 说明CDK5、Tau的表达量较模型细胞降低, 提示补阳还五汤类方能对抗H2O2的过氧化作用, 对PC12发挥保护作用。
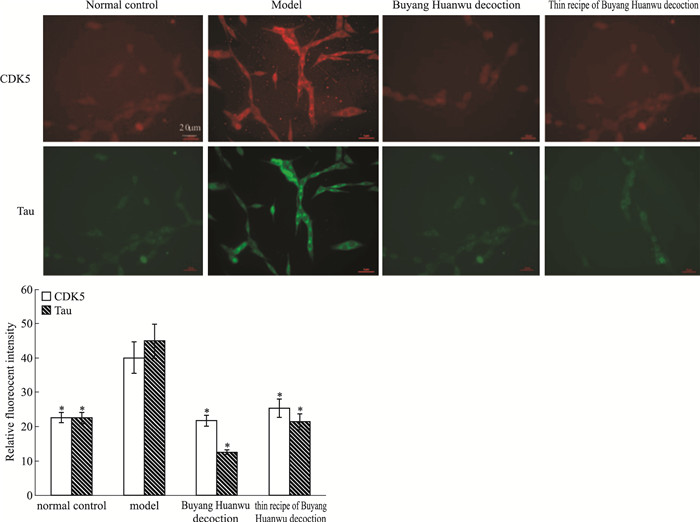
|
| Fig 4 Expression of CDK5 and Tau by IF staining(x±s, n=5) *P < 0.05 vs model |
如Fig 5所示, caspase-3 mRNA、Bax/Bcl-2 mRNA的比值在氧化应激模型细胞中的表达较正常组明显增加(P<0.01);补阳还五汤及其类方与模型组比较亦有统计学差异(P<0.05)。结果表明, 补阳还五汤及其类方均能一定程度降低caspase-3 mRNA和Bax/Bcl-2 mRNA的比值, 从而抑制凋亡的发生。
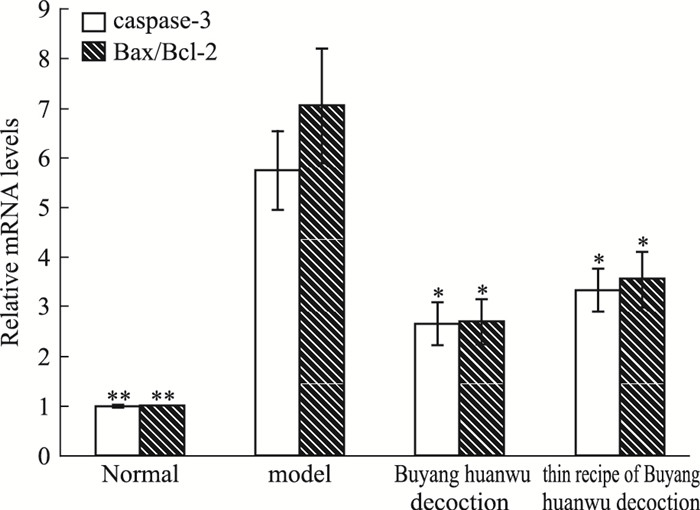
|
| Fig 5 Caspaes-3, Bax/Bcl-2 mRNA expression in PC12 cells(x±s, n=6) *P < 0.05, **P < 0.01 vs model |
本实验研究表明:以0.3 mmol·L-1 H2O2处理细胞2 h成功复制脑缺血体外氧化应激细胞模型; 1.0 g·L-1的补阳还五汤及其类方对氧化应激模型细胞具有保护作用, 两方均能明显降低L-LDH的渗漏, 增加胞内GSH的水平, 抑制胞内ROS的异常增多。氧化应激过程中, L-LDH的含量可以反映细胞的损伤程度, 正常细胞L-LDH的渗透率低, 当细胞受损时, L-LDH释放至细胞培养上清液中, 上清液中含量越多, 说明细胞损伤或死亡程度越大。GSH是生物体内最重要的非蛋白巯基化合物, 参与保护细胞免受毒物的损害, 是一个良好的表示氧化胁迫的指标, 其含量可以直接反映该细胞的生理活性。ROS是指由分子氧直接或间接转化而来、具有比分子氧更活泼的化学反应性的一类含氧物。正常情况下, 可将ROS维持在一个稳定的范围内, 当平衡打破, ROS持续升高, 将导致细胞损伤死亡。DCFH-DA是一种能自由通过细胞膜但不发光的化合物, 在细胞内经脂酶水解生成DCFH, 再经过ROS氧化生成有荧光的DCF, 荧光强度与ROS含量呈正相关。
研究发现, CDK5及其下游蛋白Tau与神经元的分化、凋亡等多种生理及病理功能密切相关。当CDK5过量表达, 将激活下游Tau蛋白在Ser199/202、Ser396/404位点过度磷酸化, 引起脑组织中典型的神经纤维结缠, 导致细胞凋亡。早在1997年, Green等[11]曾在大鼠全脑缺血模型中证明, 脑缺血5 min时, 海马CA1区出现组蛋白H1激酶活性的增加, 15 min后CDK5的磷酸化活性增加。Weishaupt等[12]发现, 小鼠短暂性脑缺血损伤后, CDK5活性和p25表达增加与海马CA1区的神经细胞凋亡有关。CDK5可以在细胞凋亡信号传导途径的上游进行调控, Rashidian等[13]通过免疫组化、水迷宫等方法, 证明了局限性脑缺血模型和缺氧处理的神经细胞发生凋亡时, CDK5起着关键性的作用。本实验研究表明, 在氧化应激模型细胞中, CDK5信号通路被激活, CDK5及其下游蛋白Tau异常活化, 凋亡相关蛋白caspase-3、Bax/Bcl-2表达水平上调, 证实CDK5信号通路对脑缺血后神经细胞凋亡调控的重要性。补阳还五汤类方能有效抑制CDK5、Tau的表达水平, 从而下调caspase-3、Bax/Bcl-2, 且其效果与补阳还五汤原方差异无统计学意义, 证实补阳还五汤类方可能通过CDK5信号转导途径下调凋亡因子, 有效防止细胞凋亡, 对氧化应激模型细胞发挥保护作用。从分子层面进一步证实了补阳还五汤类方的合理性和有效性。
补阳还五汤类方以黄芪30 g、川芎9 g、地龙3 g的比例入药, 重用原方中君药黄芪, 黄芪既治气虚之本, 又治血瘀之标, 既大补元气, 又利营卫之气, 通营卫之阻滞以活血; 川芎能升能散, 其性走窜, 补而不滞, 走而不守, 能上行头目, 旁达四肢, 下行血海, 血行则瘀去脉通也, 使气血和顺, 正所谓“血行风自灭”; 地龙长于行散走窜, 通经活络, 为佐药。各药合用, 使气足以推动血行, 瘀去络通, 药专力宏。为了更好发挥中药复方的整体功效, 减少传统汤剂在煎煮过程中一些有效成分的丢失, 补阳还五汤类方采用现代中药制备工艺, 将超临界二氧化碳萃取法和醇提、水煎工艺相结合, 保证中药有效成分最大限度的溶出。
( 致谢: 本实验完成于湖南省中药饮片标准化及功能工程技术研究中心, 得到该研究中心全体老师的指导及同学的协助, 在此表示感谢。)
| [1] |
王清任. 医林改错[M]. 上海: 上海科技出版社, 1966: 31. Wang Q R. Corrections on the Errors of Medical Works[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1966: 31. |
| [2] |
刘芳, 王宇红, 蔡光先, 等. 补阳还五汤及其精简方(脑健片)对脑缺血大鼠海马组织CDK4/CyclinD1表达的影响[J]. 中国中药杂志, 2015, 40(20): 4058-62. Liu F, Wang Y H, Cai G X, et al. Effect of Buyang Huanwu decoction and its recipe composition(NaoJian Tablet) on CDK4/CyclinD1 expression of rats with cerebral ischemia[J]. Chin J Chin Mat Med, 2015, 40(20): 4058-62. |
| [3] |
刘芳, 刘青萍, 王宇红, 等. 补阳还五汤及其精简方抗脑缺血损伤功效比较[J]. 中国中医药信息杂志, 2014, 21(9): 46-9. Liu F, Liu Q P, Wang Y H, et al. Comparison of the effects of Buyang Huanwu decoction and its recipe composition on cerebral ischemic injury[J]. Chin J Infor TCM, 2014, 21(9): 46-9. doi:10.3969/j.issn.1005-5304.2014.09.014 |
| [4] |
Mushtaq G, Greig N H, Anwar F, et al. Neuroprotective mechanisms mediated by CDK5 inhibition[J]. Curr Pharm Des, 2016, 22(5): 527-34. doi:10.2174/1381612822666151124235028 |
| [5] |
Cheung Z H, Ip N Y. Cdk5: a multifaceted kinase in neurodegenerative diseases[J]. Trends Cell Biol, 2012, 22(3): 169-75. doi:10.1016/j.tcb.2011.11.003 |
| [6] |
刘芳, 周小江, 陈乃宏. Cdk5介导的凋亡与自噬交互作用对脑缺血的调控[J]. 中国药理学通报, 2018, 34(4): 463-6. Liu F, Zhou X J, Chen N H. Regulation on intercross effect between Cdk5 mediated apoptosis and autophagy after cerebral ischemia[J]. Chin Pharmacol Bull, 2018, 34(4): 463-6. doi:10.3969/j.issn.1001-1978.2018.04.006 |
| [7] |
Ji Y B, Zhuang P P, Ji Z, et al. TFP5 peptide, derived from CDK5-activating cofactor p35, provides neuroprotection in early-stage of adult ischemic stroke[J]. Sci Rep, 2017, 3(7): 40013. |
| [8] |
刘芳, 王宇红, 邵乐, 等. 补阳还五汤精简方对大脑中动脉阻塞模型大鼠海马组织Cdk5的调控[J]. 中国药理学通报, 2017, 33(8): 1176-81. Liu F, Wang Y H, Shao L, et al. Regulation of thin recipe of Buyang Huanwu decoction on Cdk5 expression of rats after cerebral ischemia[J]. Chin Pharmacol Bull, 2017, 33(8): 1176-81. doi:10.3969/j.issn.1001-1978.2017.08.026 |
| [9] |
Spicer Z, Millhorn D E. Oxygen sensing in neuroendocrine cells and other cell types: pheochromocytoma(PC12) cells as an experimental model[J]. Endocr Pathol, 2003, 14(4): 277. |
| [10] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-8. doi:10.1006/meth.2001.1262 |
| [11] |
Green S L, Kulp K S, Vulliet R. Cyclin-dependent protein kinase 5 activity increases in rat brain following ischemia[J]. Neurochem Int, 1997, 31(4): 617-23. doi:10.1016/S0197-0186(97)00012-0 |
| [12] |
Weishaupt J H, Neusch C, Bähr M. Cyclin-dependent kinase 5(CDK5) and neuronal cell death[J]. Cell Tissue Res, 2003, 312(1): 1-8. doi:10.1007/s00441-003-0703-7 |
| [13] |
Rashidian J, Iyirhiaro G, AleyasinH, et al. Multiple cyclin-dependent kinases signals are critical mediators of ischemia-hypoxic neuronal death in vitro and in vivo[J]. PNAS, 2005, 102(39): 14080-5. doi:10.1073/pnas.0500099102 |

