

术后认知功能障碍(postoperative cognitive dysfunction, POCD)是老年患者术后常见的一种中枢神经系统并发症, 主要表现为精神错乱、焦虑、人格改变和记忆受损, 可导致患者术后致残率和死亡率的增加, 以及社会经济负担的增加[1]。在接受心脏手术的老年患者中, POCD的发生率为20%~79%, 在接受非心脏手术的老年患者中是4.1%~22.3%[2]。一项多中心的研究显示, 老年患者在接受非心脏手术治疗后, 25.8%的患者在术后一周罹患POCD, 9.9%的患者在术后3个月持续存在认知功能障碍[3]。目前对于术后认知功能障碍的病理改变仍未阐明。tau蛋白磷酸化后形成神经纤维缠结是阿尔兹海默病的主要病理改变之一, 有文献表明, tau也参与了术后认知功能障碍的发生发展[4]。高磷酸化的tau在海马区聚集后会引起线粒体结构和功能障碍, 还会导致神经元树突棘数量减少, 最终导致认知功能下降[5]。自噬是清除胞内高磷酸化tau的主要途径, 正常的自噬功能可以清除胞内高磷酸化的tau蛋白, 降低其对神经元的损伤并改善认知功能[6]。伐尼克兰是一种α4β2烟碱型乙酰胆碱受体亚型的部分激动剂, 通过前期实验, 我们发现伐尼克兰可通过减少tau的错误定位和神经元凋亡改善认知功能[7]。而伐尼克兰改善术后认知功能障碍是否与降低海马组织中高磷酸化的tau含量有关还无相关研究。本实验拟评估伐尼克兰对老年小鼠术后认知功能障碍的影响, 并进一步研究其相关机制, 为临床研究提供参考。
1 材料 1.1 试剂七氟醚(83291, 艾伯维), RIPA裂解液(P0013B, 碧云天), BCA蛋白浓度测定试剂盒(P0012, 碧云天), AT8抗体(MN1020, Thermo Fisher Scientific), STAT3抗体(9139, Cell Signaling Technology), p-STAT3(Tyr705)抗体(9145, Cell Signaling Technology), PKR抗体(184257, abcam), p-PKR抗体(3076, CST), GAPDH抗体(5014, Cell Signaling Technology), LC3B抗体(3868, Cell Signaling Technology), actin抗体(66009-I-Ig, Proteintech), 辣根过氧化物酶标记山羊抗小鼠IgG(ZB-2305, 中杉金桥), 辣根过氧化物酶标记山羊抗兔IgG(ZB-2301, 中杉金桥), ECL显影液(34095, Thermo Fisher Scientific), 抗荧光淬灭封片液(P0126, 中杉金桥), Alexa Fluor 568和488二抗购自Thermo Fisher Scientific公司。
1.2 仪器多通道小动物麻醉机(R550, 瑞沃德), 七氟醚蒸发器(R582S, 瑞沃德), Y迷宫和新物体识别实验装置购自深圳市瑞沃德生命科技有限公司, 凝胶图像分析系统购自上海天能科技有限公司, 激光共聚焦显微镜(LSM880, 蔡司, 德国)由安徽医科大学科研实验中心提供。
2 方法 2.1 实验动物及分组SPF级♂健康C57BL/6J小鼠40只, 18月龄, 体质量(27.5 ± 2.5)g, 由安徽医科大学实验动物中心提供。采用随机数字表法将小鼠随机分为4组(n=10):对照组(CON)、剖腹探查组(LAP)、伐尼克兰+剖腹探查组(Var + LAP)和伐尼克兰组(Var)。CON组不进行手术, 从术前1 d给予生理盐水(与伐尼克兰等量)灌胃; LAP组七氟醚麻醉下行剖腹探查, 从术前1 d给予生理盐水(与伐尼克兰等量)灌胃; Var + LAP组在剖腹探查术前1 d给予伐尼克兰溶液(1 mg·kg-1·d-1)灌胃; Var组不进行手术, 从术前1 d给予伐尼克兰溶液(1 mg·kg-1·d-1)灌胃, 所有小鼠灌胃均持续至术后d 13。
2.2 小鼠POCD模型制备参照文献[8]将小鼠置于啮齿动物吸入麻醉装置, 用4%~5%七氟醚麻醉诱导和维持, 氧流量为0.8 L·min-1。麻醉后, 将小鼠仰卧位固定于手术台上, 腹部消毒备皮, 沿腹中线行2.5 cm纵向切口, 将大约10 cm的肠袢拉出体外剧烈摩擦30 s并置于体外1 min, 之后将肠袢放回到腹腔中并用无菌铬肠缝合线缝合腹膜、腹部肌肉和皮肤。在手术过程中, 监测小鼠的呼吸节律和频率, 以及爪子的颜色, 整个手术过程尽量在15 min内完成。
2.3 Y迷宫实验Y迷宫实验被广泛用于评估啮齿动物的空间工作记忆。Y迷宫实验装置由3个尺寸为34 cm(长)×10 cm(宽)×10 cm(高)的带盖塑料臂组成, 互成120°, 其中两臂为黑色, 底部连续排布有不锈钢线管, 连接(2Hz, 40±5V)的电箱; 另一个臂为白色, 盖子透明, 室内光线可进入, 底部未排电线。整个实验分为两个阶段:术前4 d为训练期, 术后d 14为实验期。训练时将小鼠放入迷宫三臂交汇处, 允许其在迷宫内自由活动、适应8 min, 之后将小鼠面朝墙壁轮流放入两个黑色臂中的一个的末端, 立即给予10 s/ 2 Hz/ 40±5 V的电刺激, 小鼠逃避到白色臂记为正确反应, 在白色臂休息30s后, 进行下一次训练。在两个黑色塑料臂间随机选择放置小鼠, 直到小鼠在10次训练中有9次为正确反应。否则增加电刺激次数直到小鼠学会为止。实验时采用同样电刺激方式, 记录每次电刺激时小鼠逃避到白色塑料臂所需时间为进洞潜伏期, 10次电刺激中错误反应的次数为逃往安全区的错误次数, 作为评价记忆能力的参数。
2.4 新物体识别实验(novel object recognition task, NOR)新物体识别实验用于评估动物在环境中识别新物体的能力, 术后d 10开始进行新物体识别实验, 持续3 d。实验包括3个阶段:在适应阶段, 将小鼠放在没有物体的开放场地中适应24 h; 在记忆阶段, 将两个完全相同的物体放置于箱体中间(与四壁等距), 将小鼠沿着箱体一面中间等距位置面壁放于箱中, 记录10 min内小鼠对物体的探索时间和次数(纳入标准为小鼠的嘴巴或者鼻子靠近物体约2 cm范围之内); 实验阶段的步骤与记忆阶段相同, 只是将两个物体中的一个换为一个不同材质、形状、颜色的物体, 记录10 min内小鼠对新、旧物体的探索时间和次数。用辨别指数(discrimination index, DI)评估评小鼠的学习与记忆能力, 辨别指数=(新物体探索时间-旧物体探索时间)÷(新物体探索时间+旧物体探索时间)。
2.5 全蛋白制备及Western blot检测待行为学测试完成后用二氧化碳窒息处死小鼠, 冰上取右侧海马组织, 立即用含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液中在冰上机械研磨海马组织来制备全蛋白裂解物, BCA方法蛋白定量后进行蛋白质印迹分析(n=6), 将全蛋白裂解物加入10%聚丙烯酰胺凝胶中, 50 V电泳30 min, 90 V电泳90 min, 恒压100 V湿转2 h将蛋白转移到PVDF膜上, 5%脱脂奶粉室温封闭非特异性结合位点2 h, 然后将PVDF膜置于特异性一抗中, 4 ℃孵育过夜。洗膜后将PVDF膜置于辣根过氧化物酶偶联的相应二抗中, 室温孵育1 h。化学发光显现免疫反应性条带信号强度, 以β-actin或GAPDH作为内参, Image-J软件测量灰度值。
2.6 免疫荧光检测小鼠二氧化碳窒息后, 生理盐水灌流, 取下左侧脑组织, OCT包埋后, 液氮梯度速冻, 连续冠状位切片, 厚度15 μm, 10%山羊血清室温下封闭非特异性结合2 h, 经特异性一抗4 ℃下孵育过夜, PBS洗后与特异性Alexa Fluor 568和488二抗室温孵育2 h, 再孵育DAPI 15~20 min, 用抗荧光淬灭封片液封片。在激光共聚焦显微镜下观察海马组织CA3区阳性细胞。
2.7 统计学分析用SPSS 16.0软件进行统计分析。计量资料以x±s表示, 组间比较采用单因素方差分析, 两两比较采用Tukey检验。
3 结果 3.1 伐尼克兰对POCD模型小鼠认知功能的影响如Fig 1所示, 与对照组小鼠比较, 剖腹探查组小鼠在Y迷宫实验中逃往安全区的错误次数明显增加(P<0.01)、进洞潜伏期延长(P<0.05), 在新物体识别实验中的辨别指数降低(P<0.01), 表明剖腹探查引起小鼠认知功能下降, 学习与记忆能力受损; 与剖腹探查组比较, 伐尼克兰加剖腹探查组小鼠逃往安全区的错误次数明显降低(P<0.01)、进洞潜伏期缩短(P<0.05), 辨别指数明显增加(P<0.01), 表明围术期给予伐尼克兰后, 小鼠认知功能障碍得以改善, 学习与记忆能力增强。伐尼克兰组逃小鼠往安全区的错误次数、进洞潜伏期和辨别指数差异无统计学意义。
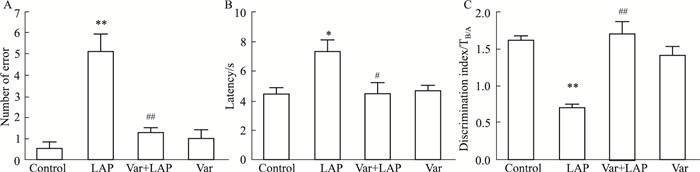
|
| Fig 1 Effects of varenicline on behavioral experiments (x±s, n=10) A: Number of error; B: Latency; C: Discrimination index. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs LAP |
Western blot检测小鼠海马组织中AT8和LC3B总蛋白在各组的表达。如Tab 1所示, 与对照组比较, 剖腹探查组小鼠海马组织中AT8表达增加、LC3B表达降低(P<0.01), 表明剖腹探查可以引起tau磷酸化程度增加, 而自噬功能发生障碍; 围术期给予伐尼克兰后, AT8表达降低、LC3B表达增加(P<0.01), 表明伐尼克兰可以恢复正常的自噬功能, 减少高磷酸化tau的含量; 伐尼克兰组AT8和LC3B的蛋白表达差异无统计学意义。
| Group | AT8 | LC3B |
| CON | 1.00±0.00 | 1.00±0.00 |
| LAP | 2.67±1.28** | 0.33±0.14** |
| Var+LAP | 1.08±0.30## | 0.88±0.20## |
| Var | 0.50±0.11 | 0.88±0.11 |
| **P<0.01 vs CON; ##P<0.01 vs LAP | ||
免疫荧光染色检测小鼠海马组织CA3区AT8和LC3B分别在核内和胞质的表达。如Fig 2所示, 与对照组比较, 剖腹探查组小鼠海马CA3区AT8核内表达增加、LC3B在胞质的表达减少; 围术期给予伐尼克兰处理后, AT8核内表达减少、LC3B胞质表达增加。与对照组比较, 伐尼克兰组AT8和LC3B在CA3区的表达无明显变化。
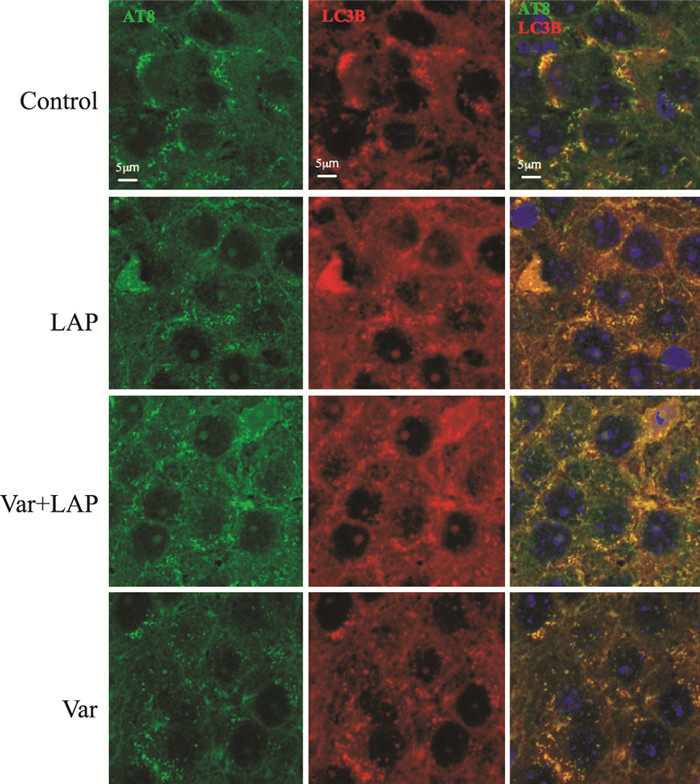
|
| Fig 2 Effects of varenicline on expression of AT8 and LC3B in CA3 region of hippocampus (n=6) Expression of AT8 (green) and LC3B (red) in the CA3 region of hippocampus; Nuclei were stained with DAPI (blue). |
免疫荧光双标记检测PKR和STAT3在小鼠海马CA3区的相互作用。如Fig 3所示, 与对照组比较, 剖腹探查组小鼠海马组织中PKR和STAT3的共定位增多; 围术期给予伐尼克兰处理后, PKR和STAT3的共定位减少。
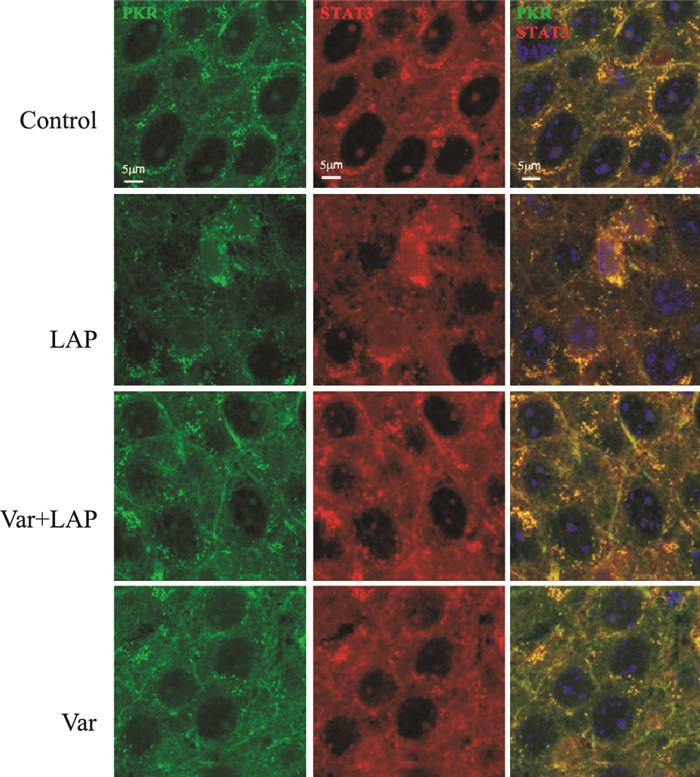
|
| Fig 3 Effects of varenicline on co-localization of PKR and STAT3 in CA3 region of hippocampus (n=6) Expression of PKR (green) and STAT3 (red) in CA3 region of hippocampus; Nuclei were stained with DAPI (blue). |
Western blot结果显示, 海马组织中PKR和STAT3总蛋白的表达在各组间差异无显著性。如Fig 4所示, 与对照组比较, 剖腹探查组小鼠海马组织中p-PKR表达增加、p-STAT3表达降低(P<0.05), 表明剖腹探查会引起PKR活性增强, 而STAT3活性降低; 给予伐尼克兰后, p-PKR表达降低、p-STAT3表达增加(P<0.05), 表明围术期给予伐尼克兰可以降低PKR活性, 增加STAT3活性。与对照组比较, 伐尼克兰组p-PKR表达降低(P<0.05), p-STAT3的蛋白表达差异无统计学意义。
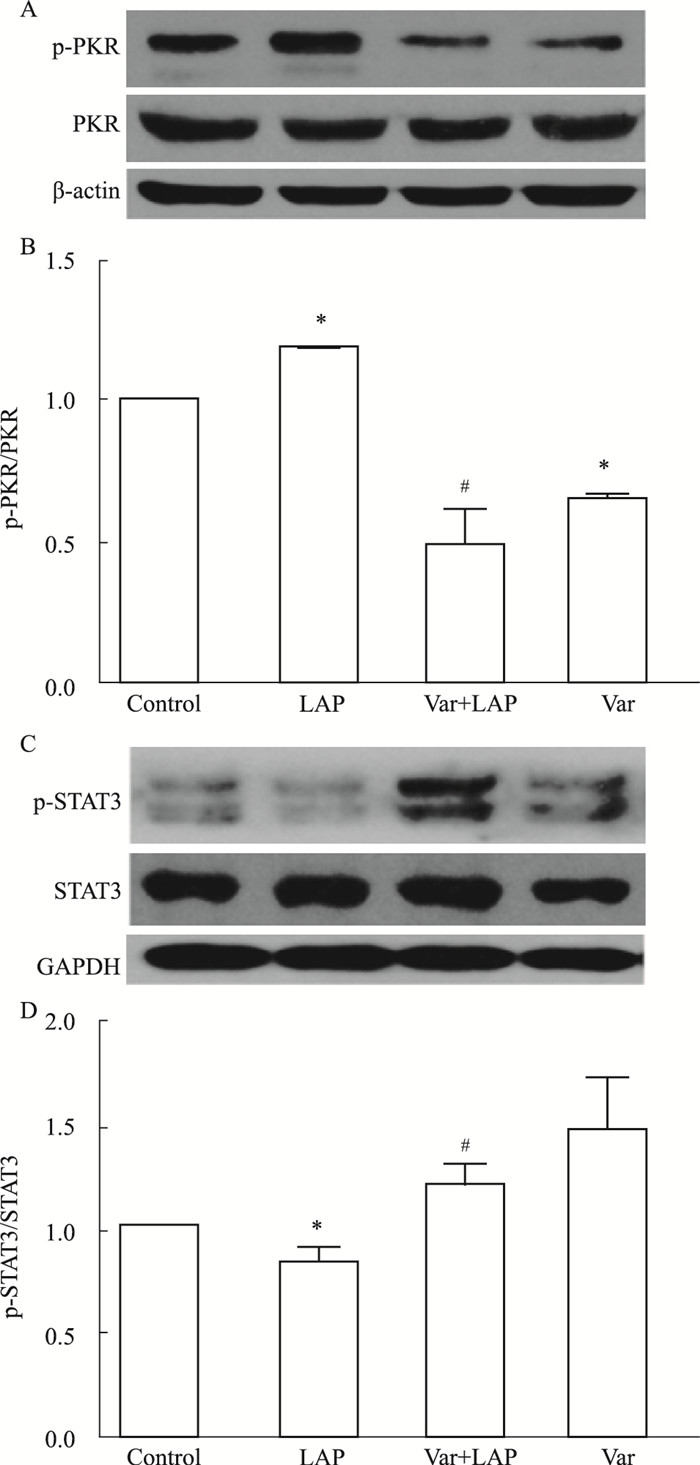
|
| Fig 4 Effects of varenicline on expression of p-PKR and p-STAT3 in hippocampus (x±s, n=6) A: Expression of p-PKR and PKR proteins examined by Western blot in the hippocampus; B: Ratio of p-PKR and PKR proteins expression; C: Expression of p-STAT3 and STAT3 proteins examined by Western blot in the hippocampus; D: Ratio of p-STAT3 and STAT3 proteins expression. *P < 0.05 vs CON; #P < 0.05 vs LAP |
伐尼克兰是一种新合成的高选择性α4β2-烟碱型乙酰碱受体亚型的部分激动剂, 于2006年获FDA批准作为一种戒烟药物使用。有研究表明, 急性注射伐尼克兰可以改善认知功能障碍[9], 并且对记忆能力产生增强作用[10]。本实验中, Var + LAP组和Var组从术前1 d给予伐尼克兰(1 mg·kg-1·d-1)灌胃, 持续至术后d 13;另外两组用等量生理盐水进行灌胃。于术后d 10~12进行新物体识别实验和d 14进行Y迷宫实验检测小鼠认知功能的改变。实验结果显示, LAP组的小鼠逃往安全区的错误次数增加、进洞潜伏期延长和辨别指数下降, 提示剖腹探查可以引起术后认知功能障碍。围术期给予伐尼克兰后, 小鼠在Y迷宫实验和新物体识别实验中的错误次数降低、进洞潜伏期缩短和辨别指数增加, 表明伐尼克兰可以改善术后认知功能障碍。
有文献表明, 剖腹探查引起的认知功能障碍与高磷酸化tau的神经毒性相关[11]。tau蛋白是含量最高的微管相关蛋白, 其主要生物学功能是促进微管组装和维持微管的稳定性, 维系神经元骨架系统的稳定。通过合成和降解维持tau的适当水平对细胞的健康至关重要。在阿尔兹海默病及其他tau蛋白病中, tau的磷酸化程度和认知功能障碍程度呈正相关[12]。自噬是一种进化上保守的降解途径, 自噬的主要功能是通过降解胞内异常聚集的蛋白质和已经损伤的细胞器来达到维持胞内大分子和细胞器功能正常的作用。在神经元中, 自噬可以清除高磷酸化的tau蛋白, 降低其神经毒性, 改善认知功能[13]。当自噬功能被抑制后, tau会发生聚集并且无法被清除, 最终导致细胞死亡[14]。LC3B是自噬的标记物, 其表达水平的变化可以反映自噬功能的变化。本实验通过对LC3B的表达进行检测, 结果表明, 剖腹探查会降低LC3B的表达, 导致自噬功能障碍; 而给予伐尼克兰灌胃后, LC3B含量增加, 自噬功能得到改善。AT8是tau在S202/T205位点磷酸化的产物, 其表达水平可以反映tau的磷酸化程度。本实验结果发现, 在POCD中, AT8含量增加, 给予伐尼克兰后, AT8表达降低, 其表达水平的变化与自噬功能的变化一致。
STAT3是一种信号传导及转录激活因子, 可以调控自噬功能。近年来有研究表明, PKR和STAT3结合后, 可以抑制自噬功能[15]。为进一步探讨伐尼克兰调节自噬的机制, 我们用免疫荧光双标记检测PKR和STAT3在海马组织的表达, 并用Western blot检测p-PKR和p-STAT3在海马组织的表达。实验结果表明, 伐尼克兰可以减少PKR和STAT3的结合, 降低其复合物对自噬的抑制作用, 增加STAT3的活性, 改善POCD中的自噬功能。
综上所述, 本研究发现, 伐尼克兰可以通过PKR/STAT3通路调节自噬功能, 降低海马组织中高磷酸化tau的含量, 改善术后认知功能障碍。
( 致谢: 本实验在麻醉与围术期医学安徽普通高校重点实验室和安徽医科大学第二附属医院中心实验室完成, 感谢所有实验参与人员的大力帮助!)
| [1] |
Steinmetz J, Christensen K B, Lund T, et al. Long-term consequences of postoperative cognitive dysfunction[J]. Anesthesiology, 2009, 110(3): 548-55. doi:10.1097/ALN.0b013e318195b569 |
| [2] |
Zhang Q, Li Y, Bao Y, et al. Pretreatment with nimodipine reduces incidence of POCD by decreasing calcineurin mediated hippocampal neuroapoptosis in aged rats[J]. BMC Anesthesiol, 2018, 18(1): 42. doi:10.1186/s12871-018-0501-0 |
| [3] |
Moller J T, Cluitmans P, Rasmussen L S, et al. Long-term postoperative cognitive dysfunction in the elderly ISPOCD1 study. ISPOCD investigators. International Study of Post-Operative Cognitive Dysfunction[J]. Lancet, 1998, 351(9106): 857-61. doi:10.1016/S0140-6736(97)07382-0 |
| [4] |
Xu G, Li L L, Sun Z T, et al. Effects of dexmedetomidine on postoperative cognitive dysfunction and serum levels of b-amyloid and neuronal microtubule-associated protein in orthotopic liver transplantation patients[J]. Ann Transplant, 2016, 21: 508-15. doi:10.12659/AOT.899340 |
| [5] |
Kandimalla R, Manczak M, Yin X, et al. Hippocampal phosphorylated tau induced cognitive decline, dendritic spine loss and mitochondrial abnormalities in a mouse model of Alzheimer's disease[J]. Hum Mol Genet, 2018, 27(1): 30-40. doi:10.1093/hmg/ddx381 |
| [6] |
Corsetti V, Florenzano F, Atlante A, et al. NH2-truncated human tau induces deregulated mitophagy in neurons by aberrant recruitment of Parkin and UCHL-1: implications in Alzheimer's disease[J]. Hum Mol Genet, 2015, 24(11): 3058-81. doi:10.1093/hmg/ddv059 |
| [7] |
Huang C, Chu J M, Liu Y, et al. Varenicline reduces DNA damage, tau mislocalization and post surgical cognitive impairment in aged mice[J]. Neuropharmacology, 2018, 143: 217-27. doi:10.1016/j.neuropharm.2018.09.044 |
| [8] |
Qiu L L, Ji M H, Zhang H, et al. NADPH oxidase 2-derived reactive oxygen species in the hippocampus might contribute to microglial activation in postoperative cognitive dysfunction in aged mice[J]. Brain Behav Immun, 2016, 51: 109-18. doi:10.1016/j.bbi.2015.08.002 |
| [9] |
Kruk-Slomka M, Budzynska B, Biala G. Involvement of cholinergic receptors in the different stages of memory measured in the modified elevated plus maze test in mice[J]. Pharmacol Rep, 2012, 64(5): 1066-80. doi:10.1016/S1734-1140(12)70904-0 |
| [10] |
Gould R W, Garg P K, Garg S, Nader M A. Effects of nicotinic acetylcholine receptor agonists on cognition in rhesus monkeys with a chronic cocaine self-administration history[J]. Neuropharmacology, 2013, 64: 479-88. doi:10.1016/j.neuropharm.2012.08.004 |
| [11] |
Drewes G. MARKing tau for tangles and toxicity[J]. Trends Biochem Sci, 2004, 29(10): 548-55. doi:10.1016/j.tibs.2004.08.001 |
| [12] |
罗洪斌, 刘翔宇, 牟南樵, 等. 板桥党参对激活GSK-3β诱导的AD模型大鼠认知功能障碍的保护作用及其机制[J]. 中国药理学通报, 2017, 33(8): 1060-7. Luo H B, Liu X Y, Mou N Q, et al. Banqiao Codonopisis Pilosula improves cognitive dysfunction induced by high GSK-3β activity and its possible mechanism[J]. Chin Pharmacol Bull, 2017, 33(8): 1060-7. doi:10.3969/j.issn.1001-1978.2017.08.006 |
| [13] |
Lei Z, Brizzee C, Johnson G V. BAG3 facilitates the clearance of endogenous tau in primary neurons[J]. Neurobiol Aging, 2015, 36(1): 241-8. doi:10.1016/j.neurobiolaging.2014.08.012 |
| [14] |
Falcon B, Noad J, McMahon H, et al. Galectin-8-mediated selective autophagy protects against seeded tau aggregation[J]. J Biol Chem, 2018, 293(7): 2438-51. doi:10.1074/jbc.M117.809293 |
| [15] |
Shen S, Niso-Santano M, Adjemian S, et al. Cytoplasmic STAT3 represses autophagy by inhibiting PKR activity[J]. Mol Cell, 2012, 48(5): 667-80. doi:10.1016/j.molcel.2012.09.013 |

