

2. 锦州医科大学生理学教研室, 辽宁 锦州 121001
2. Dept of Physiology, Jinzhou Medical University, Jinzhou Liaoning 121001, China
肝性脑病(hepatic encephalopathy, HE)是由肝衰竭导致的神经紊乱。根据肝脏疾病的不同类型, HE可分为三种类型:急性肝衰竭可引起A型HE; 单纯门体旁路(无肝脏疾病)可引起B型HE; 肝硬化可引起C型HE[1]。绝大多数的肝硬化患者在其病程中都会出现不同程度的HE。HE患者普遍存在隐匿性或显性的精神心理异常和认知功能损害, 严重影响患者的生活质量。
目前学界就肝性脑病的发病机制提出了多种假说, 其中最为重要的是“氨中毒学说”。该学说认为严重肝病导致机体对氨的清除不力, 导致血氨升高, 增高的血氨通过血脑屏障进入脑组织, 干扰脑细胞, 尤其是星形胶质细胞的功能和代谢, 导致脑功能障碍的出现。最近研究显示, 氨刺激可导致星形胶质细胞发生老化性改变, 这可能是引起患者持续认知损害的病理基础[2]。
二甲双胍是目前广泛使用的一种2型糖尿病降糖药物。但在其降糖效应之外, 近年来越来越的研究显示二甲双胍还可对老化相关状态和老化疾病起到保护作用。这些保护作用可体现在生理功能(如活动度、肌肉强度与耐力)、临床预后(如血压、体重和心血管健康)和心理预后(如认知、抑郁和生活质量)等多个方面[3]。二甲双胍可通过调控炎症、自噬、细胞老化等多种机制发挥其对老化性疾病的保护作用[4]。目前, 对于二甲双胍是否能对氨诱导的星形胶质细胞老化起到保护作用并不清楚。因此, 本研究旨在就此问题进行探讨。
1 材料与方法 1.1 主要试剂DMEM培养基、马血清购自美国Gibco公司; 二甲双胍、双丁酰环磷腺苷(dibutyryl cyclic AMP, dBcAMP)、Bafilomycin购自Sigma公司; BeyoClickTM EdU-488细胞增殖检测试剂盒购自碧云天生物技术有限公司; 微管相关蛋白轻链Ⅰ/Ⅱ(microtube-associated protein 1 light chain Ⅱ, LC3BⅠ/Ⅱ)、p62、Beclin1、p16一抗均购自Abcam公司; 辣根过氧化物酶标记的二抗购自美国Santa Cruz公司。
1.2 仪器CO2培养箱(美国Thermo Fisher Scientific公司)、电泳仪及转膜仪(美国Bio-Rad公司); 多功能酶标仪(美国Bio Tek公司)。
1.3 细胞培养取24 h内出生CD-1小鼠乳鼠大脑半球新皮层, 经涡旋震荡及尼龙网滤过后接种于60 mm的Falcon Primaria培养皿、24孔培养板或35 mm的共聚焦培养皿中。培养基先是含15%胎牛血清及青霉素和链霉素的DMEM, 10天后, 将血清更换为10%的马血清。每3~4 d换液, 细胞生长两周后, 加入0.25 mmol·L-1的dBcAMP以促细胞分化。生长25~28 d的细胞用于后续实验。
1.4 实验分组待体外培养星形胶质细胞分化成熟后将细胞分为4组:对照组、氯化铵组、二甲双胍(250、500 μmol·L-1)组, 检测二甲双胍对细胞自噬和老化的影响。细胞先以二甲双胍预处理30 min, 随后加入3 mmol·L-1氯化铵共同作用72 h。
1.5 细胞DNA合成检测利用BeyoClickTM EdU-488细胞增殖检测试剂盒检测DNA合成来间接反映细胞的增殖情况。用5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine, EdU)溶液标记细胞后, 室温下用4%多聚甲醛固定15 min, 再用TritonX-100(0.3%)室温通透15 min, 最后加入Click反应液室温避光反应30 min。充分洗涤后, 用多功能酶标仪检测细胞荧光强度。检测参数为, 激发波长:495 nm, 发射波长:519 nm。
1.6 Western blot实验细胞加入RIPA裂解液(临用前加入1% PMSF)提取总蛋白, BCA法测蛋白后, 取50 g蛋白行SDS聚丙烯酰胺凝胶电泳, 并电转仪至PVDF膜。随后, PVDF膜用5%脱脂牛奶室温封闭1 h, 加入LC3、p62、Beclin1、p62一抗4℃孵育过夜。于次日加入辣根过氧化物酶标记的二抗室温孵育2小时, 增强化学发光显色。
1.7 统计学方法数据采用SPSS 17.0统计软件进行分析。数值以x±s表示。两组间比较采用t检验, 多组间比较采用单因素方差分析。
2 结果 2.1 氨对星形胶质细胞自噬标志蛋白表达的影响Fig 1A结果显示, 与对照组相比, 3 mmol·L-1氯化铵刺激72 h可明显上调星形胶质细胞LC3Ⅱ、Beclin1、p62的表达。Fig 1B结果显示, 在bafilomycin存在的情况下, 氨诱导的LC3Ⅱ表达发生了进一步的上调。表明氯化铵对星形胶质细胞具有启动自噬和阻断自噬流的双重作用。
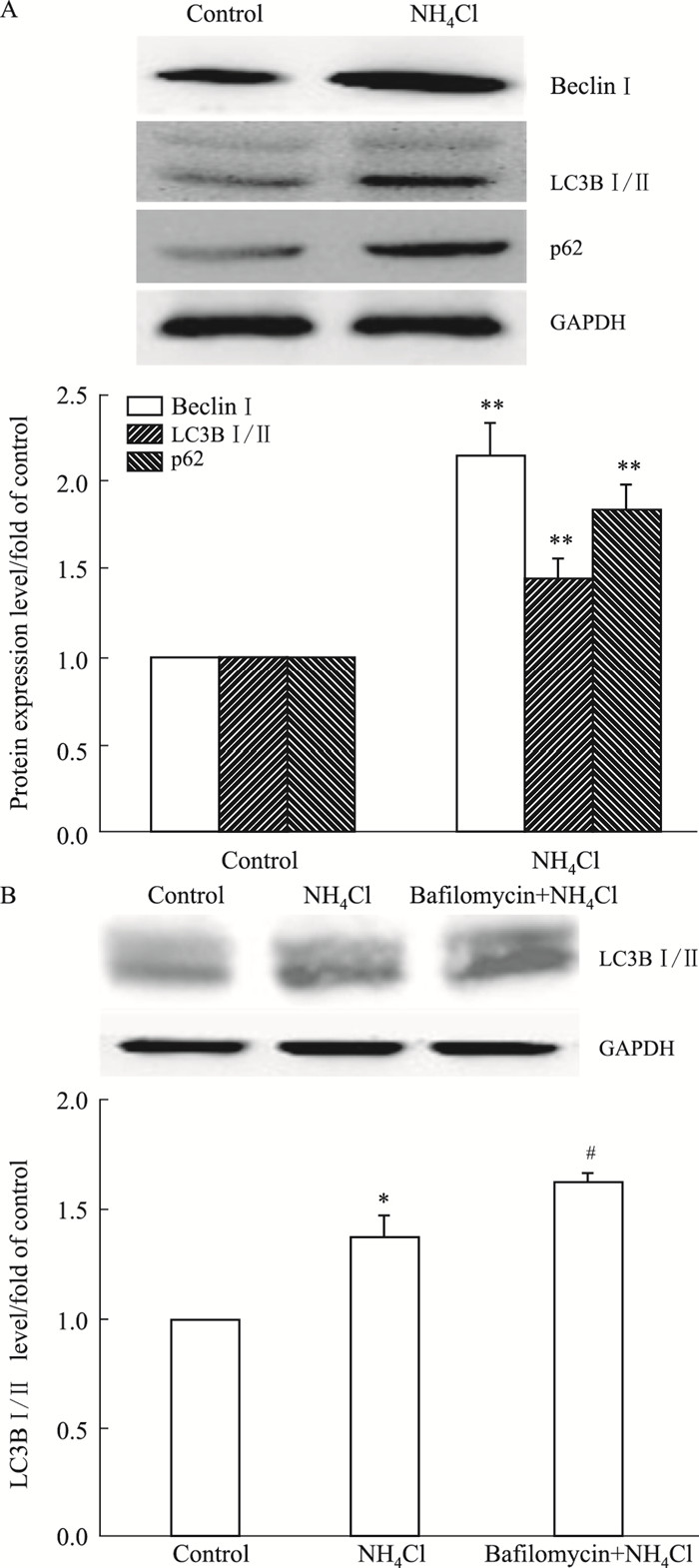
|
| Fig 1 Effect of ammonia on expression of autophagic markers in astrocytes (x±s, n=3) A: Effect of ammonia on expression of autophagic markers Beclin1, LC3BⅠ/Ⅱ and p62;B: Effect of bafilomycin on ammonia-induced upregulation of LC3BⅠ/Ⅱ expression. *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group. |
Fig 2结果显示, 与对照组相比, 3 mmol·L-1氯化铵刺激72 h可明显抑制星形胶质细胞增殖, 3-甲基腺苷(3-methyladenine, 3-MA)预处理进一步增强了氨对星形胶质细胞的抑制作用。提示自噬启动对于氨诱导的星形胶质细胞的增殖抑制具有保护作用。
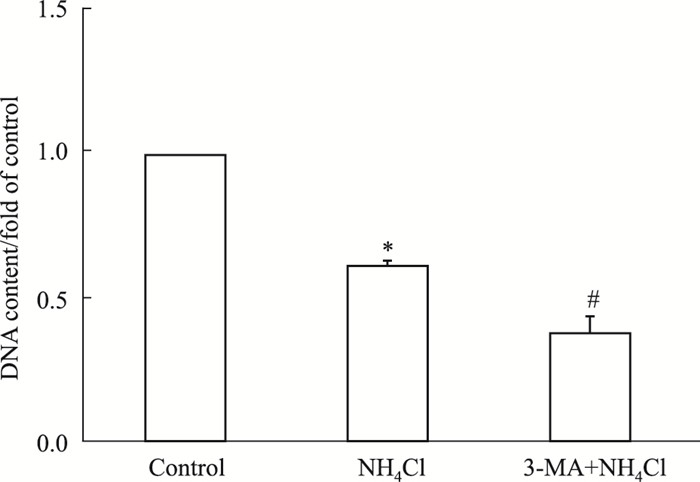
|
| Fig 2 Effect of 3-MA on ammonia-induced proliferation inhibition of astrocytes (x±s, n=5) *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group |
Fig 3结果显示, 3 mmol·L-1氯化铵刺激72 h可明显上调星形胶质细胞老化标志物p16的表达, 3-MA预处理进一步增加了氨诱导的星形胶质细胞p16的表达。提示自噬启动对于氨诱导的星形胶质细胞的老化具有保护作用。
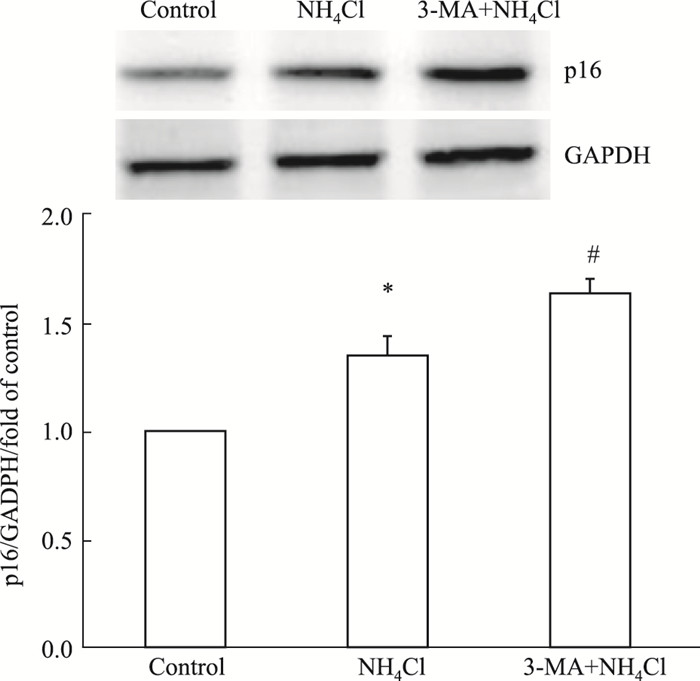
|
| Fig 3 Effect of 3-MA on ammonia-induced up-regulation of senescence marker p16 in astrocytes (x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group. |
Fig 4结果显示, 与对照组相比, 3 mmol·L-1氯化铵刺激72 h可明显上调星形胶质细胞LC3BⅡ的表达, 二甲双胍预处理进一步增加了LC3BⅡ的表达; 3 mmol·L-1氯化铵刺激72 h可明显上调星形胶质细胞p62的表达, 二甲双胍预处理则明显降低了氨诱导的p62表达。表明二甲双胍可强化氨对星形胶质细胞自噬诱导效应。
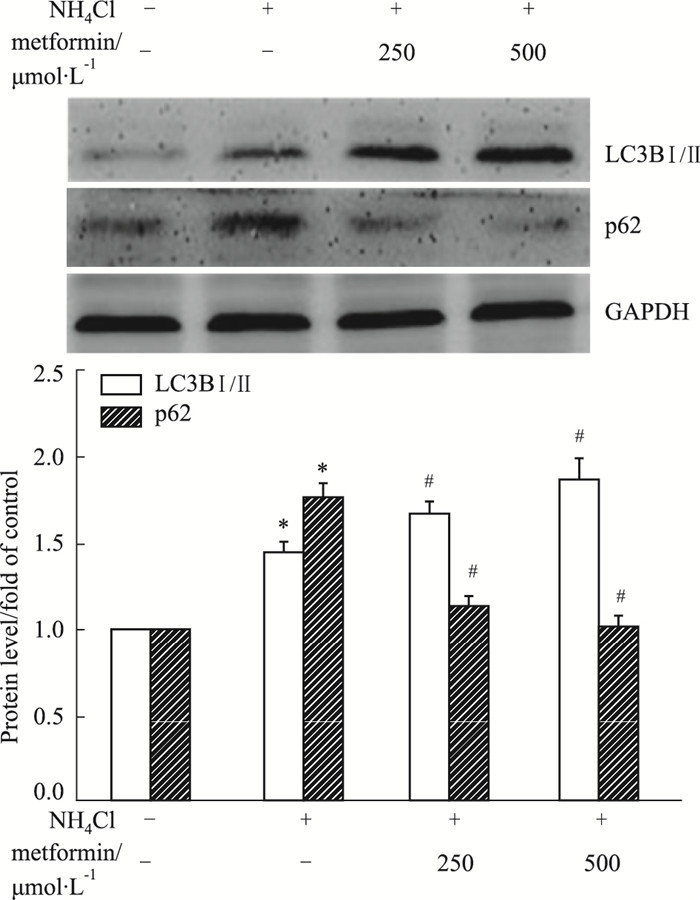
|
| Fig 4 Effect of metformin on ammonia-induced up-regulation of LC3BⅡ and p62 in astrocytes (x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group. |
Fig 5结果显示, 与对照组相比, 3 mmol·L-1氯化铵刺激72 h可明显抑制氨诱导的星形胶质细胞增殖, 二甲双胍预处理明显缓解氨诱导的星形胶质细胞增殖抑制。表明二甲双胍可缓解氨导致的星形胶质细胞增殖抑制。
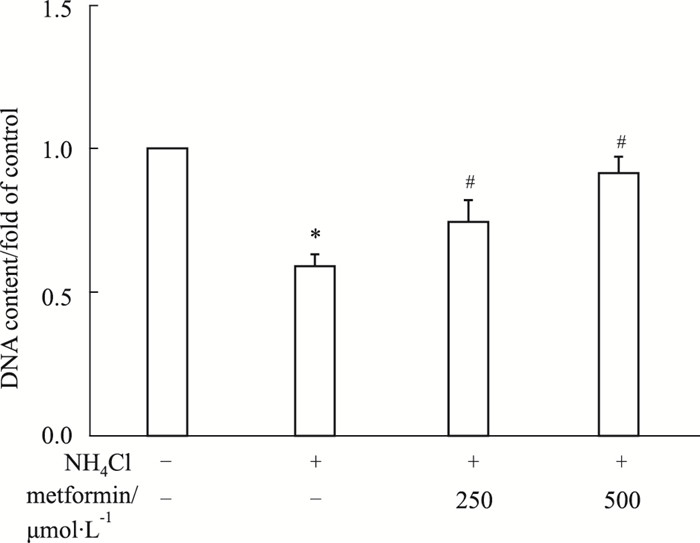
|
| Fig 5 Effect of metformin on ammonia-induced proliferation inhibition of astrocytes (x±s, n=5) *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group. |
Fig 6结果显示, 与对照组相比, 3 mmol·L-1氯化铵刺激72 h可明显上调星形胶质细胞老化标志物p16的表达, 二甲双胍预处理明显缓解氨诱导的星形胶质细胞p16的表达。表明二甲双胍可缓解氨导致的星形胶质细胞老化。
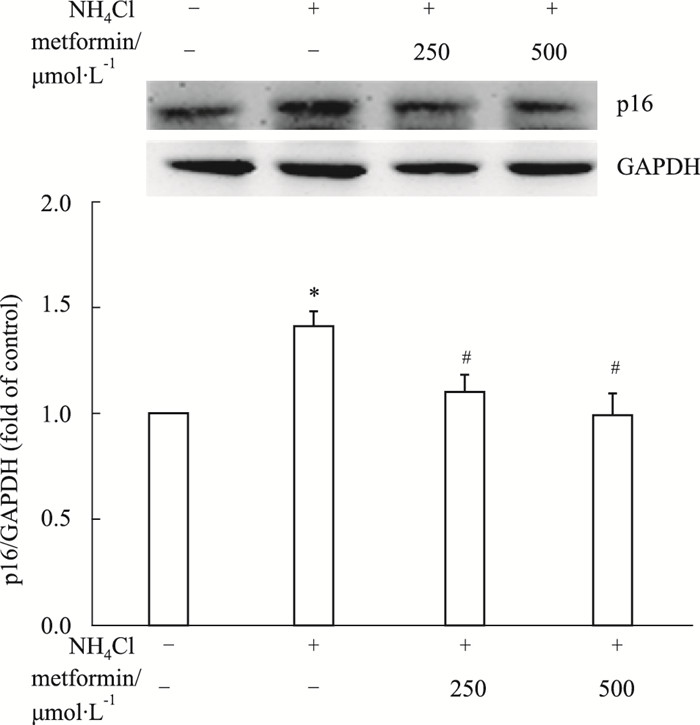
|
| Fig 6 Effect of metformin on ammonia-induced up-regulation of senescence marker p16 in astrocytes (x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs NH4Cl group. |
自噬是细胞维持其内稳态一种高度保守的重要生物学过程, 当细胞遭受到营养剥夺等各种应激时, 其可通过自噬降解长寿命蛋白和细胞器, 引起胞质成分的大量降解和循环利用, 从而为细胞提供必要的营养物质[5]。之前研究证实在不同的细胞, 氨可对细胞自噬过程起到促进和/或抑制作用[6-8], 但目前尚不清楚氨如何影响星形胶质细胞的自噬过程。常用的自噬标志蛋白有LC3、p62和Beclin1等。当自噬启动时, LC3BII表达水平上调, p62则随着自噬溶酶体的降解而减少[6]。Beclin1对于自噬的启动至关重要[9]; 而当自噬流发生阻断时, 则会出现LC3BII和p62表达水平的同时上调。在本研究中, 氨刺激可增加LC3BII和p62的表达, 同时Beclin1的表达也明显增加。而且, bafilomycin预处理的情况下, 氨可进一步促进LC3BII表达的上调。上述结果表明氨刺激对星形胶质细胞细胞自噬的调控呈现出双重作用:一方面可促进自噬的启动, 而另一方面, 其又可阻断细胞自噬流。
自噬的发生与脑缺血、帕金森氏病、多发性硬化等多种中枢神经系统功能紊乱密切相关。诱导自噬发生可缓解炎症的发生, 并对神经退行性疾病起到保护作用[10]。值得注意的是, 自噬对机体并不总是起着保护性的作用, 过度的自噬可能会破坏胞质和细胞器, 释放出凋亡相关因子, 导致细胞的死亡。因此, 自噬对细胞来说是一把双刃剑[11]。在本研究中, 自噬抑制剂3-MA可使氨刺激诱导的星形胶质细胞老化标志物p16蛋白的表达进一步增加, 提示自噬活动的增强有利于缓解氨对星型胶质细胞老化的毒性作用。
二甲双胍是目前临床上使用的2型糖尿病一线治疗药物。最近研究显示, 二甲双胍还可通过其非降糖作用发挥其生物学保护效应[12]。二甲双胍可通过抗氧化、抗炎、抗凋亡、自噬调控等途径对中枢神经系统产生有益影响。已有研究显示二甲双胍可通过促自噬活性调控老化过程, 延长寿命, 改善老年个体心血管功能[13]。Chen等[14]最近研究也证实, 二甲双胍可通过其促自噬活性抗髓核细胞的凋亡和老化, 缓解腰椎间盘退变。同时, 二甲双胍明显改善大脑的老化状态的机制也与其促自噬活性有关[15]。基于以上研究, 我们推测二甲双胍亦有可能对氨诱导的星形胶质细胞老化起到保护作用。在本研究中, 二甲双胍预处理可明显促进氨诱导的LC3BII的进一步上调, 并降低p62的水平, 提示二甲双胍可促进氨毒性状态下星形胶质细胞的自噬; 同时, 二甲双胍预处理明显降低老化标志物p16的表达。说明二甲双胍对氨诱导的星形胶质细胞老化确实起到了保护作用, 其机制可能与其促自噬活性有关。
综上所述, 天然产物衍生物二甲双胍可通过增强星形胶质细胞自噬的过程, 缓解氨对抗星形胶质细胞老化的毒性作用。
( 致谢: 本课题在辽宁省脑与脊髓损伤重点实验室完成, 特别感谢实验室的指导老师及各位参与者!)
| [1] |
Lima L C D, Miranda A S, Ferreira R N, et al. Hepatic encephalopathy: Lessons from preclinical studies[J]. World J Hepatol, 2019, 11(2): 173-85. doi:10.4254/wjh.v11.i2.173 |
| [2] |
Gorg B, Karababa A, Haussinger D. Hepatic encephalopathy and astrocyte senescence[J]. J Clin Exp Hepatol, 2018, 8(3): 294-300. doi:10.1016/j.jceh.2018.05.003 |
| [3] |
Valencia W M, Palacio A, Tamariz L, et al. Metformin and ageing: improving ageing outcomes beyond glycaemic control[J]. Diabetologia, 2017, 60(9): 1630-8. doi:10.1007/s00125-017-4349-5 |
| [4] |
Song J, Jiang G, Zhang J, et al. Metformin prolongs lifespan through remodeling the energy distribution strategy in silkworm, Bombyx mori[J]. Aging (Albany NY), 2019, 11(1): 240-8. |
| [5] |
Hsu H C, Chen C Y, Lee B C, et al. High-fat diet induces cardiomyocyte apoptosis via the inhibition of autophagy[J]. Eur J Nutr, 2016, 55(7): 2245-54. doi:10.1007/s00394-015-1034-7 |
| [6] |
Li Z, Ji X, Wang W, et al. Ammonia Induces Autophagy through Dopamine Receptor D3 and MTOR[J]. PLoS One, 2016, 11(4): e0153526. doi:10.1371/journal.pone.0153526 |
| [7] |
Harder L M, Bunkenborg J, Andersen J S. Inducing autophagy: a comparative phosphoproteomic study of the cellular response to ammonia and rapamycin[J]. Autophagy, 2014, 10(2): 339-55. doi:10.4161/auto.26863 |
| [8] |
Cheong H, Lindsten T, Wu J, et al. Ammonia-induced autophagy is independent of ULK1/ULK2 kinases[J]. Proc Natl Acad Sci USA, 2011, 108(27): 11121-6. doi:10.1073/pnas.1107969108 |
| [9] |
Wurstle S, Schneider F, Ringel F, et al. Temozolomide induces autophagy in primary and established glioblastoma cells in an EGFR independent manner[J]. Oncol Lett, 2017, 14(1): 322-8. doi:10.3892/ol.2017.6107 |
| [10] |
Shao B Z, Ke P, Xu Z Q, et al. Autophagy plays an important role in anti-inflammatory mechanisms stimulated by alpha7 nicotinic acetylcholine receptor[J]. Front Immunol, 2017, 8: 553. doi:10.3389/fimmu.2017.00553 |
| [11] |
He C, Zhu H, Li H, et al. Dissociation of Bcl-2-Beclin1 complex by activated AMPK enhances cardiac autophagy and protects against cardiomyocyte apoptosis in diabetes[J]. Diabetes, 2013, 62(4): 1270-81. doi:10.2337/db12-0533 |
| [12] |
薛晶, 杨陈, 安宁, 等. 二甲双胍非降糖肾脏保护作用的研究新进展[J]. 中国药理学通报, 2018, 34(5): 593-6. Xue J, Yang C, An N, et al. Non-hypoglycemic effect of metformin in renal protection:a literature review[J]. Chin Pharmacol Bull, 2018, 34(5): 593-6. doi:10.3969/j.issn.1001-1978.2018.05.001 |
| [13] |
Ren J, Zhang Y. Targeting autophagy in aging and aging-related cardiovascular diseases[J]. Trends Pharmacol Sci, 2018, 39(12): 1064-76. doi:10.1016/j.tips.2018.10.005 |
| [14] |
Chen D, Xia D, Pan Z, et al. Metformin protects against apoptosis and senescence in nucleus pulposus cells and ameliorates disc degeneration in vivo[J]. Cell Death Dis, 2016, 7(10): e2441. doi:10.1038/cddis.2016.334 |
| [15] |
Garg G, Singh S, Singh A K, et al. Antiaging effect of metformin on brain in naturally aged and accelerated senescence model of rat[J]. Rejuvenation Res, 2017, 20(3): 173-82. doi:10.1089/rej.2016.1883 |

