


2. 湖北民族大学医学部病理教研室, 湖北 恩施 445000;
3. 生物资源保护与利用湖北省重点实验室, 湖北 恩施 445000;
4. 恩施州中心血站, 湖北 恩施 445000
 ,
YANG Qing-yu2,
CHEN Ying2,
QIN Xiao-li2,
ZHAO Fang-yu1,2,
TANG Xian-e1,2,
WANG Feng-jie1,
HE Yi-duo1,
SHI Si-rong4
,
YANG Qing-yu2,
CHEN Ying2,
QIN Xiao-li2,
ZHAO Fang-yu1,2,
TANG Xian-e1,2,
WANG Feng-jie1,
HE Yi-duo1,
SHI Si-rong4

2. Dept of Pathology, Medical School of Hubei Minzu University, Enshi Hubei 445000, China;
3. Key Lab of Biological Resource Protection and Utilization of Hubei Province, Enshi Hubei 445000, China;
4. Blood Bank Center of Enshi, Enshi Hubei 445000, China
随着人口老龄化的加剧, 与衰老相关的疾病逐渐成为人类健康的大敌, 如神经系统疾病、癌症等受到广泛的关注和重视。研究发现, 微小RNA(miRNA)参与细胞凋亡及衰老等多种生命过程[1], 其中miR-155是一个多功能miRNA, 在肺、心、脑及肾脏表达较丰富[2], 通过和靶基因Rheb(Ras homolog enriched in brain, Rheb)的3'UTR相结合, 负向调控细胞自噬[3, 4]。提高Rheb表达水平可以激活mTORC1(mammalian target of rapamycin C1, mTORC1)的活性, 对延缓衰老具有重要作用[5]。头顶一颗珠(Trillium tschonoskii Maxim, TTM)系百合科延龄草属植物延龄草的干燥根茎, 其主要成分为延龄草苷, 具有抗氧化和保护神经损伤作用[6, 7]; 亦可通过上调睫状神经营养因子和其受体的表达来保护脊髓损伤[8]。为深入探讨延龄草苷延缓衰老的机制, 本研究采用大鼠皮下注射D-半乳糖法构建大脑衰老模型, 评估miR-155/Rheb/mTOR信号通路中的相关基因、蛋白质的表达来证实我们的假设, 以期为延缓衰老相关疾病提供潜在的靶向药。
1 材料与方法 1.1 药物和试剂头顶一颗珠提取物延龄草苷(CAS No.14144-6-0, Bellancom)购自北京寰宇科创有限公司, 纯度大于98%。D-半乳糖(D-Galactose, D-gal)购自美国Sigma-Aldrich有限公司。一抗mTOR, p-mTOR购自美国Cell Signaling Technology公司; Rheb, 8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine, 8-OHDG)购自美国Sigma公司; 其余Western blot相关试剂购自上海碧云天公司。
1.2 动物分组和处理50只SD大鼠, ♂, 体质量(220±20)g, 由湖北省实验动物研究中心提供, ,许可证号:SCXK(鄂)2015-0018。实验接受湖北民族大学动物伦理委员会的监督。随机分为5组, 每组10只。正常组, 常规喂养; D-gal组, 皮下注射D-半乳糖(200 mg·kg·d-1); TTM组, 皮下注射D-半乳糖(200 mg·kg·d-1), 并给予50 mg·kg·d-1、100 mg·kg·d-1和200 mg·kg·d-1 TTM灌胃, 共6周, 常规喂养, 自由饮水。
1.3 行为学测试定位航行测试, 在大鼠入水时采集信号, 大鼠成功上台, 且在平台上停留时间超过10 s, 记录总路程、潜伏期、平均速度等。空间探索实验记录1 min内大鼠穿越原有平台的次数。Morris水迷宫完成24 h后, 麻醉, 每组选5只大鼠, 先用0.9%生理盐水经心脏行主动脉灌洗, 并用4%中性多聚甲醛灌注固定。剩余大鼠灌流后取海马, -80 ℃冰箱中保存备用。
1.4 HE、Nissl及8-OHdG和Rheb染色脑组织常规切片, 行HE及Nissl染色, 观察海马CA1区神经元形态及Nissl小体情况。
免疫荧光染色:抗原修复后用BSA封闭, 滴加8-OHdG(1 :250)和Rheb(1 :300)抗体, 4 ℃冰箱过夜, 加入二抗(1 :1 000), DAPI染核, Nikon 80i荧光显微镜下观察并采集图像。以PBS代替一抗作为阴性对照。
1.5 Real-time PCR法检测miR-155-3p水平取海马组织, 采用miRNA Purification Kit miRNA提取试剂盒(Tiangen), 提取其miRNA(具体步骤参照说明书进行)。引物设计与合成在miRBase数据库(http://www.mirbase.org)和GenBank查找基因序列, 使用软件Primer 5进行引物设计, 并将所得引物进行合成(生工生物工程(上海)有限公司合成)。miRNA-155-3p基因引物序列:CCTCCTACCTGTTAGCATTAAC。miRNA逆转录和real time RT-PCR选用U6 snRNA作为内参。整个扩增反应体系参照miRNA Real-Time PCR Assay Kit(SuperReal PreMix Plus(SYBR GREEN))试剂说明书进行。miRNA的逆转录选用miRNA第一链cDNA合成(加尾法), Poly(A)加尾反应和cDNA合成反应同步进行。反应条件:95 ℃, 15 min预变性, 95 ℃ 10 s变性, 60 ℃ 30 s退火/延伸, 40个循环。标本均作复管PCR反应, 重复3次。miRNA-155-3p表达采用2-△△Ct法计算其相对表达量。△Ct=Ct(miRNA)-Ct(U6), △△Ct=△Ct实验-△Ct对照。实验数据由美国安捷伦Mx3005P实时荧光定量系统自动采集分析。
1.6 海马组织蛋白的提取及WB检测取海马加入裂解液和蛋白磷酸酶抑制剂及PMSF, 冰上匀浆, 离心(4 ℃, 12 000 r·min-1, 15 min), BCA法测定蛋白浓度, SDS-PAGE凝胶电泳, 冰浴转膜, 加一抗Rheb(1 :500)、mTOR, p-mTOR, β-actin(1 :1 000)4 ℃孵育过夜, 加二抗(HRP标记的羊抗兔IgG, 1 :5 000)/(HRP标记的羊抗鼠IgG), 室温孵育4 h后TBST洗膜, LAS 4000 mini凝胶成像系统显影并分析。
1.7 统计学分析所有数据用x±s表示, 结果用单因素方差分析和t检验进行分析处理。
2 结果 2.1 TTM对D-半乳糖所致衰老大鼠学习能力的影响定位航行实验中, 5组大鼠逃避潜伏期、路程长度呈缩短趋势(Fig 1 Ai、Fig 1 Bi); 定位航行训练第1~2天, 各组之间差异无显著性。d5, D-gal组大鼠平均逃避潜伏期和路程长度均比正常对照组和TTM组长(P<0.01;P<0.05;Fig 1Aii、Fig 1Bii)。5组大鼠游泳速度没有明显差别(Fig 1 Ci, Fig 1 Cii)。
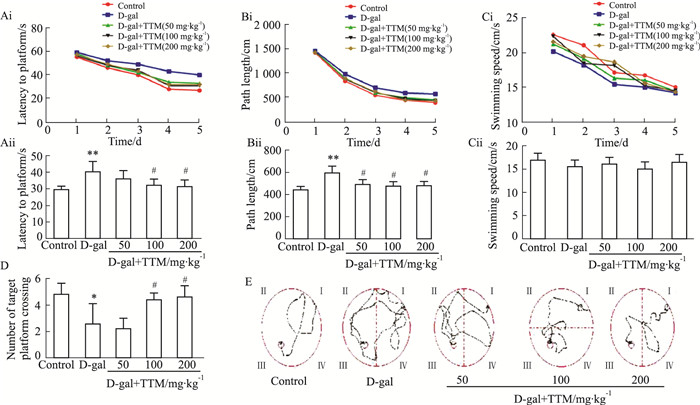
|
| Fig 1 D-gal induced spatial memory retention dysfunction in rats prevented by TTM (x±s, n=10) *P < 0.05, **P < 0.01 vs control group, #P < 0.05 vs D-gal group |
空间探索实验中, 穿越平台次数D-gal组明显少于正常对照组和TTM组(P<0.05, Fig 1D), 提示与正常组大鼠相比, D-gal组大鼠记忆能力有所下降, 而TTM组大鼠则有明显的改善(Fig 1E)。
2.2 TTM对D-半乳糖所致衰老大鼠海马结构的影响HE染色显示, D-gal组神经元层次减少, 排列不规则, 细胞核淡染; TTM组比D-gal组改变要轻(Fig 2A)。
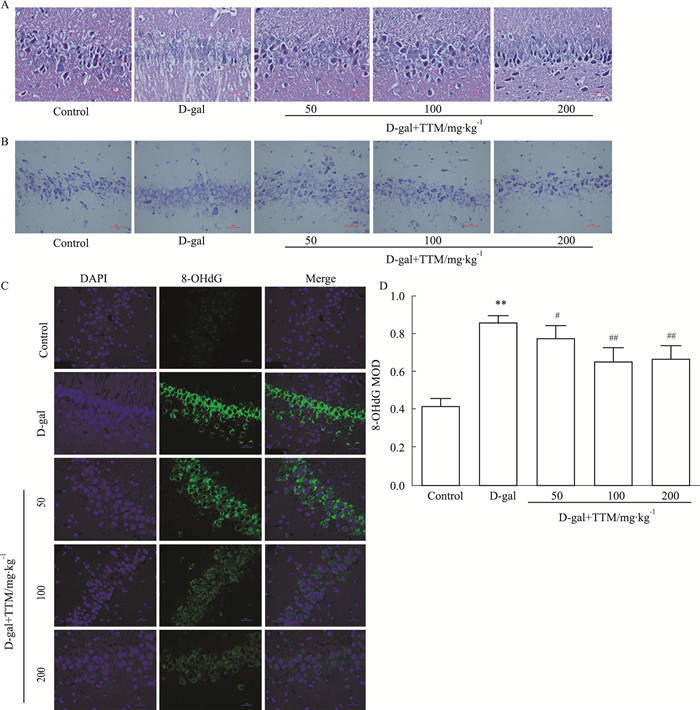
|
| Fig 2 Effects of TTM on D-gal induced tissue structure, Nissl bodies and 8-OHdG in SD rat hippocampus A: HE staining, ×400; B: Nissl's staining, ×400; C: Immunofluorescence staining of 8-OHdG, ×400; D: Immunofluorescence staining results of 8-OHdG (x±s, n=5). **P < 0.01 vs control group, #P < 0.05 ##P < 0.01 vs D-gal group |
尼氏染色显示D-gal组尼氏小体颗粒明显减少, TTM组尼氏小体较模型组增多(Fig 2B)。
免疫荧光染色结果显示, 8-OHdG主要分布于海马神经元突起和胞体, D-gal组荧光分布比正常组和TTM组的密集、亮度更高(Fig 2C); D-gal组免疫荧光MOD值明显高于正常组(P<0.01), 而TTM组低于D-gal组(P<0.05)(Fig 2D)。
2.3 TTM对D-半乳糖所致衰老大鼠海马组织中miR-155-3P水平的影响Real-time PCR结果显示, D-gal组miR-155-3P表达水平比正常组升高(P<0.05)。而TTM处理组的miR-155-3P表达上调得到明显的缓解(P<0.05)(Fig 3), 提示miR-155-3P表达上调与D-gal诱导的老化有密切关系, TTM有抑制其表达上调的作用。
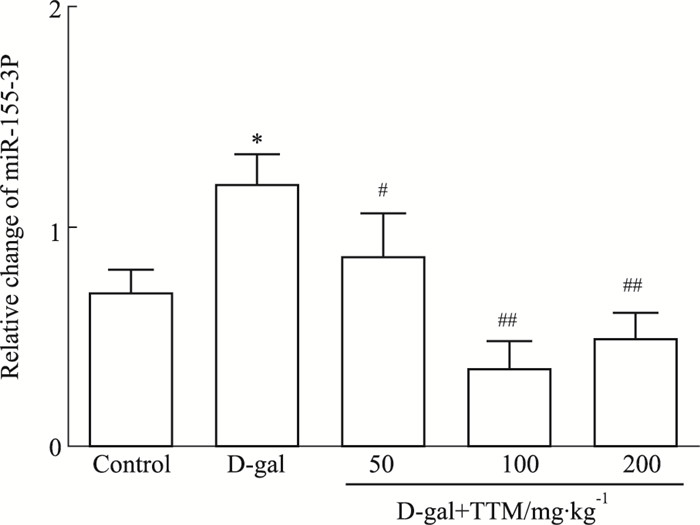
|
| Fig 3 Effects of TTM on D-gal induced miR-155-3P in SD rat hippocampus (x±s, n=5) *P < 0.05 vs control group, #P < 0.05 ##P < 0.01 vs D-gal group |
Western blot结果显示, 与正常组相比, D-gal组大鼠海马内Rheb、p70S6K表达下调, TTM处理可上调其表达(P<0.01, P<0.05)。与正常对照组比较, D-gal处理组内p-mTOR/mTOR水平增加(P<0.05), 而TTM处理后能够明显抑制D-gal所致的mTOR活化(P<0.05)(Fig 4)。
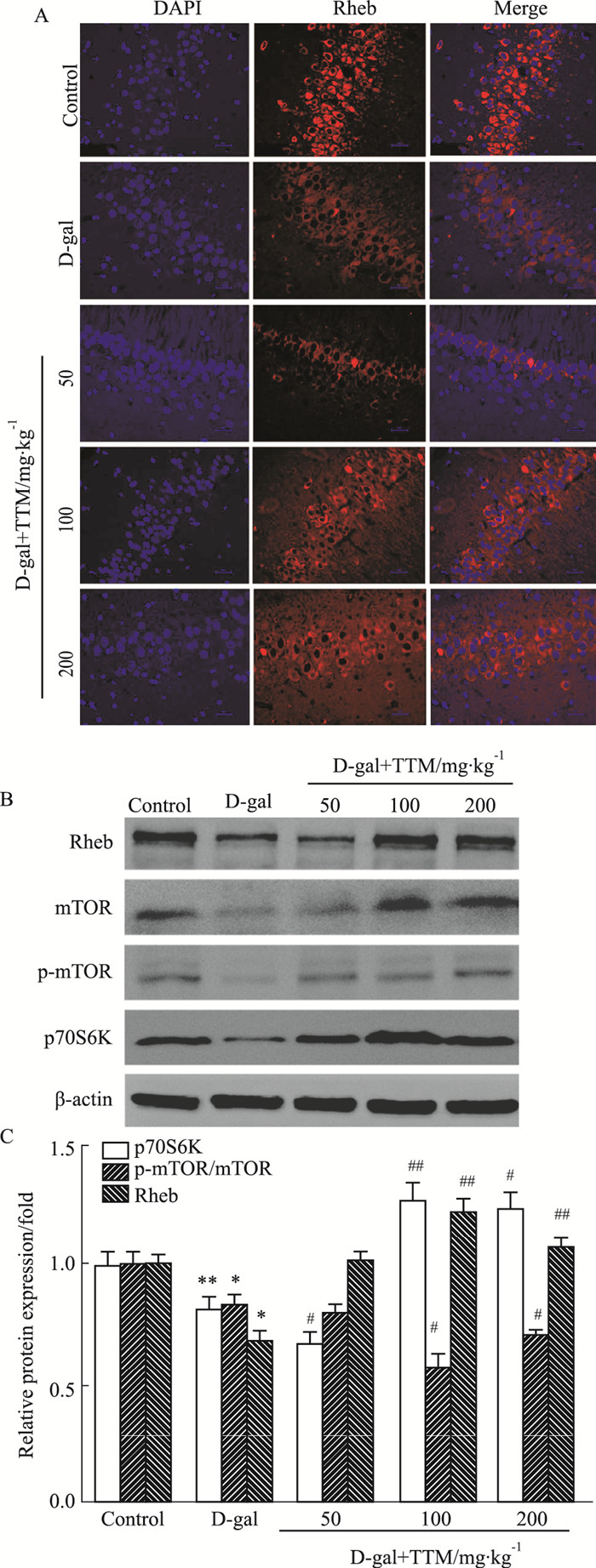
|
|
Fig 4 Effects of TTM on D-gal induced Rheb, p70S6k, mTOR in SD rat hippocampus (x±s, n=5)
A:Immunofluorescence staining of Rheb, ×400; B:Western blot research showed the level of Rheb, p70S6K, mTOR; C: Results of Rheb, p70S6K, mTOR *P < 0.05, **P < 0.01vs control group, #P < 0.05, ##P < 0.01vs D-gal group |
脑衰老过程中引起一些行为改变, 如学习和记忆等认知能力的下降[9]。研究发现D-gal会导致机体氧化应激水平增高、抗氧化功能下降, 促使脑的退行性改变[10]。因此给予D-gal注射被认为是一种理想的脑衰老模型的构建方法, 广泛用于衰老相关研究中[11]。水迷宫实验结果发现注射D-半乳糖可降低大鼠空间学习及记忆能力, 而不同剂量TTM干预可改善其空间认知功能障碍及提高定向航行能力, 有一定剂量依赖性, 表明TTM能有效改善衰老大鼠认知功能障碍。
研究发现, miRNA广泛参与到神经系统生长发育及相关疾病的发生发展过程中, 包括神经元生长、突触可塑性等方面均有miRNA在转录后水平对基因表达的调控作用[12]。其中miRNA-155广泛参与到免疫及炎症性疾病中, 脑退行性病变的发生发展与免疫及炎症密切相关, 因而推测miRNA-155可能是其治疗的靶点[13]。基于这些研究发现, 我们分析了miR-155-3p在D-半乳糖诱导的脑衰老大鼠模型中的表达, 发现D-半乳糖皮下注射可引起大鼠海马组织内miR-155-3p水平增加, 而TTM干预可逆转D-半乳糖所诱导的miR-155-3p水平的改变。
Rheb是Ras同源基因, 表达于各种哺乳动物体内, 是miR-155-3p的靶基因之一, 可能参与调控机体自噬进而延缓衰老[14]。研究显示, 在神经系统中Rheb过表达会促进轴突的生长、影响神经元棘突形成[15]。因此, 我们采用蛋白免疫印迹技术进一步检测海马组织内Rheb通路相关蛋白的表达, 发现D-半乳糖诱导可降低海马内Rheb和p70S6k的水平、增加mTOR磷酸化, 表明衰老大鼠脑组织内Rheb通路出现抑制; 而不同剂量TTM干预可上调D-半乳糖诱导的Rheb和p70S6k水平的降低、抑制p-mTOR表达, 表明TTM抗衰老作用可能与调控Rheb/mTOR/p70S6k信号通路有关。但TTM是否通过下调miR-155-3p来激活该通路发挥抗衰老作用还有待深入研究证实。
综上所述, 我们研究发现, TTM干预可下调D-半乳糖诱导的海马内miR-155-3p水平增加、调控Rheb/mTOR/p70S6k信号通路, 改善D-半乳糖诱导大鼠的认知障碍, 从而发挥抗衰老作用, 这可能为延龄草苷干预衰老相关疾病提供一定的理论基础, 为开发和利用天然产物在促进健康和疾病治疗提供参考, 但其作用机制有待深入研究。
( 致谢: 本实验在湖北民族大学医学部病理学研究所实验室完成, 感谢课题组成员的支持与协助 )
| [1] |
López-Otín C, Blasco M A, Partridge L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-217. doi:10.1016/j.cell.2013.05.039 |
| [2] |
Faraoni I, Antonetti F R, Cardone J, et al. miR-155 gene: a typical multifunctional microRNA[J]. Biochim Biphys Acta, 2009, 1792(6): 497-505. doi:10.1016/j.bbadis.2009.02.013 |
| [3] |
Yang K, Wu M, Li M, et al. miR-155 Suppresses bacterial clearance in pseudomonas aeruginosa-induced keratitis by targeting rheb[J]. J Infect Dis, 2014, 210(1): 89-98. |
| [4] |
Wang J, Yang K, Zhou L, et al. MicroRNA-155 promotes autophagy to eliminate intracellular mycobacteria by targeting Rheb[J]. PLoS Pathogens, 2013, 9(10): e1003697. doi:10.1371/journal.ppat.1003697 |
| [5] |
Jung C H, Ro S H, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Lett, 2010, 584(7): 1287-95. doi:10.1016/j.febslet.2010.01.017 |
| [6] |
Wu H, Qiu Y, Shu Z, et al. Protective effect of Trillium tschonoskii saponin on CCl4-induced acute liver injury of rats through apoptosis inhibition[J]. Can J Physiol Pharmacol, 2016, 94: 1291-7. doi:10.1139/cjpp-2016-0228 |
| [7] |
邱勇, 李人鹏, 刘粟, 等. 头顶一颗珠醇提物对新生大鼠缺血/缺氧性脑损伤的保护作用[J]. 中国药理学通报, 2016, 32(11): 1548-52. Qiu Y, Li R P, Liu S, et al. The protective effects of ethanol extract of Trillium tschonoskii Maxim on hypoxia-ischemia brain damage in neonatal rats[J]. Chin Pharmacol Bull, 2016, 32(11): 1548-52. doi:10.3969/j.issn.1001-1978.2016.11.014 |
| [8] |
陈显兵, 朱明月, 覃芙蓉, 等. 头顶一颗珠提取液对大鼠脊髓损伤后CNTF及CNTFRα表达的影响[J]. 解放军医学杂志, 2015, 40(8): 622-6. Chen X B, Zhu M Y, Qin F R, et al. Effect of extract of Trillium tschonoskii Maxim on ciliary neurotropic factor and its receptor α in? rats suffering from spinal cord injury[J]. Med J Chin PLA, 2015, 40(8): 622-6. |
| [9] |
Epstein R. Brutal. Truths: About the aging brain[J]. Discovery, 2012, 33(8): 48-76. |
| [10] |
Haider S, Liaquat L, Shahzad S, et al. A high dose of short-term exogenous D-galactose administration in young male rats produces symptoms simulating the natural aging process[J]. Life Sci, 2015, 3(124): 110-9. |
| [11] |
于引航, 任桂萍, 刘要南, 等. FGF-21对D-半乳糖诱导的衰老模型小鼠学习记忆能力和脑组织抗氧化能力的影响[J]. 药学学报, 2014, 49(7): 1000-6. Yu Y H, Ren G P, Liu Y N, et al. Effect of FGF-21 on learning and memory ability and antioxidant capacity in brain tissue of D-galactose-induced aging mice[J]. Acta Pharm Sin, 2014, 49(7): 1000-6. |
| [12] |
Bartel D P. Micro RNAs: genomics, biogenesis, mechanism and function[J]. Cell, 2004, 116(2): 281-97. doi:10.1016/S0092-8674(04)00045-5 |
| [13] |
Liu D Z, Tian Y, Ander B P, et al. Brain and blood microRNA expression profiling of ischemic stroke, intracerebral hemorrhage and kainate seizures[J]. J Cerebr Blood F Met, 2010, 30(1): 92-101. |
| [14] |
Heard J J, Fong V, Bathaie S Z, et al. Recent progress in the study of the Rheb family GTPases[J]. Cell Signal, 2014, 26(9): 1950-7. doi:10.1016/j.cellsig.2014.05.011 |
| [15] |
Sugiura H, Yasuda S, Katsurabayashi S, et al. Rheb activation disrupts spine synapse formation through accumulation of syntenin in tuberous sclerosis complex[J]. Nat Commun, 2015, 6: 6842. doi:10.1038/ncomms7842 |