

恶性肿瘤的发病率、死亡率高, 且逐年呈现上升趋势, 在临床上也是难以攻克的疑难之症。目前其治疗手段有:手术、放疗、化疗、靶向药物、基因治疗等。目前化疗药物在临床上使用量依然很大, 但其选择性差、毒副作用大, 而且容易产生耐药性, 这使得化疗药物在治疗效果和病人的生活质量都较差[1]。因此, 研究新一代低毒、高选择性的抗肿瘤药物成为肿瘤治疗研究领域热点之一。
含氮杂环化合物具有低毒、靶向性等优点, 在抗肿瘤、抗菌等方面表现出良好的生物活性[2-4]。目前常采用不同的官能团对含氮杂环化合物进行修饰, 以期获得活性高的化合物, 为抗肿瘤药物研发奠定基础。6-氯-1-(4-氯苯基)-1-H-吲唑-3-甲酰呋喃甲胺(DY386)是以吲唑-3-甲酸为基础进行改造所得的一种新化合物, 其化学结构见Fig 1。本文通过MTT、流式细胞术、BrdU免疫荧光染色、Western blot等方法考察了化合物DY386对肿瘤细胞增殖和细胞周期的抑制作用, 并对其作用机制进行了初步研究。
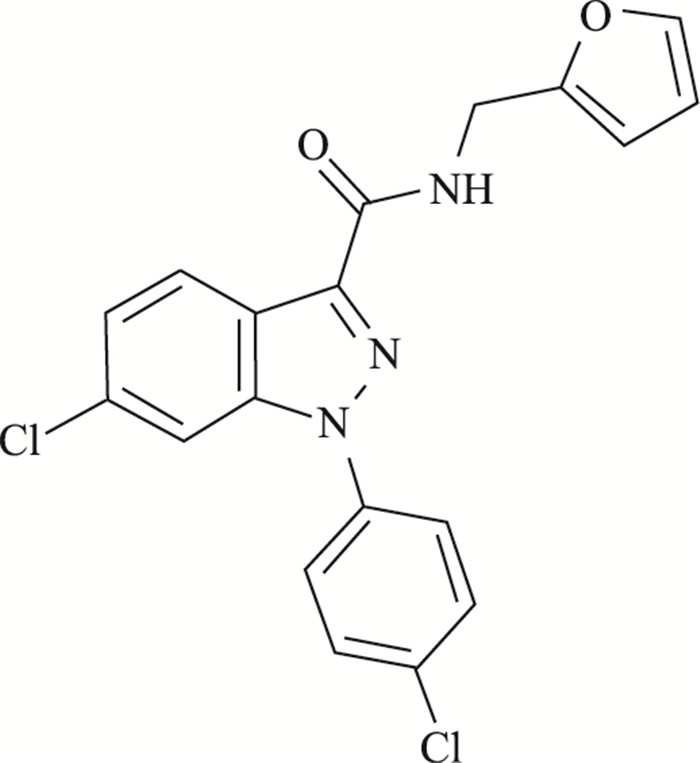
|
| Fig 1 Chemical structure of DY386 |
前列腺癌细胞DU145、PC-3;神经胶质瘤细胞U87;非小细胞肺癌H1975、HCC827;乳腺癌细胞MCF-7;肝癌细胞Hep3B;结肠癌细胞SW620为本实验室保存; 细胞培养基(Hyclone); 胎牛血清(Natocor); 双抗(Gibco); DY386用DMSO配制成10 mmol·L-1母液, 4 ℃保存备用; MTT、DAPI购于碧云天生物科技有限公司; 一抗cyclinE1(20808S)、cyclinB1(4138S)、CDK2(2546S)、p27(3686S)、Tubulin(2128L)购于Cell Signaling Technology (CST)公司。
1.2 实验方法 1.2.1 MTT法测定DY386对肿瘤细胞生长抑制率将DU145、PC-3、U87、H1975、HCC827、MCF-7、Hep3B、SW620肿瘤细胞用0.25%胰酶消化、重悬、计数后按3 000~4 000个/100 μL/孔加入96孔板中, 实验组加入吲唑衍生物DY386使其终浓度为20 μmol·L-1, 对照组加入相应体积的DMSO。培养48 h后每孔加入10 μL MTT溶液继续孵育4 h, 吸弃培养基并加入200 μL二甲基亚砜(DMSO)试剂, 摇床80 r·min-1振摇30 min; 使用酶标仪(BioTek Cytation 5)读取570 nm波长下的吸光值(optical density, OD), 细胞增殖抑制率/%=(1-实验组OD/对照组OD)×100%。
1.2.2 BrdU免疫荧光染色将2×104个DU145细胞接种于12孔板中, 设置DMSO、DY386(5, 10, 20 μmol·L-1), 将BrdU加入培养液中使其终浓度为5 mg·L-1, 培养48 h。4%多聚甲醛固定后0.1% TritonX-100处理使细胞膜通透, 然后加入10%山羊血清(北京中杉金桥生物技术公司)封闭1 h。4 ℃孵育anti-BrdU兔抗过夜, 加入Cy3标记的二抗避光孵育2 h。DAPI染色后, 使用荧光显微镜观察、拍照, 并计算增殖率。
1.2.3 克隆形成将500个DU145细胞接种于6孔板中, 加入DMSO、DY386(5、10、20 μmol·L-1)继续培养14 d。加入4%多聚甲醛固定细胞, 用生理盐水(phosphate-buffered saline, PBS)洗涤, 然后加入1 mL结晶紫溶液染色2 min, 吸弃染液并用PBS洗涤5次。置于孔板扫描仪中拍摄图片, 并进行克隆数统计分析。
1.2.4 流式细胞仪检测DU145细胞周期变化将1.5×105个DU145细胞接种于6孔板中, 加入DMSO、DY386(5、10、20 μmol·L-1)处理, 继续培养24 h后胰酶消化收集细胞, 800 rpm室温离心5 min, 加入4%多聚甲醛固定细胞, PBS洗涤3次后加入碘化丙啶(propidium iodide, PI)室温染色15 min, 然后用流式细胞仪(BD Accuri C6)进行分析。
1.2.5 Western blot检测细胞周期相关蛋白收集DMSO、DY386(5、10、20 μmol·L-1)处理的DU145细胞, 提取总蛋白并定量。上样30 μg总蛋白, 通过分离胶浓度为10%的SDS-PAGE电泳分离后, 恒压100 V, 湿转120 min。将含目的条带的PVDF膜用5%脱脂牛奶室温封闭2 h, 随后孵育anti-CyclinB1、anti-CyclinE1、anti-CKD2、anti-p27、anti-Tubulin抗体4 ℃过夜, Tris-buffered saline with Tween 20 (TBST)缓冲液漂洗5次; 加入相应的二抗, 室温下孵育2 h; TBST缓冲液漂洗5次后滴加ECL化学发光液于PVDF膜上置于化学发光凝胶成像系统(天能Tanon-5200Multi)中进行拍照。
1.2.6 统计学分析所有实验均重复3次。实验数据采用GraphPad Prism 6软件进行处理, 数据结果均以x±s表示, 组间比较采用F检验。
2 结果 2.1 DY386对体外抗肿瘤效果的影响MTT检测结果显示, 化合物DY386对前列腺癌细胞DU145、PC-3, 神经胶质瘤细胞U87, 非小细胞肺癌H1975、HCC827, 乳腺癌细胞MCF-7, 肝癌细胞Hep3B, 结肠癌细胞SW620的生长具有抑制作用, 其中对前列腺癌细胞(DU145)抑制活性最好(Fig 2)。化合物DY386对前列腺癌细胞DU145、PC-3的IC50值分别为11.86 μmol·L-1和18.32 μmol·L-1。
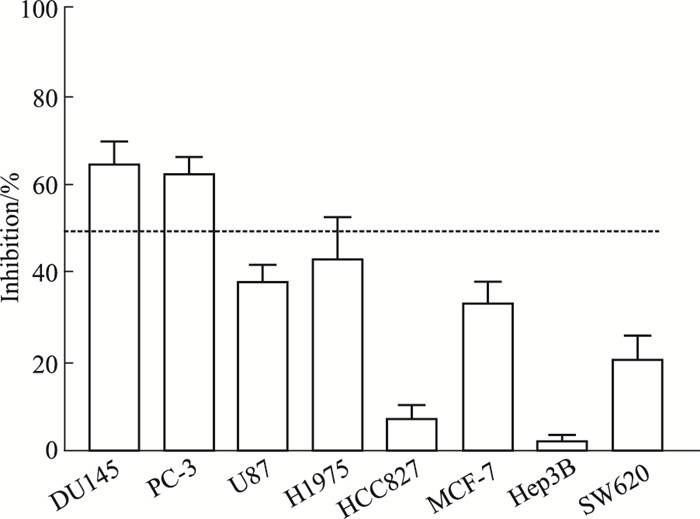
|
| Fig 2 Inhibition activity of DY386 in a variety of cancer cell lines in vitro (x±s, n=3) |
BrdU标记实验结果显示, 吲唑衍生物DY386对DU145细胞增殖具有抑制作用, 且存在一定的剂量依赖关系(Fig 3)。克隆形成实验结果也显示DY386对DU145细胞克隆形成具有抑制作用, 且显示出剂量依赖关系。Fig 3显示DY386不仅能抑制DU145细胞克隆数量, 而且能减少克隆大小。
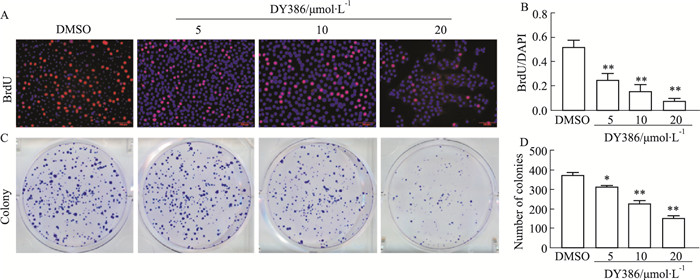
|
| Fig 3 Effect of DY386 on cell proliferation ability and clonogenicity in vitro (A) BrdU immunofluorescence staining of DU145 cells after treated with different concentrations of DY386 (5, 10, 20μmol·L-1). DAPI was used to stain the nucleus. (B) The ratio of BrdU fluorescence intensity to DAPI fluorescence intensity from panel (A), (x±s, n=5). (C) Colony formation assay after DY386 treated DU145 cells. (D) Colony numbers from each group of panel (C) (x±s, n=3). *P < 0.05, **P < 0.01 vs DMSO group. |
如Fig 4A、4B所示, 与对照组DMSO处理相比, 吲唑衍生物DY386 (5, 10, 20 μmol·L-1)处理人前列腺癌DU145细胞24 h后, S期细胞数量由20.33%分别增加至27.66%、37.23%、36.58%, G2/M期细胞数量由36.04%分别降低至22.44%、21.97%、13.91%。结果表明随着吲唑衍生物DY386浓度的增加DU145细胞S期细胞数量逐渐增多, G2/M期细胞数量逐渐减少。Western blot结果显示, 周期蛋白CyclinB1、CyclinE1的表达随着吲唑衍生物DY386浓度增高而降低, 促使细胞周期阻滞在S期, 抑制细胞分裂。另外, 随着药物浓度增加, p27表达量增高, 对细胞分裂具有抑制作用(Fig 4C)。

|
| Fig 4 Cell cycle arrest in DU145 cells induced by DY386 (A) Cell cycle distribution was determined by flow cytometry in DU145 cells. (B) Quantification of DU145 cells at various phases of the cell cycle (x±s, n=3), **P < 0.01 vs DMSO group. (C) Western blot was used to analyze the cell cycle related protein expression level in DU145 cells. |
吲唑类化合物具有一定的抗肿瘤活性, 本文以吲唑-3-甲酸为基础合成的6-氯-1-(4-氯苯基)-1-H-吲唑-3-甲酰呋喃甲胺(DY386), 是一类新型的吲唑类衍生物。因此, 采用MTT法检测了该化合物在前列腺癌细胞DU145、PC-3, 神经胶质瘤细胞U87, 非小细胞肺癌H1975、HCC827, 乳腺癌细胞MCF-7, 肝癌细胞Hep3B及结肠癌细胞SW620中的抗肿瘤活性, 发现新衍生物DY386可以抑制前列腺癌、神经胶质瘤、肺癌、乳腺癌及结肠癌细胞增殖。其中DY386对人前列腺癌DU145细胞的抑制作用最显著, IC50值为11.86 μmol·L-1。表明化合物DY386对肿瘤生长的抑制作用具有一定的选择性。可能是因为前列腺癌细胞中某些特定的基因表达量较其他肿瘤细胞高, 而DY386正好作用于这些基因, 从而使得DY386对DU145细胞的抑制率比其他肿瘤高。当然, 这需要进一步实验探索才能确定。这也为将吲唑类衍生物开发成特异性抗前列腺癌药物提供了实验基础。为了使实验结果更加显著, 本研究采用DU145细胞深入研究了化合物抗肿瘤作用机制。
吲唑类化合物是一类含氮杂环化合物, 具有消炎、抗菌、抗肿瘤活性。刘书娟等[5]合成一种新的吲哚咔唑衍生物, 该化合物抑制人慢性白血病细胞K562的增殖, 并抑制Bcl-2表达、激活caspase-9和caspase-3蛋白, 促进PARP剪切, 通过激活线粒体途径诱导细胞凋亡。Liao等[6]报道了以6-(4-嘧啶基)-1H-吲唑为基础合成了一系列衍生物, 该类化合物通过线粒体介导细胞凋亡, 同时使人鼻咽癌细胞SUNE1的细胞周期阻滞在G2/M期。本文以吲唑-3-甲酸为基础合成的衍生物DY386是DU145细胞周期阻滞在S期从而发挥抗肿瘤活性。
细胞周期是细胞生命活动的重要过程, 细胞周期调控紊乱是导致肿瘤发生发展的重要原因之一。研究发现, 周期调控蛋白CyclinE1在调控G1/S期中起重要作用, CyclinE1表达的下调可使肿瘤细胞阻滞在S期, 起到抗肿瘤作用[7, 8]。另外, CyclinB1是G2/M期起调控作用的重要周期蛋白, 肿瘤细胞中该蛋白过表达。Li等[9]发现槲皮素-3-甲醚处理乳腺癌SK-Br-3细胞后, 下调周期蛋白CyclinB1表达, 该化合物主要是抑制ATM-Chk1-CDC25C-CyclinB1途径导致乳腺癌细胞周期阻滞在G2/M期, 从而使细胞分裂停止。同样, 通过下调CyclinB1的表达也可使宫颈癌、胰腺癌、胃癌细胞周期阻滞在G2/M期, 从而抑制细胞增殖[10-12]。p27蛋白与CyclinE1相互作用, 抑制CDK2磷酸化, 使细胞从G1期进入S期的过程受到抑制[13]。p27蛋白表达降低将导致细胞异常增殖, 促进肿瘤恶性转变[14]。本文利用6-氯-1-(4-氯苯基)-1-H-吲唑-3-甲酰呋喃甲胺抑制CyclinE1、CyclinB1周期蛋白表达, 增加p27蛋白表达, 从而抑制前列腺癌DU145细胞增殖。
综上所述, 新型的吲唑类衍生物6-氯-1-(4-氯苯基)-1-H-吲唑-3-甲酰呋喃甲胺对体外培养的肿瘤细胞具有抗肿瘤活性, 其中对人前列腺癌细胞具有显著抑制作用。该化合物抗肿瘤机制可能通过下调周期蛋白CyclinE1、CyclinB1, 上调p27蛋白, 阻滞细胞周期在S期, 具有潜在的抗肿瘤活性, 但其具体的作用靶点尚不清楚, 还有待进一步研究。
( 致谢: 本研究是在重庆文理学院创新靶向药物国际研究院实验室完成, 衷心感谢研究院各位老师在实验室过程中的指导与帮助!)
| [1] |
Kheir W J, Sniegowski M C, El-Sawy T, et al. Ophthalmic complications of targeted cancer therapy and recently recognized ophthalmic complications of traditional chemotherapy[J]. Surv Ophthalmol, 2014, 59(5): 493-502. doi:10.1016/j.survophthal.2014.02.004 |
| [2] |
Vidyacharan S, Adhikari C, Krishna V S, et al. A robust synthesis of functionalized 2H-indazoles via solid state melt reaction (SSMR) and their anti-tubercular activity[J]. Bioorg Med Chem Lett, 2017, 27(7): 1593-7. doi:10.1016/j.bmcl.2017.02.021 |
| [3] |
Feng S, Li C, Chen D, et al. Discovery of methylsulfonyl indazoles as potent and orally active respiratory syncytial Virus(RSV) fusion inhibitors[J]. Eur J Med Chem, 2017, 138: 1147-57. doi:10.1016/j.ejmech.2017.07.032 |
| [4] |
张飞, 刘振国, 王海芳, 等. 2-(N-丙基)-6-三氟甲氧基苯并噻唑抗肿瘤活性研究[J]. 中国药理学通报, 2019, 35(5): 644-8. Zhang F, Liu ZG, Wang HF, et al. Research on anti-tumour activity of 2-(N-propylamine)-6-trifluoromethoxy-benzothiazole[J]. Chin Pharmacol Bull, 2019, 35(5): 644-8. doi:10.3969/j.issn.1001-1978.2019.05.012 |
| [5] |
刘书娟, 戚欣, 朱伟明, 等. 一种新的吲哚咔唑类化合物(ZWM233)的体外抗肿瘤作用及机制探讨[J]. 中国药理学通报, 2012, 28(6): 828-32. Liu S J, Qi X, Zhu W M, et al. Anticancer effects of ZWM233 in vitro and its mechanisms[J]. Chin Pharmacol Bull, 2012, 28(6): 828-32. doi:10.3969/j.issn.1001-1978.2012.06.022 |
| [6] |
Liao B, Peng L, Zhou J, et al. Synthesis and activity evaluation of nasopharyngeal carcinoma inhibitors based on 6-(pyrimidin-4-yl)-1H-indazole[J]. Chem Biodivers, 2019. doi:10.1002/cbdv.201800598 |
| [7] |
Wang Y, Compton C, Rankin G O, et al. 3-Hydroxyterphenyllin, a natural fungal metabolite, induces apoptosis and S phase arrest in human ovarian carcinoma cells[J]. Int J Oncol, 2017, 50(4): 1392-402. doi:10.3892/ijo.2017.3894 |
| [8] |
Tania M, Shawon J, Saif K, et al. Cordycepin downregulates Cdk-2 to interfere with cell cycle and increases apoptosis by generating ROS in cervical cancer cells: in vitro and in silico study[J]. Curr Cancer Drug Targets, 2019, 19(2): 152-9. doi:10.2174/1568009618666180905095356 |
| [9] |
Li J, Zhu F, Lubet R A, et al. Quercetin-3-methyl ether inhibits lapatinib-sensitive and -resistant breast cancer cell growth by inducing G(2)/M arrest and apoptosis[J]. Mol Carcinog, 2013, 52(2): 134-43. doi:10.1002/mc.21839 |
| [10] |
Cheng Y M, Tsai C C, Hsu Y C. Sulforaphane, a dietary isothiocyanate, induces G(2)/M arrest in cervical cancer cells through cyclinB1 downregulation and GADD45beta/CDC2 association[J]. Int J Mol Sci, 2016, 17(9): E1530. doi:10.3390/ijms17091530 |
| [11] |
Feng W, Cai D, Zhang B, et al. Combination of HDAC inhibitor TSA and silibinin induces cell cycle arrest and apoptosis by targeting survivin and cyclinB1/Cdk1 in pancreatic cancer cells[J]. Biomed Pharmacother, 2015, 74: 257-64. doi:10.1016/j.biopha.2015.08.017 |
| [12] |
Gao S Y, Li J, Qu X Y, et al. Downregulation of Cdk1 and cyclinB1 expression contributes to oridonin-induced cell cycle arrest at G2/M phase and growth inhibition in SGC-7901 gastric cancer cells[J]. Asian Pac J Cancer Prev, 2014, 15(15): 6437-41. doi:10.7314/APJCP.2014.15.15.6437 |
| [13] |
Hnit S S, Xie C, Yao M, et al. p27(Kip1) signaling: Transcriptional and post-translational regulation[J]. Int J Biochem Cell Biol, 2015, 68: 9-14. doi:10.1016/j.biocel.2015.08.005 |
| [14] |
Raghu D, Paul P J, Gulati T, et al. E6AP promotes prostate cancer by reducing p27 expression[J]. Oncotarget, 2017, 8(26): 42939-48. |

