


2. 中国科学技术大学附属第一医院麻醉科, 安徽 合肥 230001;
3. 石河子大学医学院第一附属医院麻醉科, 新疆 石河子 832000
2. Dept of Anesthesiology, the First Affiliated Hospital, University of Science and Technology of China, Hefei 230001, China;
3. Dept of Anesthesiology, the First Affiliated Hospital of Shihezi University, Shihezi Xingjiang 832000, China
目前,中国中风患者人数为7 000万,对国民健康构成严重威胁,且大多数幸存者伴有不同程度的残疾,给社会和家庭带来沉重的负担。目前阿替普酶仍然是全球唯一公认的最有效的溶栓治疗药物,但因其时间窗较窄,国内卒中溶栓率不到1.5%[1],迫切需要研究用于临床卒中治疗的药物。
异氟醚是临床常用的吸入麻醉药,大量研究表明,吸入麻醉剂可以产生脑保护作用。目前,大多数研究对象是异氟醚和七氟醚,对异氟醚的研究更为广泛[2-3]。研究表明,异氟醚可增加血管生成标志物血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进增殖和血管生成[4]。我们之前的研究表明,1.5%的异氟醚后处理具有明显的脑保护作用[5]。尽管异氟醚的脑保护作用已被大量文献报道证实,但其具体机制尚不清楚。长期以来,人们一直认为异氟醚可通过降低脑代谢率发挥保护作用。随着研究的深入,发现脑保护的确切机制非常复杂,降低脑代谢率可能是其中一个原因,但机体相关信号通路中的许多生物因子可能参与了该保护过程。
Smad蛋白家族是在脊椎动物、昆虫和线虫中发现的转录因子家族,Smads信号分子是信号通路中的重要家族。Smad蛋白有8个成员,其中Smad3是脊椎动物TGF-β和活化素受体的底物,是目前公认的TGF-β信号传导的关键下游介质。近期研究表明,通过TGF-β/Smad信号通路可恢复大鼠下肢缺血/再灌注损伤中的血管内皮细胞功能[6]。此外,TGF-β通过Smad2/3-VEGF/TNF-α信号通路,参与脉络膜新生血管形成[7]。因此,我们推测,Smad信号通路可能通过调节血管生成起到脑缺血后神经保护作用。本研究通过线栓法建立大鼠大脑中动脉栓塞模型,缺血90 min,再灌注的即刻给予1.5%的异氟醚持续吸入60 min,模拟临床上脑卒中病人的手术麻醉过程,旨在阐明Smad通路在脑卒中后脑缺血/再灌注损伤中的作用,以及异氟醚的神经保护机制,以期为临床卒中治疗提供新的依据和思路。
1 材料 1.1 实验动物SPF级♂SD大鼠,体质量(220~280) g,购自北京维通利华实验动物技术有限公司(SCXK(京) 2012-0001),动物实验部分已经通过石河子大学伦理委员会批准。
1.2 试剂异氟醚(美国雅培制药有限公司);SIS3 HCl抑制剂(美国Selleck公司);2,3,5-氯化三苯基四氮唑(TTC)(美国Sigma公司);Smad3、CD34抗体(美国Santa Cruz);p-Smad3抗体(美国Cell Signaling Technology);VEGF抗体(Abcam公司);BCA蛋白测定试剂盒(中杉金桥生物技术有限公司),TUNEL试剂盒(德国Roche公司)。
1.3 仪器麻醉气体检测仪(美国Datex Ohmeda);激光共聚焦扫描显微镜(日本Olympus);电泳仪(北京六一仪器厂)。
2 方法 2.1 动物模型建立、分组及给药将动物按照随机数字表法分为:假手术组(Sham组)、缺血/再灌注组(I/R组)、异氟醚后处理组(ISO组)和Smad3抑制剂组(ISO+SIS3组),每组10只。Sham组游离右侧颈总动脉、颈内动脉和颈外动脉,不进行栓塞。I/R组结扎颈总动脉和颈外动脉,在颈总动脉上剪一小口,插入4-0线栓约18 mm以阻断大脑中动脉的血流,90 min后拔出线栓进行再灌注。ISO组先建立大脑中动脉栓塞模型,90 min栓塞后开始再灌注,再灌注的即刻吸入1.5%异氟醚60 min。实验过程中保持大鼠体温在37 ℃左右。ISO+SIS3组在大鼠脑缺血前30 min腹腔注射SIS3 HCl 2.5 mg·kg-1,其余操作同ISO组。Sham组、I/R组和ISO组于缺血前30 min给予等量的DMSO。
2.2 神经行为学评分按照Zea-Longa法评估脑缺血对神经功能的影响。0分为无神经功能缺陷;1分为轻微神经功能缺陷,无法完全伸展对侧前爪;2分为中度神经功能缺陷,表现为向对侧旋转;3分为严重的神经功能缺陷,表现为向对侧倾倒;4分为无法独立行走,意识水平低下。1~3分为成功模型,可用于进一步实验。
2.3 TTC染色大鼠再灌注24 h后,深度麻醉处死,然后用咬骨钳打开颅骨,并完整取脑。用4 ℃生理盐水冲洗脑组织周围的血液,然后将脑置于-20 ℃的冰箱中30 min。将大鼠大脑冠状切成2 mm厚脑片,然后进行TTC染色。将新鲜脑组织切片与2% TTC染色溶液于37 ℃避光染色30 min,每5 min翻动脑组织并观察染色情况。染色后,将脑移入4%多聚甲醛中固定过夜,拍照并分析梗死体积。使用Image-Pro Plus 6.0和SPSS 17.0进行梗死体积百分比的统计分析,并用GraphPad Prim 6.0绘图。
2.4 HE染色大脑中动脉栓塞24 h后,将大鼠麻醉后,用300 mL生理盐水经心脏灌注,然后用300 mL 4%多聚甲醛溶液灌注。取出脑,并在4%多聚甲醛溶液中固定24 h,然后进行乙醇梯度脱水、二甲苯透明和石蜡包埋。用切片机连续4 μm厚的石蜡切片,经二甲苯脱蜡和乙醇脱水后,将石蜡切片用苏木精染色3 min,伊红染色1 min。染色后,用蒸馏水冲洗切片,脱蜡脱水后用中性树胶封片。最后在光学显微镜下观察大脑皮层和海马CA1区的脑损伤情况。
2.5 尼氏染色常规脱蜡脱水,然后将切片用硫堇在37 ℃下染色1 h。分化液分化4~8 s,直至消除大部分染色。双蒸水冲洗染料后,分别在70%、80%、95%、100%乙醇中脱水,二甲苯透明,中性树胶封片。最后在显微镜下观察大脑皮层和海马CA1区的细胞形态,以评估脑损伤。
2.6 TUNEL分析石蜡切片置于60 ℃的烘箱中烤片2 h。按说明书进行TUNEL测定。将石蜡切片常规脱蜡脱水,然后用PBS冲洗切片3次5 min。在室温下用含有0.3% Triton X-100的PBS处理30 min后,用3% H2O2孵育20 min。37 ℃下将脑组织在黑暗中浸于反应液中染色1 h,然后在37 ℃下浸入POD转化溶液中30 min,最后DAB显色。在显微镜下,计数缺血脑中的棕色TUNEL阳性和蓝色正常神经元的数目。细胞凋亡指数(apoptotic index,AI)是100个细胞核中凋亡细胞核的数量:AI/%=(TUNEL阳性细胞数/总细胞数)×100%。
2.7 免疫荧光染色将切片浸入柠檬酸盐缓冲液(pH 6.0)中,并在标准组织化学程序后微波修复20 min。然后,将切片用3% H2O2孵育20 min。用含有0.3% Triton X-100和10%牛血清白蛋白的PBS封闭后,将切片与1 :100抗VEGF和1 :100抗-CD34在4 ℃过夜。PBS冲洗后,与FITC标记的二抗在37 ℃下温育1 h,然后碘化丙锭溶液中避光染核5 min。最后,使用共聚焦激光扫描显微镜获取图像,并通过Image-Pro Plus 6.0测量平均荧光强度(mean density,MD),GraphPad Prim 6.0绘制免疫荧光半定量统计图。
2.8 Western blot使用RIPA裂解物、PMSF和磷酸酶抑制剂从缺血脑组织中提取蛋白。RIPA裂解物、PMSF和磷酸酶抑制剂以100 :1 :1的比例制备混合物,将1 μg组织与10 μL混合物混合,然后用剪刀在冰上切割组织。将组织匀浆以12 000 r·min-1、4 ℃离心10 min。弃沉淀物,取上清液作为总蛋白,BCA法测定蛋白浓度。将蛋白上样到SDS-PAGE凝胶电泳,电转至PVDF膜上。5%脱脂奶粉封闭后,将膜分别与抗体Smad3、p-Smad3、VEGF、CD34和β-actin在4 ℃孵育过夜。用ECL化学发光试剂检测蛋白表达水平,并用Image J进行定量分析。
2.9 统计学分析所有数据均表示为x±s。用SPSS 19.0软件进行统计学分析,通过单因素方差分析(ANOVA)进行组间比较,Turkey法进一步行各组比较。
3 结果 3.1 异氟醚对MCAO大鼠神经行为学评分的影响如Fig 1所示,与Sham组比较,I/R组大鼠神经功能评分升高(P<0.05);与I/R组比较,ISO组神经行为学评分明显降低(P<0.05);与ISO组比较,ISO+SIS3组神经行为学评分明显升高(P<0.05)。
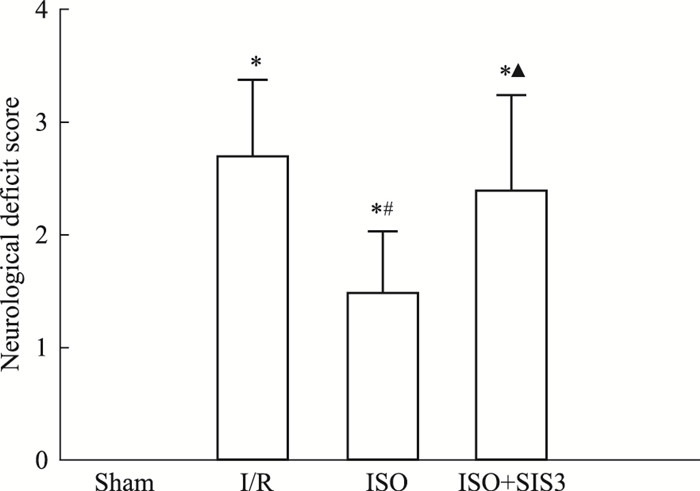
|
| Fig 1 Neurological function scores with Zea-Longa score(x±s, n=10) *P < 0.05 vs sham; #P < 0.05 vs I/R; ▲P < 0.05 vs ISO. |
如Fig 2所示,2% TTC溶液染色后,Sham组无梗死;I/R组缺血侧可见明显白色梗死灶;与I/R组比较,ISO组大鼠脑梗死面积减少(P<0.05);与ISO组比较,ISO+SIS3组大鼠脑梗死面积明显增加(P<0.05)。
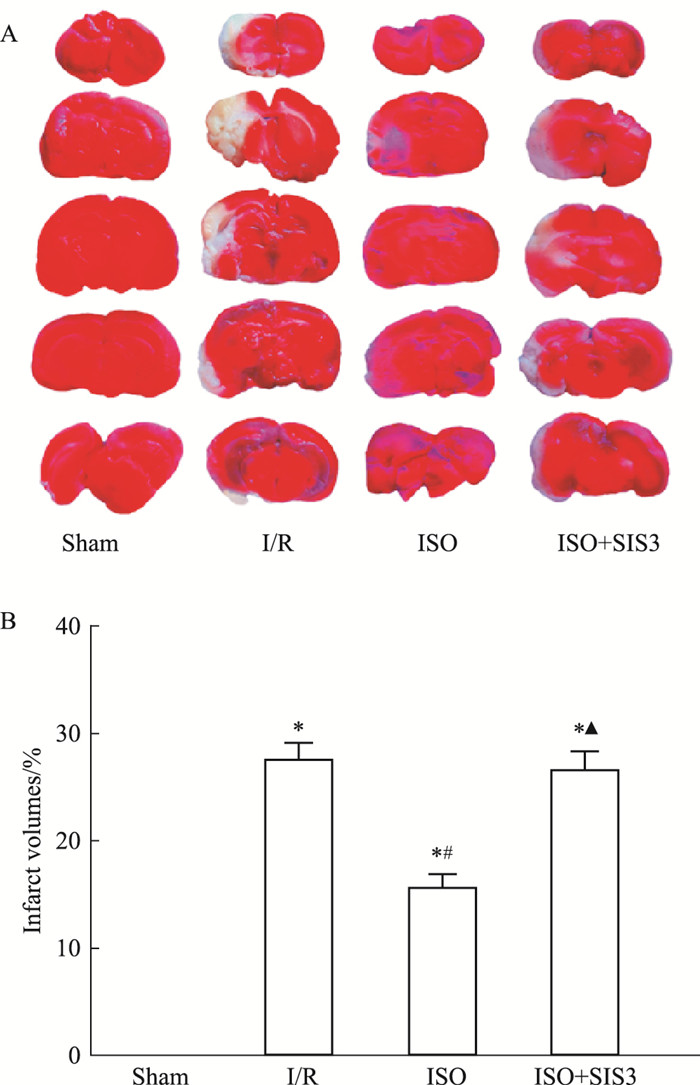
|
| Fig 2 Cerebral infarct volumes in rats reduced by isoflurane post-conditioning A: Infarct volumes were assessed by TTC. Red represented normal tissues, and white represented infarct tissues; B: Quantitative data of infarct volumes(x±s, n=5). *P < 0.05 vs sham; #P < 0.05 vs I/R; ▲P < 0.05 vs ISO. |
Fig 3A、3B的HE染色结果显示,海马CA1神经元的形态学变化与皮质神经元相似。Sham组细胞形态正常,边界清晰;缺血/再灌注组中,细胞核明显固缩,呈现不规则外观;与缺血/再灌注组相比,ISO组神经元核固缩减少;在ISO+ SIS3组中,大量不规则和空泡细胞,细胞周围间隙变宽。尼氏染色显示(Fig 3C、3D),Sham组神经元呈蓝紫色,染色深,神经元内尼氏小体丰富;缺血/再灌注组细胞明显减少、染色浅、结构模糊、尼氏小体减少;ISO组中的神经元数量明显高于缺血/再灌注组,尼氏小体增多;与ISO组相比,ISO+ SIS3组中的细胞染色浅,尼氏小体数量明显减少。
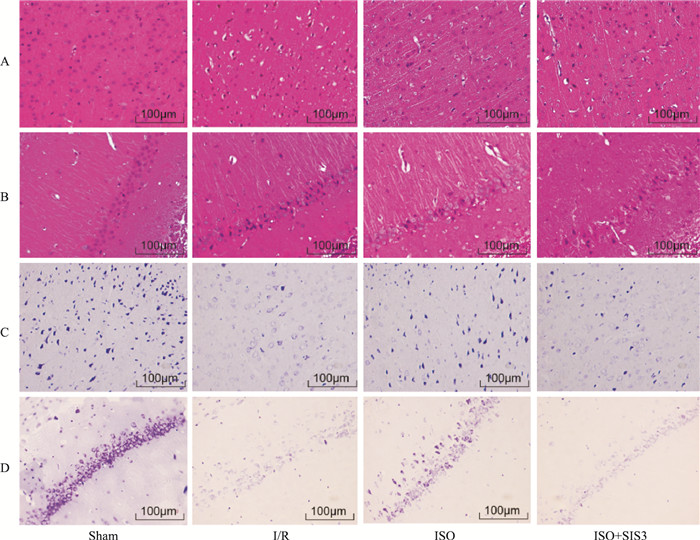
|
| Fig 3 Morphological evaluation of HE staining and Nissl staining in hippocampal CA1 and cortex after I/R injury(scale bar=100 μm) A: Cell morphology by HE staining in the cortex; B: Cell morphology by HE staining in the hippocampal CA1; C: Nissl staining of the surviving cells in the cortex; D: Nissl staining of the surviving cells in the hippocampal CA1. |
如Fig 4所示,在Sham组中,仅有少量TUNE阳性细胞;与缺血/再灌注组相比,异氟醚后处理降低了缺血侧脑组织中的凋亡细胞(P<0.05);Smad3抑制剂明显增加了缺血侧脑组织的凋亡细胞(P<0.05)。
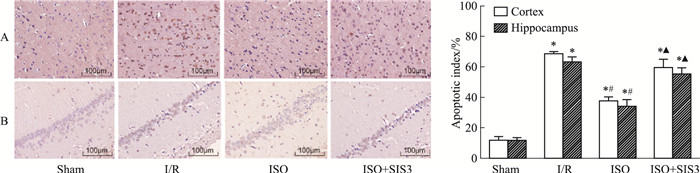
|
| Fig 4 TUNEL staining in cerebral cortex (A) and hippocampus (B) after I/R injury in rats(x±s, n=5) *P < 0.05 vs sham; #P < 0.05 vs I/R; ▲P < 0.05 vs ISO. |
如Fig 5所示,在免疫荧光染色中,再灌注24 h后,缺血/再灌注损伤明显增强缺血侧皮质和海马CA1区VEGF和CD34的表达水平;1.5%异氟醚进一步增强了VEGF和CD34的表达水平;而Smad3抑制剂明显降低了VEGF和CD34的表达。
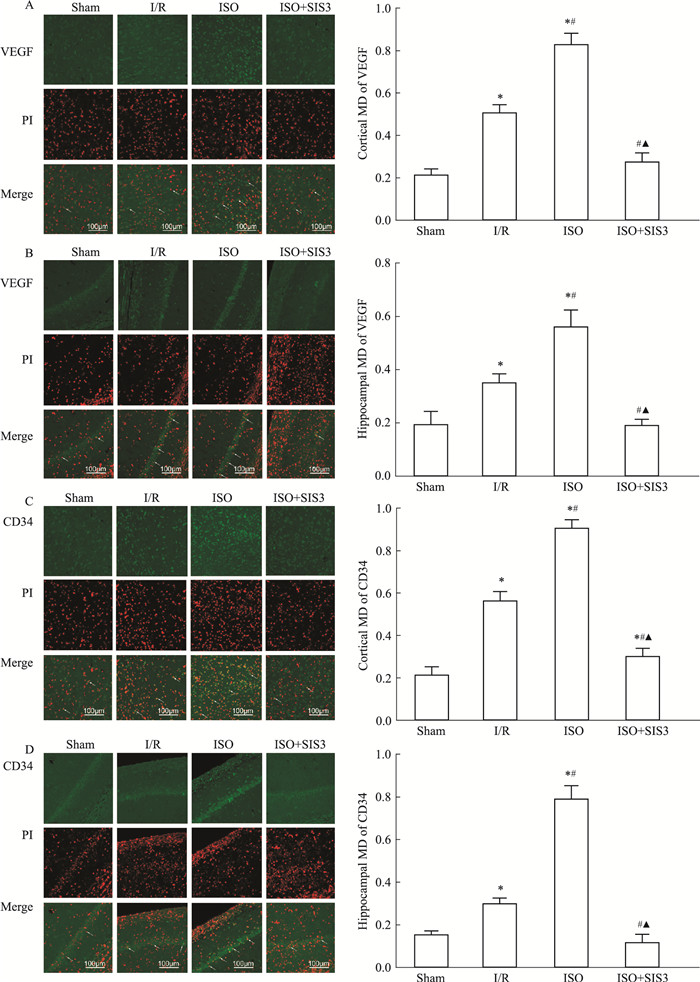
|
| Fig 5 Expression of VEGF and CD34 in ischemic brain of rats(x±s, n=5) A: IF of VEGF and MD analysis of VEGF in the cerebral cortex. The arrows (white) indicated VEGF protein expression; B: IF of VEGF and MD analysis of VEGF in the hippocampal CA1. The arrows (white) indicated VEGF protein expression; C: IF of CD34 and MD analysis of CD34 in the cerebral cortex. The arrows (white) indicated CD34 protein expression; D: IF of CD34 and MD analysis of CD34 in the hippocampal CA1. The arrows (white) indicated CD34 protein expression. *P < 0.05 vs sham; #P < 0.05 vs I/R; ▲P < 0.05 vs ISO. |
如Fig 6所示,各组Smad蛋白表达差异无统计学意义(P>0.05)。与Sham组比较,I/R组p-Smad3、VEGF和CD34蛋白表达水平明显升高(P<0.05);与I/R组比较,ISO组p-Smad3、VEGF和CD34蛋白表达水平进一步升高(P<0.05);与ISO组相比,ISO+SIS3组p-Smad3、VEGF和CD34蛋白表达水平明显降低(P<0.05)。
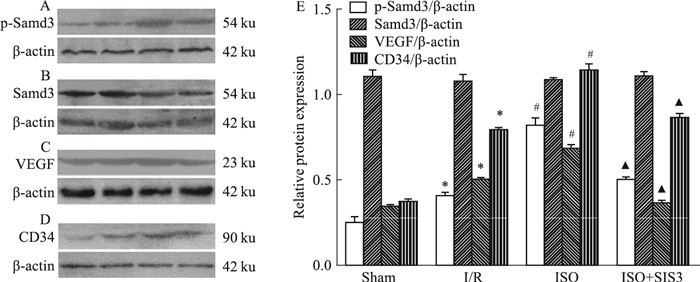
|
| Fig 6 Protein expression levels and Western blot analysis of p-Smad3, Smad3, VEGF and CD34(x±s, n=5) *P < 0.05 vs sham; #P < 0.05 vs I/R; ▲P < 0.05 vs ISO |
中风是一种脑血管疾病,可分为血管栓塞引起的缺血性中风和血管破裂引起的出血性中风,前者较常见,约占80%[8]。脑卒中一段时间后,血流再通常会加重脑损伤和脑功能障碍,这种现象称为脑缺血/再灌注损伤。其病理生理机制包括氧化应激、炎症、兴奋性毒性、凋亡途径的激活和钙超载等。这些因素相互作用导致神经细胞凋亡和神经功能障碍,因此,研究具有神经保护作用的药物具有重要的临床价值和意义。
本研究表明,Smad3信号通路通过促进VEGF和CD34的表达,介导中风后异氟醚诱导的神经保护作用。本实验首先观察大鼠缺血侧皮质的变化,由于海马CA1区域的锥体神经元易受缺血/再灌注损伤,且海马锥体神经元在缺血性脑损伤后可以再生[9],我们对海马CA1区也进行了观察。本研究表明,异氟醚后处理可以明显降低脑梗死体积和神经功能评分,增加存活神经元,减少大鼠脑缺血/再灌注损伤后的凋亡细胞。
异氟醚在脑卒中MCAO模型缺血的急性期具有神经保护作用。本研究的数据与Gaidhani等[10]最近的一项研究一致,后者证明90 min异氟醚麻醉几乎完全保护脑组织免受(transient MCAO)tMCAO诱导的损伤。此外,Jeong等[11]报道,异氟醚对肝脏缺血/再灌注损伤有明显的保护作用。研究还发现,乳化异氟醚后处理改善了动物全脑缺血/再灌注损伤模型中大鼠心脏骤停模型的存活率和神经功能[12]。根据这些发现,本研究证明了异氟醚在改善缺血性损伤方面的保护作用。
本研究表明,Smad3特异性抑制剂SIS3 HCl可以抑制异氟醚的神经保护作用。我们进一步研究了大鼠缺血/再灌注损伤后,MCAO模型中异氟醚的神经保护作用的分子机制。我们通过Western blot实验,在蛋白质水平证明异氟醚后处理后p-Smad3上调。表明缺血/再灌注损伤后,异氟醚诱导的Smad3信号通路的激活。此外,Western blot实验结果表明,SIS3 HCl的应用降低了p-Smad3的表达水平,然而,总Smad3的含量没有明显差异。总之,当体内Smad3信号传导途径被SIS3 HCL抑制时,异氟醚的脑保护作用减弱。因此,本研究表明,异氟醚的神经保护作用与Smad3信号途径相关。海马细胞实验证明,Smad途径介导TGF-β调节的海马颗粒神经元的增殖和分化[13]。辛二酰苯胺异羟肟酸预处理通过抑制Smad信号,有效抑制TGF-β驱动的细胞增殖、分化和血管生成细胞因子的表达[14]。因此,先前的研究和本研究都表明,激活的Smad3信号通路对介导缺血性脑损伤的神经保护至关重要。
VEGF促进血管生成以改善缺血/再灌注损伤后的神经功能和神经血管重塑。CD34被认为是血管生成的间接标志物。本研究免疫荧光和Western blot分析表明,异氟醚后处理明显增加缺血侧脑组织VEGF和CD34的表达水平。本研究的结果与最近的研究结果一致,缺血性损伤增加细胞培养物中VEGF的表达水平,促进缺血性中风的血管生成[15]。有研究表明,补阳还五汤可提高VEGF的mRNA和蛋白表达,从而减轻大鼠脑缺血性损伤[16]。此外,hyperforin治疗可明显增加缺血半球VEGF和CD34的表达,对急性缺血性脑卒中发挥神经保护作用[17]。总之,本研究表明异氟醚增强了VEGF和CD34的表达,促进血管生成,并减弱大鼠脑缺血/再灌注损伤。
最后,我们进一步确定Smad3信号通路是否参与了异氟醚诱导的血管生成。给予抑制剂SIS3 HCL后,通过免疫荧光和Western blot实验测定VEGF和CD34的表达水平。结果表明,给予SIS3 HCL后,缺血侧皮质和海马CA1区的VEGF和CD34的表达水平明显下调,同时神经行为学评分升高,脑梗死体积增加,凋亡神经元增多。提示Smad3信号通路介导异氟醚的保护作用,并且与大鼠脑缺血/再灌注损伤后VEGF和CD34的表达有关。
血管生成是脑卒中后功能恢复的关键因素。目前,中风病理生理学研究的重点已从单纯血管概念转向神经血管单元,神经血管单元被认为在卒中恢复中发挥关键作用[18]。我们接下来将对神经血管单元进行更全面的研究,例如中风后神经胶质细胞和神经血管单元细胞之间的串扰,进一步探索异氟醚的神经保护机制。总之,我们发现异氟醚通过Smad3信号通路调节大鼠脑缺血/再灌注损伤后VEGF和CD34的表达。异氟醚在减轻中风和脑缺血方面的作用机制值得进一步研究。
( 致谢: 本实验完成于新疆地方与民族高发病教育部重点实验室,感谢各位老师和同学对实验的指导及帮助。)
| [1] |
王萍, 闫东明, 黄茜, 等. 三七总皂苷治疗缺血性脑卒中的神经保护机制[J]. 中国药理学通报, 2018, 34(12): 1750-5. Wang P, Yan D M, Huang Q, et al. The neuroprotection molecular basis and mechanism of Panax Notoginseng saponins in the treatment of ischemic stroke[J]. Chin Pharmacol Bull, 2018, 34(12): 1750-5. doi:10.3969/j.issn.1001-1978.2018.12.025 |
| [2] |
De-An Zhao, Ling-Yun Bi, Huang Q, et al. Isoflurane provides neuroprotection in neonatal hypoxic ischemic brain injury by suppressing apoptosis[J]. Braz J Anesthesiol, 2016, 66(6): 613-21. doi:10.1016/j.bjan.2016.08.003 |
| [3] |
Cheon S Y, Kim S Y, Kam E H, et al. Isoflurane preconditioning inhibits the effects of tissue-type plasminogen activator on brain endothelial cell in an in vitro model of ischemic stroke[J]. Int J Med Sci, 2017, 14(5): 425-33. doi:10.7150/ijms.18037 |
| [4] |
Luo X, Zhao H, Hennah L, et al. Impact of isoflurane on malignant capability of ovarian cancer in vitro[J]. Braz J Anesthesiol, 2015, 114(5): 831-9. doi:10.1093/bja/aeu408 |
| [5] |
Wang S, Yin J, Ge M, et al. Transforming growth-beta 1 contributes to isoflurane postconditioning against cerebral ischemia-reperfusion injury by regulating the c-Jun N-terminal kinase signaling pathway[J]. Biomed Pharmacother, 2016, 78(2): 280-90. |
| [6] |
Yong-Le X, Min-Hong Z, Wei G, et al. MicroRNA-19 restores vascular endothelial cell function in lower limb ischemia-reperfusion injury through the KLF10-dependent TGF-β1/Smad signaling pathway in rats[J]. J Cell Biochem, 2018, 119(11): 9303-15. doi:10.1002/jcb.27207 |
| [7] |
Wang X, Ma W, Han S, et al. TGF-β participates choroid neovascularization through Smad2/3-VEGF/TNF-α signaling in mice with Laser-induced wet age-related macular degeneration[J]. Sci Rep, 2017, 7(1): 9672. |
| [8] |
Members W G, Mozaffarian D, Benjamin E J, et al. Heart disease and stroke statistics-2016 update: A report from the American heart association[J]. Circulation, 2016, 133(4): e38-e360. |
| [9] |
Oya S, Yoshikawa G, Takai K, et al. Attenuation of Notch signaling promotes the differentiation of neural progenitors into neurons in the hippocampal CA1 region after ischemic injury[J]. Neuroscience, 2009, 158(2): 683-92. doi:10.1016/j.neuroscience.2008.10.043 |
| [10] |
Gaidhani N, Sun F, Schreihofer D, et al. Duration of isoflurane-based surgical anesthesia determines severity of brain injury and neurological deficits after a transient focal ischemia in young adult rats[J]. Brain Res Bull, 2017, 134: 168-76. doi:10.1016/j.brainresbull.2017.07.018 |
| [11] |
Jeong J S, Kim D, Kim K Y, et al. Ischemic preconditioning produces comparable protection against hepatic ischemia/reperfusion injury under isoflurane and sevoflurane anesthesia in rats[J]. Transplant Proc, 2017, 49(9): 2188-93. doi:10.1016/j.transproceed.2017.07.002 |
| [12] |
Zhang Y.J, Yu. Emulsified isoflurane postconditioning improves survival and neurological outcomes in a rat model of cardiac arrest: 13AP1-2[J]. Exp Ther Med, 2017, 14(1): 65-72. doi:10.3892/etm.2017.4446 |
| [13] |
Lu J, Wu Y N, Almeida O F. SMAD pathway mediation of BDNF and TGF beta2 regulation of proliferation and differentiation of hippocampal granule neurons[J]. Development, 2005, 132(14): 3231-42. doi:10.1242/dev.01893 |
| [14] |
Akiko F, Toshihiro I, Tomokazu F, et al. Molecular mechanisms underlying the filtration bleb-maintaining effects of suberoylanilide hydroxamic acid (SAHA)[J]. Invest Ophthalmol Vis Sci, 2017, 58(4): 2421-9. doi:10.1167/iovs.16-21403 |
| [15] |
Liu Y, Li Y, Zhan M, et al. Astrocytic cytochrome P450 4A/20-hydroxyeicosatetraenoic acid contributes to angiogenesis in the experimental ischemic stroke[J]. Brain Res, 2019, 1 708: 160-70. |
| [16] |
Zheng X, Shan C, Xu Q, et al. Buyang Huanwu decoction targets SIRT1/VEGF pathway to promote angiogenesis after cerebral ischemia/reperfusion injury[J]. Front Neurosci, 2018, 4(12): 911. |
| [17] |
Zhang J, Yao C, Chen J, et al. Hyperforin promotes post-stroke functional recovery through interleukin (IL) 17A-mediated angiogenesis[J]. Brain Res, 2016, 1 646: 504-13. |
| [18] |
Dirnagl U. Pathobiology of injury after stroke: the neurovascular unit and beyond[J]. Ann N Y Acad Sci, 2012, 1 268: 21-5. |

