


Toll样受体(toll-like receptors, TLRs)家族是一类重要的模式识别受体, 通过识别病原体相关分子模式参与先天性免疫进程, 在天然免疫中发挥关键作用[1]。作为TLRs家族的重要成员之一, TLR9在人类疾病发生进展中扮演着重要的角色。TLR9主要表达于免疫细胞, 如B淋巴细胞、树突细胞、中性粒细胞、单核细胞等。TLR9通过识别细菌和病毒DNA中非甲基化CpG基序, 诱导产生强烈的Th1优势免疫应答, 调节IFN-α、IL-6、IL-12等细胞因子分泌, 参与抵抗缺血/缺氧性脑损伤、自身免疫性疾病、炎症相关疾病的发生[2-3]。近年来研究发现, TLR9在肺癌、胃癌、卵巢癌、结肠癌多种肿瘤细胞中高表达, 可能与恶性肿瘤发生发展密切相关[4-6]。TLR9激活后可通过NF-кB与JNK信号转导途径, 诱导促炎症细胞因子及免疫抑制分子分泌而形成炎性环境, 同时肿瘤细胞分泌的免疫抑制分子如MMP2、MMP7、COX-2等均会对肿瘤细胞逃避机体的免疫监视起重要作用, 促进肿瘤生长[7]。TLR9在肿瘤免疫中发挥重要作用, 已经成为肿瘤免疫治疗研究的热点之一。因此, 研究TLR9蛋白功能对我们了解免疫、炎症相关性疾病和肿瘤的发生机制具有重要意义。采用基因敲除小鼠来研究TLR9功能及在相关疾病进展中的作用, 相比其他研究方法能排除内源性基因的干扰, 而且实验结果直观, 可靠。本课题组拟利用CRISPR-Cas9技术构建TLR9基因敲除小鼠, 并初步研究TLR9基因敲除对小鼠遗传表型, 组织形态的影响, 为TLR9基因的相关研究提供实验动物模型, 为进一步探究TLR9在免疫性疾病、肿瘤发生发展中作用及机制奠定基础。
1 材料 1.1 实验动物采用CRISPR/Cas9基因编辑技术构建TLR9基因敲除小鼠(C57BL/6J), 本工作委托新乡医学院梁银明博士实验室制备。野生型(wild type, WT)C57BL/6J小鼠购自北京维通利华实验动物技术有限公司, 实验动物生产许可证号:[SCXK-(京)2012-0001]。严格按照SPF级动物饲养标准进行饲养, 饲养过程实行自由采食和饮水, 每周更换3次垫料并补充饲料和饮用水。饲养环境内的温度控制在(20~25) ℃, 湿度控制在40%~60%, 通风良好, 环境安静, 室内保持12 h明暗交替。所有实验动物的操作及饲养均符合河南大学实验动物管理与伦理委员会相关规定。
1.2 主要试剂与仪器TIANamp Genomic DNA Kit(天根生化科技公司); RNA提取试剂(TRIzol)(美国Invitrogen公司); Prime ScriptTM 1st Strand cDNA Synthesis Kit逆转录试剂盒、TB GreenTM Fast qPCR Mix反应试剂(日本TaKaRa公司); 免疫组化试剂盒(上海生工生物公司); 蛋白酶抑制剂Cocktail(罗氏公司); RIPA裂解液(碧云天公司)。TLR9抗体(Abcom公司); 偶联HRP抗鼠、抗兔二抗(Cell Signaling公司); SLAN-96实时荧光定量PCR仪器(ZEESAN公司), Qsep100全自动核酸分析仪(光鼎Bioptic公司), C1000 Touch Thermal Cycler热循环仪(BIO-RAD), Nanodrop2000核酸定量仪(Thermo公司)。
1.3 C57BL/6J小鼠TLR9基因敲除模型制备与处理繁殖初期, 将TLR9基因敲除雄性小鼠与野生型雌性小鼠, 1 :2进行合笼, 小鼠的性成熟期为8周左右, 母鼠妊娠期为21 d左右。待繁殖出F1代杂合型小鼠后, 1:2进行合笼, 扩大繁殖得到更多F2代小鼠进行检测。小鼠出生后第2周, 打耳标, 剪鼠尾, 提取基因组DNA进行基因型鉴定, 与母鼠分笼单独饲养。1年内共繁殖6代, 获得F6代小鼠。每代交配与繁殖根据实验所需的基因型及小鼠数量确定。小鼠出生后第2~12周内每周称量体质量1次, 并进行后续实验。
1.4 引物的合成根据Gene ID小鼠基因组序列信息和打靶位点侧翼序列信息(从美国国家生物技术信息中心数据库网站https://www.ncbi.nlm.nih.gov下载), 采用Primer Premier5.0软件设计小鼠DNA鉴定引物(TLR9-WT)及Real-time-PCR引物(TLR9-RT)序列, 所有引物均由上海生工合成(Tab 1)。
| Primer type | Forward (5'→3') | Reverse (5'→3') |
| TLR9-WT | 5’-CTGACTTCGTCCACCTGTC-3’ | 5’-TCTTCAGGGGTGGCTTCTG-3’ |
| TLR9-RT | 5’-GTATAGAATGTGGCCAAAAGTCCC-3’ | 5’-ACCAGGAAGAGTTCAGTGTATGGAG-3’ |
剪取约0.5-1 cm鼠尾组织放入1.5 mL无菌Ep管中, 参照TIANamp Genomic DNA Kit说明书步骤提取基因组DNA。PCR反应体系(25 μL):10×Buffer 2.5 μL、DNTP 2 μL、Taq HS 0.1 μL、Forward Primer(2 μmol·L-1)2 μL、Reverse Primer(2 μmol·L-1)2 μL、DNA template 4 μL、ddH2O 4.8 μL。反应条件:94 ℃预变性, 3 min; 98 ℃变性, 10 s; 60 ℃退火, 30 s; 72 ℃后延伸, 1 min; 循环35次。利用毛细管凝胶电泳技术进行鉴定基因型。将PCR产物用Dilution Buffer进行10倍稀释, 通过Qsep100全自动核酸蛋白分析仪检测小鼠基因型, 采用较高灵敏度的S2(standard cartridge 2, S2)卡夹, S2卡夹为可替换的预制胶卡夹, 无需制胶, 灌胶, 全自动进样, 每支卡夹可分析100~200个样品。电泳过程中使用20 bp~5000 bp的Alignment Marker和Size Marker, 分析系统自动输出电泳峰图和凝胶电泳图。PCR产物送往上海生工生物公司测序。测序结果利用Chromas软件进行分析对比确定TLR9基因敲除效果。
2.2 Real-time PCR检测TLR9 mRNA的表达采用TRIzol法提取组织总RNA, 根据Prime ScriptTM 1st Strand cDNA Synthesis Kit逆转录试剂盒的说明制备cDNA样品。使用TB GreenTM Fast qPCR Mix进行qRT-PCR实验检测组织中mRNA的表达。PCR反应体系(20 μL):SYBR Fast qPCR Mix(2×) 10 μL、Forward Primer(10 μmol·L-1) 0.8 μL、Reverse Primer(10 μmol·L-1) 0.8 μL、cDNA template 2 μL、ddH2O 6.4 μL。反应条件:95 ℃, 30 s; 95 ℃, 5 s; 95 ℃, 15 s; 60 ℃, 1 min, 循环40次; 15 ℃, 2 min。实验结果采用2-ΔΔCt法分析处理。
2.3 Western blot检测TLR9蛋白的表达提取小鼠脾组织和肝组织的总蛋白, BCA定量试剂盒进行蛋白定量。采用10% SDS-PAGE进行电泳, 转膜, 5%脱脂奶粉室温封闭1 h, 加入一抗(TLR9 1 :1 000, β-actin 1 :10 000), 4 ℃孵育过夜, 次日用PBST洗涤3次, 每次5 min, 加入对应的山羊抗鼠IgG二抗(1 :5 000), 室温孵育2 h, PBST洗涤3次, 每次5 min。ECL法显影处理。
2.4 组织HE染色及免疫组化检测TLR9蛋白的表达分离小鼠新鲜的脾、肝组织, 4%多聚甲醛固定后进行常规石蜡包埋、切片, 进行苏木精-伊红(hematoxylin-eosin, HE)染色, 观察TLR9基因敲除小鼠组织结构的变化。60 ℃烤片、组织切片脱蜡水化, 参照上海生工生物公司产品即用型免疫组化学试剂盒说明书, 以TLR9抗体为一抗进行免疫组化染色。显微镜观察拍照。
2.5 血常规检测剪鼠尾采血, 利用血细胞分析仪进行血常规检测。此实验由武汉赛维尔生物科技有限公司完成。
2.6 统计学方法数据采用SPSS.20软件进行统计学分析, 计量资料经正态性检验服从正态分布, 实验结果用x±s表示, 组间比较采用单因素方差分析。
3 结果 3.1 TLR9基因敲除小鼠基因型鉴定结果在TLR9基因第二个外显子区域设计DNA片段长度为1079 bp的引物, 可根据条带长度及Qsep100全自动核酸蛋白分析系统自动输出电泳峰图分析小鼠基因型。基因分型鉴定结果显示, 野生型(TLR9+/+)小鼠的基因组DNA扩增片段长度为1073 bp, 单峰; 纯合型TLR9敲除(TLR9-/-)小鼠扩增片段长度约为522 bp, 单峰; 而杂合型(TLR9+/-)小鼠则两条带都可得到并显示为双峰(Fig 1A)。通过对测序结果对比发现, 与野生型小鼠比较, TLR9-/-小鼠外显子部位约缺失550 bp碱基序列, 表明在TLR9基因敲除小鼠中, TLR9基因敲除成功(Fig 1B)。
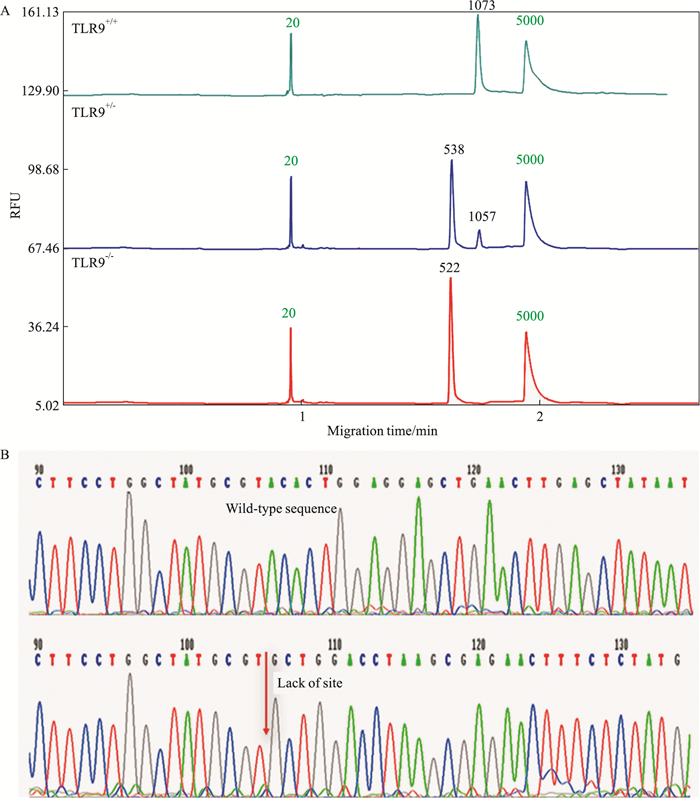
|
| Fig 1 Genotyping of TLR9 knockout mice A. Genotyping results; B. Sequencing analysis results |
我们进一步应用qRT-PCR方法检测TLR9 mRNA在脾和肝脏组织中的表达水平。由Fig 2A可见, TLR9基因敲除小鼠的脾、肝组织中TLR9 mRNA表达水平低于野生型小鼠(P<0.01)。Western blot和免疫组织化学技术结果表明, TLR9-/-小鼠脾、肝组织中的TLR9蛋白几乎不表达, 而野生型小鼠脾、肝组织中的TLR9表达水平较高(Fig 2B、2C)。综上可知, 我们已成功建立TLR9基因敲除小鼠。

|
| Fig 2 Identification of TLR9 gene knockout effect A. Detection of TLR9 mRNA expression in tissues by qRT-PCR(x±s, n=3); B. Detection of TLR9 protein expression in tissues by Western blot; C. Detection of the expression of TLR9 protein in tissues by immunohistochemistry (×40), **P < 0.01 vs TLR9+/+ group |
本课题组采用雄性TLR9基因敲除小鼠与雌性野生型小鼠交配获得F1代。将获得的F1代杂合型小鼠进行自交, 成功繁育出更多纯合型F2代基因敲除小鼠。并对所得子代113只小鼠的性别及基因型进行分析, 结果显示, 雌、雄的比例为49 :64;各基因型分布情况, TLR9+/+小鼠27只(占0.24), TLR9+/-小鼠56只(占0.495), TLR9-/-小鼠30只(占0.265), 分离比例基本符合孟德尔遗传定律的1 :2 :1, 说明TLR9基因敲除后对小鼠繁殖能力无明显影响(Fig 3)。
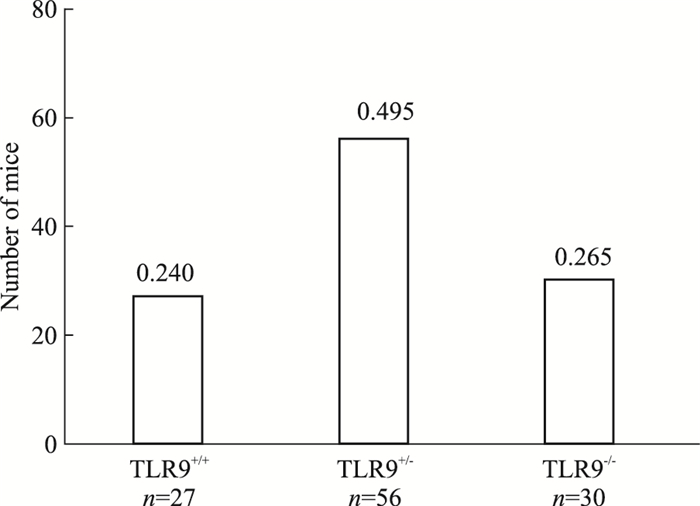
|
| Fig 3 Effect of TLR9 gene knockout on hereditary traits in mice |
为了解TLR9敲除对小鼠生长的影响, 我们进一步对小鼠的相对体质量进行跟踪。结果显示, 从第9周龄开始, 雄性野生型小鼠体质量略高于TLR9基因敲除雄性小鼠, 但差异无统计学意义, TLR9-/-小鼠与TLR9+/+小鼠体质量增长趋势一致。结果表明, TLR9基因的缺失并不影响小鼠的生长(Fig 4)。
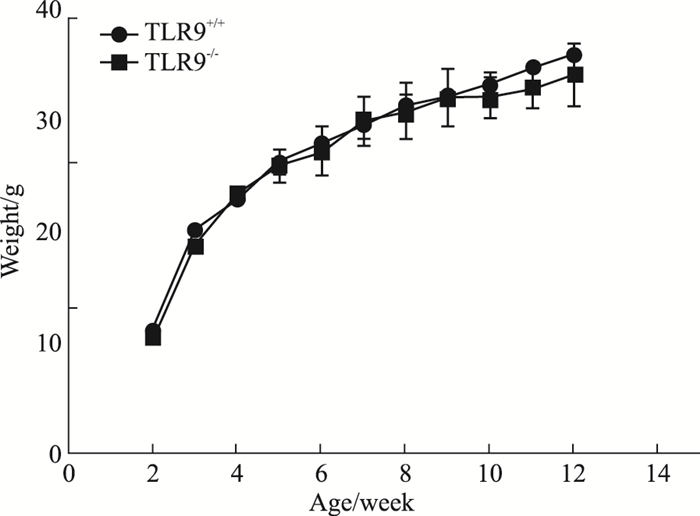
|
| Fig 4 Body weight analysis of TLR9 knockout mice |
将TLR9+/+与TLR9-/-小鼠(14周龄)的主要组织进行HE染色, 观察TLR9基因的缺失对小鼠组织病理形态学的影响。结果发现TLR9敲除小鼠主要脏器脾、肝组织结构清晰, 与野生型小鼠一致, 未出现明显异常, 说明TLR9基因的敲除并不影响各主要脏器的生长发育(Fig 5)。

|
| Fig 5 HE staining results of mouse tissues(×40) |
取14周龄左右TLR9+/+和TLR9-/-小鼠外周血进行血常规检测。检测结果发现, TLR9基因敲除小鼠外周血淋巴细胞含量显著少于野生型小鼠(P<0.05), TLR9基因的敲除对小鼠外周血红细胞、白细胞及血小板等组成及相关参数均无明显影响(Tab 2)。
| Index | TLR9+/+ | TLR9-/- |
| WBC(109/L) | 13.8±5.92 | 11±4.08 |
| Lymph(109/L) | 11.17±5.39 | 8±3.24* |
| Mon(109/L) | 0.09±0.30 | 0.06±0.24 |
| Gran(109/L) | 2.09±0.83 | 1.84±0.80 |
| Lymph%(%) | 79.58±7.06 | 73.8±13.68 |
| Mon%(%) | 2.55±0.52 | 2.65±0.70 |
| Gran%(%) | 16.36±5.12 | 18.35±5.45 |
| RBC(1012/L) | 7.92±1.37 | 8.62±1.02 |
| HGB(g/L) | 120.42±21.94 | 131.71±17.16 |
| HCT(%) | 36.75±7.03 | 39.67±4.85 |
| MCV(f/L) | 46.17±2.12 | 45.9±2.21 |
| MCH(pg) | 15.08±0.79 | 15.24±0.43 |
| MCHC(g/L) | 328.30±10.90 | 327.90±14.68 |
| RDW(%) | 15.90±1.85 | 15.10±1.19 |
| PLT(109/L) | 801.00±439.347 | 784.50±244.42 |
| MPV(f/L) | 5.17±0.57 | 5.33±0.73 |
| PDW | 16.08±0.28 | 16.14±0.35 |
| PCT(%) | 0.45±0.52 | 0.19±0.40 |
| WBC:white blood cell; Lymph:lymphocyte; Mon:monocyte; Gran:granulocyte; Lymph%:percentage of lymphocytes; Mon%:percentage of monocytes; Gran%:percentage of granulocytes; RBC:red blood cell; HGB:hemoglobin; HCT:hematocrit; MCV:mean corpuscular volume; MCH:mean red blood cell hemoglobin content; MCHC:mean corpuscular hemoglobin concentration; RDW:red blood cell distribution width; PLT:platelet count; MPV:mean platelet volume; PDW:platelet distribution width; PCT:plateletcrit. *P<0.05 vs TLR9+/+ group | ||
TLR9是激活天然免疫应答的重要受体, 也是连接天然免疫和获得性免疫的重要桥梁, 在机体免疫反应中均发挥重要作用。Song等[8]研究发现, TLR9在小鼠支气管的炎症反应发生过程中发挥重要作用, TLR9抑制剂能够显著减少烟雾环境(environmental tobacco smoke, EST)诱导的支气管纤维化。Suresh[9]等构建TLR9-/-小鼠模型, 并发现TLR9敲除可明显抑制促炎性细胞因子和巨噬细胞趋化蛋白5(MCP-5)的释放, 减少肺泡巨噬细胞及中性粒细胞的募集和浸润, 最终影响了闭合性肺挫伤的发生。此外, TLR9参与肿瘤的发生发展, 在许多肿瘤细胞系和肿瘤中表达上调, 与肿瘤发生进展密切相关。研究表明, TLR9异常表达可诱导长期慢性炎症反应, 并进一步促进恶性转变, 导致肿瘤发生。在乳腺癌和卵巢癌中TLR9/NF-кB炎症信号通路异常活化, 且TLR9的表达水平与肿瘤的恶性程度呈正相关[10]。随着TLR9在不同阶段结肠癌组织中差异表达, 其下游分子NF-κB蛋白在结肠癌组织中表达增加, 并且在直肠癌组织中减少, TLR9信号激活参与结直肠癌的临床过程并影响NF-κB的表达, 促进炎症因子的分泌形成炎性环境, 加速结肠癌的发生发展[11]。Zhang等[12]发现, 食管鳞状细胞癌中TLR9的表达显著高于正常组织, 并与肿瘤的大小及病理分化程度呈正相关。另外, TLR9信号通路的激活在肿瘤侵袭、转移等过程中也起着重要的作用。利用siRNA技术沉默前列腺癌PC3细胞中TLR9表达, 可明显抑制前列腺癌细胞的侵袭和迁移能力[13]。Rath等[14]在体外研究中发现, 利用TLR9激动剂处理结直肠癌株LS174和SW620后, 肿瘤侵袭迁移相关的金属蛋白激酶MMP13表达量增加, 并且MMP13在结直肠癌中的显著表达与较差存活率和远处转移存在相关, 提示TLR9的激活可能促进结直肠癌细胞的转移。上述这些研究结果均表明, TLR9在机体炎症反应中发挥作用; 其表达异常可能会导致机体免疫失衡, 并促进肿瘤的生长、侵袭和迁移, 加快肿瘤的发展。
基因敲除小鼠是构建人类遗传疾病模型和药物筛选的重要模式动物, 可在短时间内模拟疾病的发生和发展, 在疾病发生机制研究及药物筛选中具有重要的应用价值[15]。构建TLR9基因敲除小鼠对于进一步研究其在免疫调节、炎症发生及肿瘤进展中的作用具有重要意义。目前, 应用CRISPR/Cas9系统来构建基因敲除小鼠模型是广泛认可的实验手段。本研究利用CRISPR/Cas9基因编辑技术构建TLR9基因敲除小鼠模型, 并在DNA、mRNA及蛋白多个水平对敲除效果进行验证, 确认成功构建TLR9基因敲除小鼠。通过观察TLR9基因敲除小鼠生长繁殖情况, 发现TLR9基因敲除小鼠与野生型小鼠一样具有正常的生长繁殖能力, 子代生长状况良好, 并且TLR9基因敲除对小鼠脾、肝组织这些重要脏器的结构没有明显影响。综上所述, 本研究成功建立了TLR9基因敲除小鼠模型, 为详细阐明TLR9基因的生物学功能奠定基础, 为探究TLR9在免疫、炎症相关性疾病和肿瘤发病机制中的作用提供实验动物模型。
| [1] |
Medzhitov R. Recognition of microorganisms and activation of the immune response[J]. Nature, 2007, 449(7164): 819-26. doi:10.1038/nature06246 |
| [2] |
黄莹, 叶兰, 冯占辉, 等. CpG-ODN对新生大鼠缺血/缺氧性脑损伤的保护作用研究[J]. 中国药理学通报, 2017, 33(7): 956-61. Huang Y, Ye L, Feng Z H, et al. Protective effect of CpG-ODN conditioning on hypoxic/ischemic brain damage in neonatal rats[J]. Chin Pharmacol Bull, 2017, 33(7): 956-61. doi:10.3969/j.issn.1001-1978.2017.07.014 |
| [3] |
Megjugorac N J, Young H A, Amrute S B, et al. Virally stimulated plasmacytoid dendritic cells produce chemokines and induce migration of T and NK cells[J]. J Leukoc Biol, 2004, 75(3): 504-14. doi:10.1189/jlb.0603291 |
| [4] |
Ren T, Wen Z K, Liu Z M, et al. Functional expression of TLR9 is associated to the metastatic potential of human lung cancer cell[J]. Cancer Biol Ther, 2007, 6(11): 1704-9. doi:10.4161/cbt.6.11.4826 |
| [5] |
Tian R W, Jiang C P, Yu Q Q, et al. Helicobacter pylori regulates TLR4 and TLR9 during gastric carcinogenesis[J]. Int J Clin Exp Pathol, 2014, 7(10): 6950-5. |
| [6] |
Shahriari S, Rezaeifard S, Moghimi H R, et al. Cell membrane and intracellular expression of toll-like receptor 9 (TLR9) in colorectal cancer and breast cancer cell-lines[J]. Cancer Biomark, 2017, 18(4): 375-80. doi:10.3233/CBM-160260 |
| [7] |
Xu X F, Wang G Q, Ai L L, et al. Melatonin suppresses TLR9-triggered proinflammatory cytokine production in macrophages by inhibiting ERK1/2 and AKT activation[J]. Sci Rep, 2018, 8(1): 15579. doi:10.1038/s41598-018-34011-8 |
| [8] |
Song D J, Min M G, Miller M, et al. Toll-like receptor-9 agonist inhibits airway inflammation, remodeling and hyperreactivity in mice exposed to chronic environmental tobacco smoke and allergen[J]. Int Arch Allergy Immunol, 2010, 151(4): 285-96. doi:10.1159/000250437 |
| [9] |
Suresh M V, Thomas B, Dolgachev V A, et al. Toll like receptor-9(TLR9) is requisite for acute inflammatory response and injury following lung contusion[J]. Shock, 2016, 46(4): 412-9. doi:10.1097/SHK.0000000000000601 |
| [10] |
Berger R, Fiegl H, Goebel G, et al. Toll-like receptor 9 expression in breast and ovarian cancer is associated with poorly differentiated tumors[J]. Cancer Sci, 2010, 101(4): 1059-66. doi:10.1111/j.1349-7006.2010.01491.x |
| [11] |
Gao C X, Qiao T K, Zhang B, et al. TLR9 signaling activation at different stages in colorectal cancer and NF-kappaB expression[J]. Onco Targets Ther, 2018, 11: 5963-71. doi:10.2147/OTT.S174274 |
| [12] |
Zhang Y, Wang Q, Ma A, et al. Functional expression of TLR9 in esophageal cancer[J]. Oncol Rep, 2014, 31(5): 2298-304. doi:10.3892/or.2014.3095 |
| [13] |
Luo Y, Jiang Q W, Wu J Y, et al. Regulation of migration and invasion by Toll-like receptor-9 signaling network in prostate cancer[J]. Oncotarget, 2015, 6(26): 22564-74. |
| [14] |
Rath T, StÖckle J, Roderfeld M, et al. Matrix metalloproteinase-13 is regulated by toll-like receptor-9 in colorectal cancer cells and mediates cellular migration[J]. Oncol Lett, 2011, 2(3): 483-8. doi:10.3892/ol.2011.276 |
| [15] |
石玉衡. 基因敲除模型小鼠在疾病研究中的应用[J]. 中国组织工程研究, 2011, 15(33): 6239-42. Shi Y H. Gene knockout mouse models for disease study[J]. J Clin Rehabil Tis Eng Res, 2011, 15(33): 6239-42. doi:10.3969/j.issn.1673-8225.2011.33.039 |

