


2. 中南大学湘雅医学院生理学教研室,湖南 长沙 410000;
3. 南华大学公共卫生学院社会医学与卫生事业管理学教研室, 湖南 衡阳 421000
 ,
LUO Jin-ding1,
WU Di1,2,
XU Tuo1,
HE Jian-qin1,
YANG Si-si1,
FENG Shui-dong3,
LING Hong-yan1
,
LUO Jin-ding1,
WU Di1,2,
XU Tuo1,
HE Jian-qin1,
YANG Si-si1,
FENG Shui-dong3,
LING Hong-yan1

2. Dept of Physiology, Xiangya Medical College, Central South University, Changsha 410000, China;
3. Dept of Social Medicine and Health Management, School of Public Health, University of South China, Hengyang Hunan 421000, China
随着生活水平的提升以及生活方式的改变,肥胖人数呈现逐年上升的趋势[1]。肥胖不仅对人们的健康造成极大的危害,而且给国家及社会带来沉重的负担。因此,如何预防和治疗肥胖问题一直是科学界研究的热点。
文献报道脂肪组织在肥胖及其相关的疾病中具有重要作用。人体内存在两种不同类型的脂肪组织:白色脂肪组织和棕色脂肪组织[2]。研究显示:促进白色脂肪组织棕色化,能增加能量消耗从而有效抵抗肥胖。二氢杨梅素(DHM)为野生藤类黄酮类化合物,3, 5, 7, 3’, 4’, 5’-六羟基2, 3二氢黄酮醇,又名蛇葡萄素,存在于葡萄科、滕黄科、杨梅科等植物中,其中在藤茶属植物中含量最高,具有抗氧化,抗血栓,抗肿瘤,降血糖等作用[3]。研究显示,DHM可通过激活PPARγ共激活因子1α(peroxisome proliferator activated receptor-γcoactivator-1 α,PGC-1α)改善小鼠骨骼肌胰岛素的敏感性[4],PGC-1α是白色脂肪组织向棕色脂肪组织转化过程中重要的转录调控因子; Liu等[5]发现DHM可降低肥胖Zucker糖尿病大鼠体质量和肝脏及脂肪组织脂肪沉积,这些研究提示:DHM可能促进WAT棕色化抵抗高脂饮食诱导的小鼠肥胖。为此,本文通过检测DHM对肩胛下脂肪组织形态,UCP-1、PRDM16、AMPK、PGC-1α和Sirt1的mRNA以及蛋白表达水平的影响,观察DHM对肥胖小鼠肩胛下脂肪组织棕色化的影响并阐明其机制。
1 材料与方法 1.1 实验动物3~4周龄C57BL/6J小鼠, ♂, 体质量(16~19) g,购于湖南斯莱克景达实验动物有限公司,动物使用许可证号:SCXK(湘)2013-0004。小鼠在南华大学动物房(3~5只一笼)适应性喂养一周后,正式开始实验。动物房12h明暗交替; 环境温度为(23~24) ℃,湿度为0.40~0.60,实验操作遵照《国家实验动物健康与管理条例》进行。
1.2 材料二氢杨梅素(DHM)由张家界志诚生物科技有限公司提供。UCP1和Prdm16兔抗鼠多克隆抗体(Abcam公司),PGC1α和AMPK兔抗鼠单克隆抗体(Cell Signaling公司)、β-actin和Sirt1兔抗鼠多克隆抗体(Absin公司)。UCP1、Prdm16、AMPK、PGC1α和Sirt1引物由在线软件primer5设计,上海生工生物工程有限公司合成,Pubmed验证。
1.3 仪器-80 ℃超低温冰箱(奥林巴斯生物公司); 定量PCR仪(美国BIO-TEK公司); 高速低温离心机(其林贝尔生物公司); 蛋白电泳转膜系统、电泳槽/转印槽(美国Bio-Rad公司)。
1.4 小鼠肥胖模型的建立和实验分组C57bl/6j小鼠(60只)适应性喂养1周后,分别普通饲料和高脂饲料喂养,同时用或不用低、高剂量的DHM(125 mg·kg-1·d-1、250 mg·kg-1·d-1)灌胃处理,因此,本实验共分成6小组:正常对照组(ND组)、正常对照+低剂量DHM组(ND+L-DHM组)、正常对照+高剂量DHM组(ND+H-DHM组)、高脂饮食组(HFD组)、高脂饮食+低剂量DHM组(HFD+L-DHM组)、高脂饮食+高剂量DHM组(HFD+H-DHM组)。每4周测小鼠体质量一次,16周末高脂饲料喂养的小鼠体质量为普通饲料喂养的小鼠体质量的1.2倍,认为小鼠肥胖模型成功建立。
1.5 空腹血糖和Lee’s指数16周末,小鼠禁食过夜,称重后,剪断尾尖流出尾静脉血,采用北京仪成血糖仪检测小鼠空腹血糖。接着脱颈椎处死小鼠,测量体长(从小鼠鼻尖到肛门的距离)后,根据公式计算Lee’s指数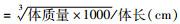
取肩胛下脂肪组织,置于4 ℃磷酸缓冲液(0.01 mol·L-1 PBS,pH 7.3)中洗去血液,在10%甲醛溶液中固定脱水后、浸蜡、包埋、切片、苏木精染色、200倍显微镜下随机选择4个视野进行观察。
1.7 实时定量PCR检测肩胛下脂肪组织UCP1、Prdm16、AMPK、PGC1α和Sirt1的基因表达取肩胛下脂肪组织,按照说明书提取RNA、逆转录合成cDNA,进行PCR扩增。UCP1正义引物:5′-CACGGGGACCTACAATGCTT-3′,反义引物:5′-ACAGTAAATGGCAGGGGACG-3′(191bp); Prdm16正义引物:5′-CACGTCTACGGTGAACGGAA-3′,反义引物:5′-ATGGGATCCATGAAGAACGGT-3′(122 bp); AMPK正义引物:5′-GATGATGACCATGTGCCAACTC-3′,反义引物:5′-TTATTGCGGCCCTCTTCATG-3′(136 bp); PGC1α正义引物:5′-TGACCACAAACGATGACCCTC-3′,反义引物:5′-GACTGCGGTTGTGTATGGGAC-3′(103 bp); Sirt1正义引物:5′-CAGCATCTTGCCTGATTTGTAA-3′,反义引物:5′-TGGGGTATAGAACTTGGAATTAGTG-3′(268 bp); GAPDH正义引物:5′-AGGAGCGAGACCCCACTAACA-3′,反义引物:5′-AGGGGGGCTAAGCAGTTGGT-3′(247 bp)。PCR反应条件为:95 ℃,5 min; 94 ℃,1 min; 58 ℃,30 s; 72 ℃,30 s(35 cycle); 72 ℃,7 min。各个基因的相对表达使用2-ΔΔCt计算。
1.8 Western blot检测肩胛下脂肪组织UCP1、Prdm16、AMPK、PGC1α和Sirt1蛋白表达提取各组小鼠肩胛下脂肪组织总蛋白,经蛋白定量后取30μg蛋白样品进行电泳, 转膜、封闭、分别加入抗UCP1、Prdm16、AMPK、PGC1α和Sirt1抗体过夜,洗涤后孵二抗,2 h后充分洗涤后,加ECL化学发光试剂,曝光后扫描,用图像分析软件进行灰度分析。
1.9 统计学处理SPSS 20.0软件进行统计分析,实验数据多组间比较采用单因素方差分析(ANOVA)、两两比较采用t检验,结果以x±s表示。
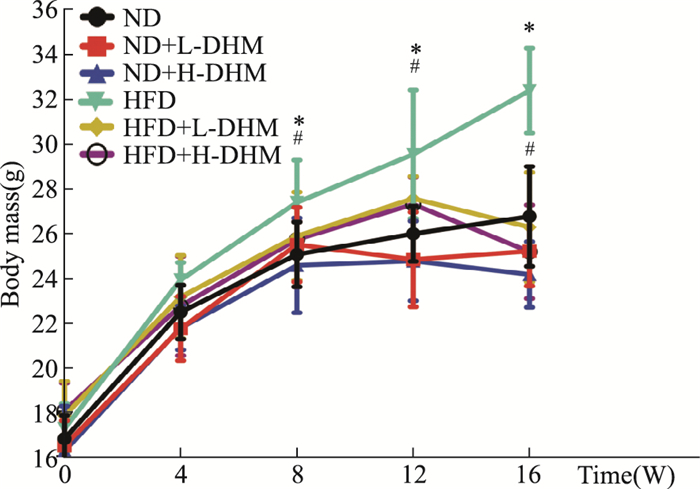
2 结果 2.1 二氢杨梅素对高脂饮食诱导的肥胖小鼠的体质量影响如Fig 1所示:高脂饲料处理c57bl/6j小鼠16周后,体质量高于正常对照小鼠,提示肥胖模型复制成功。与HFD组比较,HFD+L-DHM组和HFD+H-DHM组小鼠体质量降低,但ND、ND+L-DHM、ND+H-DHM 3组小鼠体质量差异无显著性,说明DHM仅仅降低高脂饲料喂养的肥胖小鼠体质量,而对正常小鼠体质量无明显影响。
|
| Fig 1 Body mass of c57bl/6j mice fed with high fat diet reduced by dihydromyricetin(x±s, n=10) *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
如Fig 2所示:与ND相比,HFD组血糖和Lee’s指数增高,无论是高剂量还是低剂量的DHM均能降低HFD的小鼠血糖和Lee’s指数。而ND、ND+L-DHM、ND+H-DHM三组小鼠血糖和Lee’s指数差异无显著性。

|
| 图 2 Effect of dihydromyricetin on the blood glucose and Lee’s index in obese mice induced by high fat diet(x±s, n=10) A:Blood sugar; B:Lee's index. 1: ND; 2:ND+L-DHM; 3:ND+H-DHM; 4:HFD; 5:HFD+L-DHM; 6:HFD+H-DHM; #P < 0.05 vs HFD group. |
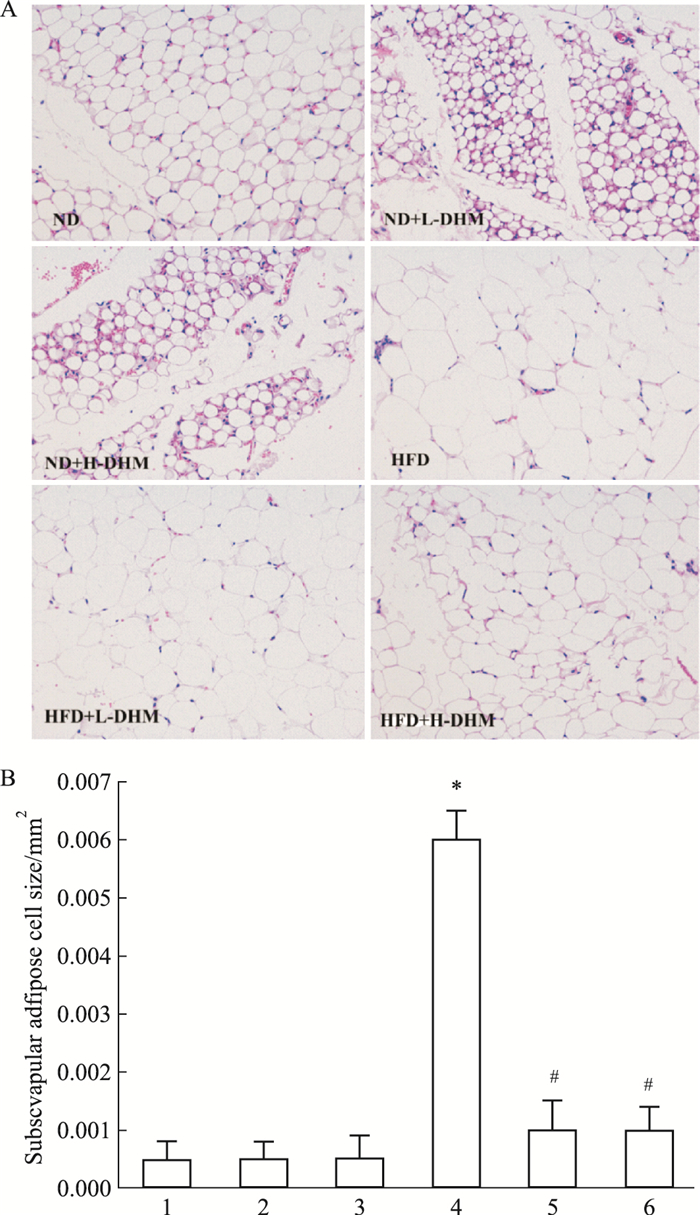
HE染色结果显示:与ND组相比,HFD组肩胛下脂肪组织脂肪细胞的直径增加,而经DHM(125 mg·kg-1·d-1或250 mg·kg-1·d-1)处理的HFD诱导的肥胖小鼠肩胛下脂肪组织脂肪细胞变小,但ND、ND+L-DHM、ND+H-DHM 3组小鼠肩胛下脂肪组织脂肪细胞大小无差异。提示:DHM可限制高脂喂养的肥胖小鼠肩胛下脂肪组织脂肪细胞变大。
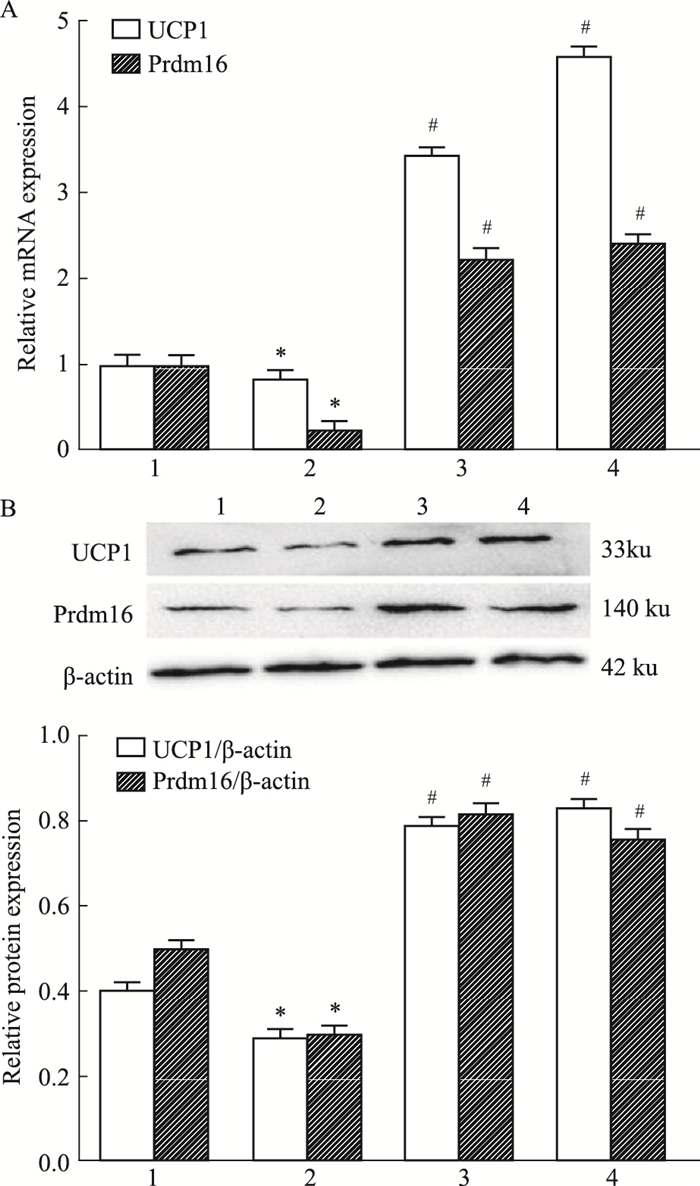
2.4 DHM对肩胛下脂肪组织UCP1和Prdm16的基因及蛋白表达的影响为观察DHM能否促进HFD喂养的肥胖小鼠肩胛下脂肪组织棕色化,我们检测了各组小鼠肩胛下脂肪组织WAT棕色化因子(UCP1和Prdm16)的基因及蛋白表达。图 4显示:与ND组比较,HFD组肩胛下脂肪组织UCP1和Prdm16的基因及蛋白表达降低,无论是高剂量还是低剂量DHM均能提高HFD小鼠UCP1和Prdm16的表达; 但DHM不影响正常小鼠UCP1和Prdm16的表达。提示:DHM可促进HFD喂养的肥胖小鼠肩胛下脂肪组织棕色化。
|
| Fig 3 Effect of dihydromyricetin on size of subscapular fat cells in high fat diet induced obese mice(x±s, n=4) A:Subscapular fat HE staining(20×); B:Subscapular fat cell size; 1: ND; 2:ND+L-DHM; 3:ND+H-DHM; 4:HFD; 5:HFD+L-DHM; 6:HFD+H-DHM. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
|
| Fig 4 Effect of dihydromyricetin on the mRNA and protein expression of UCP1 and Prdm16 in high fat diet induced obese mice(x±s, n=3) 1:ND; 2:HFD; 3:HFD+L-DHM; 4:HFD+H-DHM. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
为进一步探讨DHM促进HFD喂养的肥胖小鼠肩胛下脂肪组织棕色化的机制,小鼠肩胛下脂肪组织AMPK、PGC1α和Sirt1 mRNA及蛋白表达被检测。如图 5所示:与ND组比较,HFD组肩胛下脂肪组织AMPK、PGC1α和Sirt1 mRNA及蛋白表达水平下降; 与HFD组比较,HFD+L-DHM和HFD+H-DHM组肩胛下脂肪组织AMPK、PGC1α和Sirt1 mRNA及蛋白表达水平升高,但DHM不影响正常小鼠AMPK、PGC1α和Sirt1 mRNA及蛋白表达。提示:DHM可能通过激活AMPK-PGC1α-Sirt1信号通路促进HFD喂养的肥胖小鼠肩胛下脂肪组织棕色化。
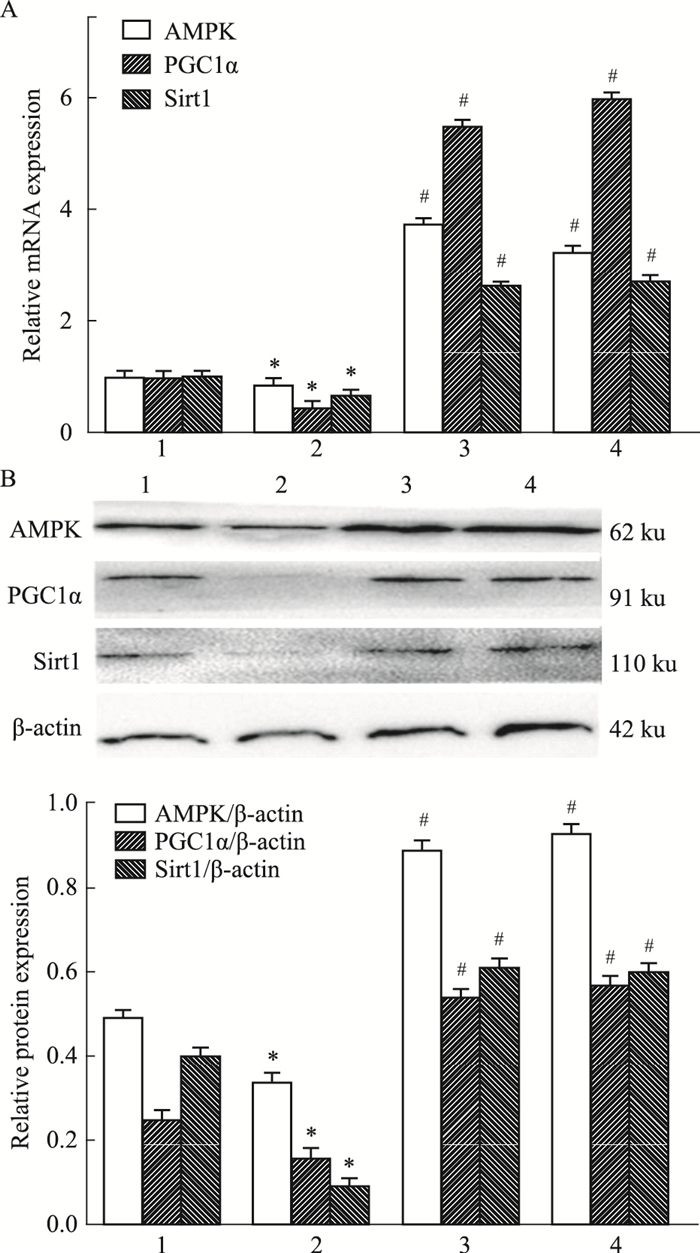
|
| Fig 5 Effect of dihydromyricetin on the mRNA and protein expression of AMPK, PGC1α and Sirt1 in obese mice induced by high fat diet(x±s, n=3) 1:ND; 2:HFD; 3:HFD+L-DHM; 4:HFD+H-DHM. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
据统计现今全世界肥胖及超重的人数已达21亿,接近全世界总人口的30%,而中国已成为世界的第二大“肥胖国”[6],其肥胖人数仅次于美国[7]。因此,肥胖问题亟待解决。目前对肥胖的治疗主要是改变生活方式、药物和手术治疗[8]。改变生活方式常常由于病人无法坚持而失败[9],手术治疗存在极大的手术风险,而药物治疗虽然在一定程度上可靠,但由于其毒副作用较大限制其使用[10]。因此,寻找安全、毒副作用少的减肥药物一直是科学家们的追求。
传统的观点认为:哺乳动物体内存在两种不同类型的脂肪组织,白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织。WAT能将体内的能量以脂肪形式储存起来,当能量摄入超过能量消耗时,WAT将会在体内堆积,从而引发肥胖。棕色脂肪组织内含许多线粒体,线粒体膜上存在大量解耦联蛋白UCP1,UCP1能将葡萄糖和脂肪分解[11]。因此,棕色脂肪组织可燃烧脂肪,具有减肥作用。因此,若能促进肥胖患者体内的WAT转变成棕色脂肪组织,将促进体内能量消耗,从而达到减肥的目的,这无疑给肥胖治疗带来福音。
二氢杨梅素(DHM)为藤类植物黄酮类化合物,具有多种药理学作用,大量文献表明DHM具有降糖、降脂和抗肿瘤等作用[12-13]。我们在前期预实验中发现,经DHM处理过的2型糖尿病小鼠皮下脂肪组织出现肉眼可见的棕色化改变,但DHM是否可促进WAT棕色化从而抵抗肥胖,还未见文献报道。因此,本实验通过高脂饮食喂养小鼠复制肥胖小鼠模型,观察DHM对肥胖小鼠的体质量、血糖、Lee’s指数、肩胛下脂肪细胞的形态及大小和棕色化因子UCP1, Prdm16的基因及蛋白表达的影响。结果显示:与ND组比较,HFD组小鼠体质量、血糖、Lee’s指数和肩胛下脂肪组织脂肪细胞直径明显增加,UCP1、Prdm16基因及蛋白表达明显降低; DHM可明显逆转HFD小鼠上述指标的改变,但DHM对正常小鼠无影响。提示DHM可促进肩胛下脂肪组织棕色化,抵抗高脂饮食诱导的肥胖。那么,DHM促进肩胛下脂肪组织棕色化的机制是什么呢?
长期以来,人体内的棕色脂肪被认为仅存在于婴幼儿时期。近年的研究显示,成人体内亦有少量棕色脂肪存在。人体内的棕色脂肪主要分布于肩胛间、腋窝下、肾周及脊柱旁。因此,本文选择肩胛下的脂肪组织作为研究对象。另有研究显示,“WAT棕色化”有关的作用靶点是PGC1α,AMPK是PGC1α的重要调节因子[2]。又有文献报道:DHM可经AMPK-PGC1α-Sirt1信号通路提高小鼠骨骼肌胰岛素的敏感性,改善胰岛素抵抗[4]。提示:DHM可能通过AMPK-PGC1α-Sirt1信号通路来促进肩胛下脂肪组织棕色化抵抗高脂饮食诱导的肥胖。因此,我们通过实时定量PCR和WB检测了各实验组小鼠肩胛下脂肪组织中AMPK、PGC1α和Sirt1mRNA和蛋白表达,结果显示:HFD组中AMPK、PGC1α和Sirt1mRNA和蛋白表达水平低于ND组,但DHM对正常小鼠这些基因及蛋白表达无影响。
综上所述,我们推测DHM可通过AMPK-PGC1α-Sirt1信号通路促进肩胛下脂肪组织棕色化抵抗高脂饮食诱导的肥胖,为DHM减肥提供了新的途径和策略,为肥胖相关的代谢综合征也带来新的治疗方案。
( 致谢: 本实验在南华大学神经生理研究所以及南华大学实验动物中心完成,衷心感谢各位老师的支持与帮助。)
| [1] |
Shalev D, Arbuckle M R. Metabolism and memory: obesity, diabetes, and dementia[J]. Biol Psychiatry, 2017, 82(11): e81-e83. doi:10.1016/j.biopsych.2017.09.025 |
| [2] |
Kim G, Lee Y H, Yun M R, et al. Effects of lobeglitazone, a novel thiazolidinedione, on adipose tissue remodeling and brown and beige adipose tissue development in db/db mice[J]. Inter J Obes, 2018, 42: 542-51. doi:10.1038/ijo.2017.222 |
| [3] |
屠梦珏, 魏进歌, 陈鑫, 等. 二氢杨梅素对APAP诱导小鼠急性肝损伤的保护作用[J]. 中国药理学通报, 2018, 34(12): 84-9. Tu M J, Wei J G, Chen X, et al. Effect of dihydromyricetin on acetaminophen induced liver injury in mice[J]. Chin Pharmacol Bull, 2018, 34(12): 84-9. |
| [4] |
Shi L, Zhang T, Liang X, et al. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol, 2015, 409(C): 92-102. |
| [5] |
Liu L, Wan J, Lang H, et al. Dihydromyricetin delays the onset of hyperglycemia and ameliorates insulin resistance without excessive weight gain in Zucker diabetic fatty rats[J]. Mol Cell Endocrinol, 2017, 439: 105-15. doi:10.1016/j.mce.2016.10.028 |
| [6] |
Zhao Y, Wang L, Xue B, et al. Associations between general and central obesity and hypertension among children: The childhood obesity study in china mega-cities[J]. Sci Rep, 2017, 7(1): 16895. |
| [7] |
Walker E, Wolfe B M. Editorial comment: Obesity in America[J]. Surg Obes Relat Dis, 2017, 13(10): 1650-1. doi:10.1016/j.soard.2017.08.011 |
| [8] |
Carpaij O A, Maarten V D B. The asthma-obesity relationship[J]. Curr Opin Pulmon Med, 2018, 24(1): 42-9. doi:10.1097/MCP.0000000000000446 |
| [9] |
Ten Hoor G A, Kok G, Peters G J Y, et al. The psychological effects of strength exercises in people who are overweight or obese: A systematic review[J]. Sports Med, 2017, 47: 2069-81. doi:10.1007/s40279-017-0748-5 |
| [10] |
Levitsky A, Brismar K, Hafstr M I, et al. Obesity is a strong predictor of worse clinical outcomes and treatment responses in early rheumatoid arthritis: results from the SWEFOT trial[J]. RMD Open, 2017, 3(2): e000458. doi:10.1136/rmdopen-2017-000458 |
| [11] |
Shabalina I, Petrovic N, De Jong J A, et al. UCP1 in brite/beige adipose tissue mitochondria is functionally thermogenic[J]. Cell Rep, 2013, 5(5): 1196-203. doi:10.1016/j.celrep.2013.10.044 |
| [12] |
祝晓庆, 杨洁, 邵娟, 等. 复方总黄酮对ApoE-/-基因敲除小鼠动脉粥样硬化的影响[J]. 中国药理学通报, 2017, 33(2): 180-4. Zhu X Q, Yang J, Shao J, et al. Effect of compound flavonoids on atherosclerosis in ApoE-/- mice[J]. Chin Pharmacol Bull, 2017, 33(2): 180-4. doi:10.3969/j.issn.1001-1978.2017.02.008 |
| [13] |
朱景平, 卫欣妤, 许晓乐. 二氢杨梅素对高脂喂养ApoE(-/-)小鼠体内胆固醇逆向转运的影响[J]. 中国药理学通报, 2018(11): 1610-6. Zhu J P, Wei X Y, Xu X L. Effect of dihydromyricetin on reverse cholesterol transport in high-fat feeding ApoE-/- mice[J]. Chin Pharmacol Bull, 2018(11): 1610-6. doi:10.3969/j.issn.1001-1978.2018.11.026 |