

2. 中国科学技术大学附属第一医院(安徽省立医院)药剂科,安徽 合肥 230001
唐丽琴(1972-),女,博士,主任药师,教授,博士生导师,研究方向:内分泌与代谢药理学,通讯作者,Email:tangliqin@ustc.edu.cn
2. Dept of Pharmacy, Anhui Provincial Hospital, the First Affiliated Hospital of University of Science and Technology of China, Hefei 230001, China
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的微血管并发症,也是糖尿病患者死亡的主要原因之一[1]。DN的发病机制十分复杂,主要为糖脂代谢紊乱、炎症介质释放、氧化应激、细胞凋亡等多种因素的共同作用,引起肾小球滤过屏障的破坏、肾小管炎性细胞浸润、肾小球硬化、小管间质纤维化等,最终促进疾病的发展与转化[2-3]。众多病理改变中,肾小球滤过屏障的损伤可显著性的影响肾小球的滤过功能,进而引起蛋白尿与肾脏功能损伤,促进糖尿病肾病的进一步发展。研究发现,肾小球足细胞是一种高度分化的上皮细胞,在肾小球滤过膜中,足细胞是维持整个肾小球滤过膜正常通透性的主要成分,足细胞结构的完整性和数量维持一定的比率,是保证肾小球滤过膜功能正常运行的基础,足细胞的损伤和凋亡会引起蛋白尿并最终导致肾功能损害,是触发和加速糖尿病肾病的关键因素之一[4]。因此,干预肾小球足细胞凋亡有利于延缓和治疗糖尿病肾病。
小檗碱(berberine,BBR)是从黄连中提取的一种异喹啉生物碱单体,对多种疾病如高脂血症、高血压、炎症、腹泻和肿瘤等均有一定的调节作用,多种证据表明,小檗碱在治疗糖尿病及其并发症如糖尿病肾病方面具有巨大的治疗潜力[5-7]。
高糖环境能够对肾小球滤过膜产生直接和间接的损伤,其中,高糖对肾小球足细胞的影响表现在足细胞数量减少、黏附能力下降、足突消失以及屏障功能减弱,导致蛋白尿发生,最终出现肾小球硬化、肾功能进行性丧失等[8-10]。本实验通过体外高糖培养肾小球足细胞,研究不同浓度高糖在不同时间对足细胞凋亡的诱导与促进作用,为临床干预足细胞凋亡提供参考; 研究小檗碱对高糖诱导足细胞凋亡的调节作用,并探讨相关凋亡通路的变化,为足细胞损伤和糖尿病肾病的药物治疗提供重要的理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠肾小球足细胞,北纳生物,货号:337685;小檗碱,纯度≥95.0%,由安徽省立医院药剂科药学实验室提供。
1.1.2 试剂CCK-8细胞活力试剂盒,贝博生物,货号:BB4202;小鼠重组γ干扰素,MedChemExpress公司,批号:33158;Annexin V-FITC/PI双染试剂盒,诺唯赞生物,货号:A211-02;RPMI 1640培养基,Hyclone公司,货号:SH30809.01;Hoechst细胞凋亡染色试剂盒,碧云天生物,货号:C0003;GAPDH、caspase-3、caspase-6、caspase-7、caspase-8、caspase-9、Bcl-2单克隆抗体,Cell Signaling Technology,货号:5174、9662、9762、9492、9746、9508、15071;BCA试剂盒,碧云天生物,货号:P0010S;胎牛血清,四季青生物,货号:11011-8611;辣根过氧化物酶标记的山羊抗鼠二抗和辣根过氧化物酶标记的山羊抗兔二抗,Proteintech公司,货号:SA00001-1,SA00001-2。
1.1.3 仪器CO2培养箱(Heal Force公司); 酶标仪(Molecular Devices公司); 流式细胞仪(Beckman Coulter公司); 凝胶成像系统(Peiqing公司); 荧光显微镜(Leica公司),激光共聚焦显微镜(Leica公司)。
1.2 方法 1.2.1 细胞培养用(含10%胎牛血清,1%青霉素和链霉素)RPMI 1640培养基于33 ℃,5% CO2培养箱中培养细胞,并加入0.2%小鼠重组γ干扰素(IFN-γ)。当细胞生长至70%~80%时,将细胞转移至37 ℃,5% CO2培养箱(培养基中无IFN-γ)诱导分化1~2周。随后,将分化的足细胞用于实验。
1.2.2 高糖诱导足细胞凋亡将足细胞消化处理计数后接种6孔板,用5.5、10、15、20、25、30 mmol·L-1浓度的高糖培养基培养,均于12、24、36、48、60、72 h后在显微镜下观察各组足细胞的形态。
1.2.3 CCK-8检测足细胞活力取对数生长期细胞,计数后加入细胞悬液于96孔板中,置37 ℃,5% CO2培养箱过夜。每组依次加入3.75、7.5、15、30、45、60、75、90 μmol·L-1高糖培养基(30 mmol·L-1葡萄糖)配制的小檗碱溶液,并设置空白对照(未加入细胞)和正常对照(5.5 mmol·L-1葡萄糖)和模型对照组(30 mmol·L-1葡萄糖),于37 ℃孵育24 h,每孔加入CCK-8溶液10μL,于37 ℃孵育1h,用酶标仪测定各孔450 nm处的吸光值,并计算细胞活力值。
1.2.4 Hoechst染色观察足细胞凋亡取对数生长期的细胞,计数后加入细胞悬液于6孔板中。设置5组:正常组,高糖组,BBR(30、45、60 μmol·L-1)组,置37 ℃,5% CO2培养箱过夜。每组依次加入培养基和BBR溶液,37 ℃孵育24 h后,每孔加入0.5 mL的细胞固定液固定20 min,PBS洗涤2次,吸干液体后加入Hoechst染液避光孵育5 min,PBS再次洗涤后于荧光显微镜下观察细胞核的颜色变化。
1.2.5 Annexin V-FITC/PI双染检测足细胞的凋亡取对数生长期足细胞,用0.25%胰酶消化后,计数后加入细胞悬液于6孔板,24 h后加入不同浓度的BBR溶液,培养24 h后,用0.25%(不含EDTA)胰酶消化细胞,与培养液共收集后,400 g离心5 min,重悬,再离心。每个样品掺入5 μL FITC和5 μL PI染色溶液并在黑暗中温育10 min,同时建立单染色对照和单染色FITC和PI,流式仪测定每组足细胞的凋亡率。
1.2.6 激光共聚焦显微镜检测caspase-3蛋白的表达将细胞在24孔板中培养。用4%多聚甲醛处理细胞30 min并用PBS洗涤3次。然后用3%的BSA封闭30 min,并在4 ℃下与caspase-3一抗(1 :500)孵育过夜。PBS洗涤2次,与二抗(1 :200)在37 ℃下孵育2 h,然后DAPI染色10 min,PBS洗涤3次,在激光共聚焦显微镜下观察。
1.2.7 Western blot检测相关蛋白的表达收集加药24 h后的细胞,RIPA裂解液提取细胞总蛋白,经BCA法进行蛋白定量后,通过SDS-PAGE凝胶电泳对蛋白样品进行分离,并将SDS-PAGE凝胶上的蛋白质转移至聚偏二氟乙烯(PVDF)膜上。在5%脱脂牛奶中封闭2 h后,将PVDF膜置于以下一抗(1 :1 000)中并在4 ℃孵育过夜,然后将PVDF膜洗涤3次后在二抗(1 :5 000)中孵育2 h。TBST洗涤3次后,使用发光试剂进行显色,通过Imagine J对条带进行灰度分析。
1.3 统计学方法实验结果采用x±s表示,单因素方差分析(one-way ANOVA)进行组间比较,采用SPSS 23.0统计软件处理结果。
2 结果 2.1 高糖对足细胞凋亡的影响Fig 1结果显示,与正常组相比,在相同高糖诱导时间下,高糖浓度不同,足细胞的凋亡率不同。高糖(10、15、20、25、30 mmol·L-1)组在12 h未观察到细胞凋亡; 在24 h时,高糖(15、20、25 mmol·L-1)组仍未见凋亡,高糖(30 mmol·L-1)组有少量细胞凋亡; 在36 h时可观察到高糖(10、15、20 mmol·L-1)组未见凋亡细胞,高糖(25、30 mmol·L-1)组出现凋亡细胞,且高糖(30 mmol·L-1)组凋亡细胞增多; 在48 h时可观察到高糖(20 mmol·L-1)组出现凋亡细胞,高糖(25、30 mmol·L-1)组细胞凋亡数量增加。在60 h时,高糖(20、25、30 mmol·L-1)组凋亡细胞增多,在72 h时,高糖(10 mmol·L-1)并未引起凋亡,高糖(15 mmol·L-1)出现少量凋亡细胞。

|
| Fig 1 Effect of different concentrations of high glucose on podocyte apoptosis at different time points |
Fig 2的CCK-8结果表明,高糖组细胞活力值较正常组明显降低(P<0.01);与高糖组相比,BBR(30、45、60、75、90 μmol·L-1)组均具有显著性差异,表明BBR可增强足细胞的活力,且呈浓度相关性(P<0.05,P<0.01)。但BBR(75、90 μmol·L-1)组活力较BBR(45、60 μmol·L-1)组减弱,可能与BBR浓度过高产生药物毒性有关。

|
| Fig 2 Effect of BBR for 24 h on podocyte viability induced by high glucose (x±s, n=3) ##P < 0.01 vs normal control group; *P < 0.05, **P < 0.01 vs high glucose group. |
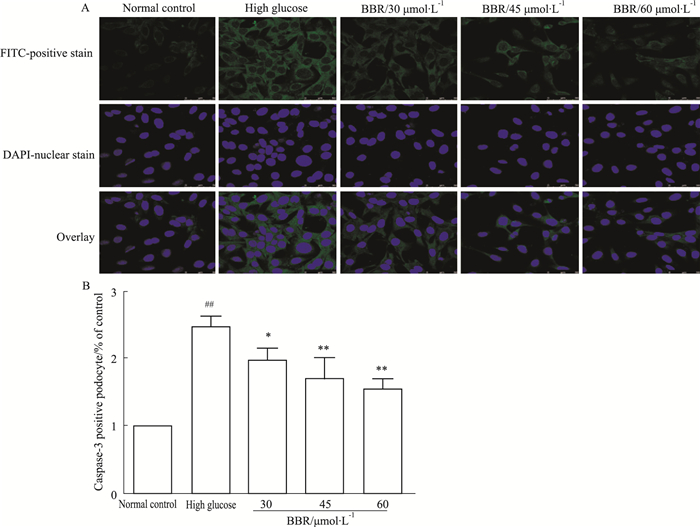
Hoechst染色结果表明,高糖组细胞核较正常组呈致密浓染,且透亮; 与高糖组相比,BBR(30、45、60 μmol·L-1)组细胞核浓染减弱且细胞核透亮程度降低(Fig 3)。Fig 4的Annexin V-FITC/PI双染结果表明,与高糖组相比,BBR(30、45、60 μmol·L-1)组细胞的凋亡率减少(P<0.01)。Fig 5的激光共聚焦显微镜结果显示,与高糖组相比,BBR(30、45、60 μmol·L-1)组caspase-3蛋白表达明显减少(P<0.05,P<0.01)。

|
| Fig 3 Effect of BBR on podocyte apoptosis induced by high glucose Hoechst staining was used to detect the effect of high glucose on podocyte apoptosis. |

|
| Fig 4 Effect of BBR on podocyte apoptosis induced by high glucose (x±s, n=3) A: Podocyte apoptosis examined using Annexin V-FITC/PI double staining assay; B: Quantitative analysis showed the percentage of the apoptotic podocytes relative to different groups. ##P < 0.01 vs normal control group; **P < 0.01 vs high glucose group. |
|
| Fig 5 Effect of BBR on expression of caspase-3 (x±s, n=3) A: The positive expression of caspase-3 was detected by laser scanning confocal microscope; B: Quantitative analysis showed the positive expression of caspase-3 relative to different groups. ##P < 0.01 vs normal control group; *P < 0. 05, **P < 0.01 vs high glucose group. |
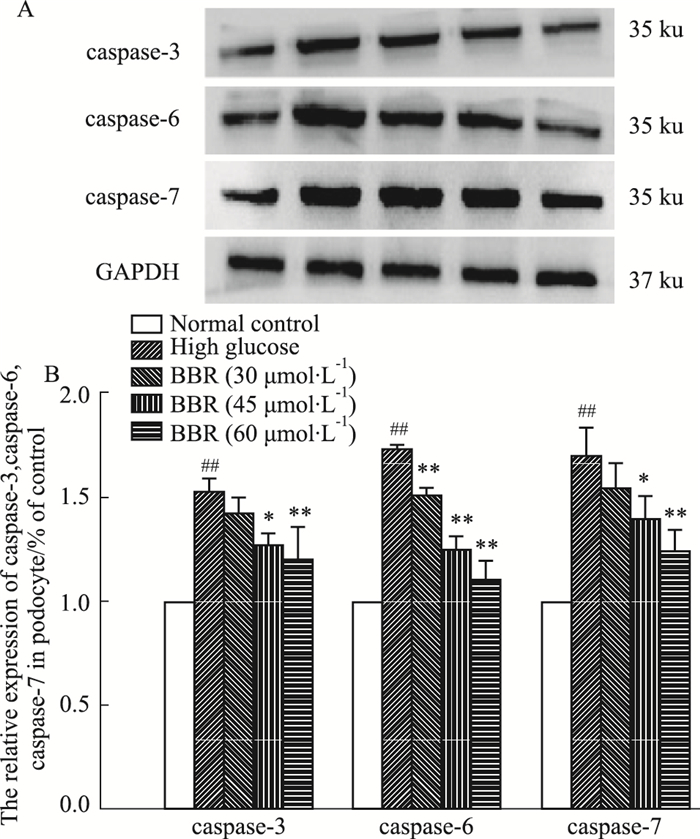
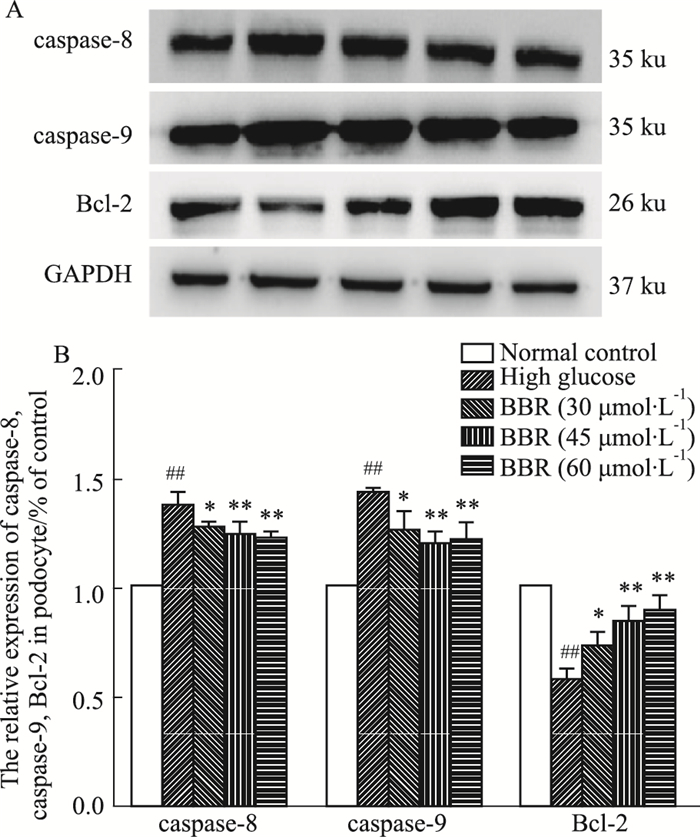
Fig 6和Fig 7的Western blot结果显示,高糖组caspase-3、6、7、8、9蛋白表达较正常组明显增加,Bcl-2表达减少(P<0.05,P<0.01);与高糖组相比,BBR(30、45、60 μmol·L-1)组能不同程度降低caspase-3、6、7、8、9蛋白的表达,减少Bcl-2蛋白的表达(P<0.05,P<0.01)。
|
| Fig 6 Effect of BBR on expression of caspase-3, 6 and 7 (x±s, n=3) ##P < 0.01 vs normal control group; *P < 0.05, **P < 0.01 vs high glucose group. |
|
| Fig 7 Effect of BBR on expression of caspase-8, 9 and Bcl-2 (x±s, n=3) ##P < 0.01 vs normal control group; *P < 0.05, **P < 0.01 vs high glucose group. |
糖尿病肾病是糖尿病的并发症之一,足细胞损伤和凋亡加速并触发了糖尿病肾病。研究证明糖尿病肾病终末期肾小球损伤从足细胞损伤凋亡开始,致使肾小管基底膜增厚,肾小管上皮细胞萎缩,引起肾衰竭[11]。因此,干预足细胞的凋亡能够有效减少肾衰竭。研究表明,高血糖是引起足细胞和内皮细胞损伤的因素之一,可引发多种疾病,如2型糖尿病等。控制血糖,调节细胞的增殖和凋亡对足细胞损伤,减缓肾脏衰竭具有意义[12]。本研究通过体外用高糖对足细胞刺激,发现足细胞凋亡率受高糖浓度影响明显,10 mmol·L-1的高糖不能诱导足细胞凋亡,高糖浓度超过15 mmol·L-1时,足细胞开始出现凋亡趋势,增殖缓慢,且这种凋亡比率随时间的推移而增加。这种现象在一定程度上可反映糖尿病肾病中的足细胞凋亡是一个缓慢进展性过程,为临床干预足细胞凋亡提供参考价值。BBR是从黄连中提取的天然化合物,对各种慢性疾病具有多种治疗活性,具有良好的降糖效果,课题组前期研究已经发现BBR对肾脏的保护作用较为明显。实验结果表明,BBR (30、45、60 μmol·L-1)明显增加了高糖诱导的足细胞活力。为了验证BBR对足细胞凋亡现象的改善作用,我们用Hoechst染色,Annexin V-FITC/PI双染和激光共聚焦显微镜检测BBR对高糖诱导的足细胞凋亡的影响,结果表明,BBR能不同程度地降低高糖诱导的足细胞凋亡,对足细胞起保护作用。
细胞凋亡的两种主要方式,一是大量细胞内信号包括缺氧、低血糖、氧化应激以及细胞生长微环境的改变可引起前凋亡蛋白活化及抗凋亡蛋白抑制的线粒体内部途径,二是外部途径利用细胞间的死亡配基去活化死亡受体,引起caspase相关蛋白激活的外部途径[13-15]。研究表明,高糖作用下,细胞内环境发生变化,细胞间的死亡配基去活化,通过死亡受体发出凋亡信号活化caspase-8,引起caspase-3、6、7的酶联激活反应,可直接降解胞内的结构和功能蛋白,引起凋亡。此外,高糖抑制了抗凋亡蛋白Bcl-2的表达,诱导线粒体释放细胞色素C,并活化caspase-9,促进caspase-3、6、7的表达,加速细胞进入凋亡程序。BBR作用下,由高糖加速凋亡的两种途径受到明显抑制,结果表明,BBR可能通过影响外部途径caspase-8/caspase-3和线粒体内部途径Bcl-2/caspase-9 /caspase-3减少足细胞的凋亡。但caspase凋亡机制错综复杂,我们尚未证明,BBR能够直接作用外部途径和线粒体内部途径对高糖诱导的足细胞凋亡起保护作用。因此,后续的实验我们会通过加入caspase-8和Bcl-2特异性抑制剂,同时对caspase-8和Bcl-2分别进行小分子RNA干扰,从蛋白和基因水平上研究BBR对高糖诱导的足细胞凋亡的作用机制。
综上所述,本研究揭示了不同高糖环境能在不同时间诱发足细胞凋亡,BBR能缓解高糖诱发的足细胞凋亡,其作用机制可能与caspase-8/caspase-3和Bcl-2/caspase-9 /caspase-3凋亡途径相关,为临床进行足细胞凋亡与肾脏损伤干预提供重要的时间参考,为治疗糖尿病肾病提供了重要依据。但其具体机制还有待进一步的研究。
( 致谢: 本实验完成于中国科学技术大学附属第一医院药剂科药物基因检测实验室,实验过程中得到实验室全体老师和同学的帮助。)
| [1] |
Kanwar Y S, Sun L, Xie P, et al. A glimpse of various pathogenetic mechanisms of diabeticNephropathy[J]. Ann Review Pathol, 2011, 6(1): 395-423. |
| [2] |
Liang S, Cai GY. Clinical and pathological factors associated with progression of diabeticnephropathy[J]. Nephrology, 2017, 22(4): 14-19. |
| [3] |
Mizuno T, Hayashi T, Kato R, et al. Risk factors for an early dialysis start in patients with diabetic nephropathy end-stage renal disease[J]. Therap Clin Risk Manag, 2014, 10: 73-76. |
| [4] |
Gassler N, Elger M, Kränzlin B, et al. Podocyte injury underlies the progression of focal segmental glomerulosclerosis in the fa/fa Zucker rat[J]. Kidney intern, 2001, 60(1): 106-16. doi:10.1046/j.1523-1755.2001.00777.x |
| [5] |
Ni WJ, Tang LQ, Zhou H, et al. Renoprotective effect of berberine via regulating the PGE2 -EP1-Gαq-Ca(2+) signalling pathway in glomerular mesangial cells of diabetic rats[J]. J Cell Mol Med, 2016, 20(8): 1491-502. doi:10.1111/jcmm.12837 |
| [6] |
Zan Y, Kuai CX, Qiu ZX. Berberine ameliorates diabetic neuropathy: TRPV1 modulation by PKC pathway[J]. Am J Chin Med, 2017, 45(8): 1709-23. doi:10.1142/S0192415X17500926 |
| [7] |
张旭, 朱元美, 郑书国, 等. 丹酚酸B对糖尿病大鼠肾纤维化的改善作用及其机制[J]. 中国药理学通报, 2019, 35(1): 51-5. Zhang X, Zhu Y M, Zheng S G, et al. Ameliorative effect of salvianolic acid B on renal fibrosis in diabetic rats and potential mechanisms implicated[J]. Chin Pharmacol Bull, 2019, 35(1): 51-5. doi:10.3969/j.issn.1001-1978.2019.01.012 |
| [8] |
Yang H, Zhao B, Liao C, et al. High glucose-induced apoptosis in cultured podocytes involves TRPC6-dependent calcium entry via the RhoA/ROCK pathway[J]. Biochem Biophys Res commun, 2013, 434(2): 394-400. doi:10.1016/j.bbrc.2013.03.087 |
| [9] |
Miyauchi M, Toyoda M, Kobayashi K, et al. Hypertrophy and loss of podocytes in diabetic nephropathy[J]. Intern Med, 2009, 48(18): 1615-20. doi:10.2169/internalmedicine.48.2137 |
| [10] |
王盈盈, 刘青, 唐丽琴, 等. 小檗碱对高糖诱导足细胞功能及相关蛋白表达的影响[J]. 中国药理学通报, 2018, 34(8): 1158-63. Wang Y Y, Liu Q, Tang L Q, et al. Effect of berberine on high glucose induced podocyte functions and related protein expression[J]. Chin Pharmacol Bull, 2018, 34(8): 1158-63. doi:10.3969/j.issn.1001-1978.2018.08.024 |
| [11] |
Chen Y, Lin L, Tao X, et al. The role of podocyte damage in the etiology of ischemia-reperfusion acute kidney injury and post-injury fibrosis[J]. BMC nephrology, 2019, 20(1): 106. doi:10.1186/s12882-019-1298-x |
| [12] |
Zhao X, Liu G, Shen H, et al. Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J]. Int J Mol Med, 2015, 35(3): 684-92. doi:10.3892/ijmm.2014.2052 |
| [13] |
李帅, 张炳东. 细胞凋亡途径的研究进展[J]. 山东医药, 2017, 57(37): 103-6. Li S, Zhang B D. Research progress of apoptosis pathway[J]. Shandong Med, 2017, 57(37): 103-6. doi:10.3969/j.issn.1002-266X.2017.37.036 |
| [14] |
Shin M, Lee BM, Kim O, et al. Triterpenoids from Ziziphus jujuba induce apoptotic cell death in human cancer cells through mitochondrial reactive oxygen species production[J]. Food Funct, 2018, 9(7): 3895-905. doi:10.1039/C8FO00526E |
| [15] |
杨涛, 费振海, 钟兴明. Caspase家族与细胞凋亡的研究进展[J]. 浙江医学, 2018, 40(18): 2083-7. Yang T, Fei Z H, Zhong X M. Research progress of Caspase family and apoptosis[J]. Zhejiang Med, 2018, 40(18): 2083-7. doi:10.12056/j.issn.1006-2785.2018.40.18.2017-950 |

