


2. 甘肃省高校重大疾病分子医学与中医药防治研究重点实验室, 甘肃 兰州 730000;
3. 甘肃中医药大学中西医结合研究所,甘肃 兰州 730000;
4. 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000
2. Provincial Key Lab of Molecular Medicine and Prevention and Treatment of Major Diseases with Traditional Chinese Medicine in Gansu Colleges and Universities, Lanzhou 730000, China;
3. Institute of Integrative Traditional Chinese and Western Medicine, Gansu University of Chinese Medicine, Lanzhou 730000, China;
4. Gansu Provincial Lab of Chinese Medicine Pharmacology and Toxicology, Lanzhou 730000, China
近年来研究提示,细胞存活能力基于消除压力条件的能力,此种过程涉及自噬和细胞凋亡的调节及相互整合[1]。肿瘤细胞可通过自噬作用抵抗由于过度增殖造成的营养缺乏和缺氧,以维持生存[2]。黄芪多糖(astragalus polysaccharides,APS)是黄芪(astragalus membranaceus,AM)干燥根主要的活性成分之一,在肺癌的治疗中应用广泛[3]。自噬与肺癌发生和治疗的关系是近年来的研究热点,因此,本实验采用20 U·L-1黄嘌呤氧化酶(xanthine oxidase,XOD)作用于人肺癌A549细胞24 h诱导自噬发生[4],前期预实验利用透射电镜与Western blot验证自噬模型,结果提示XOD可成功诱导人肺癌A549细胞发生自噬;模型成功后通过药物干预,观察并检测APS对人肺癌A549细胞自噬模型增殖、自噬小体形态及自噬相关分子表达的影响。
1 材料 1.1 细胞株人肺癌A549细胞株购买于中国科学院上海细胞库,保存于甘肃中医药大学科研实验中心超低温冰箱。
1.2 试剂黄嘌呤氧化酶(xanthine oxidase,XOD),购自Sigma公司;APS(纯度>90%),购自中国上海源叶生物科技公司;3-甲基腺嘌呤(3-methyladenine,3-MA)(纯度>99%),购自APExBIO公司;胎牛血清(fetal bovine serum,FBS),购自中国杭州四季青公司;DMEM高糖培养基,购自Hyclone公司;0.25%胰蛋白酶、青霉素链霉素混合液,购自gibco公司;Gluta固定液(电镜专用,2.5%),购自Solarbio公司;细胞计数(cell counting kit-8,CCK-8)试剂盒,购自中国上海翊圣公司;蛋白提取试剂盒和SDS-PAGE凝胶快速制备试剂盒,均购自Solarbio公司;微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3 alpha,LC3A/B)抗体、蛋白激酶B(protein kinase B,PKB/AKT)、抗体死骨片1(Seques-tosome 1,SQSTM1/p62)抗体、3-磷酸肌醇激酶(phosphoinosi-tide 3-kinase,PI3K)多克隆抗体,均购自Gene Tex公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体,购自Immunoway公司;山羊抗兔IgG二抗,购自Abcam公司。
1.3 仪器超净工作台(苏洁净化公司,SW-CJ-1D);二氧化碳培养箱(日本三洋电机公司,MCO-18AIC);酶标仪(美国BIO-RAD公司,IMARK);全自动细胞荧光计数分析仪(美国CELLOM ETER公司,AUTO X4);倒置相差显微镜(日本OLYMPUS公司,IX81);凝胶成像分析系统(美国BIO-RAD公司,Chemi Doc);-80 ℃超低温冰箱(Thermo公司,900 SERIES);透射电子显微镜(Transmission electron microscope,TEM,日本电子株式会社,JEM-2100F)。
2 方法 2.1 A549细胞培养取肺癌A549细胞株1支,移至37 ℃恒温水浴锅中迅速解冻复苏,移液枪移至5 mL培养体系的培养瓶中,将提前配好的完全培养基加至5 mL,并加入50 μL青霉素链霉素混合液,置于5% CO2、37 ℃饱和湿度孵箱中培养,于次日PBS轻柔洗涤并换液1次,待细胞完全贴壁后可2~3 d换液1次,融合度达80%后,0.25%胰蛋白酶1 mL进行消化传代,取第3代细胞用于实验。
2.2 肺癌A549细胞自噬模型的建立及分组实验采用5 mL培养体系培养瓶进行细胞培养,分为空白组、模型组、(100、200、400) mg·L-1APS处理组、2 mmol·L-1 3-MA处理组,每组设3个平行样本。给药干预前,除空白组外,其余5组使用20 U·L-1XOD干预24h,建立自噬模型,前期预实验观察自噬体形态和检测自噬标志蛋白LC3B、p62水平,结果提示XOD可成功诱导肺癌A549细胞发生自噬。按照实验分组,造模成功后,模型组给予完全培养基培养24 h,其余4组分别加入相应浓度的药物处理24h。采用倒置相差显微镜观察各组细胞形态,收集细胞进行指标的检测。
2.3 CCK-8检测各组细胞生长曲线收集对数期各组细胞,移液枪吹打均匀制成细胞悬液,调节细胞浓度至2×107·L-1,将其接种于96孔板,每孔接种100 μL细胞悬液,设6个复孔,在接种有细胞孔的外围加入100 μL PBS以排除干扰;待测前1~2 h加入10 μL CCK-8溶液,于酶标仪分别检测接种后第6、12、24、48、72 h 450 nm波长处的OD值,每组检测3次。
2.4 透射电镜观察自噬小体的形态各处理组A549细胞培养48小时后,PBS冲洗3次,胰蛋白酶消化细胞1 min左右,倒置显微镜下观察细胞变圆、变亮及间隙增大,立即加入500 μL完全培养基终止消化,轻轻吹打直至细胞全部脱落,将细胞悬液移至1.5 mL子弹头离心管封口离心,细胞离心至管底,吸出废液,加入1 mL PBS连续离心2次,管底细胞团至米粒样大小,弃掉上清,加入200 μL体积分数为0.025的戊二醛,4 ℃冰箱过夜固定细胞,PBS洗涤3次,用4 ℃预冷的体积分数为0.01锇酸固定2 h,PBS洗涤3次,体积分数为0.5、0.7、0.8、0.9、1乙醇及体积分数为1的丙酮梯度脱水,环氧树脂浸透、包埋,超薄切片机切片,厚约50~70 nm,醋酸双氧铀-柠檬酸铅双重染色,制片成功后,透射电镜观察并拍照。
2.5 Western blot检测肺癌A549细胞LC3B、p62、PI3K、AKT等蛋白的表达收集各组细胞,提取细胞蛋白并定量。各组样品恢复至室温后上样,经0.05、0.12 SDS-PAGE分离,转膜,封闭后,分别与一抗LC3A/B(1 :150)、p62(1 :1 000)、PI3K(1 :1 000)、AKT(1 :1 000)及GAPDH(1 :5 000)蛋白相结合,室温摇床过夜;次日PBST侵洗后分别与山羊抗IgG二抗(1 :5 000)结合,室温轻摇1 h;HRP-ECL发光显色后,凝胶成像系统曝光检测。采用Quantity One 4.6.2软件对图像进行灰度值分析,以GAPDH作内参,蛋白相对表达量为目的蛋白条带与内参GAPDH条带的比值,每组测3组数据。
2.6 统计学分析计量资料以x±s表示。实验数据的统计采用SPSS22.0统计软件,采用单因素方差分析(One-way ANOVA)比较,组间差异采用q检验。
3 结果 3.1 黄芪多糖对肺癌A549细胞增殖活力的影响如Fig 1所示,与空白组比较,模型组、APS (200、400) mg·L-1干预组及3-MA组在第12~48 h,细胞活力显著性降低,100 mg·L-1APS干预组在第12~48 h,细胞活力增强(P<0.05);与模型组比较,APS (200、400) mg·L-1干预组与3-MA组在第12~48h,细胞活力降低(P<0.05);与3-MA比较,APS (200、400) mg·L-1干预组对肺癌A549细胞活力抑制能力更接近;且APS各干预组在第24 h出现作用峰值。
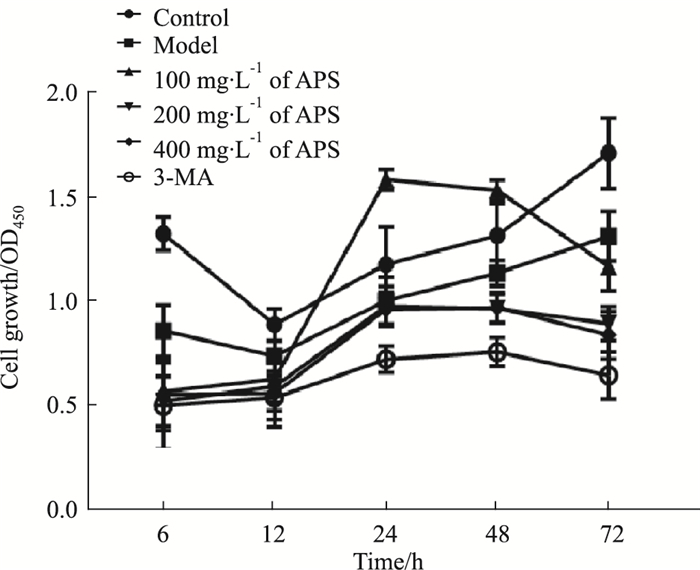
|
| Fig 1 Effect of APS on proliferation of A549 cells in a XOD-induced autophagy model (x±s, n=6) |
如Fig 2、3所示。TEM结果提示,空白组肺癌A549细胞内可观察到线粒体、内质网基本形态及脂肪滴。与空白组比较,经XOD处理后的模型组,细胞内可见双层膜自噬小体、脂滴及自噬泡,LC3B蛋白表达显著性增高,p62蛋白表达降低(P<0.05)。与模型组比较,100 mg·L-1APS干预组细胞内仍可见双层膜自噬小体及其吞噬的内容物,LC3B蛋白表达显著性降低,p62蛋白表达增高(P<0.05);与模型组比较,APS (200、400)mg·L-1干预组细胞内几乎观察不到自噬小体,3-MA组细胞内偶见自噬小体,LC3B蛋白表达显著性降低,p62蛋白表达增高(P<0.05)。
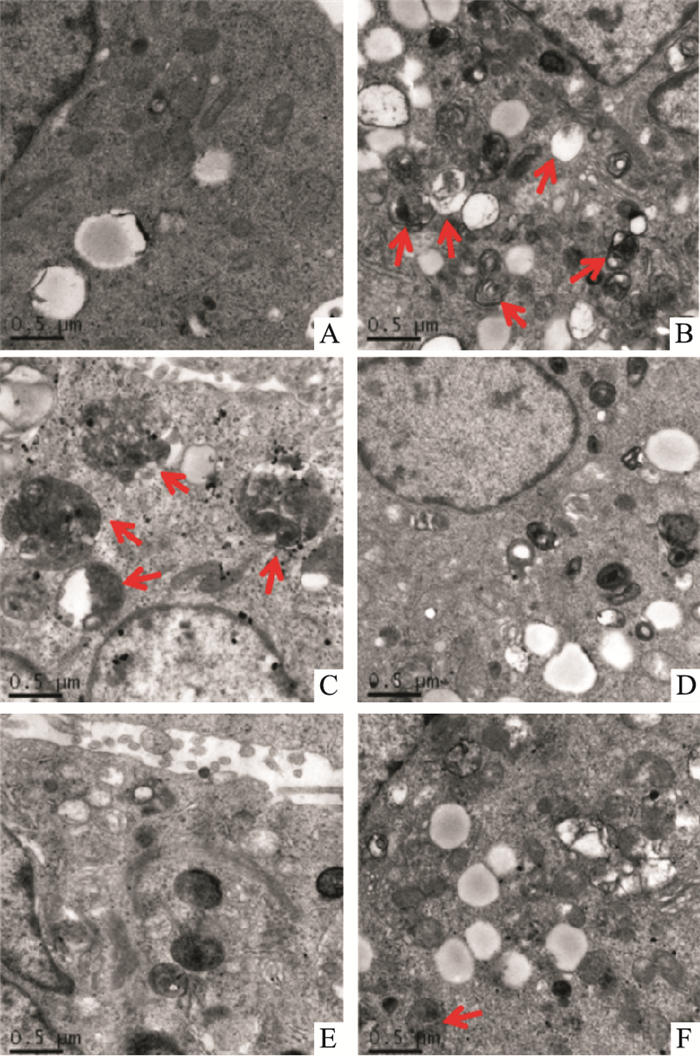
|
| Fig 2 Ultrastructure of autophagosomes in A549 cells of each group(×25 000, bar=0.5 μm) A:Control group; B:Model group; C:100 mg·L-1 of APS-treated group; D:200 mg·L-1 of APS-treated group; E:400 mg·L-1 of APS-treated group; F:2 mmol·L-1 of 3-MA treated group. |
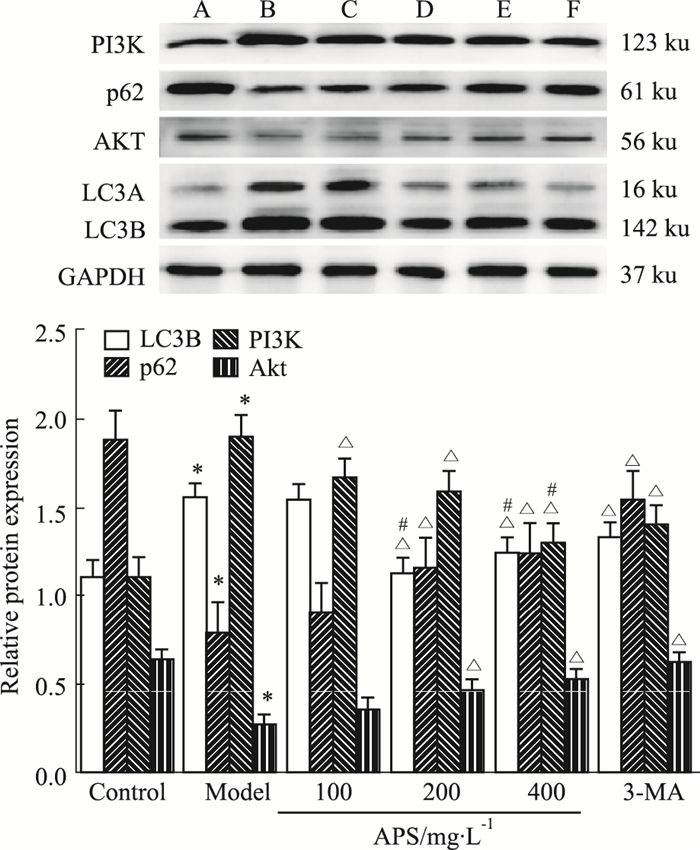
|
| Fig 3 Expression of autophagy markers LC3A/B, p62, AKT and PI3Kin each group(x±s, n=6) A:Control group; B:Model group; C:100 mg·L-1 of APS-treated group; D:200 mg·L-1 of APS-treated group; E:400 mg·L-1 of APS-treated group; F:2 mmol·L-1 of 3-MAtreated group. *P < 0.05 vs control group; △P < 0.05 vs model group; #P < 0.05 vs 3-MA-treated group. |
如Fig 3所示。与空白组比较,模型组LC3B及PI3K蛋白表达增高,p62及AKT降低(P<0.05)。与模型组比较,200、400 mg·L-1APS组及3-MA组LC3B、PI3K蛋白表达下降,p62及AKT蛋白增高(P<0.05)。与3-MA组比较,200 mg·L-1APS组LC3B蛋白表达下降,400 mg·L-1APS组PI3K蛋白下降(P<0.05)。
4 讨论真核生物在进化过程中,保留自噬用于细胞内物质的更新,特别是PI3K/AKT信号通路与大多数生理过程相关,包括细胞代谢、增殖等。在肿瘤中,自噬对细胞具有保护和细胞毒性双重作用,一方面通过自噬作用维持基因组完整性和防止肿瘤细胞增殖,与免疫监视作用相结合防止肿瘤发生;另一方面在已发生的实体瘤中,肿瘤细胞外环境缺氧和营养缺乏影响其自身生存,迫于生存压力,肿瘤细胞可利用自噬机制,获得继续生长的能量及增殖的空间[5]。因此,利用某种药物抑制此过程中的自噬作用,可起到抗肿瘤目的。
自噬是一种细胞内溶酶体参与分解未折叠蛋白或处理变异蛋白、降解胞内受损的细胞器、外源微生物的自我保护机制,形态学上以形成自噬体为特征。LC3定位于自噬泡的内层膜,其表达产物LC3A随着自噬过程被启动,与磷脂酰乙醇胺结合形成膜型LC3B,其含量与自噬发生程度正相关,间接反映自噬体数量,被认为是判定自噬活性的特异性灵敏标志分子[6]。相反当自噬抑制后,p62蛋白开始累积,而当自噬诱导时,p62水平下降,但LC3B的增加与p62的下降并无明显相关[7]。因此,可采用自噬标志性蛋白LC3B与p62及透射电镜观察自噬小体典型形态学特征(即大量双层膜结构)共同监测自噬反应[8-9]。
李蓉[10]、廖双叶[11]研究发现,黄芪多糖可抑制人肺癌A549细胞增殖及促进细胞凋亡。本课题组前期研究也发现[12],APS及联合化疗药物顺铂(cis-diamm inodichloroplatinum Ⅱdichloride,DDP)可能通过调节线粒体凋亡途径相关蛋白抑制小鼠Lewis肺癌移植瘤的生长。细胞凋亡(Ⅰ型细胞程序性死亡)和细胞自噬(Ⅱ型程序性死亡)是细胞程序性死亡的两种主要表现。因此,本研究在前人实验基础上,寻求APS对肺癌A549细胞自噬的影响及其分子机制。实验结果发现,200、400 mg·L-1APS组及自噬抑制剂3-MA组细胞内自噬反应明显减弱,同时细胞活性降低,与蒲泽锦等[13]研究结果一致。TEM结果提示:与空白组比较,经XOD处理24 h后的模型组,细胞可见双层膜自噬小体、脂滴及自噬泡,LC3B蛋白表达增高,p62及AKT显著性降低,PI3K蛋白升高,TEM与Western blot结果共同确定模型组发生较高水平的自噬(P<0.05);与模型组比较,200、400 mg·L-1APS干预组细胞内几乎观察不到自噬小体,LC3B蛋白表达降低,p62及AKT蛋白增高,PI3K蛋白下降,且细胞活性降低(P<0.05),TEM与Western blot共同提示200、400 mg·L-1APS可降低A549细胞自噬水平;与3-MA组比较,200 mg·L-1APS组LC3B蛋白表达下降,400 mg·L-1APS浓度组PI3K蛋白下降(P<0.05),这表明APS对PI3K蛋白表达的抑制优于3-MA。上述结果表明APS可抑制肺癌A549细胞的自噬程度,可能与调节LC3B、PI3K及AKT蛋白表达有关,使用PI3K抑制剂3-MA可以阻断LC3的表达,APS具有相同趋势[14]。通过降低PI3K蛋白表达阻断自噬泡和溶酶体的融合,降低LC3B蛋白表达而抑制自噬小体双层膜的形成,从而抑制自噬程度[15]。APS可增高AKT蛋白的表达,可能与PI3K蛋白表达降低致使其对下游分子AKT蛋白的活化作用减弱有关,使得AKT积累。综上所述。APS可能通过抑制PI3K/AKT信号通路发挥自噬抑制作用。因此,我们推测APS能通过自噬抑制作用,使A549细胞面临快速增殖带来的缺氧和营养缺乏等困境,进而抑制肿瘤细胞的生长。综上所述,本研究发现,APS可能通过抑制肺癌A549细胞自噬而发挥抗肿瘤作用。
| [1] |
Sisinni L, Pietrafesa M, Lepore S, et al. Endoplasmic reticulum stress and unfolded protein response in breast cancer:The balance between apoptosis and autophagy and its role in drug resistance[J]. Int J Mol Sci, 2019, 20(4): 857-73. doi:10.3390/ijms20040857 |
| [2] |
Liang Q P, Xu T Q, Liu B L, et al. Sasanquasaponin ΙΙΙ from Schima crenata Korth induces autophagy through Akt/mTOR/p70S6K pathway and promotes apoptosis in human melanoma A375 cells[J]. Phytomedicine, 2018, 58(2019): 152769-79. |
| [3] |
张莹, 贾英杰, 李小江, 等. 注射用黄芪多糖联合CIK细胞治疗中晚期气虚型非小细胞肺癌的临床观察[J]. 中草药, 2018, 49(7): 1647-51. Zhang Y, Jia Y J, Li X J, et al. Clinical observation on Astragalus Polysaccharide Injection combined with CIK cells treating NSCLC patients with qi deficiency syndrome[J]. Chin Tradit Herb Drugs, 2018, 49(7): 1647-51. |
| [4] |
师腾瑞. XOD诱导人肝细胞系L-02细胞自噬模型的建立及线粒体机制研究[D].第四军医大学, 2016. Shi T R. The mitochondrial mechanism in the autophagy model induced by XOD in human hepatic cell line L-02[D]. The Fourth Military Medical University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-90032-1016778033.htm |
| [5] |
Bishop E. Autophagy modulation: a prudent approach in cancer treatment?[J]. Cancer chemother and pharmacol, 2018, 82(6): 913-22. doi:10.1007/s00280-018-3669-6 |
| [6] |
Schaaf M B, Keulers T G, Vooijs M A. LC3/GABARAP family proteins: autophagy-(un)related functions[J]. FASEB J, 2016, 30(12): 3961-78. doi:10.1096/fj.201600698R |
| [7] |
Şentürk M, Lin G, Zuo Z, et al. Ubiquilins regulate autophagic flux through mTOR signalling and lysosomal acidification[J]. Nat Cell Biol, 2019, 21(3): 384-96. doi:10.1038/s41556-019-0281-x |
| [8] |
Napoletano F, Baron O, Vandenabeele P, et al. Intersections between regulated cell death and autophagy[J]. Trends Cell Biol, 2019, 29(4): 323-38. doi:10.1016/j.tcb.2018.12.007 |
| [9] |
蒲泽锦, 周小涛, 吴灵飞, 等. 腺苷对肝癌细胞自噬和增殖的作用[J]. 中国药理学通报, 2018, 34(4): 508-12. Pu Z J, Zhou X T, Wu L F, et al. Effect of adenosine on autophagy and proliferation of hepatocellular carcinoma cells[J]. Chin Pharmacol Bull, 2018, 34(4): 508-12. doi:10.3969/j.issn.1001-1978.2018.04.014 |
| [10] |
李蓉.黄芪多糖联合顺铂对人肺腺癌A549细胞增殖的抑制作用及对Bax、Bcl-2、Caspase-3的影响[D].南华大学, 2015. Li R. Effect of Astragalus Polysaccharide combined with cispiating on hunman lung cancer A549 cells proliferation inhibition and Bax, Bcl-2 and Caspase-3 effects[D].University of South China, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10555-1015425668.htm |
| [11] |
廖双叶.蜜炙黄芪多糖诱导肿瘤细胞免疫原性死亡的实验研究[D].广东药科大学, 2017. Liao S Y. Experimental study on the immunological death of tumor cells treated with honey-processing astragalus polysaccharides[D].Guangdong Pharmaceutical University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10573-1017734525.htm |
| [12] |
庄梦婕, 刘丹, 明海霞, 等. 黄芪多糖联合顺铂对小鼠Lewis肺癌移植瘤Caspase-3、Smac/Diablo表达的影响[J]. 解剖学报, 2018, 49(01): 63-9. Zhuang M J, Li D, Ming H X, et al. Astragalus polysaccharide inhibiting Lewis lung carcinoma transplanted tumor in mice and influences the expression of Caspase-3 and Smac/Diablo[J]. Acta Anat Sin, 2018, 49(1): 63-9. |
| [13] |
蒲泽锦, 李国平, 詹浩炼, 等. MEG3和腺苷对HepG2细胞自噬和增殖的影响[J]. 中国病理生理杂志, 2018, 34(9): 1706-10. Pu Z J, Li G P, Zhan H L, et al. Effects of MEG3 and adenosine on autophagy and proliferation of HepG2 cells[J]. Chin J Pathophys, 2018, 34(9): 1706-10. doi:10.3969/j.issn.1000-4718.2018.09.028 |
| [14] |
裴慧. G蛋白偶联雌激素受体1通过PI3k-Akt-mTOR信号通路抑制自噬缓解AngⅡ诱导的心肌肥大[D].山东大学, 2018. Pei H. G protein-coupled estrogen receptor Attenuation of AngⅡ Induced Cardiac hypertrophy and Inhibition autophagy via PI3K-Akt-mTOR signaling[D].Shandong University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10422-1018109954.htm |
| [15] |
Lina T T, Luo T, Velayutham T S, et al. Ehrlichia activation of Wnt-PI3K-mTOR signaling inhibits autolysosome generation and autophagic destruction by the mononuclear phagocyte[J]. Infect Immun, 2017, 85(12): e00690-17. |

