

胃癌是一种较为常见的消化道恶性肿瘤,其发病率位于恶性肿瘤发病率的第5位,死亡率位于第3位[1]。胃癌在我国的发病率很高,严重危害着我国人民的身体健康,目前主要的治疗方式还是以外科手术切除及化疗为主,但是术后复发率高、化疗药物不耐受等问题仍然困扰着许多胃癌患者。有研究表明,进展期胃癌即使接受了手术为主的综合治疗,5年生存率仍低于30%[2]。
天然有效成分仍然是抗肿瘤研究的关注点之一。橘红素(Tangeretin,Tan)是一种存在于中药枳实中的多甲氧基黄酮成分,对于多种肿瘤细胞如肺癌、胃癌、结肠癌、乳腺癌等均有一定的抑制作用[3]。前期研究表明,橘红素可明显抑制人胃癌AGS细胞的增殖,主要机制可能是通过抑制细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化和上调CyclinB1蛋白表达使细胞阻滞于S期和G2/M期[4]。橘红素还可以通过p53依赖的线粒体途径和Fas/FasL介导的死亡受体途径诱导胃癌AGS细胞的凋亡[5]。近期有很多相关研究发现,在胃癌的病变过程中,细胞自噬起到很大的作用[6]。因此,本研究从自噬的角度进一步探究橘红素对人胃癌AGS细胞的影响,并初步探讨其分子机制,为橘红素防治胃癌提供新的实验依据。
1 材料 1.1 细胞株人胃癌AGS细胞株购自中科院细胞库(上海)。
1.2 药物与试剂橘红素(纯度>98%, 批号:09102121)购自上海同田生物技术有限公司;氯喹(chloroquine,CQ)(批号:#105M4035V)购自美国Sigma公司;雷帕霉素(Rapamycin,Rapa, 批号:53123-889)购自北京诺特莱斯(Notlas)生物科技有限公司;0.25%胰酶(批号:1854874)购自美国GIBCO公司;胎牛血清(批号:1706126)购自以色列Biological Industries生物科技公司;HAM’s/F12培养液(批号:AC10256410)购自美国Hyclone公司;ECL plus显影试剂盒购自美国Merk Millipore公司;β-actin一抗为美国CST公司产品。
1.3 仪器BD FACS Calibur流式细胞仪(美国),Sonics超声细胞破碎仪(美国),Bio-Rad水平、垂直电泳及转膜装置(美国),Thermo HERA cell 150二氧化碳培养箱,Bio-Rad-Image-Lab凝胶成像分析系统(美国)。
2 方法 2.1 细胞培养人胃癌AGS细胞株接种于含10%胎牛血清的HAM’s/F12培养液,置于37 ℃,5%CO2饱和湿度的培养箱中培养。
2.2 Western blot检测蛋白表达收集细胞,加入配制好的RIPA裂解液100 μl,冰上裂解30min,充分裂解后,4 ℃,10 000 rpm,离心10 min,取上清,按BCA试剂盒说明测定蛋白浓度。分别取10~30 μg样品蛋白/孔上样,电泳,湿转60 min(4 ℃,100 V),5% BSA封闭2 h,然后分别用β-actin、LC3、p62一抗4 ℃平摇过夜,二抗避光孵育1 h,ECL显色液显色,Bio-Rad-Image-Lab凝胶成像分析系统拍照,对蛋白条带进行数据分析,以目标蛋白条带与β-actin条带的比值作相对定量,分析各样品中目标蛋白表达的差别。
2.3 流式细胞仪检测细胞凋亡选择处于对数生长期的AGS细胞,以1×108个·L-1的密度,2 ml/孔,接种于6孔培养板。贴壁生长12~24 h后,各孔分别加入相应药物,作用48 h。然后用无EDTA胰酶消化细胞,并收集至离心管内,1 000 rpm离心5 min。弃上清,用冰冷PBS洗涤1次,1 200 rpm离心5min。弃上清,加入稀释好的1×Buffer混匀并转移至流式管,继续1 200 rpm离心5min。弃上清,各样品管,先加入5 μl Annexin V,再加入5 μl PI,混匀,4 ℃避光,静置染色20 min。染色后,每管加入1×Buffer 0.5 ml,流式细胞仪检测分析。
2.4 统计分析数据以x±s表示。PrismDemo 5.0统计软件进行统计分析,one-way ANOVA进行多组比较。
3 结果 3.1 橘红素对自噬相关蛋白的影响橘红素作用24 h,可剂量依赖地增强LC3Ⅱ蛋白(P<0.05, P<0.01)和p62蛋白(P<0.05)的表达。作用48h,橘红素可呈剂量依赖地增强p62蛋白的表达(P<0.05, P<0.01),对LC3Ⅱ蛋白的表达无明显影响。见Fig 1。提示橘红素可以促进自噬体的堆积,抑制自噬体的降解。
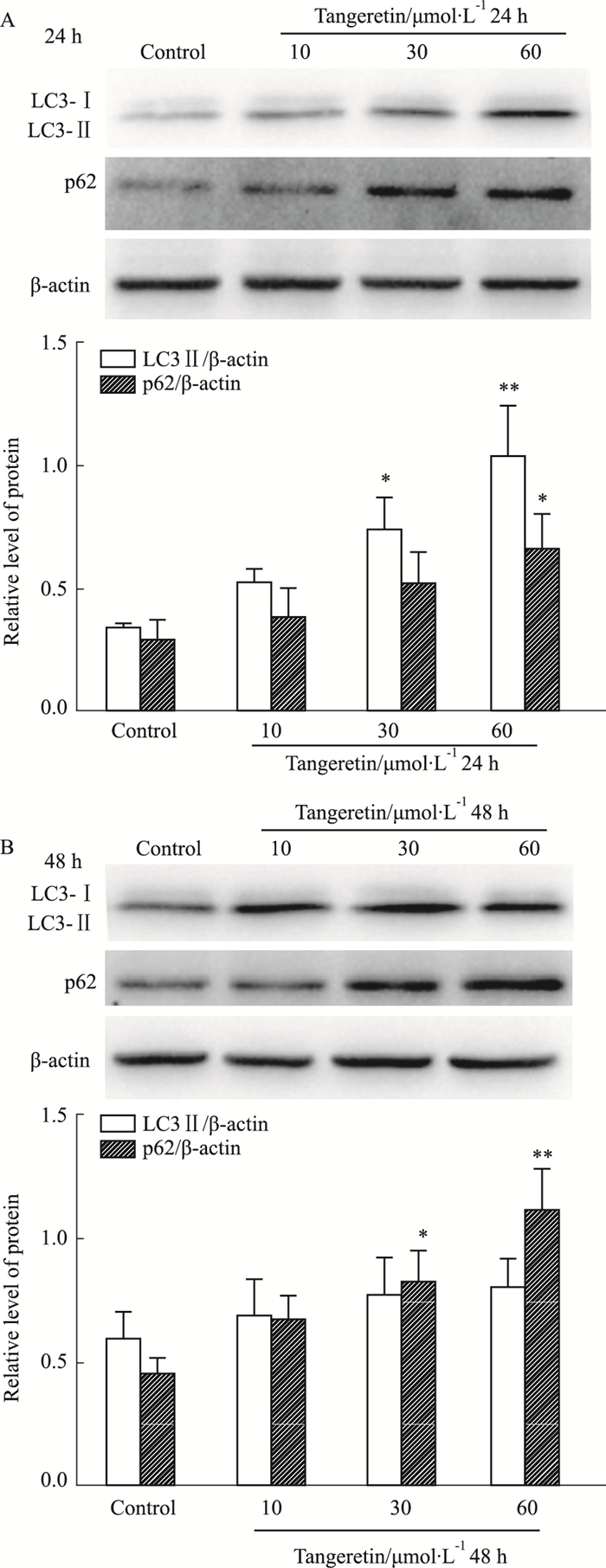
|
| Fig 1 Effects of tangeretin on autophagy in AGS cells (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
作用24 h和48 h,CQ和橘红素联合处理(CQ+Tan)组与橘红素单独处理(Tan)组比较,LC3Ⅱ和p62蛋白的表达明显增加(P<0.01)。见Fig 2。提示橘红素与自噬抑制剂CQ有相似的作用,进一步验证了橘红素对AGS细胞自噬主要是抑制作用。
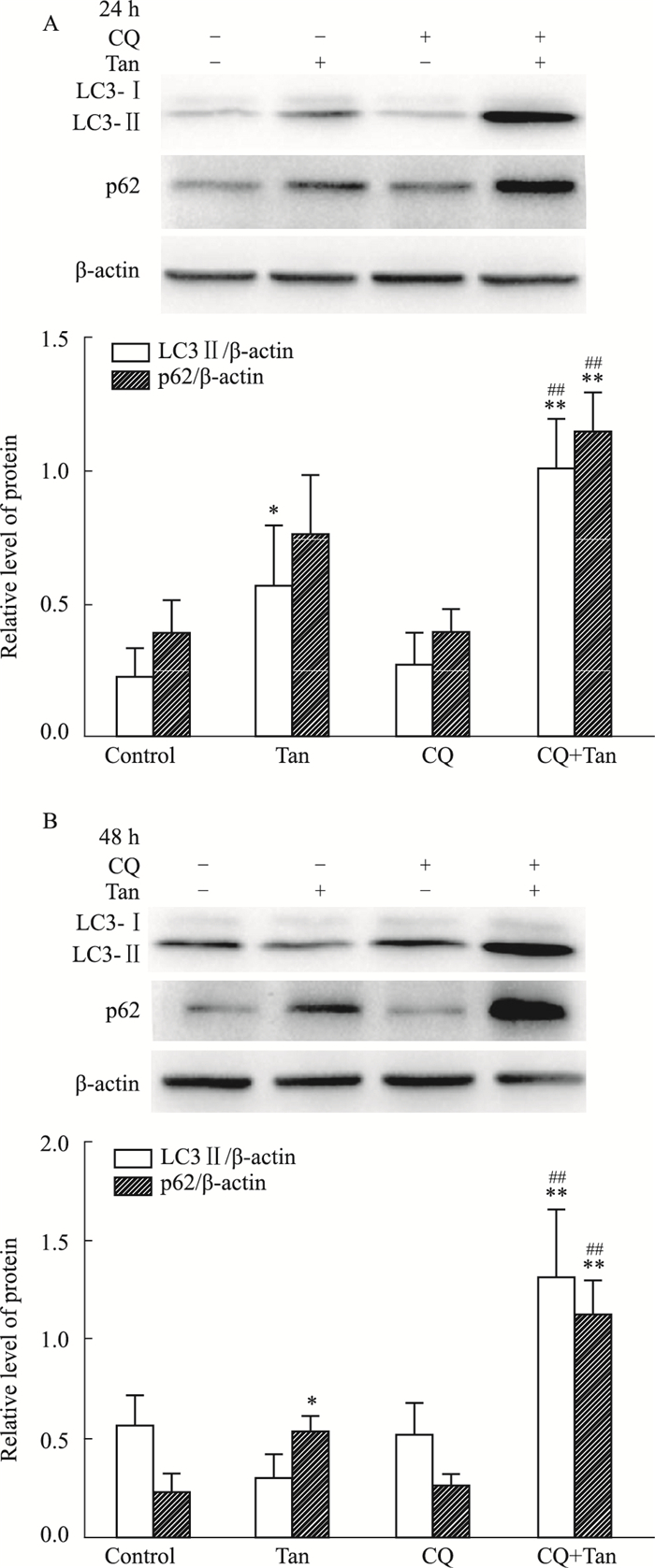
|
| Fig 2 Effects of CQ on autophagic flux blocked by tangeretin (x±s, n=3) *P < 0.05, **P < 0.01 vs control group; ##P < 0.01 vs tangeretin group |
如Fig 3所示,Rapa和橘红素联合处理(Rapa+Tan)组与Tan组比较,LC3Ⅱ和p62蛋白的表达均下降(P<0.05)。提示橘红素对AGS细胞主要不是促进自噬的作用。
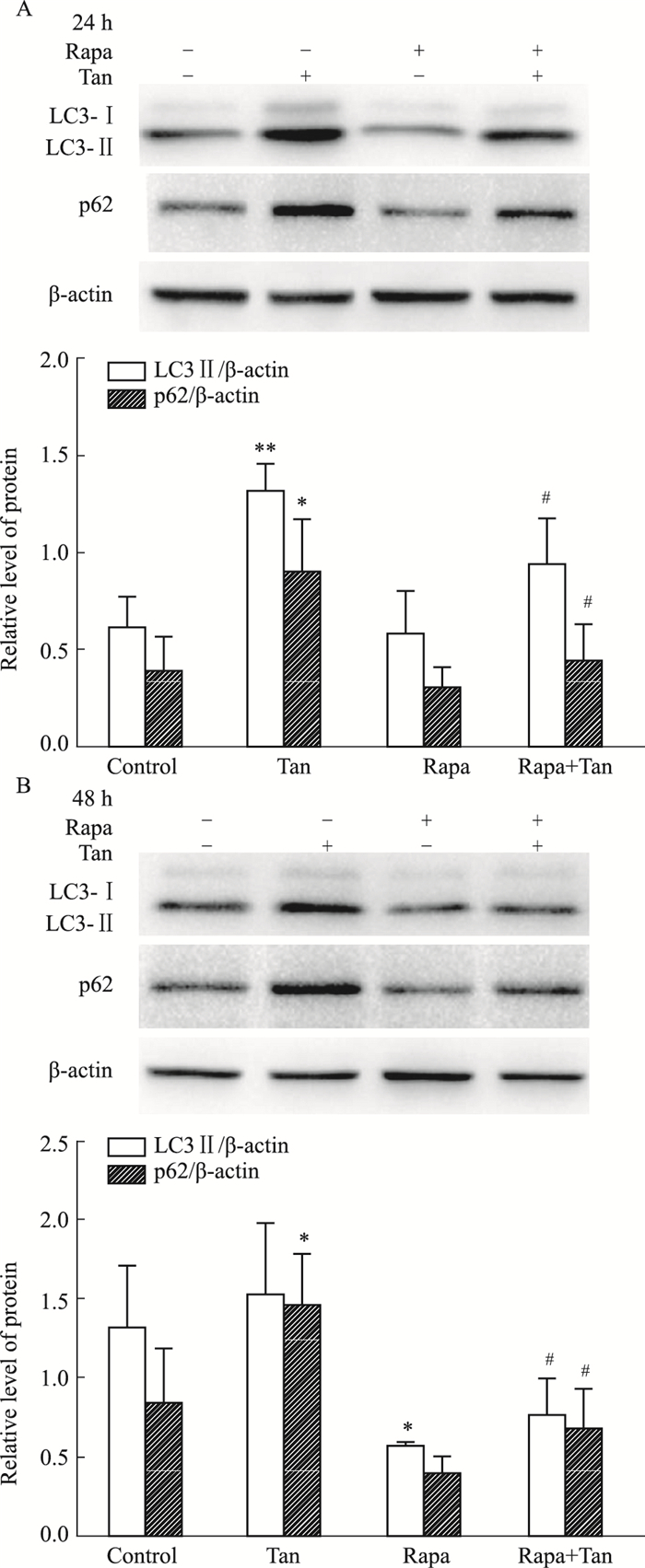
|
| Fig 3 Effects of Rapa on autophagic flux blocked by tangeretin (x±s, n=3) *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs tangeretin group |
如Fig 4所示,CQ+Tan组与Tan单独处理组比较,细胞凋亡率有统计学差异(P<0.01))。该结果提示,橘红素与CQ具有协同作用,可能通过抑制自噬流促进AGS细胞的凋亡。
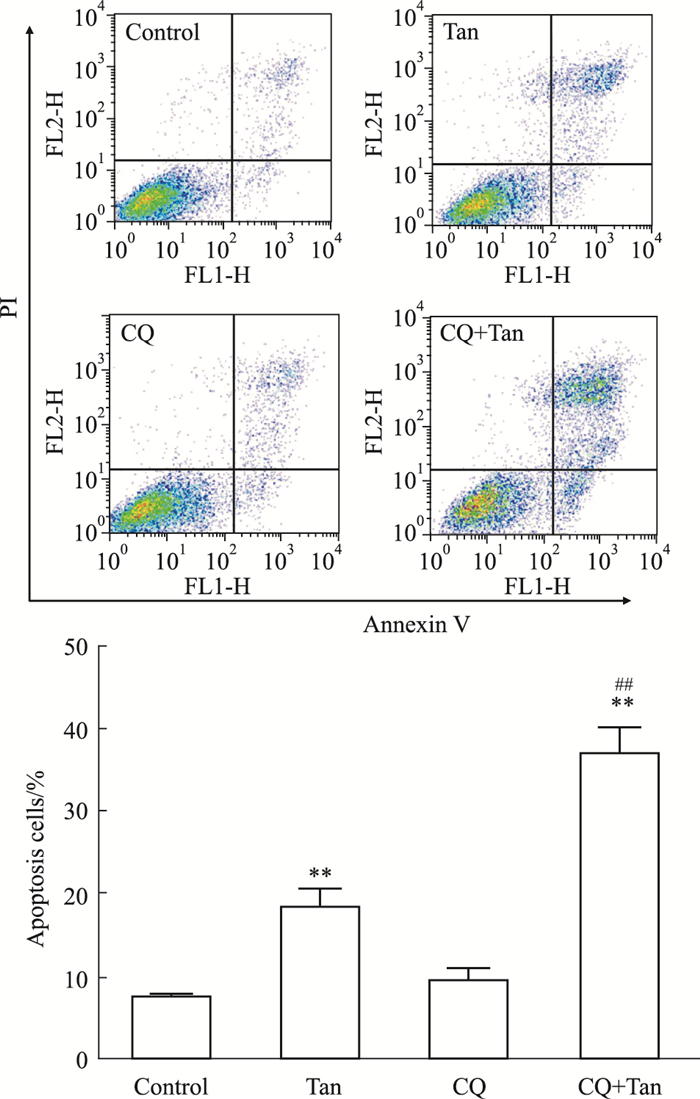
|
| Fig 4 Effects of CQ on tangeretin-induced apoptosis (x±s, n=3) **P < 0.01 vs control group; ##P < 0.01 vs tangeretin group |
如Fig 5所示,不同浓度橘红素(10、30、60 μmol·L-1)作用24和48 h,Akt蛋白的磷酸化水平均可呈剂量依赖地下降(P<0.05, P<0.01)。以上结果提示,橘红素可以降低Akt蛋白的磷酸化水平,并具有剂量依赖性。
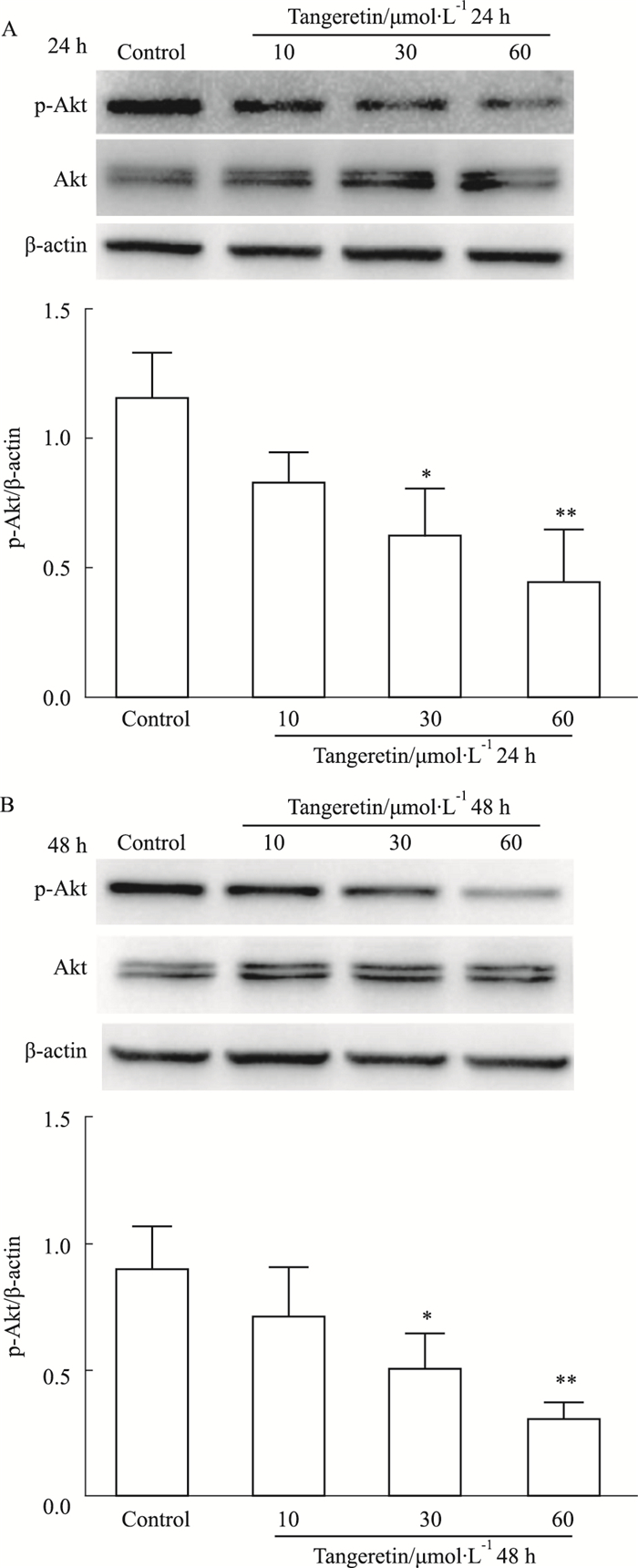
|
| Fig 5 Effects of tangeretin on Akt phosphorylation (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
自噬是细胞在饥饿、缺氧或其它应激条件下,在自噬相关基因(Autophagy associated gene,Atg)的调控下,利用溶酶体降解受损的细胞器和大分子物质,为细胞自身提供营养的过程。自噬作为一种自我防御途径,通过防止垃圾或毒素的积累,在特殊情况下有利于肿瘤细胞生存[7]。然而,异常的自噬活性可能导致细胞内蛋白质和细胞器的不适当的降解,最终可以导致细胞自噬死亡[8]。尽管自噬与肿瘤的关系密切又复杂而且有争议,但近年来,不少研究提示自噬与胃癌的发生、发展及转移都密切相关, 自噬相关蛋白在预测胃癌预后中有潜在临床意义。因此,深入了解自噬与胃癌的关系,将有助于更好地理解自噬在胃癌中的临床应用价值。
自噬是一个动态连续的过程,包括自噬体的形成,自噬体成熟后与溶酶体融合,形成自噬溶酶体,同时降解其内容物[9]。近年来,越来越多研究以自噬流来评价自噬的活性[10]。自噬体的形成和消除,是自噬流的两个十分紧密的过程。LC3蛋白是一种自噬标记物,LC3的C端能够被Atg4分割成LC3 I,分布在细胞质中。形成自噬体以后,LC3 I能够和磷脂酰乙醇胺结合,生成LC3Ⅱ [11]。p62是选择性自噬的底物蛋白, 在自噬溶酶体的降解中有着十分重要的作用。当缺少Atg基因或自噬体与溶酶体融合受到阻碍时,p62蛋白会明显堆积[12]。因此,可以通过检测p62蛋白的表达量来观测自噬流。本研究结果发现,橘红素作用后LC3Ⅱ和p62蛋白表达均有所增加,表明橘红素增加了自噬体的堆积,而且自噬体的降解可能是受阻的。为了进一步证明橘红素有抑制AGS细胞自噬流的作用,又分别检测了自噬抑制剂CQ和自噬促进剂Rapa的作用。结果表明,CQ可以明显上调LC3Ⅱ和p62蛋白表达量,而Rapa则相反,提示橘红素与CQ作用相似,有抑制AGS细胞自噬流的作用,可能主要是抑制自噬体的降解引起自噬体的堆积。
细胞凋亡和自噬虽然是细胞死亡的两种途径,但两者常存在着密切关系,凋亡和自噬常相互作用,在肿瘤发病中发挥作用[13]。前期研究发现,橘红素有诱导AGS细胞的凋亡的作用,那么橘红素抑制AGS细胞的自噬流与细胞凋亡是否存在关系呢?本研究观察了自噬抑制剂CQ与橘红素联合作用48 h对人胃癌AGS细胞凋亡率的影响,结果显示,CQ与橘红素联合处理比橘红素单独处理,AGS细胞凋亡率明显增加,提示橘红素与CQ具有协同作用,可能通过抑制AGS细胞自噬流,促进细胞的凋亡。
Akt又被称为蛋白激酶B (protein kinase B,PKB),是丝氨酸/苏氨酸蛋白激酶的一种,广泛参与肿瘤细胞的增殖、凋亡和分化等过程的调节[14]。活化的Akt既可以直接激活mTOR,也可以通过间接途径,即抑制TSC2和TSC1来激活mTOR,参与自噬[15]。本研究发现,橘红素作用24 h和48 h均可以抑制Akt的磷酸化,因此认为,Akt的磷酸化可能参与橘红素抑制细胞自噬流,促进细胞凋亡的过程。
综上,橘红素可能通过阻断AGS细胞的自噬流,抑制AGS细胞自噬体的降解,造成自噬体的堆积,从而促进细胞的凋亡。Akt蛋白的磷酸化可能参与了这一过程。
( 致谢: 本研究在上海中医药大学教学实验中心微生物与免疫实验室完成,在此致以衷心的感谢! )
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-86. doi:10.1002/ijc.29210 |
| [2] |
Ajani J A, Bentrem D J, Besh S, et al. Gastric cancer, version 2.2013:featured updates to the NCCN Guidelines[J]. J Natl Compr Canc Netw, 2013, 11(5): 531-46. doi:10.6004/jnccn.2013.0070 |
| [3] |
陈圣敏, 董杨. 多甲氧基黄酮抗肿瘤作用研究进展[J]. 中国药理学通报, 2017, 33(11): 1493-5. Chen S M, Dong Y. The research progress of anti-tumor effect polymethoxyflavonoids[J]. Chin Pharmacol Bull, 2017, 33(11): 1493-5. |
| [4] |
董杨, 季光, 施建蓉, 等. 橘红素上调Cyclin B1和抑制ERK磷酸化诱导人胃癌AGS细胞周期阻滞[J]. 中国药理学通报, 2012, 28(6): 823-7. Dong Y, Ji G, Shi J R, et al. Arreste of human gastric cancer AGS cells by tangeretin via CyclinB1 upregulation and inhibition of ERK phosphorylation[J]. Chin Pharmacol Bull, 2012, 28(6): 823-7. |
| [5] |
Dong Y, Cao A, Shi J, et al. Tangeretin, a citrus polymethoxyflavonoid, induces apoptosis of human gastric cancer AGS cells through extrinsic and intrinsic signaling pathways[J]. Oncol Rep, 2014, 31(4): 1788-94. doi:10.3892/or.2014.3034 |
| [6] |
Qian H R, Yang Y. Functional role of autophagy in gastric cancer[J]. Oncotarget, 2016, 7(14): 17641-51. |
| [7] |
Yang X, Yu D D, Yan F, et al. The role of autophagy induced by tumormicroenvironment in different cells and stages of cancer[J]. Cell Biosci, 2015, 5: 14. doi:10.1186/s13578-015-0005-2 |
| [8] |
Levine B, Kroemer G. Autophagy in the pathogenesis ofdisease[J]. Cell, 2008, 132: 27-42. doi:10.1016/j.cell.2007.12.018 |
| [9] |
Zhang X J, Chen S, Huang K X and Le W D. Why should autophagic flux be assessed[J]. ? Acta Pharmacol Sin, 2013, 34: 595-9. doi:10.1038/aps.2012.184 |
| [10] |
Kim M, Park Y, Kwon Y, et al. MiR-135-5p-p62 axis regulates autophagic flux, tumorigenic potential, and cellular interactions mediated by extracellular vesicles during allergic inflammation[J]. Front Immunol, 2019, 10: 738. doi:10.3389/fimmu.2019.00738 |
| [11] |
Rubinsztein D C, Cuervo A M, Ravikumar B, et al. In search of an 'autophagomometer'[J]. Autophagy, 2009, 5: 585-9. doi:10.4161/auto.5.5.8823 |
| [12] |
Gao W, Chen Z, Wang W, et al. E1-like activating enzyme Atg7 is preferentially sequestered into p62 aggregates via its interaction with LC3-I[J]. PLoS One, 2013, 8: e73229. doi:10.1371/journal.pone.0073229 |
| [13] |
Park B S, Choi N E, Lee J H, et al. Crosstalk between Fisetin-induced apoptosis and autophagy in human oral squamous cell carcinoma[J]. J Cancer, 2019, 10(1): 138-46. doi:10.7150/jca.28500 |
| [14] |
Yang H, Bai X, Zhang H, et al. NADPH dependent metabolism, encourages crosstalk between autophagy and apoptosis in lung carcinoma cells by use of an AMPK inhibition-independent blockade of the Akt/mTOR pathway[J]. Molecules, 2019, 24(5): E993. doi:10.3390/molecules24050993 |
| [15] |
Xu Y Z, Li Y H, Lu W J, et al. YL4073 is a potent autophagy-stimulating antitumor agent in an in vivo model of Lewis lung carcinoma[J]. Oncol Rep, 2016, 35(4): 2081-8. doi:10.3892/or.2016.4603 |

