

2. 中国医学科学院北京协和医学院 药物研究所天然药物活性物质与
2. State Key Laboratory of Bioactive Natural Products and Function, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的病程包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和肝纤维化,如不加以有效控制,可能会发展成肝硬化和肝癌[1]。NAFLD目前无特异性药物治疗,主要治疗方法包括降血脂、减肥、胰岛素增敏和保肝等[1]。
丁酸钠(sodium butyrate,NaB)是丁酸的可溶性钠盐。丁酸是一种短链脂肪酸(short chain fatty acid,SCFA),在牛奶中富含,并可由肠道菌发酵膳食纤维而产生。研究发现[2-3],其在动物体内具有改善糖脂代谢、减肥、抗炎、抗氧化、防治肿瘤等有益作用。小规模临床研究也证明,富含丁酸的食物能改善人体糖脂代谢,并抑制体质量增加[2]。丁酸对饮食诱导的大鼠NAFLD有明显改善作用,能明显减轻肝脏脂肪蓄积和肝纤维化[2]。小檗碱(berberine,BBR)是一种异喹啉类生物碱,提取自黄连和黄柏等植物,长期以来,一直用于腹泻的治疗,近年来,也被用于临床治疗高脂血症[4]。大量基础和临床研究表明,其对人体内分泌代谢、循环、消化和神经系统的多种慢性疾病有一定改善作用,是一种有广泛临床应用价值和前景的天然药物[4]。BBR对NAFLD有明确的改善作用,如在动物模型中,BBR明显减少肝脏脂肪含量,减轻肝组织炎症反应和氧化应激[5]。临床研究也发现,BBR明显减少NAFLD患者的肝脏脂肪含量,并改善肝功能[6]。由于丁酸与BBR对NAFLD均有改善作用,因此,我们推测二者联合应用可能进一步减轻NAFLD。目前,NaB与BBR联合用于改善NAFLD的作用尚未见文献报道,因此,本文以高脂饲料(high-fat diet,HFD)诱导了小鼠的NAFLD模型,并研究NaB与BBR的联合作用。
1 材料与方法 1.1 药物与试剂NaB和丙二醛(malondialdehyde,MDA)检测试剂盒,购自美国Sigma-Aldrich公司;BBR购自阿拉丁试剂(上海)有限公司。血清胆固醇(cholesterol,CHO)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、甘油三酯(tyiglyceride,TG)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天门冬氨酸转氨酶(aspartate aminotransferase,AST)检测试剂盒,购自北京中生北控生物科技有限公司;组织CHO和TG检测试剂盒,购自北京普利莱基因技术有限公司;AMP依赖的蛋白激酶α(AMP-activated protein kinase α, AMPKα)、磷酸化AMPKα(p-AMPKα)(Thr172)、β-actin的兔源单克隆抗体,购自美国Cell Signaling Technology公司;蛋白提取、定量和ECL试剂盒,购自美国Thermo Fisher Scientific公司;细胞和组织总RNA提取试剂盒,购自德国QIAGEN公司;反转录试剂盒、实时荧光定量PCR Master Mix,购自美国Promega公司;PCR引物,由美国Invitrogen公司合成;超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒,购自上海碧云天生物技术有限公司;异氟烷,购自北京友诚嘉业生物科技有限公司。
1.2 实验动物♂SPF级6周龄C57BL/6J小鼠50只,体质量(18.7±1.48)g,购自北京维通利华实验动物技术有限公司,许可证编号为SCXK(京)2007-0001。饲养环境为中国医学科学院医药生物技术研究所实验动物房,室温(20~24) ℃,自由饮水,12 h明暗循环。
1.3 方法 1.3.1 动物实验实验方案由中国医学科学院医药生物技术研究所伦理委员会审核并批准。所有动物适应性喂养3 d后,随机分为5组,每组10只。其中一组继续以基础饲料(normal diet,ND)喂养作为正常对照,其余动物投喂HFD(购自北京华阜康生物科技股份有限公司,成分为60% kcal脂肪、20% kcal蛋白质、20% kcal碳水化合物)。以HFD喂养的动物共4组,分别为生理盐水(normal saline,NS)组、NaB 200 mg·kg-1组、BBR 100 mg·kg-1组、NaB 200 mg·kg-1+ BBR 100 mg·kg-1组。NaB以NS溶解,BBR以NS制成混悬液,于每日10 :00 am进行灌胃给药。给药与HFD投喂同时进行,持续7周,每周测量1次小鼠体质量和摄食量。
1.3.2 肝脏1H磁共振波谱(magnetic resonance spectroscopy,MRS)检测和分析给药6周后,每组随机选5只小鼠进行肝脏1H MRS检测。动物禁食12 h后,在Matrx VIP3000吸入式麻醉机(美国Matrx公司)中,以3%异氟烷诱导麻醉,并以1.5%异氟烷维持麻醉,然后以PharmaScan70/16 US小动物磁共振成像仪(德国Bruker公司)进行检测,具体方法和参数与文献报道一致[7]。检测后,使用MestReNova软件分析波谱信号,根据文献报道的公式[7-8]计算肝脏脂肪酸的多不饱和指数(polyunsaturation index,PUI)和不饱和指数替代物(surrogate unsaturation index,UIs)。饱和指数(saturation index,SI)的计算方法为1-UIs[8]。
1.3.3 血清、肝脏标本收集和测定实验结束前1 d晚上,所有动物禁食12 h,摘眼球取血,室温静置2 h后,以2 000×g离心20 min,吸取血清转移至新离心管,以相应试剂盒测定血脂和肝功能等血清生化指标。
颈椎脱位处死小鼠后,取肝脏称重,并计算肝指数:肝指数=肝质量/体质量(实验后)×100。取肝脏左叶于4%甲醛中固定,石蜡(5 μm)及冰冻(8 μm)切片后,分别进行HE和油红O(oil red O,ORO)染色并照相。剩余肝脏放入液氮中迅速冷冻,随后转移至-80 ℃冰箱保存。匀浆后以试剂盒测定肝组织中CHO、TG、SOD、T-AOC和MDA的含量或水平,并以蛋白浓度进行校正。
1.3.4 Western blot肝组织匀浆后,以试剂盒测定蛋白浓度,取含25 μg蛋白的样品进行SDS-PAGE。以电转法(240 mA,2 h)将蛋白转移至PVDF膜上,封闭后,与AMPKα或β-actin的单抗4 ℃孵育过夜,洗膜后,与HRP标记的二抗室温孵育1 h,再次洗膜后,以ECL试剂盒显色并拍照。然后,以抗体洗脱液处理含AMPKα的膜以移除抗体,膜与p-AMPKα单抗和HRP标记的二抗孵育后,再次显色检测信号。以Gel-Proanalyzer凝胶定量分析软件扫描条带灰度,再以AMPKα为参照,对p-AMPKα的表达量进行校正,结果以ND组的倍数表示。
1.3.5 实时荧光定量反转录-PCR肝组织匀浆后,以试剂盒提取总RNA,定量后,取1 μg作为模板进行反转录,反应体系(15 μL)参考文献报道[9],条件为25 ℃ 5 min,42 ℃ 60 min,70 ℃ 15 min。然后利用基因特异性引物(Tab 1)和ABI 7500 FAST实时荧光定量PCR仪(美国Applied Biosystems公司)对cDNA进行扩增,反应体系(25 μL)参考文献报道[9],条件为95 ℃ 2 min,40个循环:95 ℃ 15 s,60 ℃ 1 min。以GAPDH为内参,对目的基因的循环阈值(cycle threshold,Ct)进行校正,并以ΔΔCt法对目的基因mRNA的表达进行相对定量分析,结果以ND组的倍数表示。
| Gene | Forward primer(5’→3’) | Reverse primer(5’→3’) | Productlength/bp |
| FAS | GGGTTCTAGCCAGCAGAGTC | TCAGCCACTTGAGTGTCCTC | 114 |
| SCD1 | CAACTTCACCACGTTCTTCATC | CCCGTCTCCAGTTCTCTTAATC | 112 |
| CPT1A | GGAGGAGGTAAGACTACTATG | TACATGCAATGGACAGATTAG | 118 |
| ACOX1 | TTTGTTGTCCCTATCCGTGAGA | GCCGATATCCCCAACAGTGA | 69 |
| IL-1β | CCACCTCAATGGACAGAATATCA | CCCAAGGCCACAGGTATTT | 96 |
| IL-6 | CCATCCAGTTGCCTTCTTGG | TGCAAGTGCATCATCGTTGT | 226 |
| TNF-α | CCAAAGGGATGAGAAGTTCC | CTCCACTTGGTGGTTTGCTA | 107 |
| GAPDH | CTCTGGAAAGCTGTGGCGTGATG | ATGCCAGTGAGCTTCCCGTTCAG | 120 |
数据以x±s表示,利用SPSS 21.0软件进行统计学分析,以单因素方差分析(one-way ANOVA)进行多组间比较,以LSD-t检验进行两组间比较。
2 结果 2.1 NaB与BBR联合对NAFLD小鼠血脂、肝功能和体质量增加的影响以HFD喂养7周后,C57BL/6J小鼠出现高脂血症(Tab 2),表现为血清CHO、LDL-C和TG水平较ND组明显升高(P<0.01)。200 mg·kg-1的NaB或100 mg·kg-1的BBR单独应用,可使血脂水平明显降低(P<0.05);与NaB或BBR单独应用比较,二者联合时降血脂效果更为明显(P<0.05)。HFD诱导小鼠发生肝功能损害,表现为血清ALT和AST水平明显升高(P<0.01)。NaB或BBR单独应用可使肝功能明显改善(P<0.05),与NaB或BBR单独应用比较,二者联合应用可使肝功能基本恢复正常(P<0.05)。
| Group | CHO/mmol·L-1 | LDL-C/mmol·L-1 | TG/mmol·L-1 | ALT/U·L-1 | AST/U·L-1 |
| ND | 2.75±0.27 | 0.17±0.01 | 0.57±0.05 | 33.5±2.79 | 118±10.3 |
| HFD+NS | 5.18±0.68** | 0.39±0.05** | 1.12±0.14** | 65.2±7.27** | 206±24.1** |
| HFD+NaB | 3.92±0.41# | 0.30±0.03# | 0.86±0.10# | 49.7±5.33# | 158±18.2# |
| HFD+BBR | 3.88±0.38# | 0.29±0.03# | 0.84±0.09# | 48.8±5.12# | 154±17.2# |
| HFD+NaB+BBR | 2.82±0.29##△ | 0.21±0.02##△ | 0.61±0.07##△ | 34.3±4.17##△ | 120±13.8##△ |
| **P<0.01 vs ND; #P<0.05, ##P<0.01 vs HFD+NS; △P<0.05 vs HFD+NaB or HFD+BBR | |||||
HFD+NS组小鼠平均摄食量较ND组明显减少(P<0.05),而以HFD喂养的各组动物间摄食量没有差异(Tab 3)。实验结束时,HFD+NS组小鼠体质量增加值较ND组明显增加(P<0.01);与HFD+NS组比较,NaB或BBR单独应用组小鼠体质量增加值明显减少(P<0.05);NaB与BBR联合应用时,小鼠体质量增加值基本恢复正常(与HFD+NS比P<0.01),且效果较二者单独应用更为明显(P<0.01)。
| Group | Food intake/g·mouse-1day-1 | Body weight gain/g | Liver index/% | Liver CHO/mmol·g-1 Pro | Liver TG/mmol·g-1 Pro |
| ND | 3.32±0.28 | 4.73±0.33 | 3.48±0.41 | 35.6±4.02 | 47.8±4.45 |
| HFD+NS | 2.71±0.31* | 11.9±1.37** | 5.77±0.62** | 61.2±7.68** | 89.4±10.8** |
| HFD+NaB | 2.69±0.25* | 9.62±0.92# | 4.49±0.52# | 47.4±4.97# | 68.8±8.12# |
| HFD+BBR | 2.72±0.33* | 9.53±0.91# | 4.44±0.46# | 47.2±4.65# | 66.7±7.90# |
| HFD+NaB+BBR | 2.70±0.32* | 5.04±0.61##△△ | 3.57±0.41##△ | 36.3±4.11##△ | 48.6±5.11##△ |
| *P<0.05, **P<0.01 vs ND; #P<0.05, ##P<0.01 vs HFD+NS; △P<0.05, △△P<0.01 vs HFD+NaB or HFD+BBR | |||||
如Tab 3所示,HFD+NS组小鼠的肝组织CHO、TG水平以及肝指数较ND组明显升高(P<0.01),NaB或BBR单独应用可使这些指标明显降低(P<0.05),二者联合应用时这些指标进一步改善并几乎恢复到正常水平(与HFD+NS组比P<0.01,与NaB或BBR单独应用比P<0.05)。
肝脏切片和HE染色显示,ND组小鼠肝组织结构正常,ORO染色仅见少量散在的红染脂滴;HFD+NS组小鼠肝索结构紊乱,出现明显脂肪变性,表现为肝细胞气球样变和空泡样变,并有点状坏死,ORO染色出现大量红染脂滴并有融合现象;NaB或BBR单独应用能使这些病理改变得到明显改善;二者联合时能使HFD诱导的肝组织病理改变基本恢复正常(Fig 1、2)。
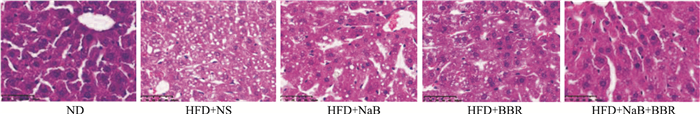
|
| Fig 1 Effects of NaB, BBR, or their combination on liver HE staining in HFD-fed C57BL/6J mice(×200) |
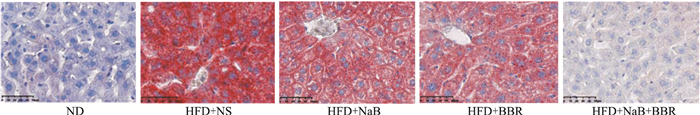
|
| Fig 2 Effects of NaB, BBR, or their combination on liver ORO staining in HFD-fed C57BL/6J mice(×200) |
肝脏1H MRS分析显示(Fig 3),HFD使小鼠肝脏脂肪酸的组成发生改变,表现为PUI和UIs明显减少,而SI明显增加(P<0.01)。NaB或BBR单独应用可使这些指标明显改善(P<0.05),二者联合时小鼠肝脏PUI和UIs进一步增加,而SI进一步减少(与HFD+NS组比P<0.01,与NaB或BBR单独应用比P<0.05)。
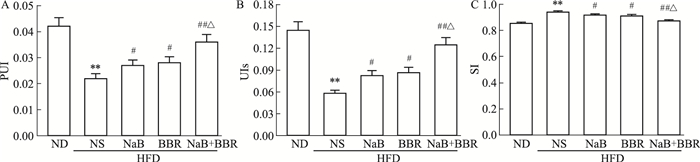
|
| Fig 3 Effects of NaB, BBR, or their combination on liver PUI (A), UIs (B) and SI (C) in HFD-fed C57BL/6J mice(x±s, n=5) **P < 0.01 vs ND; #P < 0.05, ##P < 0.01 vs HFD+NS; △P < 0.05 vs HFD+NaB or HFD+BBR |
如Fig 4A所示,HFD+NS组小鼠肝脏AMPK信号通路受到抑制,表现为p-AMPKα(Thr172)水平较ND组明显降低(P<0.01)。NaB或BBR单独应用明显激活肝脏APMK通路(P<0.05),二者联合应用效果更为明显,使肝脏p-AMPKα(Thr172)水平基本恢复正常(与HFD+NS组比P<0.01,与NaB或BBR单独应用比P<0.05)。
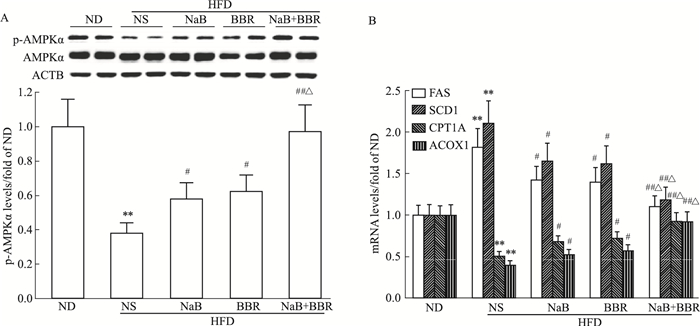
|
| Fig 4 Effects of NaB, BBR, or their combination on liver AMPKα phosphorylation (A) and mRNA expression levels of lipogenic and lipolytic genes (B) in HFD-fed C57BL/6J mice(x±s, n=10) **P < 0.01 vs ND; #P < 0.05, ##P < 0.01 vs HFD+NS; △P < 0.05 vs HFD+NaB or HFD+BBR |
与ND组比,HFD+NS组小鼠肝脏脂肪合成基因如脂肪酸合成酶(fatty acid synthase,FAS)和硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)的mRNA表达水平明显增加(P<0.01),而脂肪分解基因如肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)和酰基辅酶A氧化酶1(acyl-CoA oxidase 1,ACOX1)的mRNA表达水平明显减少(P<0.01)。NaB或BBR单独应用明显下调FAS和SCD1的表达,并上调CPT1A和ACOX1的表达(P<0.05)。NaB与BBR联合应用效果更为明显,使肝脏脂肪合成和分解基因的表达基本恢复正常(与HFD+NS组比P<0.01,与NaB或BBR单独应用比P<0.05)(Fig 4B)。
2.4 NaB与BBR联合对肝脏炎症因子表达和氧化应激的影响如Fig 5所示,HFD+NS组小鼠肝脏白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎症因子的mRNA表达水平较ND组明显升高(P<0.01),同时出现氧化应激反应,表现为肝组织的SOD活力和T-AOC明显减少,而MDA含量明显增加(P<0.01)。NaB或BBR单独应用明显减少炎症因子的表达,并抑制氧化应激(P<0.05),二者联合应用效果更明显,使上述指标基本恢复正常(与HFD+NS组比P<0.01,与NaB或BBR单独应用比P<0.05)。
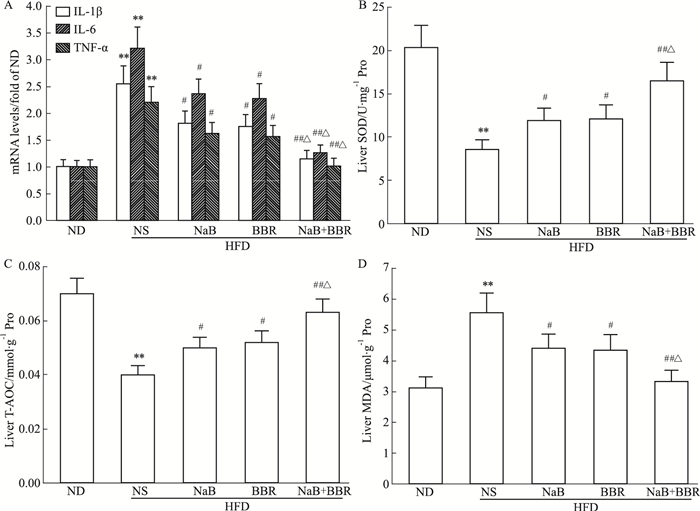
|
| Fig 5 Effects of NaB, BBR, or their combination on liver mRNA expression levels of inflammatory factors (A), SOD (B), T-AOC (C) and MDA (D) in HFD-fed C57BL/6J mice (x±s, n=10) **P < 0.01 vs ND; #P < 0.05, ##P < 0.01 vs HFD+NS; △P < 0.05 vs HFD+NaB or HFD+BBR |
本文首次报道了NaB与BBR联合,改善HFD诱导的C57BL/6J小鼠NAFLD的作用。丁酸与BBR在生物体内存在内在联系。BBR口服给药后吸收差,在肠道中浓度很高,能调控肠道菌群,使SCFA产生菌在肠道中富集,从而明显增加丁酸等SCFA的产生[10-11]。在体内肠道菌产生的丁酸可进入血液循环,到达靶器官后,可能与BBR产生联合作用从而调控代谢[11]。
与文献报道二者单独应用时的效果[2, 4-6]相一致,本文的结果显示,200 mg·kg-1的NaB与100 mg·kg-1的BBR联合应用于HFD喂养的小鼠7周,具有明显的降血脂、抑制体质量异常增加、减少肝脏脂肪蓄积、改善肝脏脂肪酸组成和减轻肝功能损害的作用。进一步实验发现,NaB与BBR联合明显激活小鼠肝脏AMPK通路,抑制脂肪合成,促进脂肪分解,并且明显减轻肝组织的炎症反应和氧化应激。NaB与BBR联合应用的效果和活性明显优于二者单独应用,并且达到药理学的相加作用,说明NaB与BBR联合能进一步改善脂代谢,并减轻HFD诱导的小鼠NAFLD。我们的研究结果为将来NaB与BBR联合应用于临床治疗NAFLD等代谢性疾病提供了科学依据。
NaB与BBR调控脂代谢和改善NAFLD的机制均与AMPK的活化有关[2-4]。AMPK是细胞物质和能量代谢的关键分子,激活后具有抑制合成代谢和促进分解代谢的作用[12-13]。本文的结果与文献报道一致,NaB与BBR联合应用能进一步激活AMPK通路,增加其磷酸化水平,抑制脂肪合成并促进脂肪分解,从而进一步减少肝脏脂肪蓄积,抑制体质量的异常增加。分子和细胞水平的机制研究发现,NaB通过活化细胞肝激酶B1(liver kinase B1,LKB1)来激活AMPK[2-3],而BBR则通过抑制细胞线粒体呼吸链和ATP合成来增加AMP:ATP的比率,并激活AMPK[4]。二者联合应用时,对这些细胞信号通路以及线粒体的影响目前未知,需深入研究。
1H MRS检测显示,HFD喂养使小鼠肝脏PUI和UIs明显减少,而SI明显增加,说明NAFLD小鼠肝脏脂肪酸组成发生了病理性改变,不饱和脂肪酸明显减少,而饱和脂肪酸明显增加。与肝脏TG测定和ORO染色结果一致,NaB与BBR联合明显减少肝脏SI,而增加PUI和UIs,使这些指数基本恢复到ND组的正常水平。提示NaB与BBR联合应用能使NAFLD小鼠肝脏的脂肪酸组成发生有益改变,使饱和脂肪酸明显减少,而不饱和脂肪酸明显增加。
炎症反应和氧化应激在NAFLD的病程进展中发挥重要作用,尤其对肝星状细胞(hepatic stellate cells,HSCs)活化、肝纤维化和肝硬化的发展非常关键[14-15]。本文结果显示,NaB与BBR联合具有很强的抗炎和抗氧化活性,提示该联合方案对肝纤维化和肝硬化可能具有抑制作用,后续研究将侧重于该方向。NaB与BBR的抗炎抗氧化作用涉及多条细胞信号通路,如核因子E2相关因子2(nuclear factor erythroid-2-related factor-2,Nrf2)通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路等[2, 4]。NaB与BBR联合用于改善NAFLD时,对这些细胞信号通路的影响需要进行深入研究。
综上所述,本文的研究证明,NaB与BBR联合用于HFD诱导的C57BL/6J小鼠NAFLD能进一步激活AMPK通路,减少肝脏脂肪蓄积,抑制炎症反应和氧化应激,并改善肝功能。NaB与BBR的联合可能具有一定的开发和应用前景。
( 致谢: 本研究在中国医学科学院医药生物技术研究所病毒室和动物实验室完成,感谢在实验过程中给予帮助的所有老师和同学!)
| [1] |
Bessone F, Razori M V, Roma M G. Molecular pathways of nonalcoholic fatty liver disease development and progression[J]. Cell Mol Life Sci, 2019, 76(1): 99-128. |
| [2] |
McNabney S M, Henagan T M. Short chain fatty acids in the colon and peripheral tissues: A focus on butyrate, colon cancer, obesity and insulin resistance[J]. Nutrients, 2017, 9(12): E1348. |
| [3] |
Luo S, Li Z, Mao L, et al. Sodium butyrate induces autophagy in colorectal cancer cells through LKB1/AMPK signaling[J]. J Physiol Biochem, 2019, 75(1): 53-63. |
| [4] |
Yao J, Kong W, Jiang J. Learning from berberine: Treating chronic diseases through multiple targets[J]. Sci China Life Sci, 2015, 58(9): 854-9. |
| [5] |
Zhang Z, Li B, Meng X, et al. Berberine prevents progression from hepatic steatosis to steatohepatitis and fibrosis by reducing endoplasmic reticulum stress[J]. Sci Rep, 2016, 6: 20848. |
| [6] |
Yan H M, Xia M F, Wang Y, et al. Efficacy of berberine in patients with non-alcoholic fatty liver disease[J]. PLoS One, 2015, 10(8): e0134172. |
| [7] |
史会杰, 朱海波. 依折麦布对非酒精性脂肪肝模型金黄地鼠血清生化指标的影响[J]. 医药导报, 2016, 35(6): 565-9. Shi H J, Zhu H B. Effect of ezetimibe on serum metabolites in high-fat-diet fed hamsters with nonalcoholic fatty liver disease[J]. Herald Med, 2016, 35(6): 565-9. |
| [8] |
Shi H, Wang Q, Yang L, et al. IMM-H007, a new therapeutic candidate for nonalcoholic fatty liver disease, improves hepatic steatosis in hamsters fed a high-fat diet[J]. FEBS Open Bio, 2017, 7(9): 1379-91. |
| [9] |
Zhang Y, Wang C, Yu B, et al. Gastrodin protects against ethanol-induced liver injury and apoptosis in HepG2 cells and animal models of alcoholic liver disease[J]. Biol Pharm Bull, 2018, 41(5): 670-9. |
| [10] |
Zhang X, Zhao Y, Zhang M, et al. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J]. PLoS One, 2012, 7(8): e42529. |
| [11] |
Wang Y, Shou J W, Li X Y, et al. Berberine-induced bioactive metabolites of the gut microbiota improve energy metabolism[J]. Metabolism, 2017, 70: 72-84. |
| [12] |
Dihingia A, Bordoloi J, Dutta P, et al. Hexane-isopropanolic extract of Tungrymbai, a North-East Indian fermented soybean food prevents hepatic steatosis via regulating AMPK-mediated SREBP/FAS/ACC/HMGCR and PPARα/CPT1A/UCP2 pathways[J]. Sci Rep, 2018, 8(1): 10021. |
| [13] |
陈娟, 汪胡风, 邓军, 等. 丹红注射液对高脂血症大鼠肝脏AMPK/SREBP-1/ACC通路的影响[J]. 中国药理学通报, 2018, 34(4): 528-32. Chen J, Wang H F, Deng J, et al. Effect of Danhong injection on AMPK/SREBP-1/ACC pathways of liver in hyperlipidemic rats[J]. Chin Pharmacol Bull, 2018, 34(4): 528-32. |
| [14] |
Wree A, McGeough M D, Peña C A, et al. NLRP3 inflammasome activation is required for fibrosis development in NAFLD[J]. J Mol Med (Berl), 2014, 92(10): 1069-82. |
| [15] |
Miura K, Yang L, van Rooijen N, et al. TLR2 and palmitic acid cooperatively contribute to the development of nonalcoholic steatohepatitis through inflammasome activation[J]. Hepatology, 2013, 57(2): 577-89. |

