

肺癌是世界上发病率和死亡率增长最快的癌症之一,严重威胁人类的健康和生命。即使许多发达国家拥有先进的检测和治疗方法,患者5年生存率仍不足20%[1]。目前,肺癌的治疗方式主要包括化疗、手术、放疗和分子靶向治疗[2],其中化疗仍然是肺癌各个阶段的重要的治疗方式[3]。随着疾病的发生发展,患者往往会对顺铂等传统化疗药物产生耐药性,从而使药效降低。因此,寻找有效的肺癌治疗药物显得尤为重要。
铁死亡是一种新发现的细胞死亡模式,主要特征是铁离子依赖性的脂质过氧化物的堆积[4]。不同于细胞凋亡、细胞坏死和自噬,发生铁死亡的细胞在形态、生化和免疫特征上与其他3种细胞死亡方式有较大差别[5]。研究发现[6],铁代谢和活性氧簇(reactive oxygen species,ROS)代谢与细胞铁死亡密切相关,而铁代谢和ROS代谢通路上的相关基因则被认为是铁死亡的重要调节因子。目前的研究发现,铁代谢的失调可能与多种生理病理过程有关,包括癌细胞的死亡、神经退行性疾病以及急性肾功能衰竭等。
隐丹参酮(cryptotanshinone,CTS)是传统中药丹参中的一种脂溶性有效成分,最初多应用于心血管疾病的研究。而近年来,CTS在抗肿瘤方面的研究逐渐增多。许多研究表明,CTS对多种肿瘤细胞的生长具有抑制作用。研究发现,CTS可以明显降低A549细胞的NADPH水平,升高ROS水平,对细胞的氧化还原稳态产生影响,影响ROS代谢通路。因此,CTS对肿瘤细胞的增殖抑制作用可能与铁死亡有关。
本研究以人肺癌A549细胞及其顺铂耐药株A549/DDP细胞为研究对象,初步探讨CTS对A549细胞和A549/DDP细胞中铁死亡相关基因表达的影响,为进一步开展CTS的抗肿瘤机制研究提供新思路,并为CTS用于肺癌治疗提供理论和实验依据。
1 材料与方法 1.1 材料 1.1.1 细胞株与试剂人肺癌A549细胞和顺铂耐药A549/DDP细胞由中国医学科学院中国协和医科大学肿瘤研究所馈赠;CTS购自中国药品生物制品检定所;胎牛血清购自美国Gibco公司;青霉素链霉素溶液、DMEM培养基、0.25%胰蛋白酶-EDTA购自美国Hyclone公司;CCK-8试剂盒购自日本同仁化学研究所;TRIzol试剂、逆转录、SYBR green试剂购自日本TaKaRa公司;引物由生工生物工程(上海)股份有限公司合成;RIPA细胞裂解液、BCA蛋白浓度检测试剂盒购自美国Thermo Fisher公司,ECL化学发光液购自北京Engreen公司;兔抗TFR1抗体购自美国Proteintech公司;兔抗GAPDH抗体购自美国Cell Signaling Technology (CST)。
1.1.2 仪器二氧化碳培养箱(美国Thermo Fisher公司);多功能酶标仪(美国Thermo Fisher公司);低温高速离心机(德国Eppendorf公司);PCR仪(德国Eppendorf公司);实时荧光定量PCR系统(美国Applied Biosystems公司);电泳、电转系统(美国Bio-Rad公司);Image Quant LAS4000曝光成像仪(美国General Electric公司)。
1.2 方法 1.2.1 细胞培养A549细胞和A549/DDP细胞接种于含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养、传代。当细胞处于对数生长期时,可用于实验。
1.2.2 CCK-8检测细胞存活率将处于对数生长期的A549细胞和A549/DDP细胞分别接种于96孔板中,每孔100 μL,培养24 h。加入100 μL含不同浓度CTS的培养液,用不含血清的DMEM培养基稀释CTS,使其终浓度分别为5、10、15、20 μmol·L-1,空白对照组为含相同浓度DMSO的DMEM培养基,每组设4个复孔。培养48 h后,将孔中液体吸出,另设4个空白复孔,每孔加入100 μL含10% CCK-8的无血清DMEM培养基,培养1 h后,置于摇床上低速震荡30 s,使孔内颜色分布均匀。检测波长为450 nm的吸光度值(optical density,OD),细胞存活率/%=(实验组OD-空白孔OD)/(对照组OD-空白孔OD)×100%。
1.2.3 qPCR检测mRNA表达A549细胞和A549/DDP细胞经CTS处理48 h后,终止细胞培养。分别提取两种细胞的总RNA,按照说明书的步骤逆转录成cDNA,以cDNA为模板,qPCR检测与铁代谢相关的TFR1、DMT1、IREB2、HSPB1、VDAC2、VDAC3、GPX4的mRNA表达水平,以ACTB作为内参。引物序列见Tab 1。
| Gene | Forward sequence | Reverse sequence |
| TFR1 | 5′-ACCATTGTCATATACCCGGT TCA-3′ | 5′-CAATAGCCCAAGTAGCCAA TCAT-3′ |
| DMT1 | 5′-CTAGACTGGGAGTGGTTAC TGG-3′ | 5′-AGGATGACTCGTGGGACCT T-3′ |
| IREB2 | 5′-TCGATGTATCTAAACTTGG CACC-3′ | 5′-GCCATCACAATTTCGTACA GCAG-3′ |
| HSPB1 | 5′-ACGGTCAAGACCAAGGATG G-3′ | 5′-AGCGTGTATTTCCGCGTGA-3′ |
| VDAC2 | 5′-GGCGTGGAATTTTCAACGT CC-3′ | 5′-AGACCATACTCACACCACT TGTA-3′ |
| VDAC3 | 5′-TTGTACCGAACACAGGAAA GAAG-3′ | 5′-CCCAGCCATAGATGGTTGG TC-3′ |
| GPX4 | 5′-GAGGCAAGACCGAAGTAAA CTAC-3′ | 5′-CCGAACTGGTTACACGGGA A-3′ |
| ACTB | 5′-CATGTACGTTGCTATCCAGG C-3′ | 5′-CTCCTTAATGTCACGCACG AT-3′ |
A549细胞和A549/DDP细胞经CTS处理48 h后,终止培养。弃去培养基,PBS洗涤2次,每孔加入100 μL裂解液,置于冰上裂解30 min,刮取裂解液收集于1.5 mL EP管超声15 s,于4 ℃ 16 000×g离心20 min,获得细胞总蛋白。进行蛋白定量后,加入适量的SDS-PAGE上样缓冲液,沸水浴变性10 min。按每孔25 μg总蛋白计算上样量,电泳分离后,电转至PVDF膜上,用5%脱脂牛奶室温封闭1 h,加入一抗TFR1、GAPDH,4 ℃孵育过夜,TBST洗膜3次,每次7 min,加入二抗,室温孵育1 h,TBST洗膜3次,每次7 min,显影。使用Image J软件分析结果。
1.2.5 统计学分析使用SPSS软件进行统计学分析,数据用x±s表示,组间比较采用单因素方差分析。
2 结果 2.1 CTS对A549细胞和A549/DDP细胞存活率的影响采用CCK-8法考察CTS对A549细胞和A549/DDP细胞存活率的影响。如Fig 1所示随着CTS浓度的增高,细胞的存活率降低,提示CTS能够抑制A549细胞和A549/DDP细胞的增殖,对A549细胞的IC50为8.654 μmol·L-1,对A549/DDP细胞的IC50为4.785 μmol·L-1,表明顺铂耐药细胞A549/DDP对CTS的作用更敏感。
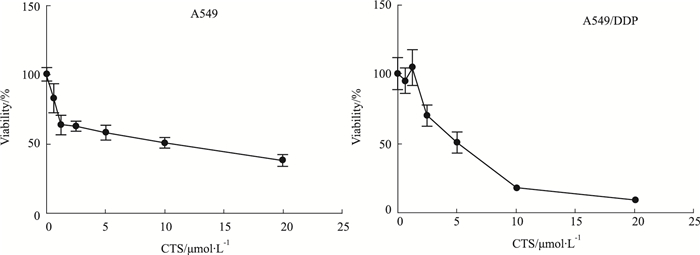
|
| Fig 1 Effect of CTS on viability of A549 cells and A549/DDP cells (x±s, n=4) |
为探讨CTS对肺癌细胞存活率的影响是否与铁死亡相关基因有关,采用qPCR技术初步考察了其对细胞铁死亡相关基因mRNA水平的影响。如Fig 2所示,CTS处理后,A549细胞HSPB1和GPX4的mRNA表达水平增高,IREB2、VDAC2和VDAC3的mRNA表达水平降低,TFR1和DMT1的mRNA表达水平变化不明显;A549/DDP细胞TFR1和IREB2的mRNA表达水平增高,VDAC3的mRNA表达水平降低,DMT1、HSPB1、VDAC2和GPX4的mRNA表达水平变化不明显。

|
| Fig 2 Effect of CTS on relative mRNA levels in A549 cells (A) and A549/DDP cells (B) (x±s, n=3) *P < 0.05, **P < 0.01 vs control |
TFR1是存在于细胞膜上的转铁蛋白受体,对细胞的铁稳态起着重要的调节作用,因此考察CTS对TFR1蛋白表达水平的影响。如Fig 3所示,与对照相比,CTS处理后A549/DDP细胞TFR1表达水平增高,当CTS浓度为2.5 μmol·L-1时,TFR1表达水平增高最明显,而CTS对A549细胞TFR1蛋白表达水平则影响不明显。
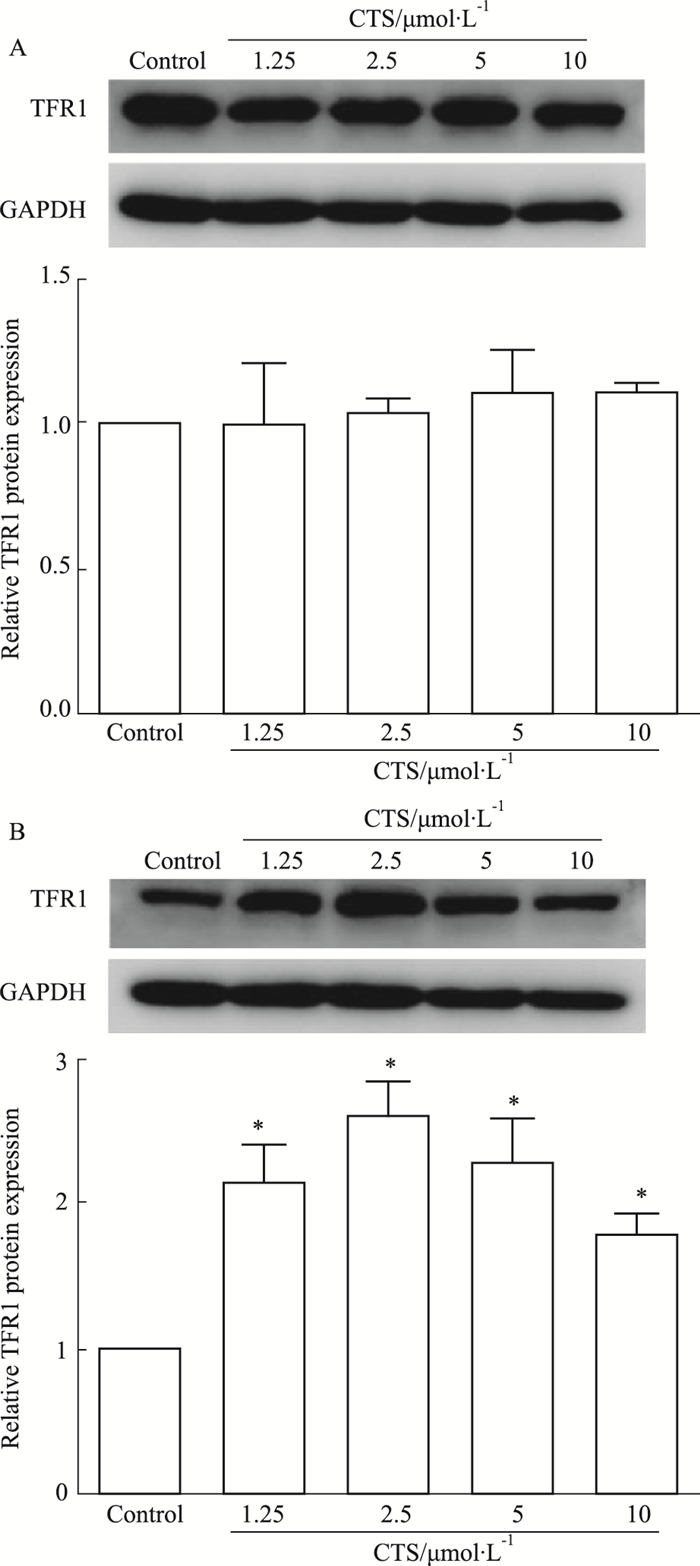
|
| Fig 3 Effect of CTS on TFR1 expression in A549 cells (A) and A549/DDP cells (B) (x±s, n=3) *P<0.05 vs control |
铁死亡是一种铁离子依赖性的细胞调控死亡模式,最初是在对神经系统疾病的研究中被提出。随着研究的深入,铁死亡在肿瘤发生发展中的作用也逐渐凸显出来。许多研究表明,多种药物在肿瘤细胞中均可诱导铁死亡的发生,影响铁死亡相关基因的表达。研究发现,顺铂能诱导A549细胞和HCT116细胞发生铁死亡,并引起GPX4表达的变化[7]。同样,索拉菲尼靶向system Xc-引起肝癌等多种癌细胞发生铁死亡[8-9]。另外,柳氮磺胺吡啶能诱导乳腺癌细胞发生铁死亡,其机制可能和DMT1 mRNA表达水平的升高有关[10]。因此,诱导肿瘤细胞发生铁死亡可能成为肿瘤治疗的一个新思路。
CTS作为传统中药丹参中的有效成分,具有较好的药理活性,在抗菌消炎和抗心血管疾病中均有较好的药理作用。在肿瘤治疗方面,CTS可以影响肿瘤细胞内的氧化还原平衡,从而抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡;另外,CTS可以抑制肿瘤血管的生成并抑制肿瘤的迁移[11]。本课题组前期研究报道,CTS可以下调顺铂耐药A549/DDP细胞Nrf2表达,影响Nrf2下游靶基因从而使细胞对顺铂敏感性升高[12]。CTS可以影响肿瘤细胞的ROS水平,引起细胞内的氧化还原平衡的改变。我们推测,CTS对肿瘤细胞的增殖抑制作用可能与铁死亡相关通路有所关联,然而目前这方面的研究仍然较少。本研究初步探讨CTS对铁死亡相关通路的基因表达水平的影响,为更深入的研究提供理论基础。
研究发现,CTS可不同程度影响A549细胞和A549/DDP细胞铁死亡相关基因的表达。CTS处理后,A549细胞HSPB1和GPX4的mRNA表达水平增高,IREB2、VDAC2和VDAC3的mRNA表达水平降低;A549/DDP细胞TFR1和IREB2的mRNA表达水平增高,VDAC3的mRNA表达水平降低。前期研究表明,抑制转铁蛋白受体1(transferrin receptor 1,TFR1)和二价金属离子转运体1(divalent metal transporter 1,DMT1)的表达可以抑制铁摄取,从而抑制铁死亡的发生;铁反应元件结合蛋白2(iron-responsive element-binding protein 2,IREB2)是与铁代谢相关的主要转录因子,抑制其表达可提高铁代谢相关基因的表达,从而抑制铁死亡;热休克蛋白β-1(heat shock protein beta-1,HSPB1)的磷酸化可阻断铁摄取和ROS的产生,从而抑制铁死亡的发生;线粒体电压依赖性阴离子通道2/3(mitochondrial voltage-dependent anion channel 2/3,VDAC2/3)位于线粒体外膜,是细胞内代谢物分子进出线粒体的必经通道,敲低VDAC2/3会抑制铁死亡的发生;谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)将具有潜在毒性的脂质过氧化物转化为无毒的脂醇,抑制GPX4表达,会诱导由脂质过氧化产生的ROS,从而诱导铁死亡[5]。CTS对两种细胞中上述基因的不同程度影响是否与铁死亡及肿瘤细胞增殖相关,有待进一步实验证明。
TFR1是细胞膜上的糖蛋白受体,是调节细胞铁稳态的关键调节因子。Fe3+通过TFR1进入细胞,被STEAP3亚铁还原酶还原为Fe2+,再通过DMT1介导释放到细胞质的iron pool[5],Fe2+的蓄积导致大量ROS的产生,最终诱导铁死亡的发生[13-14]。对铁死亡敏感的细胞TFR1表达水平较高,敲除TFR1后可抑制铁死亡阳性药erastin引发的铁死亡[15]。经CTS处理后,A549细胞TFR1 mRNA和蛋白水平变化不明显,而A549/DDP细胞TFR1 mRNA和蛋白水平均上调。细胞存活率实验发现,A549/DDP对CTS的处理更敏感,提示可能与CTS处理后TFR1表达水平的变化有关,具体机制有待进一步探讨。
综上所述,本研究发现CTS能够不同程度抑制肺癌细胞A549与顺铂耐药A549/DDP细胞的增殖,且CTS对两种细胞铁死亡相关基因表达呈现不同程度影响。本研究为开展CTS的抗肿瘤相关机制研究提供新思路,并为CTS用于肺癌治疗提供理论和实验依据。
( 致谢: 本实验在中山大学药学院临床药理研究所完成,在此衷心感谢对本实验给予指导和帮助的各位老师和同学。)
| [1] |
Torre L A, Siegel R L, Jemal A. Lung cancer statistics[J]. Adv Exp Med Biol, 2016, 893: 1-19. |
| [2] |
Hirsch F R, Scagliotti G V, Mulshine J L, et al. Lung cancer: current therapies and new targeted treatments[J]. Lancet, 2017, 389(10066): 299-311. doi:10.1016/S0140-6736(16)30958-8 |
| [3] |
O'Grady S, Finn S P, Cuffe S, et al. The role of DNA repair pathways in cisplatin resistant lung cancer[J]. Cancer Treat Rev, 2014, 40(10): 1161-70. doi:10.1016/j.ctrv.2014.10.003 |
| [4] |
Stockwell B R, Friedmann Angeli J P, Bayir H, et al. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-85. doi:10.1016/j.cell.2017.09.021 |
| [5] |
Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23(3): 369-79. doi:10.1038/cdd.2015.158 |
| [6] |
Dixon S J, Stockwell B R. The role of iron and reactive oxygen species in cell death[J]. Nat Chem Biol, 2014, 10(1): 9-17. doi:10.1038/nchembio.1416 |
| [7] |
Guo J, Xu B, Han Q, et al. Ferroptosis: a novel anti-tumor action for cisplatin[J]. Cancer Res Treat, 2018, 50(2): 445-60. doi:10.4143/crt.2016.572 |
| [8] |
Louandre C, Marcq I, Bouhlal H, et al. The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 356(2 Pt B): 971-7. |
| [9] |
Louandre C, Ezzoukhry Z, Godin C, et al. Iron-dependent cell death of hepatocellular carcinoma cells exposed to sorafenib[J]. Int J Cancer, 2013, 133(7): 1732-42. doi:10.1002/ijc.28159 |
| [10] |
喻浩宸, 陈锐, 郭世朋, 等. 柳氮磺吡啶诱导乳腺癌ZR-75-1细胞发生铁死亡及其机制研究[J]. 肿瘤, 2018, 38(10): 933-41. Yu H C, Chen R, Guo S P, et al. Sulfasalazine induces ferroptosis of breast cancer ZR-75-1 cells and its mechanism[J]. Tumor, 2018, 38(10): 933-41. doi:10.3760/cma.j.issn.1004-4221.2018.10.013 |
| [11] |
金忠明, 洪伟鹏, 黄民, 金晶. 丹参在逆转肿瘤耐药及化疗增敏中的研究进展[J]. 中国药理学通报, 2018, 34(7): 889-91. Jin Z M, Hong W P, Huang M, Jin J. Advancement of Salvia miltiorrhiza on reversing tumor resistance and chemotherapy sensitization[J]. Chin Pharmacol Bull, 2018, 34(7): 889-91. doi:10.3969/j.issn.1001-1978.2018.07.001 |
| [12] |
Xia C, Bai X, Hou X, et al. Cryptotanshinone reverses cisplatin resistance of human lung carcinoma A549 cells through down-regulating Nrf2 pathway[J]. Cell Physiol Biochem, 2015, 37(2): 816-24. doi:10.1159/000430398 |
| [13] |
Yang W S, SriRamaratnam R, Welsch M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-31. doi:10.1016/j.cell.2013.12.010 |
| [14] |
Dixon S J, Lemberg K M, Lamprecht M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-72. doi:10.1016/j.cell.2012.03.042 |
| [15] |
Yang W S, Stockwell B R. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15(3): 234-45. doi:10.1016/j.chembiol.2008.02.010 |

