

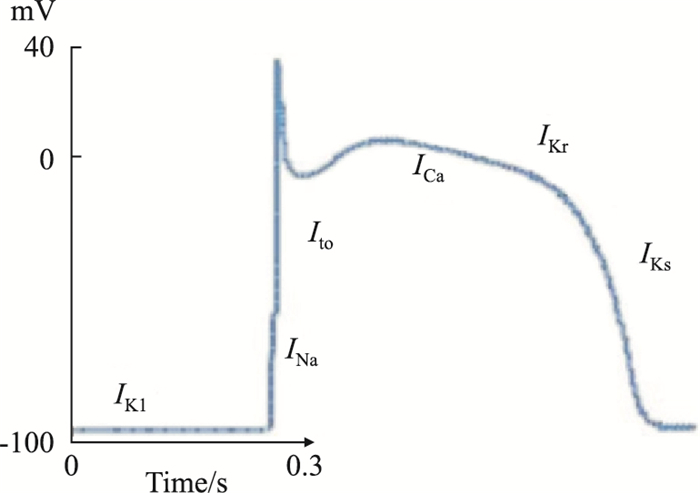
心肌离子通道是产生动作电位的基础,一般情况下,心肌细胞在静息状态时接受有效刺激,迅速产生动作电位,引发收缩效应。本文以心室乳头肌细胞为例,分析心肌细胞的动作电位,心室乳头肌细胞的动作电位具体分为以下几个时相,如Fig 1所示。
|
| Fig 1 Action potential phase and participating ion channels |
0相:细胞膜除极化,钠离子INa(Nav1.5)或钙离子进入细胞,静息膜电位发生快速变化,从-90~+30 mV。1相:激活了短暂的外流复极钾离子流Ito(Ito.f, Kv4.2/4.3; Ito.s, Kv1.4/1.7/3.4)。2相:动作电位的平台期,由于多种电流成分同时发挥作用,较为重要是L-型钙通道激活引起的内向电流ICa, L(Cav1.2),与Ikr和Iks钾通道激活产生的外向电流抵消。3相:复极期,外向钾电流包括延迟整流电流Ikr(Kv11.1, hERG)和Iks(Kv7.1, KvLQT)与部分内向整流钾通道电流Iki(Ik1, Kir2.1/2.2;IK, ATP, Kir6.2)的增强以及ICa, L电流的关闭,促进膜的快速复极。4相:舒张期,3相激活的内向整流钾通道以及双孔钾通道Ikp(TASK、TWIK、TREK)维持静息膜电位-90 mV左右,对于自律细胞还伴随超级化激活的阳离子通道电流If或Ih(HCN2/4)的激活,以及钠-钙交换体(sodium-calcium exchanger,NCX)使生电作用增强,导致细胞膜除极和重启动作电位(Fig 1)。
上述离子通道功能异常会引起心律失常,当Na+通道阻滞时,进入细胞的INa减小,使动作电位时程延长,引起折返性心律失常。当出现持续的Na+内流时,钠-钙交换增加,细胞内的钙离子浓度增高,导致后除极和快速性心律失常。Ikr电流受阻滞时,动作电位时程会延长,会诱发尖端扭转型室性心动过速。Iks减弱,导致QT间期延长,引起致命性室性心律失常。同样,Iks增强,导致QT间期缩短,也会引发心律失常。心肌细胞Ca2+流异常,导致钙稳态失衡,引起延迟后除极。L型钙通道电流被抑制会导致窦性停搏、窦房阻滞和房室传导阻滞[1]。
有潜在心肌缺血、心衰、心绞痛或者伴有心肌离子通道病变时,遇到情绪激动、应激状况,交感张力异常增高,或者使用外源性肾上腺素,如过敏性休克[2]以及与局麻药物合用[3],体内儿茶酚胺类物质升高,会诱发快速型心律失常,甚至出现室颤或猝死情况。主要原因是心肌离子通道功能调节发生异常,导致心肌自律性提高、后除极及触发活动增加、传导异常伴随折返活动、心肌除极或复极化程度不一致。反映在心肌动作电位上的变化主要体现在以下几方面[4]:最大舒张电位、阈电位水平以及4相自动除极速率发生改变并影响到心肌自律性;复极时间过长、钙内流较多诱发后除极和触发活动;改变膜反应性和传导性引发折返激动;有效不应期(effective refractory period,ERP)与动作电位时程(action potential duration,APD)比值大小影响到心肌细胞均一性。总之,上述一种或多种离子通道的异常均有可能导致心律失常。
肾上腺素作为一种重要的儿茶酚胺类神经递质和急救药物,对心脏的调节作用复杂,这可能与它对α和β受体选择性不同[5],涉及的信号转导通路有别有关。有研究表明,肾上腺素低浓度(10-7 mol·L-1)可延长动作电位时程,高浓度(10-5 mol·L-1)可以缩短动作电位时程[6],甚至有人提出,不同浓度的肾上腺素可用来预测长Q-T间期综合征(long Q-T syndrome,LQTS)综合征患者突发致死性心脏病的风险[7]。因此,研究肾上腺素受体激活后的信号转导过程,分析肾上腺素对复极过程中主要离子通道的调节作用,以期加深对儿茶酚胺类物质引发室性心律失常的分子机制认识。
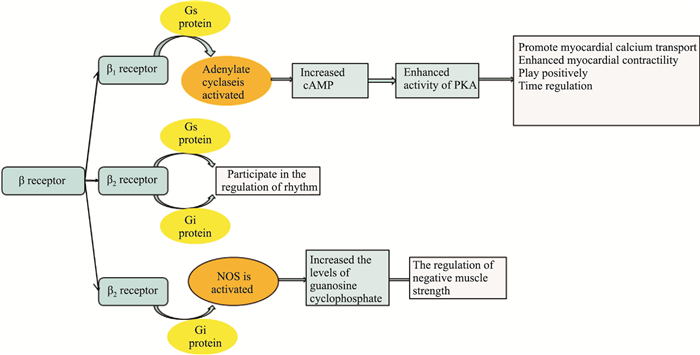
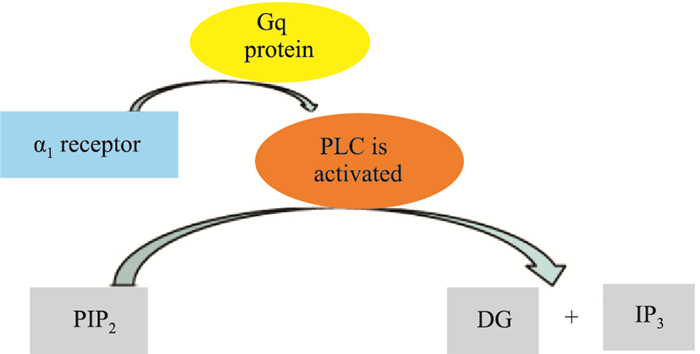
2 肾上腺素激活的受体类型及相偶联的信号转导途径肾上腺素受体是典型的G蛋白偶联受体,分为α受体和β受体两类,α受体又分α1、α2受体,β受体分为β1、β2、β3受体。肾上腺素对β受体亲和力比α受体强,所以低浓度时以β效应占主导,高浓度α受体效应为主。肾上腺素β1受体激活可影响Gs-AC-cAMP-PKA-L-Ca2+信号通路,即β1受体激活后,与Gαs蛋白偶联,激活腺苷酸环化酶(adenylate cyclase,AC),导致cAMP增多,依赖cAMP的蛋白激酶A(protein kinase A,PKA,PKA)活性增强,导致心肌细胞上的通道蛋白磷酸化,促进心肌钙转运,心肌收缩性增强,发挥正性变力、变时调节作用(Fig 2)。β2受体在蒲肯野纤维和窦房结有较高的分布,主要作用是参与心律调节。β2受体除了可以通过经典的Gs途径外,还可以通过Gi途径激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、磷酸二酯酶(phosphodiesterases,PDEs)、ERK途径,发挥转录调节作用。β3受体与Gαs和Gαi型G蛋白偶联,更多地表现出Gi蛋白激活、一氧化氮合酶(nitric oxide synthase,NOS)活化、细胞内环磷酸鸟苷水平增加,显示负性肌力调节作用。β受体,特别是β2亚型很容易脱敏,主要原因是由于G蛋白偶联受体激酶(G protein-coupled receptor kinases,GRKs)将受体磷酸化后,与抑制性蛋白β-arrestin结合,促进了受体内吞[8]。肾上腺素作用的α受体可分α1和α2两个亚型,以激动α1(α1A、α1B、α1D)受体亚型为主,可激活Gq-PLC-PIP2-IP3/DAG-Ca2+/PKC信号通路。正常情况下,心脏α1受体约占心肌肾上腺素受体总量的10%,β受体约占90%。心衰时,α1受体会上调,因此,在病理情况下,α1受体支配作用会增强。刺激心脏α1受体可以产生正性肌力作用,不同于β受体的强效快速作用,α1受体产生的收缩作用缓慢。这主要是由于α1受体与Gq蛋白偶联,α1受体激活引起细胞膜内效应器酶—磷脂酶C(phospholipase C,PLC)活化,磷脂酰二磷酸肌醇(phosphatidylinositol diphosphate,PIP2)水解成三磷酸肌醇(inositol triphosphate,IP3)和二酰甘油(diacylglycerol,DG)。IP3和DG作为第二信使,在细胞内发挥信息传递作用,IP3首先与内质网外膜上的Ca2+通道结合,使内质网释放钙离子入胞质,导致胞质内钙离子浓度明显增加,钙离子与细胞内钙调蛋白(calmodulin,CaM)结合,激活下游靶蛋白,进而调节细胞的功能活动。DG也可以通过激活PKC,进一步磷酸化离子通道,调节细胞生理病理变化[9]转导途径见Fig 3。α2(α2A、α2B、α2C)受体与Gi/o型G蛋白偶联,主要分布于支配心肌的神经突触前膜及神经节上,对递质分泌起重要调控作用。
|
| Fig 2 Regulation of β receptor |
|
| Fig 3 Regulation of α1 receptor |
L-型钙通道是心肌细胞动作电位形成平台期的主要离子通道,与细胞内钙离子浓度密切相关,影响着心肌收缩力。肾上腺素一个非常明确的作用就是经由cAMP/PKA,磷酸化L-Ca2+通道的α亚基羧基端,增加ICa, L电流,其中激动心肌β1受体可产生一个可扩散的cAMP的升高,而激动β2受体由于与Gs和Gi的双向偶联,主要由于β2R、Gαs、AC、PKA与L-Ca2+通道形成的大分子信号复合体位于小窝内,仅形成或引起较为局限的L-Ca2+通道的激活效应[10]。所以肾上腺素激活β受体,无论是β1还是β2,引起的钙内流都是导致心肌收缩、形成动作电位2相平台期重要原因,也是延长APD的一个主要参考因素。
激活α1受体后对L-Ca2+通道的影响一直是很有争议,一方面,有文献报道,α1受体激活可以抑制ICa, L电流,主要通过PKC对L-Ca2+通道磷酸化实现,这一作用可部分拮抗β受体激活引起的胞内钙升高效应[11]。另有一种报道认为,用苯肾上腺素激活α1受体虽然可以引起心肌正性肌力作用,但与缓慢钙内流并没有关系[12]。也有报道,在新生大鼠心室肌细胞上激活α1受体可引起L-Ca2+通道电流增强。近期随着对α1受体亚型分类的研究的不断深入,认为α1受体增强ICa, L电流作用是通过α1A受体激活Gq/11-PLC-DAG-PKC-CaMKII途径实现;抑制ICa, L电流效应是通过α1B受体激活-Go型G蛋白生成的Gβγ直接对L-Ca2+通道的调节作用[8]。还有一种可能是与心肌PKC亚型种类和分布不同调节作用有关[13]。目前,虽然α1受体对L-Ca2+通道调节作用的详细机制仍不清楚,但是用苯肾上腺素激活α1受体后,使心室肌细胞的APD延长现象却比较肯定,分析原因除了L-Ca2+通道调节参与之外,还应该与调节3相复极化钾通道有关。
4 对KCNQ1通道及Iks电流的调节作用心室肌3相复极化过程中Iks电流是引起快速复极的主要外向离子流,它是由KCNQ1与辅助亚基KCNE1构成。肾上腺素激活α1受体,通过PLC水解会导致心肌Iks电流的直接抑制,这种抑制效应在KCNQ1通道基因突变(R174C, R243C, R366Q和R555C)的患者上表现会更明显,导致病人交感神经轻微波动,就会引发LQT1综合征。其中一个重要原因是突变导致KCNQ1通道与PIP2亲和力减弱,通道电流减小,受体激活时,引起PIP2水解对通道电流抑制作用更敏感,心肌复极化时程明显延长,诱发室性心律失常[14]。
激动β1受体对Iks电流最主要的影响,主要是通过Gαs-AC-cAMP-PKA途径磷酸化KCNQ1/KCNE1通道蛋白,使Iks电流增强[15]。当然除了PKA之外,α1受体激活Gq/11-PLC-PIP2-DG途径激活PKC,也可以将KCNQ1/KCNE1通道磷酸化,在一定程度上也会增强Iks电流。这种由PKA或PKC介导的增强Iks电流的作用机制复杂,涉及通道动力学改变、与PIP2的亲和力、以及通道蛋白在膜上表达变化。总之,肾上腺素通过激活β1受体促进Iks钾离子外流的作用,在一定程度上可以抵消L-Ca2+通道开放导致的钙内流,加之Iks电流具有慢激活和慢失活特征,随时间推移加上hERG通道开放,共同促进钾外流作用明显增强,形成了3相快速复极。由此看来,肾上腺素导致的心肌APD缩短,其关键因素与其通过PKA/PKC途径,增强Iks电流的调节作用分不开[16]。
5 对hERG通道及Ikr电流的调节作用延迟整流钾电流Ikr是复极化过程中又一个主要外向离子流,是由α亚基(hERG基因编码)与β亚基(minK或MiRP1)共同构成。肾上腺素激动α受体(主要为α1A受体)可以抑制hERG电流,并且使通道激活曲线向去极化方向位移,其机制与PLC水解PIP2有直接关系[17]。除此之外,α受体激活还可以通过DAG-PKC途径调节该通道,研究结果提示,PKC磷酸化参与该通道调节,而且不同亚型的PKC对通道有特异性抑制途径[18]。
β受体对hERG通道调节颇有争议,Heath等[19]研究认为,异丙肾上腺素激活β受体可以减少通道C-型失活,增强hERG电流。Karle等[20]的研究认为会抑制hERG通道电流,机制是因为胞内Gs-AC-cAMP激活PKA,磷酸化hERG通道所致。与PKA抑制作用相对应的是,cAMP与hERG通道C端有一段cNBD(cyclic nucleotide binding domain)序列可以结合,在一定程度上可减弱这种调节效应,而且后来发现,辅助亚基minK和hMiRP1也参与了β1受体激活导致的PKA依赖性的调节。近期有报道,β-arrestin参与介导了hERG通道电流的增加作用,这样使得β受体的调节hERG通道的作用变得更加复杂,机制研究还会进一步深入。
比较肾上腺素对Iks和Ikr电流调节的异同,不难发现,无论通过PIP2水解还是PKC的磷酸化,对hERG通道调节作用结果是一致的,均会导致抑制效应。其实临床还有很多药物,如抗心律失常药、喹诺酮类抗菌药、抗癌药、抗组胺药等,会对hERG通道有不同程度的阻滞,还有部分人群该基因突变后通道功能下调,诸多因素的作用会导致3相复极化时程相对延长,诱发LQT2综合征,严重时还会发生尖端扭转性室性心动过速,甚至心源性猝死。所以近些年关于对hERG通道调控研究很热,包括一些药物筛选时,考虑其潜在致心律失常风险,首先要排除对hERG通道的影响。
6 对Kv4通道及Ito电流的调节作用瞬时外向钾电流Ito由快成分Ito, f和慢成分Ito, s构成,是心肌I相复极化的主要离子通道,其中快成分Ito, f主要是由Kv4.2/4.3编码α亚基与KChIP2为主的多种β亚基(如KChIP1、KChIP3、MiRP、Mink、DPP10)等共同构成,有电压依赖性特征,是复极I期主要电流,主要表达在心外膜,编码慢成分Ito, s的α亚基是Kv1.4/1.7构成,它可由肌浆中Ca2+激活,主要表达在心内膜。由于Kv4.3通道的表达都呈现出跨心肌膜梯度差异,这一特性被认为是心脏跨心肌膜电生理差异性的结构基础,在各种心脏疾病,如心肌梗死、心力衰竭中,Kv4.3通道表达或功能改变导致的早期复极化异常,被认为是各种恶性心律失常的致病原因,尤其是一种遗传性心律失常疾病Brugada综合征,主要是因为KV4.3通道上发现了两个氨基酸点突变(G600R和L450F),导致快速瞬时外向钾电流增大,进而引起动作电位穹顶的稳定消失,在心电图上表现为ST段特征性异常改变。目前,认为α肾上腺素能受体可以通过PKC途径磷酸化Kv4.3,抑制通道电流[21],并且这个过程受β亚基控制和调节,而且这种调节仅局限于小窝蛋白(脂筏一种)的通道和受体。对于β肾上腺受体对Ito电流的调节,Po等[21]报道,β1受体可以通过Ca2+-CaMK-NFκB途径产生抑制作用,而Gallego等[22]认为,通过β2受体提高Kv4.2和Kv4.3在膜上表达,增强通道电流,调节途径是通过Arrestin-cSrc-Ras-MEK1/2-ERK1/2信号通路,以及MAPK级联调节来实现,其它更详细的作用机制并不是很清楚。由于Ito在不同种属表达差异较大,在生长的不同时期也有很大差异,主要原因与β亚基多样性调节有关,这增加了研究的难度,但是,Ito电流的抑制或增强,均会对复极早期产生明显影响,尤其是2相复极的离子通道功能影响明显。例如,长期交感张力增高导致去甲肾上腺素释放增多,因α受体长期活化对Ito形成的抑制,会抬高2相平台期膜电位,导致ICa, L内流增多,成为心肌病变的重要机制之一[23]。
7 对Kir2.1/2.2和Kir6.2通道及Iki电流的调节作用心肌内向整流钾通道(IK1通道)是维持和稳定心肌静息电位最重要的离子通道,也是参与动作电位复极后期重要的离子通道,人的心室肌中记录的Iki电流主要Kir2.1和Kir2.2构成的同源及/或异源四聚体通道电流,以及Kir6.2和SUR2A(辅助亚基,磺酰脲类受体)构成的IK, ATP电流构成。α1受体激活引起的PIP2水解可导致Iki电流抑制,包括Kir2.1、Kir2.2、Kir6.2各种亚型,主要原理是因为PIP2分子中带负电的头部与各类通道中带正电的氨基酸残基之间的静电作用,各种激酶,无论是PKC,还是PKA,对Iki电流,多数是影响了PIP2合成或与通道的亲和力[24]。激活PKC(PKCβ亚型)对Kir2.1/2.2通道磷酸化可以形成电流抑制,PKC还可以使通道内化抑制KATP电流。肾上腺素β受体对IK1通道电流的调节主要通过PKA实现,可以通过PKA-AKAPs途径实现对Kir2.1/2.2的抑制,然而,β3亚型却可以通过PKA激活Kir2.2亚型,通过PKC激活Kir2.1,因此,β受体对IK1电流调节具有多样性。
8 总结综上所述,在心室肌复极化过程中,Ito、ICa, L、Ikr、Iks、IK1均是构成动作电位复极化的主要通道电流,交感神经兴奋释放的儿茶酚胺类物质,均可以通过α和β受体影响上述离子通道。α受体主要的调节途径包括:通过PLC调节细胞膜磷酯(PIP2)代谢导致的抑制作用,影响最明显的是对KCNQ1、hERG和Kir2通道,分别导致Iks、Ikr、IK1电流抑制;通过DAG-PKC途径对通道苏氨酸和丝氨酸残基的磷酸化,通常会导致Ito、Ikr、IK1电流抑制,导致Iks电流增强。随着对α受体亚型传导信号通路认识的不断加深,对通道调节的细节机制引起更多关注,例如,α1A亚型激活后产生Gβγ可以与很多离子通道产生直接作用。β受体在心室肌上主要为β1亚型占绝对优势,并由cAMP-PKA磷酸化途径介导了ICa, L和Iks电流增强效应。目前,针对β1受体对Ito和Ikr调节细节虽然还不是很清楚,甚至有些不一致,主要的原因可能是因为PKA途径升高胞内钙的现象非常明确,尤其是在正常的心肌生理活动中发挥重要调节作用,这也可能掩盖了其生理状态下对Ito和Ikr的调节作用。因此,研究病理状态下β受体对Ito和Ikr调节作用可能会更有意义。
分析肾上腺素对动作电位影响,也离不开α和β受体对上述离子通道功能调节的研究,动作电位是很多离子通道综合作用的体现,因此,在分析肾上腺素对APD影响时,也要综合对各离子通道调节规律进行综合分析。很长一段时间,人们对肾上腺素是缩短还是延长APD争议不断,主要还是因为动物种属不同、组织不同、条件不同可能产生不一样的结果,主要是因为离子通道调节机制的丰富多样性所导致。总的来说,低浓度时(10-7 mol·L-1)可使豚鼠心室乳头肌动作电位时程(APD)延长,高浓度(10-5 mol·L-1)使APD缩短[25]。而APD的延长效应在相对较低的外钙浓度下(0.6~1.2 mmol·L-1)明显,随着外钙浓度增高(>1.2 mmol·L-1),这种延长效果就被高钙所导致的缩短效应所掩盖。高浓度肾上腺素(10-5 mol·L-1)对APD的影响表现出双相的,先短暂延长,而后长时间缩短的效应。其实,肾上腺素对APD的作用还不只是受外钙的影响,还受到刺激频率和峰张力影响,在一定范围内,增加刺激频率会使APD延长,相反会缩短;在刺激频率固定随着峰张力增加,APD逐渐缩短。通过对离子通道调节机制的分析,不难看出肾上腺素延长动作电位时程的影响,主要还是促进了ICa, L电流或抑制了外向钾电流(Ito、Ikr、IK1)所导致,缩短APD的作用主要是促进了钾外流(包括所导致Iks、Ikr)所致,或者是ICa, L电流的抑制作用。
( 致谢: 感谢河北医科大学药理教研室许彦芳教授给予的指导。)
| [1] |
张铭慧, 尹永强, 康毅, 等. 牛磺酸镁对缺氧/复氧致大鼠心肌细胞钙离子通道异常的影响[J]. 中国药理学通报, 2014, 30(10): 1367-72. Zhang M H, Yin Y Q, Kang Y, et al. Effect of magnesium taurine on calcium channel abnormalities in rat cardiomyocytes induced by hypoxia/reoxygenation[J]. Chin Pharmacol Bull, 2014, 30(10): 1367-72. doi:10.3969/j.issn.1001-1978.2014.10.009 |
| [2] |
Campbell R L. Epinephrine in anaphylaxis:higher risk of cardiovascular complications and overdose after administration of intravenous bolus epinephrine compared with intramuscular epinephrine[J]. J Allergy Clin Immunol Pract, 2015, 3(1): 76-80. doi:10.1016/j.jaip.2014.06.007 |
| [3] |
Gonca E, Catli D. The effects of lidocaine with epinephrine on bupivacaine-induced cardiotoxicity[J]. Turk J Anaesthesiol Reanim, 2018, 46(6): 447-52. doi:10.5152/TJAR.2018.64624 |
| [4] |
Tse G. Mechanisms of cardiac arrhythmias[J]. Journal of arrhythmia, 2016, 32(2): 75-81. doi:10.1016/j.joa.2015.11.003 |
| [5] |
Molinoff P B. Alpha- and beta-adrenergic receptor subtypes properties, distribution and regulation[J]. Drugs, 1984, 28(2): 1-15. |
| [6] |
Quadbeck J, Reiter M. Cardiac action potential and inotropic effect of noradrenaline and calcium[J]. Naunyn Schmiedebergs Arch Pharmacol, 1975, 286(4): 337-51. doi:10.1007/BF00506649 |
| [7] |
Bos J M, Ackerman M J. Arrhythmias:Epinephrine test for sudden cardiac death——is it too early[J]. Nat Rev Cardiol, 2012, 9(12): 675-6. doi:10.1038/nrcardio.2012.155 |
| [8] |
Nuber S. β-Arrestin biosensors reveal a rapid, receptor-dependent activation/deactivation cycle[J]. Nature, 2016, 531(7596): 661-4. doi:10.1038/nature17198 |
| [9] |
殷健, 郭会彩, 王永利. 肾上腺素能受体对心肌钠钾泵的亚基特异性调节[J]. 中国药理学通报, 2011, 27(2): 156-8. Yin J, Guo H C, Wang Y L. Subunit-specific regulation of adrenergic receptors on myocardial sodium-potassium pump[J]. Chin Pharmacol Bull, 2011, 27(2): 156-8. |
| [10] |
Pabbidi M R, Ji X, Maxwell J T, et al. Inhibition of cAMP-dependent PKA activates beta2-adrenergic receptor stimulation of cytosolic phospholipase A2 via Raf-1/MEK/ERK and IP3-Dependent Ca2+ signaling in atrial myocytes[J]. PLoS One, 2016, 11(12): e0168505. doi:10.1371/journal.pone.0168505 |
| [11] |
Van der Heyden M A G, Wijnhoven T J M, Opthof T. Molecular aspects of adrenergic modulation of cardiac L-type Ca2+ channels[J]. Cardiovasc Res, 2005, 65(1): 28-39. |
| [12] |
Hescheler J, Nawrath H, Tang M, et al. Adrenoceptor-mediated changes of excitation and contraction in ventricular heart muscle from guinea-pigs and rabbits[J]. J Physiol, 1988, 1988(397): 657-70. |
| [13] |
O-Uchi J, Sasaki H, Morimoto S, et al. Interaction of alpha1-adrenoceptor subtypes with different G proteins induces opposite effects on cardiac L-type Ca2+ channel[J]. Circ Res, 2008, 102(11): 1378-88. doi:10.1161/CIRCRESAHA.107.167734 |
| [14] |
Huang H. Mechanisms of KCNQ1 channel dysfunction in long QT syndrome involving voltage sensor domain mutations[J]. Sci Adv, 2018, 4(3): 2631. doi:10.1126/sciadv.aar2631 |
| [15] |
Thompson E, Eldstrom J, Westhoff M, et al. cAMP-dependent regulation of I(Ks) single-channel kinetics[J]. J Gen physiol, 2017, 149(8): 781-98. doi:10.1085/jgp.201611734 |
| [16] |
Dvir M. Long QT mutations at the interface between KCNQ1 helix C and KCNE1 disrupt reulation by PKA and PIP2[J]. J Cell Sci, 2014, 127(18): 3943-55. doi:10.1242/jcs.147033 |
| [17] |
Kubo T, Ding W G, Toyoda F, et al. Phosphatidylinositol4-phosphate 5-kinase prevents the decrease in the HERG potassium current induced by Gq protein-coupled receptor stimulation[J]. J Pharmacol Sci, 2015, 127(1): 127-34. |
| [18] |
Liu X, Wang Y, Zhang H, et al. Different protein kinase C isoenzymes mediate inhibition of cardiac rapidly activating delayed rectifier K+ current by different G-protein coupled receptors[J]. Br J Pharmacol, 2017, 174(23): 4464-77. doi:10.1111/bph.14049 |
| [19] |
Heath B M, Terrar D A. Protein kinase C enhances the rapidly activating delayed rectifier potassium current, IKr, through a reduction in C-type inactivation in guinea-pig ventricular myocytes[J]. J Physiol, 2000, 522(3): 391-402. doi:10.1111/j.1469-7793.2000.t01-2-00391.x |
| [20] |
Karle C A, Zitron E, Zhang W, et al. Rapid component I(Kr) of the guinea-pig cardiac delayed rectifier K(+) current is inhibited by beta(1)-adrenoreceptor activation, via cAMP/protein kinase A-dependent pathways[J]. Cardiovasc Res, 2002, 53(2): 355-62. |
| [21] |
Po S S, Wu R C, Juang G J, et al. Mechanism of alpha-adrenergic regulation of expressed hKv4.3 currents[J]. Am J Physiol Heart Circ Physiol, 2001, 281(6): 2518-27. doi:10.1152/ajpheart.2001.281.6.H2518 |
| [22] |
Gallego M, Alday A, Alonso H, et al. Adrenergic regulation of cardiac ionic channels:Role of membrane microdomains in the regulation of kv4 channels[J]. Biochim Biophys Acta, 2014, 1838(2): 692-9. doi:10.1016/j.bbamem.2013.06.025 |
| [23] |
Perrier E, Kerfant B G, Lalevee N, et al. Mineralocorticoid receptor antagonism prevents the electrical remodeling that precedes cellular hypertrophy after myocardial infarction[J]. Circulation, 2004, 110(7): 776-83. doi:10.1161/01.CIR.0000138973.55605.38 |
| [24] |
Du X, Zhang H L, Lopes C, et al. Characteristic interactions with phosphatidylinositol 4, 5-bisphosphate determine regulation of kir channels by diverse modulators[J]. J Biol Chem, 2004, 279(36): 37271-81. doi:10.1074/jbc.M403413200 |
| [25] |
Toda N. Modification by Ca2+ removal, Mg2+ and Sr2+ of the membrane effect and the inotropic effect of norepinephrine in rabbit left atria[J]. J Pharmacol Exp Ther, 1972, 180(3): 698-709. |

