

2. 中山大学中山医学院药理学教研室,广东 广州 510080;
3. 郑州大学第一附属医院肿瘤科,河南 郑州 450052
2. Dept of Pharmacology, Zhongshan School of Medicine, Sun Yat-Sen University, Guangzhou 510080, China;
3. Dept of Oncology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
MicroRNAs(miRNAs)是一类小分子非编码RNA,通过碱基互补配对结合于靶mRNA,使之沉默或降解从而在转录后水平上抑制靶蛋白的合成[1]。MiR-124是一种高度保守的小编码RNA,从秀丽隐球菌到人等46种动物中均表达存在。它高表达于中枢神经系统,在神经形成和神经元的功能发展中发挥至关重要的作用[2]。相较于正常组织,miR-124在胶质瘤中表达量下降,转染miR-124可抑制胶质瘤的增殖[3]。同样,在宫颈癌组织样本及宫颈癌细胞系中,miR-124表达下调,恢复miR-124水平可抑制宫颈癌细胞的增殖[4]。
细胞缝隙连接(gap junction,GJ)是一种连接相邻细胞胞质的中空性蛋白质通道,由特殊的通道蛋白-连接蛋白(connexi,Cx)组成,可传递和扩散小分子物质(如代谢产物、离子等)到毗邻细胞内[5]。目前,人体内共发现21种Cx及相关基因,其中Cx43、Cx32、Cx26分布较广泛。不同器官、组织中Cx的分布也不同,例如:肝脏主要表达Cx32和Cx26,大脑和肺脏主要表达Cx43,乳腺组织Cx32和Cx26表达丰富,而宫颈癌Hela细胞内无任何Cx的表达[6]。另外,不同Cx组成的GJ通道,由于其通道孔径大小和对可通透物质的选择性不同,导致其传递的细胞信号也不同[7]。
近年来研究发现,GJ可影响miRNA的抗肿瘤作用,但主要集中在Cx43组成的GJ通道上。Hong等研究报道,在胶质瘤细胞和星形胶质细胞共培养体系中,GJ可在细胞间传递miR-5096和miR-4519从而促进胶质瘤细胞的侵袭转移[8]。我们课题组也发现,转染miR-124可抑制胶质瘤细胞U87和C6的增殖,改变GJ功能可影响miR-124对胶质瘤细胞的抑增殖作用[9]。但是,其它Cx组成的GJ对miRNA抗肿瘤作用的影响,及不同GJ在miRNA抗肿瘤过程中发挥作用的异同却缺乏相关研究。因此,我们选取了3种肿瘤细胞,分别表达不同的Cx及GJ,观察并对比miR-124对这3种细胞增殖性的影响,从而了解GJ在miRNA影响肿瘤细胞增殖过程中的不同作用。
1 材料与方法 1.1 试剂青霉素/链霉素(penicillin/streptomycin)、DMEM、FBS、胰酶(typsin)和多西环素(doxycyclin,Dox)购自于Gibco;甲叉双丙烯酰、BSA蛋白定量试剂盒和丙烯酰胺均购自于美国Bio-rad公司;Calcein AM和lipofectamineTM 2000购自于Invitrogen;miR-124 mimics和cy3标记的miR-124 mimics购自于锐博公司;ECL-plus化学发光剂购自GE公司;G418、结晶紫、二甲基亚砜、潮霉素和所有一抗均购自于Sigma公司;HRP标记的鼠二抗、硝酸纤维素膜(NC膜)购自于美国Amersham公司。
1.2 细胞系的获得和培养本实验用到的细胞系均由中山大学中山医学院药理教研室陶亮教授惠赠。Hela26和Hela32细胞由含有1个多克隆位点(用于表达Cx)和1个LacZ基因(用于转染细胞的鉴定)的双向表达载体质粒PBI(BD Biosciences公司)转染Tet-On Hela细胞,并经过挑选、扩增而构建的稳定转染细胞株。该PBI质粒Cx的表达是可以通过四环素对启动子的诱导而加以控制的。在野生型U87细胞内转染PRP.EX3d-MCS1>shCx43>PGK/puro质粒或对照质粒PRP.EX3d-MCS1>negative control>PGK/puro(赛业公司构建),并经过G418(0.3 mg·L-1)筛选获得稳定表达shRNA-Cx43的U87细胞株(U87shRNA-Cx43细胞)及其阴性对照细胞株(U87shRNA-NC细胞)。其中,Hela32和Hela26细胞培养于含10%FBS、G418(终浓度0.1 mg·L-1)、HYG(终浓度0.2 mg·L-1)和DMEM的细胞筛选液中,并在每次实验前48小时加Dox(终浓度1 mg·L-1)诱导Cx的表达;U87shRNA-Cx43和U87shRNA-NC细胞培养于含10%FBS、G418(终浓度0.3 mg·L-1)和DMEM的细胞筛选液中;野生型U87细胞培养于含10%FBS和DMEM的培养液中;以上所有细胞均置于37 ℃、5%CO2及饱和湿度的无菌培养箱中培养。
1.3 仪器细胞培养箱(ThermoScientific公司);倒置荧光显微镜(Motic公司);凝胶成像仪(Vilber公司);电泳仪、电泳槽及转移槽(六一生物科技有限公司);膜片钳系统(HEKA公司),膜片钳显微镜(Olympus公司);Sigma Plot10.0软件(Jandel Scientific公司)
1.4 MiR-124转染按照LipofectamineTM2000说明书操作,分别在实验细胞中转染miR-124 mimics和阴性对照miR-NC, Cy3标记的miR-124作为对照用于转染效率的测定。
1.5 标准细胞集落形成分析法(standard colony forming assay)测定miR-124对各实验细胞集落(克隆)形成的影响细胞经过筛选或诱导后种板,转染所需浓度的miR-124,6 h后,洗去培养液,胰酶消化收获细胞,计数并以50个/cm2的密度种在新的6孔板里,培养7 d后固定细胞,并以1%乙醇结晶紫常温孵育染色,洗掉多余的结晶紫,显微镜下计数细胞集落。
1.6 细胞接种荧光示踪实验(parachute Dye-coupling assay)检测GJ功能将实验细胞接种至12孔板,待生长融合后,取其中一孔吸掉培养液并加入含荧光指示剂calcein-AM(0.5 μmol·L-1)的DMED高糖培养基(0.5 mL)作为“供体细胞”,在37 ℃避光孵育30 min。Calcein-AM上所带的乙酰甲酯(acetoxymethylester,AM)在其进入细胞后被细胞的内酯酶水解,形成一种发绿色荧光能够在GJ间传递但不能透过细胞膜的calcein。胰酶收集孵育好的“供体细胞”,以500个/孔的密度接种到已生长融合的细胞(受体细胞)上。37 ℃避光共孵育4 h,待细胞贴壁并能形成稳定的GJ后,荧光显微镜拍照计数一个“供体细胞”周围含有发绿色荧光的“受体细胞”的个数作为评价GJ功能的指标。
1.7 WB检测Cx43、Cx26和Cx32的蛋白表达去除实验细胞的培养液,冰冷PBS清洗2遍后加入蛋白裂解液裂解细胞,细胞刮匙收获细胞后超声破碎,于4 ℃,12 000 g离心30 min取上清,采用BSA法蛋白定量后,制备含25 μg蛋白量的样品,95 ℃水浴锅中变性5 min,SDS-PAGE凝胶电泳中分离,转膜,5%脱脂奶粉/TBST封闭30分钟,孵育抗体,并用ECL-plus化学发光剂和凝胶成像系统曝光拍照,ImageJ软件对目的条带进行灰度分析。其中,抗体孵育条件如Tab 1所示。
| Protein | Primary antibodies | Second antibodies |
| Cx43 | 1 :3 000/5% milk | 1 :4 000/5% milk |
| Anti-HA 32 | 1 :1 000/2.5% milk | 1 :2 000/5% milk |
| Anti-HA 26 | 1 :2 000/2.5% milk | 1 :4 000/5% milk |
参考Ran等[10]和Valiunas等[11]文献中的膜片钳方法,观察Cy3荧光标记的miRNA是否能在细胞之间传递。(1)准备载玻片和镊子。膜片钳针对12孔板的专用载玻片先用75%酒精消毒浸泡30分钟,然后放在干净的锡箔纸上在生物安全柜中正反面分别紫外消毒30 min,镊子也做相同的处理;(2)种板准备细胞。将消毒好的载玻片用镊子放入12孔板,并将处于对数生长期的U87细胞按照12万/孔的密度于实验前1 d傍晚种12孔板,铺板后显微镜下观察细胞均匀地铺在12孔板内以及载玻片上;(3)配制膜片钳电极内液和电极外液。按照Ran et al. (2012)文献中提到的浓度配制电极内外液:电极外液(in mmol·L-1):101 NaCl, 1 CaCl2, 4 MgCl2, 3KCl, 5 glucose, 1.25 NaH2PO4, 20.7 NaHCO3, pH 7.2, 250 Osm。电极内液(in mmol·L-1):102 K-gluconate, 0.085 CaCl2, 1.7 MgCl2, 17 NaCl, 0.94 EGTA, 8.5 HEPES,pH 7.2,235 mOsM,配制过滤好后分装入EP管内,避免污染;(4)d 2待细胞融合度为95%有GJ形成时,显微镜下观察细胞状态,必须状态良好,胞膜清楚光滑,折光性强才可以继续试验。镊子取出一个孔内的载玻片,放入含有电极外液的载波板内,用外液清洗几次细胞,放入防震台的显微镜下,暂时不用的孔板继续放回培养箱。避光的条件下,取5 nmol的Cy3标记的miR-124 mimics溶解在20 μL的电极内液中,然后打入拉好的电极内,先高阻封接胞膜,如果细胞不能自动破膜则抽吸吸管进行破膜,稳定后,关掉明场,打开荧光,观察电极尖与细胞接触处的荧光量,一切正常后用×20物镜的ABX51WI显微镜进行明场和暗场记录拍照。
1.9 统计学处理方法所有实验结果及统计图表均采用Sigma Plot10.0软件进行分析和绘制,所有数值均用x±s表示,组间计量资料比较采用单因素方差分析和t检验。
2 结果 2.1 在有/无Dox诱导条件下,miR-124对Hela26细胞增殖性的影响将有/无Dox诱导的Hela26细胞按15万/mL的密度分别种板,parachute和WB检测细胞GJ功能和Cx26表达。Fig 1A和1B结果显示:加Dox诱导的Hela26细胞,有明显的GJ功能和Cx26蛋白表达;转染Cy3标记的miR-124进Hela26细胞,甲醇固定细胞后荧光显微镜下计数发荧光细胞数,转染比例大于90%(Fig 1C)。在细胞密度为70%的时候转染50 nmol·L-1的miR-124 mimics,集落实验观察对细胞增殖性的影响,Fig 1D结果显示:Dox诱导不能影响Hela26细胞增殖;无论有/无Dox诱导,miR-124均可抑制Hela26细胞的增殖,但两者之间差异无统计学意义。
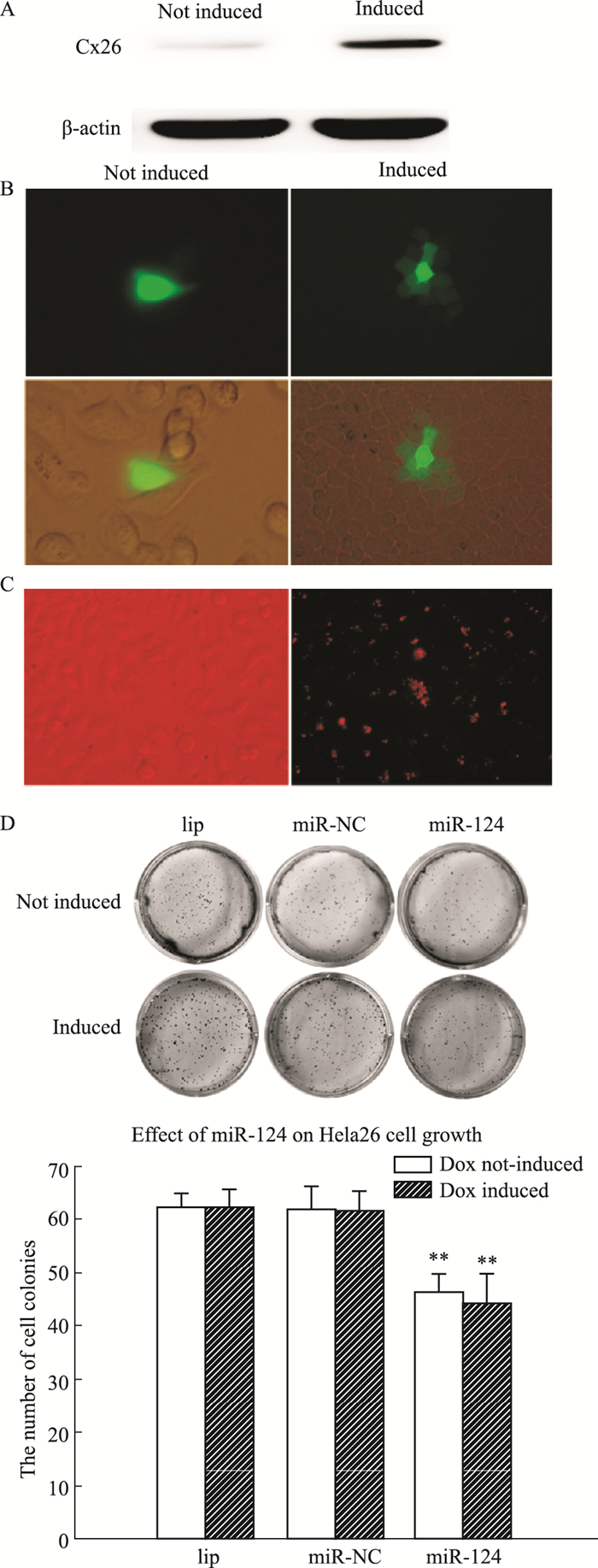
|
| Fig 1 Effect of miR-124(50 nmol·L-1)on proliferation of Hela26 cells (x±s, n=3) A: Dox induces Cx26 expression on Hela26 cells, as shown by Western blot. B: Dye spreads through Cx26-derived gap junctions, as shown by parachute dye coupling assay (Magnification:100). C: Identification of transfection efficiency using fluorescence microscopy in Hela26 cells with Cy3 labeled miR-124 transfection. D: Clonogenic survival of Hela26 cells in the presence of 50 nmol·L-1 miR-124 mimics.**P < 0.01 vs miR-NC group. |
同样,将有/无Dox诱导的Hela32细胞按15万/mL的密度分别种板,parachute和WB观察细胞GJ功能和Cx32表达,结果显示:相较于无Dox诱导,Dox诱导的Hela32细胞有显著的GJ功能和明显的Cx32蛋白表达(Fig 2A和2B);转染Cy3标记的miR-124到Hela32细胞,甲醇固定,荧光显微镜下对荧光细胞计数,得到转染比例大于90%(Fig 2C)。集落实验观察miR-124(50 nmol·L-1)对细胞增殖性的影响,Fig 2D结果显示:Dox诱导不影响Hela32细胞增殖;无论有/无Dox诱导,miR-124均可抑制Hela32细胞的增殖,但两者之间差异无统计学意义。
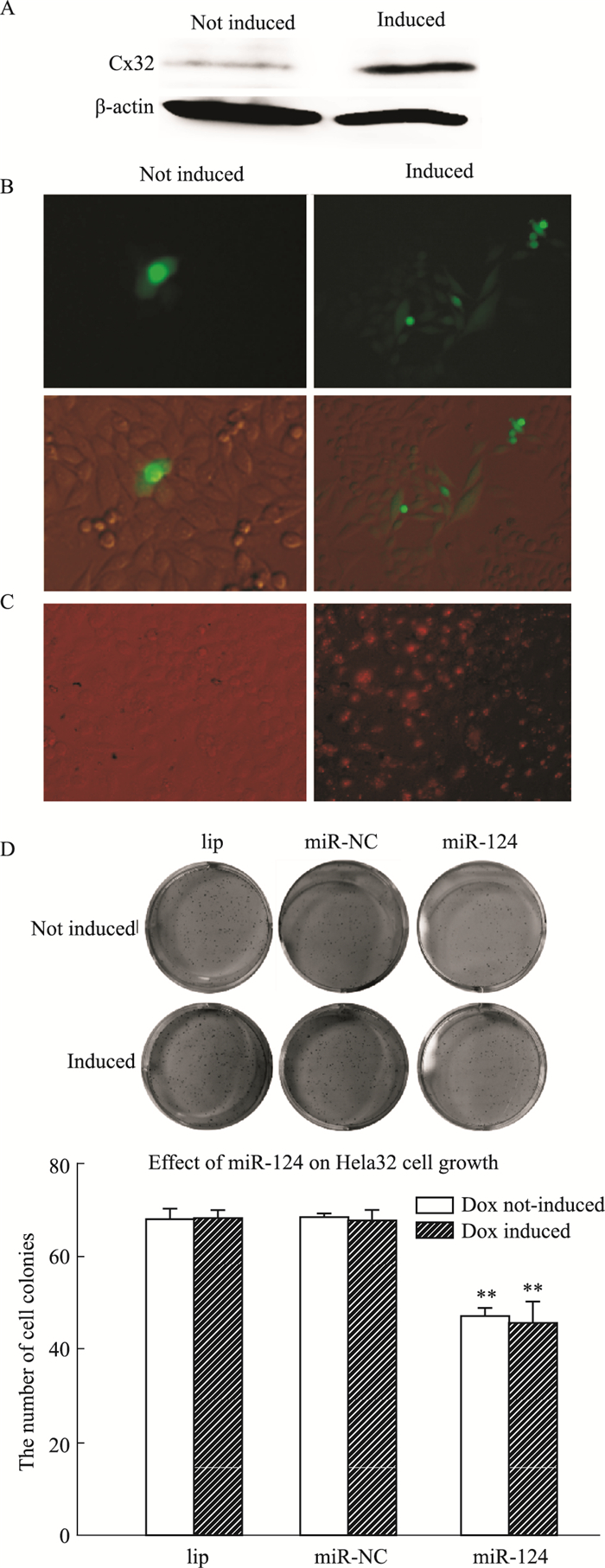
|
| Fig 2 Effect of miR-124(50 nmol·L-1)on proliferation of Hela32 cells (x±s, n=3) A: Western blot shows Cx32 expression on Hela26 cells after induction of Dox. B: Dye spreads through Cx32-derived gap junctions, as shown by parachute dye coupling assay (Magnification:100). C: Evaluation of transfection efficiency using fluorescence microscopy in Hela32 cells with Cy3 labeled miR-124 transfection. D: Clonogenic survival of Hela32 cells in the presence of 50 nmol·L-1 miR-124 mimics.**P < 0.01 vs miR-NC group. |
将U87shRNA-Cx43和U87shRNA-NC细胞分别按10万/mL的密度种板,细胞密度为80%的时候做parachute和90%的时候收集蛋白做WB,Fig 3A和3B结果显示:相较于U87shRNA-NC细胞,U87shRNA-Cx43细胞中GJ功能和Cx43表达明显减弱(P < 0.01);转染Cy3标记的miR-124到U87细胞,直接显微镜下计数荧光细胞,得到转染比例大于90%(Fig 3C)。集落实验检测50 nmol·L-1的miR-124对U87shRNA-Cx43和U87shRNA-NC细胞增殖性的影响,Fig 3D结果显示:miR-124可抑制U87shRNA-Cx43和U87shRNA-NC细胞增殖;单独降低Cx43蛋白表达不能影响U87细胞增殖,但联合miR-124转染可减弱miR-124的抑制增殖作用,提高细胞的集落形成数目(P < 0.05)。
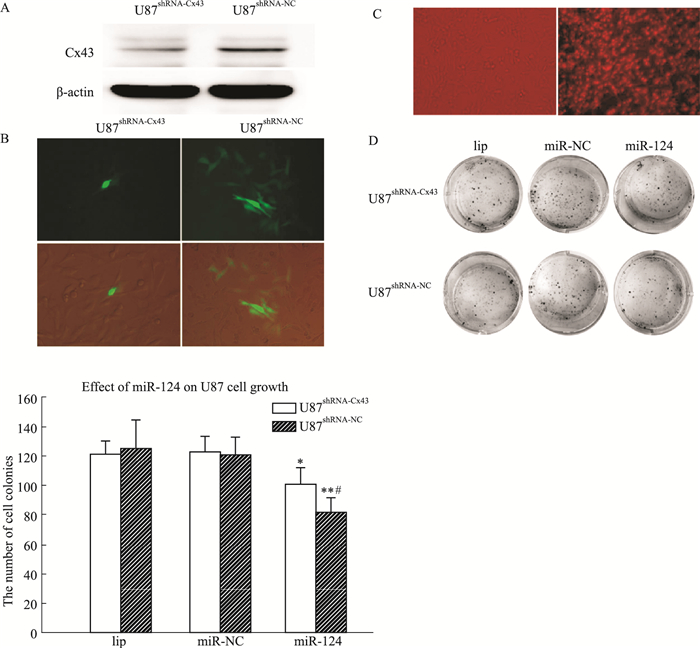
|
| Fig 3 Effect of miR-124 (50 nmol·L-1)on proliferation of U87 cells (x±s, n=4) A: The Cx43 expression in U87shRNA-Cx43 cells is significantly lower than in U87shRNA-NC cells, as shown by Western blot. B: The dye spreading number in Cx43-deficient cells (U87shRNA-Cx43) is much fewer than in the normal level in Cx43 cells (U87shRNA-NC) (Magnification:100). C: Evaluation of transfection efficiency using fluorescence microscopy in U87 cells with Cy3 labeled miR-124 transfection. D: miR-124 mimics can decrease U87shRNA-Cx43 cell survival, but is less effective than in reducing the cell colony forming in U87shRNA-NC cells. *P < 0.05, **P < 0.01 vs miR-NC group, #P < 0.05 vs miR-124 of U87shRNA-NC group. |
将处于对数增长期的野生型U87细胞接种在铺有载玻片的12孔板内,细胞融合度95%左右时,选取状态好,胞膜光滑平整,折光性好的细胞导入Cy3荧光标记的miR-124,如膜片钳示意图所示(Fig 4A)。带荧光的miR-124被导入玻璃电极内的,高阻封接在细胞膜上,破膜后只有电极尖端处发荧光,随着时间的延长,可观察到荧光逐渐布满整个细胞以及传递到相邻的细胞(Fig 4B)。

|
| Fig 4 Gap junction-mediated transport of miR-124 between U87 cells A: Schematic diagram of patch clamp method. B: Cy3 labelled miR-124 were injected into the source cell using the patch clamp technique, and the fluorescence transmitted from the sourcecell to the adjacent cell in 40 min (Magnification: 200). |
Cx是一个多基因家族表达的跨膜蛋白,不同Cx位于羧基末端和胞内连接肽链的氨基酸数目及排列方式不同,决定了由不同Cx组成的GJ通道,对信号物质的选择性以及细胞对其功能的调节方式也可以是不同的[7]。本研究中,我们同时观察了3种不同Cx组成的GJ对miR-124肿瘤抑制作用的影响发现无论诱导Cx26或Cx32的表达与否,不影响Hela细胞的增殖,并且由Cx26或Cx32组成的GJ也不影响miR-124的抗肿瘤作用。降低Cx43表达对U87细胞增殖无影响,但降低Cx43组成的GJ功能可减弱miR-124对胶质瘤细胞的抑增殖作用。膜片钳技术观察GJ对miR-124的通透性,发现标记在miR-124上的红色荧光可在U87细胞间进行传递。
Cx26、Cx32和Cx43是人体内分布最为广泛的3种Cx。天然表达Cx26或Cx32的肿瘤细胞系也很常见,但通常是同一个细胞系上同时表达两种或两种以上的Cx。本实验通过在Hela细胞上转染含有Cx26 cDNA或Cx32 cDNA的载体质粒PBI,并结合Tet-On系统,从而实现只有在实验需要的时候对Cx进行诱导,减少持续表达对细胞的伤害。U87细胞是研究Cx43及其GJ功能的常用细胞模型,作为U87细胞上最主要的一种Cx[12],Cx43及其GJ表达非常丰富。采用这3种细胞模型可有效降低其他Cx的影响和干扰,保证研究环境的相对单一性。
传统观点认为,GJ仅允许不超过1 000~1 500道尔顿的小分子物质通过,近年来研究发现分子量大于1 500道尔顿的物质如siRNA、miRNA也可以通过GJ[8-9, 11],但是不同GJ通道通透性的差异决定其对miRNA有选择性,不是所有的miRNA均能通过GJ。其中Cx43组成的GJ被认为可以传递miRNA并影响miRNA的抗肿瘤作用[8-9]。Valiunas等[11]在其研究中提到,由Cx26和Cx32组成的异质性GJ不能传递足够的siRNA来调节相邻细胞中聚合酶β基因的表达,但是Cx43组成的GJ却能够做到。Kolodny研究证明,由Cx26和Cx32组成的异质性GJ通道及同质Cx26组成的GJ对miRNA几乎都没有通透性[13]。这些研究提示不同Cx组成的GJ对miRNA的通透性确实存在差异,这可能是不同Cx组成的GJ对miR-124抗肿瘤作用影响不同的主要原因。
不同GJ的孔道内径可能是影响其对miRNA通透性的另一个重要原因。相较于早期研究认为GJ通道允许通透的最大分子量为1 000~1 500道尔顿,同型Cx43组成的GJ允许2 000~5 000道尔顿分子量的物质通过[14]。有人测定过不同Cx组成通道的孔径,从大到小依次为:Cx43>Cx32>Cx26[15],这与目前GJ与miRNA传递性的研究结果基本一致。但也不能排除其他因素的影响:如选择的miRNA的大小。综上所述,我们的研究结果提示GJ对miRNA抗肿瘤作用的影响具有Cx异质性,此异质性可能与GJ对miRNA的通透性有关。但GJ对miRNA的这种作用是否也存在于其他Cx组成的GJ及是否受到选择的miRNA的影响还需要进一步的研究。
( 致谢: 本实验主要在郑州大学第一附属医院药学部实验室完成,感谢实验室全体人员的帮助。)
| [1] |
孙嘉玲, 文彬, 孙海涛, 等. 不同转移潜能肝癌细胞株miRNAs表达谱的差异性研究[J]. 中国药理学通报, 2018, 34(5): 656-63. Sun J L, Wen B, Sun H T, et al. Research of differences of miRNAs expression profiles in different metastatic potential HCC cell lines[J]. Chin Pharmacol Bull, 2018, 34(5): 656-63. doi:10.3969/j.issn.1001-1978.2018.05.014 |
| [2] |
Makeyev EV, Zhang J, Carrasco MA, et al. The microRNA miR-124 promotes neuronal differentiation by triggering brain-specific alternative pre-mRNA splicing[J]. Mol Cell, 2007, 27(3): 435-48. doi:10.1016/j.molcel.2007.07.015 |
| [3] |
Shi Z, Chen Q, Li C, et al. MiR-124 governs glioma growth and angiogenesis and enhances chemosensitivity by targeting R-Ras and N-Ras[J]. Neuro Oncol, 2014, 16(10): 1341-53. doi:10.1093/neuonc/nou084 |
| [4] |
Wang P, Zhang L, Zhang J, et al. MicroRNA-124-3p inhibits cell growth and metastasis in cervical cancer by targeting IGF2BP1[J]. Exp Ther Med, 2018, 15(2): 1385-93. |
| [5] |
Sosinsky G E, Nicholson B J. Structural organization of gap junction channels[J]. Biochim Biophys Acta, 2005, 1711(2): 99-125. doi:10.1016/j.bbamem.2005.04.001 |
| [6] |
Johnstone S R, Best A K, Wright C S, et al. Enhanced connexin 43 expression delays intra-mitotic duration and cell cycle traverse independently of gap junction channel function[J]. J Cell Biochem, 2010, 110(3): 772-82. doi:10.1002/jcb.22590 |
| [7] |
Harris A L. Emerging issues of connexin channels:biophysics fills the gap[J]. Q Rev Biophys, 2001, 34(3): 325-472. |
| [8] |
Hong X, Sin W C, Harris A L, et al. Gap junctions modulate glioma invasion by direct transfer of microRNA[J]. Oncotarget, 2015, 6(17): 15566-77. |
| [9] |
Suzhi Z, Liang T, Yuexia P, et al. Gap junctions enhance the antiproliferative effect of microRNA-124-3p in glioblastoma cells[J]. J Cell Physiol, 2015, 230(10): 2476-88. doi:10.1002/jcp.24982 |
| [10] |
Ran D Z, Cai S, Wu H L, et al. Di (2-ethylhexyl) phthalate modulates cholinergic mini presynaptic transmission of projection neurons in Drosophila antennal lobe[J]. Food Chem Toxicol, 2012, 50(9): 3291-7. doi:10.1016/j.fct.2012.03.070 |
| [11] |
Valiunas V, Polosina Y Y, Miller H, et al. Connexin-specific cell-to-cell transfer of short interfering RNA by gap junctions[J]. J Physiol, 2005, 568(Pt 2): 459-68. |
| [12] |
Estin D, Li M, Spray D, et al. Connexins are expressed in primary brain tumors and enhance the bystander effect in gene therapy[J]. Neurosurgery, 1999, 44(2): 361-8. doi:10.1097/00006123-199902000-00068 |
| [13] |
Kolodny G M. Evidence for transfer of macromolecular RNA between mammalian cells in culture[J]. Exp Cell Res, 1971, 65(2): 313-24. doi:10.1016/0014-4827(71)90007-3 |
| [14] |
Sun J, Ahmad S, Chen S, et al. Cochlear gap junctions coassembled from Cx26 and 30 show faster intercellular Ca2+ signaling than homomeric counterparts[J]. Am J Physiol Cell Physiol, 2005, 288(3): C613-23. doi:10.1152/ajpcell.00341.2004 |
| [15] |
Bedner P, Niessen H, Odermatt B, et al. Selective permeability of different connexin channels to the second messenger cyclic APM[J]. J Biol Chem, 2006, 281(10): 6673-81. doi:10.1074/jbc.M511235200 |

