

2. 重庆医科大学附属第二医院 康复医学科,重庆 400010
2. Dept of Rehabilitation, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
脑胶质瘤是颅内最常见的原发恶性肿瘤,占颅内肿瘤的45%[1]。目前,脑胶质瘤的主要治疗方式为手术、放疗和化疗[2],然而这些治疗手段并不能完全消除肿瘤,且创伤大、副作用明显。手术切除的方式能够治愈小部分低级别脑胶质瘤患者,但是,大部分的脑胶质瘤患者在接受手术、辅以放化疗等综合治疗后仍易复发。脑胶质瘤的总体疗效有待进一步提高,寻找安全有效且毒副作用小的抗肿瘤方法迫在眉睫。
姜黄素(curcumin,CUR)是从姜科植物中提取的一种相对分子质量小的黄色多酚类物质,是姜黄的主要成分。大量的研究证明,姜黄素具有抗癌、抗氧化、抗炎、清除自由基等多种药理作用,并且对多种恶性肿瘤,如肺癌[3]、前列腺癌[4]、宫颈癌[5]、乳腺癌[6]等均有不同程度的抑制作用,与传统化疗药物相比毒副作用更小,使其成为极具潜力的抗肿瘤药物,美国国立肿瘤所已将其列为第3代化学防癌药[7]。但是,姜黄素存在水溶性差、难吸收、易降解、代谢快等缺点,导致其生物利用度低[8],使其在基础和临床中的应用受阻。近年来,可生物降解聚合物在药物的控制和靶向传递中发挥了重要作用,目前研究较多的合成生物降解聚合物之一的乳酸-乙醇酸共聚物[poly(lactic-co-glycolic acid), PLGA]是一种有机高分子化合物,具有良好的生物相容性和安全性,其优良的成囊和成膜性能为药物传递系统提供了良好的支持,大量基于PLGA的药物传递系统已经被报道用于治疗或诊断各种疾病。为了改善姜黄素的生物利用度,本实验采用PLGA作为原材料制备姜黄素-PLGA纳米粒,对其理化性质进行检测,并观察其对鼠源性胶质瘤C6细胞和人源性胶质瘤U251细胞的抗肿瘤作用,期望为胶质瘤的治疗提供新的思路。
1 材料与方法 1.1 材料 1.1.1 细胞与试剂鼠源性胶质瘤C6细胞株、人源性胶质瘤U251细胞株,由重庆医科大学生命科学院惠赠。高糖DMEM,购自美国Gibco公司;青霉素-链霉素、二甲基亚砜(DMSO)、CCK-8试剂盒、Hoechst 33342,购自上海碧云天生物公司;胎牛血清,购自德国PAN生物公司;姜黄素、PLGA、聚乙烯醇(polyvinyl alcohol, PVA),购自美国Sigma公司;二氯甲烷,购自成都市科隆化学品有限公司;Annexin V-FITC/PI,购自天津三箭生物技术股份有限公司。
1.1.2 仪器VCY-500声震仪(上海研永超声设备有限公司);恒温磁力搅拌器、SB-5200DTDN超声波清洗机(宁波新芝生物科技股份有限公司);动态光散射激光粒度测定仪(英国Malvern公司);Varioskan LUX酶标仪(美国Thermo Scientific公司);荧光倒置显微镜(日本Nikon公司);H-7500透射电子显微镜(TEM,日本Hitachi公司);流式细胞仪(美国BD公司)。
1.2 细胞培养及分组U251细胞株、C6细胞株均使用添加有10%胎牛血清和1%青霉素-链霉素的高糖DMEM培养基,并置于37 ℃、5% CO2环境下的细胞孵箱中培养。细胞实验分为空白对照组、姜黄素组和姜黄素-PLGA(100 μmol·L-1)组。待细胞贴壁后,弃培养基,PBS洗2次,姜黄素-PLGA组加入含姜黄素-PLGA纳米粒的新鲜培养基,姜黄素组加入含姜黄素的新鲜培养基,空白对照组更换为新鲜培养基,数小时后进行各项检测。
1.3 姜黄素-PLGA纳米粒的制备分别称取50 mg PLGA、2 mg姜黄素,溶于2 mL二氯甲烷中,超声波清洗机溶解;加入5 mL预冷的4% PVA,混匀,在冰水浴条件下超声乳化2 min(150 W,5 s/5 s);将乳化后的溶液在通风橱中磁力搅拌2 h,使有机溶剂二氯甲烷充分挥发,离心沉淀即姜得黄素-PLGA纳米粒。
1.4 姜黄素-PLGA纳米粒的表征取适量姜黄素-PLGA纳米粒溶液,蒸馏水适当稀释,于常温条件下固定激光波长为632.8 nm、散射角90°,使用动态光散射激光粒度测定仪(dynamic light scattering,DLS)检测纳米粒的粒径。倒置荧光显微镜观察姜黄素-PLGA纳米粒的形态。透射电镜观察姜黄素-PLGA纳米粒的形态,取适量姜黄素-PLGA纳米粒溶液滴于覆盖有碳膜的铜网上,用滤纸沿铜网边缘吸除多余液体,滴入2%磷钨酸染色,自然晾干2 d,置于TEM中,以100 kV加速电压检视、拍照。多功能酶标仪测定姜黄素及姜黄素-PLGA纳米粒的吸收波长。
1.5 姜黄素-PLGA纳米粒的载药量及包封率测定多功能酶标仪测定姜黄素浓度:取1 mg姜黄素溶于DMSO中,梯度稀释为0.5、0.25、0.125、0.062 5、0.031 25 g·L-1,离心洗涤姜黄素-PLGA纳米粒时,收集上清,将上述浓度的姜黄素溶液和收集的上清加入96孔板中,每组3个复孔,测定421 nm下各孔的吸光度,绘制标准曲线,计算上清液中姜黄素的含量。应用下列公式计算:包封率/%=(姜黄素总量-上清中姜黄素含量)/姜黄素总量×100%;载药率=(姜黄素总量-上清中姜黄素含量)/PLGA总量×100%。
1.6 荧光显微镜观察C6细胞、U251细胞对姜黄素-PLGA纳米粒的摄取C6细胞、U251细胞接种于6孔板(5×105个/孔),各组分别接受上述干预措施处理24 h后,使用4%多聚甲醛固定5 min,PBS洗涤2次后加入0.1% Triton X-100破膜5 min,再用PBS洗涤2次后,使用10 mg·L-1 Hoechst 33342染色5 min,洗掉染色液后滴加抗荧光淬灭封片液,使用荧光显微镜观察并照相。
1.7 CCK-8检测姜黄素-PLGA纳米粒对C6细胞、U251细胞的细胞毒性将C6细胞、U251细胞接种于96孔板中,每孔5×103个细胞,每组3个复孔,经上述分组处理后避光孵育24 h,每孔加入100 μL含10% CCK-8试剂的无血清高糖DMEM培养基避光培养,酶标仪检测波长为450 nm时的OD值。阴性对照组为含CCK-8试剂的无血清高糖DMEM培养基和细胞,空白对照组为含CCK-8试剂的无血清高糖DMEM培养基,不含细胞和毒性物质。细胞存活率=(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。
1.8 Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率将C6细胞、U251细胞种于6孔板中(1×105个/孔),经上述分组处理24 h后,收集所有的悬浮和贴壁细胞于EP管中,1 000 r·min-1离心5 min,PBS洗涤细胞3次,重悬后采用Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率。
1.9 Hoechst 33342染色观察细胞凋亡将C6细胞、U251细胞接种于6孔板(5×105个/孔),各组分别接受上述干预措施处理24 h后,使用4%多聚甲醛固定5 min,PBS洗涤后加入0.1% Triton X-100破膜5 min,PBS洗涤后,使用10 mg·L-1 Hoechst 33342染色5 min,洗掉染色液后滴加抗荧光淬灭封片液,使用荧光显微镜观察并照相。
1.10 统计学分析本研究中的各项实验均独立重复3次,所有实验数据采用GraphPad Prism 7进行处理,计量数据用x±s表示,采用单因素方差分析和Tukey检验分析进行统计评估。
2 结果 2.1 姜黄素-PLGA纳米粒的表征姜黄素-PLGA纳米粒呈黄色,倒置荧光显微镜下和透射电镜下观察姜黄素-PLGA纳米粒呈球形(Fig 1A、1B),其平均粒径为(284.6±9.0)nm(Fig 1C),其吸收波长为421 nm(Fig 1D),而姜黄素的吸收波长为421 nm,证明PLGA成功包载了姜黄素。
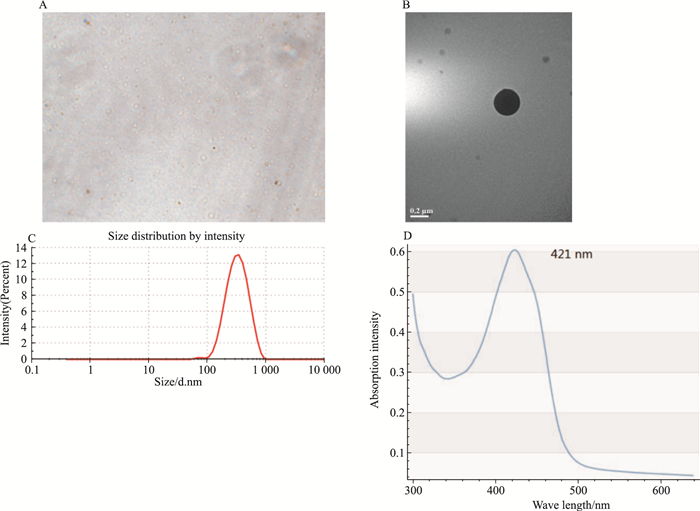
|
| Fig 1 Characterization of curcumin-PLGA nanoparticles A: Optical microscope image of curcumin-PLGA nanoparticles(magnification ×600);B:TEM image of curcumin-PLGA nanoparticles; C: Size distribution of curcumin-PLGA nanoparticles; D: Absorption wavelength of curcumin-PLGA nanoparticles. |
姜黄素-PLGA纳米粒的包封率为(70.712±2.615)%,载药率为(2.828±0.105)%。
2.3 细胞对姜黄素-PLGA纳米粒的摄取如Fig 2所示,姜黄素、姜黄素-PLGA纳米粒孵育细胞24 h后,荧光显微镜观察发现,C6细胞和U251细胞对姜黄素-PLGA纳米粒的摄取均明显多于姜黄素(P < 0.05)。

|
| Fig 2 Uptake of curcumin-PLGA nanoparticles in C6 cells and U251 cells (×200) |
CCK-8检测结果显示(Fig 3),24 h时姜黄素-PLGA组(100 μmol·L-1)的C6细胞及U251细胞活性明显低于空白对照组和姜黄素组(P < 0.05)。

|
| Fig 3 Effect of curcumin-PLGA nanoparticles on cell viability in C6 cells and U251 cells (x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs curcumin group |
流式细胞术结果显示(Fig 4),经上述分组处理24 h后,姜黄素-PLGA组C6细胞及U251细胞的凋亡率明显高于空白对照组及姜黄素组(P < 0.05);而空白对照组与姜黄素组对比,细胞凋亡差异无统计学意义(P>0.05)。
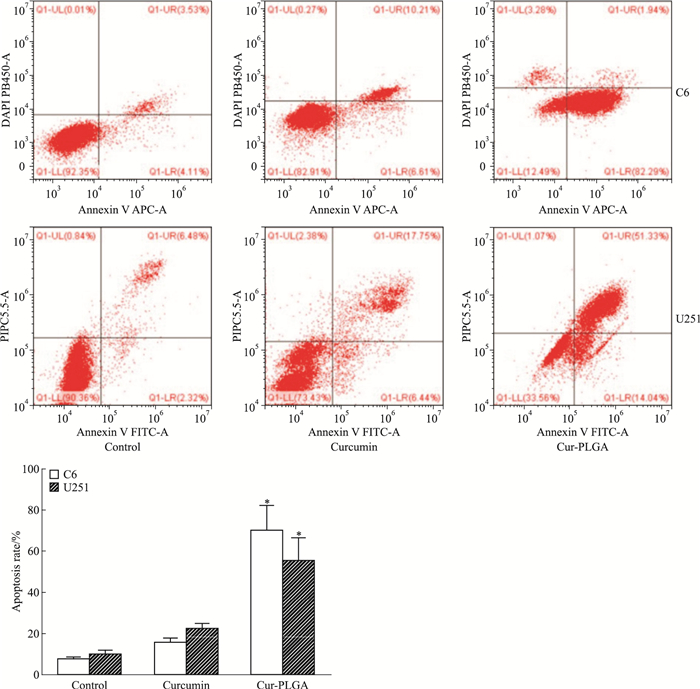
|
| Fig 4 Effect of curcumin-PLGA nanoparticles on cell apoptosis in C6 cells and U251 cells (x±s, n=3) *P < 0.05 vs control group |
Hoechst 33342染色结果显示(Fig 5),经上述干预措施处理24 h后,与空白对照组相比,姜黄素-PLGA组有明显的细胞核固缩,深染,凋亡小体形成;与姜黄素组相比,姜黄素-PLGA组也有明显的细胞核固缩,深染,凋亡小体形成。结果表明姜黄素-PLGA纳米粒可以诱导C6细胞、U251细胞凋亡。
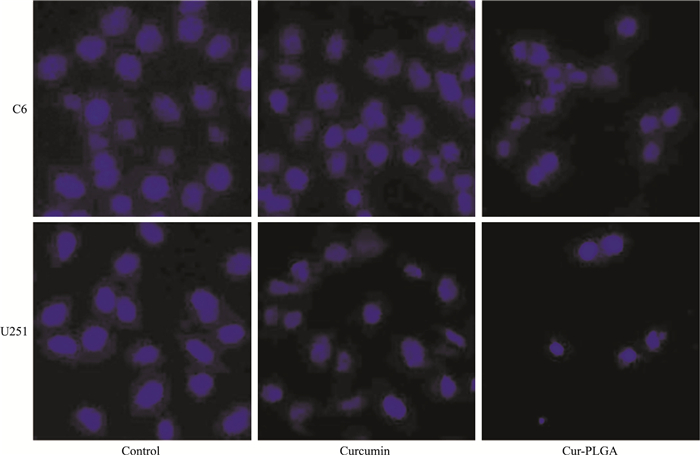
|
| Fig 5 Apoptosis in C6 cells and U251 cells induced by curcumin-PLGA nanoparticle (×200) |
姜黄素作为一种天然酚类物质,具有良好的抗肿瘤作用,且安全性好,但是其存在易降解、生物利用度低等不足。PLGA是目前应用最广泛的微胶囊化和延长治疗药物、蛋白质和抗原递送的生物材料,被广泛应用于制药、医用工程材料和现代化工业领域,被美国食品和药物管理局(FDA)和欧洲药物管理局(EMA)等国际监管机构普遍认为其是安全的。利用肿瘤的高通透性和滞留效应(enhanced permea- bility and retention effect, EPR),包载药物的PLGA纳米粒可以更好地聚集于肿瘤部位,同时,PLGA能够延缓肝脏对药物的直接代谢,延长药物在血液循环中的存在时间,提高生物利用度并产生缓释作用,从而更好地发挥药物的治疗效率。本研究以PLGA为原材料,采用乳化-溶剂挥发法成功制备了姜黄素-PLGA纳米粒,其大小均匀、粒径较小,具有良好的生物相容性。本实验结果表明,相较于单纯的姜黄素,姜黄素-PLGA纳米粒能够更好地被C6细胞、U251细胞摄取。在相同药物浓度下,姜黄素-PLGA纳米粒对C6细胞、U251细胞具有更明显的毒性。
凋亡是细胞程序性死亡的一种形式,其结果是有序和有效地清除受损细胞,细胞凋亡可由细胞内的信号(如基因毒性应激)或外部信号(如配体与细胞表面死亡受体的结合)触发,涉及一系列基因的激活、表达及调控等。凋亡发生时,细胞体积缩小,细胞-细胞连接消失,核浓缩,核膜核仁破碎,最终将凋亡细胞遗骸分割包裹为几个凋亡小体。细胞凋亡是机体维持自身稳定的重要因素,当机体组织细胞增殖和凋亡失衡,易引发肿瘤。本实验结果表明,相比于姜黄素组,姜黄素-PLGA组的细胞凋亡率明显增高,并出现明显的细胞核固缩、碎裂,表明姜黄素-PLGA纳米粒比单纯姜黄素更明显地诱导了C6细胞、U251细胞凋亡。
姜黄素诱导肿瘤细胞凋亡涉及调控细胞内外多种蛋白家族、蛋白分子和不同的分子通路,并且在不同肿瘤中的凋亡机制也存在差异。既往研究表明,姜黄素可通过凋亡相关蛋白,如caspase3、caspase-9、Bcl-2、Bcl-xL等,调控细胞凋亡[9-12],也可以通过抑制NF-κB和基质金属蛋白酶-9,抑制细胞增殖并诱导其凋亡[13]。本实验中制备的姜黄素-PLGA纳米粒是否通过上述通路诱导胶质瘤细胞凋亡,以及是否存在其他凋亡途径,将在后续实验中探讨。
综上所述,本实验成功制备了一种粒径较小、大小均一、生物相容性高、可生物降解的姜黄素-PLGA纳米粒,并证实了相比于单纯姜黄素,姜黄素-PLGA纳米粒可明显提高细胞摄取率,诱导肿瘤细胞的凋亡,为脑胶质瘤的治疗提供新的思路。
( 致谢: 本实验主要在重庆医科大学超声影像学研究所、生物医学工程学院、生命科学院公共实验平台完成,并对实验室郝兰、曹阳、李崇雁等老师,以及黄礼义、杨强、钟晓文等同学提供的帮助表示衷心感谢!)
| [1] |
Jovcevska I, Kocevar N, Komel R. Glioma and glioblastoma-how much do we(not) know?[J]. Mol Clin Oncol, 2013, 1(6): 935-41. doi:10.3892/mco.2013.172 |
| [2] |
陈正和, 陈忠平. 脑胶质瘤的治疗进展[J]. 新医学, 2015, 46(7): 417-22. Chen Z H, Chen Z P. Advances in treatment for brain glioma[J]. J New Med, 2015, 46(7): 417-22. doi:10.3969/g.issn.0253-9802.2015.07.001 |
| [3] |
Zhu J Y, Yang X, Chen Y, et al. Curcumin suppresses lung cancer stem cells via inhibiting Wnt/beta-catenin and Sonic Hedgehog pathways[J]. Phytother Res, 2017, 31(4): 680-8. doi:10.1002/ptr.5791 |
| [4] |
Yang J, Wang C, Zhang Z, et al. Curcumin inhibits the survival and metastasis of prostate cancer cells via the Notch-1 signaling pathway[J]. APMIS, 2017, 125(2): 134-40. doi:10.1111/apm.12650 |
| [5] |
Singh M, Singh N. Curcumin counteracts the proliferative effect of estradiol and induces apoptosis in cervical cancer cells[J]. Mol Cell Biochem, 2011, 347(1-2): 1-11. doi:10.1007/s11010-010-0606-3 |
| [6] |
Guan F, Ding Y, Zhang Y, et al. Curcumin suppresses proliferation and migration of MDA-MB-231 breast cancer cells through autophagy-dependent Akt degradation[J]. PLoS One, 2016, 11(1): e0146553. doi:10.1371/journal.pone.0146553 |
| [7] |
Odot J, Albert P, Carlier A, et al. In vitro and in vivo anti-tumoral effect of curcumin against melanoma cells[J]. Int J Cancer, 2004, 111(3): 381-7. doi:10.1002/ijc.20160 |
| [8] |
张立康, 汪小珍, 李婉姝, 等. 姜黄素在大鼠体内药代动力学和生物利用度研究[J]. 中国药理学通报, 2011, 27(10): 1458-62. Zhang L K, Wang X Z, Li W S, et al. Pharmacokinetics and absolute bioavailability of curcumin in rats[J]. Chin Pharmacol Bull, 2011, 27(10): 1458-62. doi:10.3969/j.issn.1001-1978.2011.10.029 |
| [9] |
Chang P Y, Peng S F, Lee C Y, et al. Curcumin-loaded nanoparticles induce apoptotic cell death through regulation of the function of MDR1 and reactive oxygen species in cisplatin-resistant CAR human oral cancer cells[J]. Int J Oncol, 2013, 43(4): 1141-50. doi:10.3892/ijo.2013.2050 |
| [10] |
Wilken R, Veena M S, Wang M B, et al. Curcumin: A review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma[J]. Mol Cancer, 2011, 10: 12. doi:10.1186/1476-4598-10-12 |
| [11] |
Hu A, Huang J J, Li R L, et al. Curcumin as therapeutics for the treatment of head and neck squamous cell carcinoma by activating SIRT1[J]. Sci Rep, 2015, 5: 13429. doi:10.1038/srep13429 |
| [12] |
Singh M, Singh N. Molecular mechanism of curcumin induced cytotoxicity in human cervical carcinoma cells[J]. Mol Cell Biochem, 2009, 325(1-2): 107-19. doi:10.1007/s11010-009-0025-5 |
| [13] |
Cao F, Liu T, Xu Y, et al. Curcumin inhibits cell proliferation and promotes apoptosis in human osteoclastoma cell through MMP-9, NF-kappaB and JNK signaling pathways[J]. Int J Clin Exp Pathol, 2015, 8(6): 6037-45. |

