

2. 天津 国际生物医药联合研究院高通量分子筛选中心,天津 300070;
3. 中国人民武装警察部队特色医学中心,天津 300162
黄凯(1995-),男,硕士生,研究方向:特发性肺纤维化,共同第一作者,E-mail: 1329056433@qq.com。
周红刚(1980-),男,博士,副教授,硕士生导师,研究方向:特发性肺纤维化,通讯作者,E-mail:honggang.zhou@nankai.edu.cn
 ,
HUANG Kai1
,
HUANG Kai1 ,
LYU Zi-wei1,
GAO Shao-yan1,2,
SU Cheng-cheng3,
LI Xiao-he1,2
,
LYU Zi-wei1,
GAO Shao-yan1,2,
SU Cheng-cheng3,
LI Xiao-he1,2
 ,
ZHOU Hong-gang1,2
,
ZHOU Hong-gang1,2

2. High-throughput Molecular Drug Screening Centre, Tianjin International Joint Academy of Biomedicine, Tianjin 300070, China;
3. Chinese Medical Police Force Special Medical Center, Tianjin 300162, China
肺纤维化是一种死亡率高的肺部疾病,其特征是瘢痕形成,导致渐进性和不可逆转的肺泡结构破坏。肺纤维化导致肺功能障碍、气体交换困难、呼吸衰竭,最终引起死亡。特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是其中最为严重和最难治疗的一种,IPF病因不明,确诊后中位生存期仅为2-6年[1]。目前已上市的针对IPF的治疗药物有两种:吡非尼酮(pirfenidone,PFD)和尼达尼布(nintedanib,NDN)。
PFD是一种吡啶酮化合物,2011年在欧盟被批准用于治疗成人轻至中度IPF,2014年在美国被批准治疗IPF[2],同年在中国上市销售。PFD抗肺纤维化的机制尚不完全清楚,动物实验结果显示,其具有抗纤维化和抗炎作用[3-4]。NDN是一种多靶点酪氨酸激酶抑制剂,分别于2014、2015、2017年被美国FDA、欧盟EMA、中国CFDA批准用于治疗IPF[5]。NDN能够通过抑制肺纤维化相关调控因子——血小板衍生生长因子受体(platelet derived growth factor receptor,PDGFR)、血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)及成纤维生长因子受体(fibroblast growth factor receptor,FGFR)活性,缓解肺纤维化进展[6]。
转化生长因子β(transforming growth factor β,TGF-β)和血小板衍生生长因子(platelet derived growth factor,PDGF)是肺纤维化进展过程中重要的促纤维化细胞因子。肌成纤维细胞是肺纤维化进程中的关键效应细胞,可合成分泌细胞外基质(extracellular matrixc,ECM)[7-8]。TGF-β和PDGF均可作用于肺成纤维细胞,促进其增殖、迁移及产生ECM。TGF-β1可通过激活其下游Smad信号,促进组织瘢痕形成和肺纤维化发生[9]。
因前期研究并未在同一实验体系中检测两个上市药物的体外抗肺纤维化药效,通过检测吡非尼酮和尼达尼布对成纤维细胞增殖、迁移和活化的影响,可以更好地阐释两个上市药物的机制,比较两个上市药物对肺纤维化关键指标的影响程度。
1 材料与方法 1.1 材料 1.1.1 细胞株人胚肺成纤维细胞HFL1(ATCC)。
1.1.2 药物与试剂吡非尼酮(大连美仑生物技术有限公司,纯度>98.5%);尼达尼布(北京华威锐科化工有限公司,纯度为99%);F12K培养基(美国Gibco公司);胎牛血清(康润生物科技有限公司);青霉素-链霉素溶液(Biosharp公司);二甲基亚砜(DMSO)(Life Science);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(碧云天生物技术有限公司);TGF-β1、PDGF(美国PeproTech公司);TRIzol试剂、DEPC-H2O(Life Technologies公司);氯仿、异丙醇、无水乙醇(天津市光复科技发展有限公司);反转录试剂盒(天根生化科技有限公司);qPCR试剂盒(北京全式金生物技术有限公司);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、纤维黏连蛋白(fibronectin,FN)、Ⅰ型胶原蛋白(collagen 1,COL1)引物(泓迅生物科技有限公司);α-SMA、FN、COL1一抗(Affinity Antibody公司);p-Smad3抗体(Cell Signaling Technology公司)。
1.1.3 仪器二氧化碳培养箱(力康发展有限公司);高速冷冻离心机、Multiskan Fc型酶标仪(赛默飞世尔科技有限公司);荧光定量PCR仪(Roche);电泳设备(北京六一生物科技有限公司)。
1.2 方法 1.2.1 细胞培养HFL1复苏后,接种于含有10%胎牛血清和1‰双抗(青霉素和链霉素)的F12K培养基中,37 ℃、5% CO2培养箱培养。根据实验前期结果,确定TGF-β1、PDGF刺激的最佳剂量分别为5 μg·L-1、10 μg·L-1。实验分组如下:对照组、TGF-β1/PDGF组、吡非尼酮组、吡非尼酮+TGF-β1/PDGF组、尼达尼布组、尼达尼布+TGF-β1/PDGF组。
1.2.2 MTT法检测HFL1增殖收集对数期细胞(细胞密度为80%左右),调整细胞悬液浓度,于96孔板中铺板,密度为30%~40%, 37 ℃、5% CO2培养箱培养,至细胞单层长至约80%,加入浓度梯度的吡非尼酮(0、0.625、1.25、2.5、5、10 mmol·L-1)或尼达尼布(0、1.25、2.5、5、10、20 μmol·L-1)。孵育24 h,每孔加入15 μL浓度为5 g·L-1的MTT溶液,继续培养3~4 h后,终止培养,每孔加入120 μL DMSO,在酶标仪490 nm处测量各孔的吸光度值。
1.2.3 划痕实验检测HFL1迁移收集对数期细胞,调整细胞悬液浓度,于24孔板中铺板,密度为50%~60%,37 ℃、5% CO2培养箱培养,至细胞单层长至约80%,划痕,更换无血清培养基,并加入吡非尼酮(1 mmol·L-1)、尼达尼布(2 μmol·L-1),分别在加药后0、12、24、48 h,于同一位置拍照。
1.2.4 qPCR、Western blot检测HFL1活化收集对数期细胞,调整细胞悬液浓度,分别在12孔板和6孔板中铺板,密度为50%~60%,37 ℃、5% CO2培养箱培养,至细胞单层长至约80%,更换0.1%血清培养基,饥饿处理24 h后,加入吡非尼酮(1 mmol·L-1)、尼达尼布(2 μmol·L-1)。分别提取细胞RNA和蛋白质进行qPCR和Western blot,检测α-SMA、FN、COL1、p-Smad3的表达,分析HFL1的活化程度。引物序列:α-SMA:F:5′-CTATGAGGGCTAT GCCTTGCC-3′,R:5′-GCTCAGCAGTAGTAACGAAG GA-3′;FN:F:5′-CGGTGGCTGTCAGTCAAAG-3′,R:5′-AAACCTCGGCTTCCTCCATAA-3′;COL1:F:5′-AG GGCAACAGCAGGTTCACTTACA-3′,R:5′-AGCGGG GGAAGGAGTTAATGAAAC-3′。
1.3 统计学处理结果以x±s表示,两组之间的差异使用t检验进行评估,用单因素方差分析评估两组以上数据之间的差异。
2 结果 2.1 吡非尼酮、尼达尼布对HFL1增殖的影响通过MTT实验比较吡非尼酮、尼达尼布对活化的肺成纤维细胞增殖的影响。Fig 1结果表明,吡非尼酮和尼达尼布均能抑制TGF-β1诱导的HFL1的增殖,尼达尼布作用效价高于吡非尼酮。
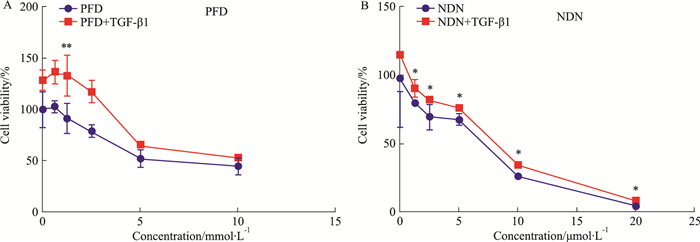
|
| Fig 1 MTT results of pirfenidone(A) and nintedanib(B) (x±s, n=3) *P < 0.05, **P < 0.01 vs TGF-β1 group |
根据MTT实验结果,选择吡非尼酮作用浓度为1 mmol·L-1,尼达尼布作用浓度为2 μmol·L-1。通过划痕实验,比较吡非尼酮、尼达尼布对活化的肺成纤维细胞迁移的影响。分别用TGF-β1、PDGF刺激HFL1,Fig 2结果表明,与模型组相比,吡非尼酮和尼达尼布均能抑制HFL1的迁移。TGF-β1刺激12 h时,尼达尼布与吡非尼酮效果相当,TGF-β1刺激24、48 h时,尼达尼布效果强于吡非尼酮;PDGF刺激,尼达尼布效果强于吡非尼酮。

|
| Fig 2 Scratch test results of TGF-β1 induced (A, B) and PDGF induced (C, D) (x±s, n=3) *P < 0.05 vs PDGF group |
通过检测TGF-β1/PDGF刺激下各组细胞α-SMA、FN、COL1的表达,观察吡非尼酮、尼达尼布对HFL1活化和ECM分泌的影响。TGF-β1/PDGF刺激下,模型组α-SMA、FN、COL1均明显高于对照组。实验结果表明,与模型组相比,吡非尼酮和尼达尼布均能抑制HFL1活化和ECM分泌。TGF-β1刺激下,吡非尼酮对α-SMA的抑制作用强于尼达尼布,尼达尼布对FN、COL1的抑制作用强于吡非尼酮;PDGF刺激下,吡非尼酮对α-SMA、COL1的抑制作用强于尼达尼布,对于FN的抑制,吡非尼酮和尼达尼布作用相当(Fig 3)。
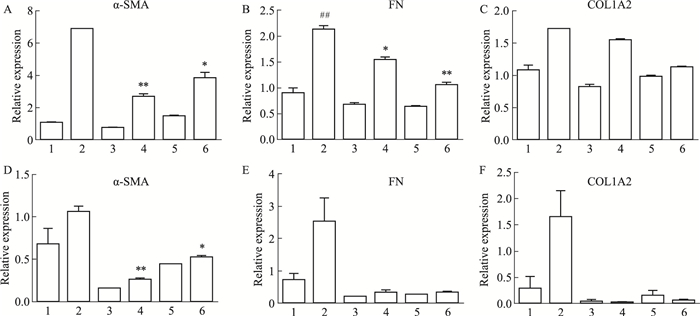
|
| Fig 3 qPCR results of markers under action of pirfenidone and nintedanib(x±s, n=3) A、B、C(1.CTL; 2.TGF-β1;3.PFD; 4.PFD+TGF-β1;5.NDN; 6.NDN+TGF-β1);D、E、F(1.CTL; 2.PDGF; 3.PFD; 4.PFD+PDGF; 5.NDN; 6.NDN+PDGF)。##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs TGF-β1 or PDGF group |
在TGF-β1刺激下,模型组α-SMA、FN、COL1、p-Smad3蛋白表达量均高于对照组。结果表明,吡非尼酮和尼达尼布给药组均能抑制活化标志物α-SMA、FN、COL1的表达,且吡非尼酮和尼达尼布能够通过抑制Smad3的磷酸化,抑制Smad3的活化,阻断TGF-β/Smad3信号通路的激活,达到抗肺纤维化的作用,其中,尼达尼布对Smad3磷酸化的抑制作用强于吡非尼酮(Fig 4)。

|
| Fig 4 Western blot results of various markers under action of pirfenidone and nintedanib(x±s, n=3) D: 1.Control; 2.TGF-β1; 3.PFD; 4.PFD+TGF-β1; 5.NDN; 6.NDN+TGF-β1. ##P<0.01 vs control group; **P<0.01 vs TGF-β1 group |
TGF-β和PDGF广泛参与不同器官纤维化的发展,在IPF患者中均高表达,并且能够促进肺成纤维细胞增殖、迁移、活化[9-10]。吡非尼酮和尼达尼布能够明显抑制TGF-β1和PDGF诱导的肺成纤维细胞的增殖,且呈明显剂量依赖性,尼达尼布低剂量抑制作用较吡非尼酮明显;吡非尼酮和尼达尼布能够明显抑制TGF-β1和PDGF诱导的肺成纤维细胞的迁移,尼达尼布抑制作用强于吡非尼酮;从实际临床用药剂量来看,尼达尼布最大剂量300 mg·d-1,吡非尼酮最大剂量1 800 mg·d-1,由于尼达尼布效价较高,低剂量给药即可明显抑制TGF-β1和PDGF诱导的肺成纤维细胞的增殖和迁移。
α-SMA阳性肺成纤维细胞在IPF患者肺部增加,并构成成纤维细胞病灶的主体部分[11]。ECM沉积是造成肺纤维化的主要原因,FN、COL1是ECM的主要成分,FN、COL1过度沉积,会导致瘢痕形成,肺功能障碍,造成呼吸衰竭,并最终导致死亡。吡非尼酮和尼达尼布明显降低TGF-β1和PDGF诱导的α-SMA、FN、COL1A2的mRNA水平,吡非尼酮对α-SMA mRNA的抑制作用较强,尼达尼布对FN、COL1A2 mRNA的抑制作用较强;吡非尼酮和尼达尼布能够降低TGF-β1诱导的α-SMA、FN、COL1的蛋白水平,尼达尼布对α-SMA蛋白表达的抑制作用与吡非尼酮相当,对FN、COL1蛋白表达的抑制作用强于吡非尼酮。
TGF-β被认为是组织纤维化中的关键调控因子,通过促进下游纤维化相关靶基因过量表达,引起组织瘢痕[12]。与用博来霉素处理的野生型小鼠相比,敲除Smad3基因的小鼠能减少Ⅰ型前胶原mRNA表达,降低肺中羟脯氨酸含量,从而改善肺纤维化[13]。吡非尼酮和尼达尼布能够抑制TGF-β1诱导的Smad3的磷酸化,吡非尼酮对Smad3磷酸化的抑制率为13%,尼达尼布对Smad3磷酸化的抑制率为51%。自噬能够促进胶原降解,在体外,TGF-β可剂量和时间依赖性地抑制肺成纤维细胞的自噬[14]。原代IPF肺成纤维细胞中,尼达尼布能够通过Beclin-1途径,促进自噬改善肺纤维化[15]。尼达尼布改善肺纤维化机制之一可能是通过抑制TGF-β/Smad3信号通路促进自噬,该机制有待进一步研究。
综上所述,吡非尼酮和尼达尼布是目前临床上治疗IPF的药物,吡非尼酮靶点未知,但其具有抗炎作用,并且可以通过影响TGF-β通路发挥抗纤维化作用。尼达尼布是一种多靶点酪氨酸激酶抑制剂,尼达尼布对TGF-β信号通路的抑制作用强于吡非尼酮。本研究首次在相同实验条件下,进行体外细胞实验,比较吡非尼酮和尼达尼布对成纤维细胞增殖、迁移、活化、ECM和TGF-β信号通路的影响,实验结果显示尼达尼布优于吡非尼酮。
( 致谢: 本实验主要在南开大学药学院完成,在此对实验室的老师及同学表示衷心的感谢!)
| [1] |
Wynn T A. Integrating mechanisms of pulmonary fibrosis[J]. J Exp Med, 2011, 208(7): 1339. doi:10.1084/jem.20110551 |
| [2] |
Kim E S, Keating G M. Pirfenidone:a review of its use in idiopathic pulmonary fibrosis[J]. Drugs, 2015, 75(2): 219-30. doi:10.1007/s40265-015-0350-9 |
| [3] |
Pourgholamhossein F, Rasooli R, Pournamdari M, et al. Pirfenidone protects against paraquat-induced lung injury and fibrosis in mice by modulation of inflammation, oxidative stress, and gene expression[J]. Food Chem Toxicol, 2017, 112: 39-46. |
| [4] |
Iyer S N, Gurujeyalakshmi G, Giri S N. Effects of pirfenidone on procollagen gene expression at the transcriptional level in bleomycin hamster model of lung fibrosis[J]. J Pharmacol Exp Ther, 1999, 291(1): 211-8. |
| [5] |
Robalo-Cordeiro C, Campos P, Carvalho L, et al. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy:Searching for new opportunities grounded in evidence[J]. Rev Port Pneumol, 2017, 23(5): 287-93. |
| [6] |
中华医学会呼吸病学分会间质性肺疾病学组. 特发性肺纤维化诊断和治疗中国专家共识[J]. 中华结核和呼吸杂志, 2016, 39(6): 427-32. Chinese Medical Association Respiratory Diseases Association Interstitial Pulmonary Diseases Group. Chinese expert consensus on diagnosis and treatment of idiopathic pulmonary fibrosis[J]. Chin J Tubere Respir Dis, 2016, 39(6): 427-32. doi:10.3760/cma.j.issn.1001-0939.2016.06.005 |
| [7] |
Kendall R T, Feghali-Bostwick C A. Fibroblasts in fibrosis:novel roles and mediators[J]. Front Pharmacol, 2014, 5(123): 123. |
| [8] |
孟哲, 李海禹, 陶海龙. 基于TGF-β1/Smad3信号通路探讨虾青素对心肌成纤维细胞Ⅰ、Ⅲ型胶原表达的影响[J]. 中国药理学通报, 2018, 34(6): 841-5. Meng Z, Li H Y, Tao H L. Effect of astaxanthin on the expression of type Ⅰ and Ⅲ collagen in cardiac fibroblasts based on TGF-β1/Smad3 protein signaling pathway[J]. Chin Pharmacol Bull, 2018, 34(6): 841-5. doi:10.3969/j.issn.1001-1978.2018.06.020 |
| [9] |
Antoniades H N, Bravo M A, Avila R E, et al. Platelet-derived growth factor in idiopathic pulmonary fibrosis[J]. J Clin Invest, 1990, 86(4): 1055-64. doi:10.1172/JCI114808 |
| [10] |
Fernandez I E, Eickelberg O. The impact of TGF-β on lung fibrosis:from targeting to biomarkers[J]. Proc Am Thorac Soc, 2012, 9(3): 111-6. doi:10.1513/pats.201203-023AW |
| [11] |
Ramos C, Montaño M, Garcí Aalvarez J, et al. Fibroblasts from idiopathic pulmonary fibrosis and normal lungs differ in growth rate, apoptosis, and tissue inhibitor of metalloproteinases expression[J]. Am J Respir Cell Mol Biol, 2001, 24(5): 591-8. doi:10.1165/ajrcmb.24.5.4333 |
| [12] |
Hu H H, Chen D Q, Wang Y N, et al. New insights into TGF-β/Smad signaling in tissue fibrosis[J]. Chem Biol Interact, 2018, 292: 76-83. doi:10.1016/j.cbi.2018.07.008 |
| [13] |
Zhao J, Shi W, Wang Y L, et al. Smad3 deficiency attenuates bleomycin-induced, pulmonary fibrosis in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 282(3): 585-93. doi:10.1152/ajplung.00151.2001 |
| [14] |
Patel AS, Lin L, Geyer A, et al. Autophagy in idiopathic pulmonary fibrosis[J]. PLoS One, 2014, 3(5): e41394. |
| [15] |
Rangarajan S, Kurundkar A, Kurundkar D, et al. Novel mechanisms for the antifibrotic action of nintedanib[J]. Am J Respir Cell Mol Biol, 2016, 54(1): 51-9. doi:10.1165/rcmb.2014-0445OC |