

2. 中国医学科学院药物研究所 神经科学中心,天然药物活性物质与功能国家重点实验室,北京 100050
陈乃宏(1961-),男,博士,研究员,博士生导师,研究方向:神经系统疾患创新药物开发及作用机制,Tel/Fax: 010-63165177,E-mail:chennh@imm.ac.cn。
2. State Key Lab of Bioactive Substances and Functions of Natural Medicines, Institute of Materia Medica & Neuroscience Center, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
认知是个体获得和整理周围环境信息的过程,包括感知、注意力、学习、记忆等。学习和记忆分别是信息、经验的获取以及储存重现过程,是认知的核心组成,可以反映认知机能。学习和记忆含义不同,但在功能和发生机制上密切相关。学习记忆是一个复杂的生理生化过程,需多种递质协同作用,同时也涉及神经元放电模式改变、长时程增强(long-term potentiation,LTP)等神经可塑性活动。
应激这一概念在20世纪30年代由加拿大内分泌学家Hans Selye提出,指应激诱因(环境、精神及心理变化)刺激下,生物体内环境稳定状态破坏,产生一系列的非特异性全身性反应[1]。应激是一种调节机体生理、心理及行为的方式,能在危急境遇下高效分配机体生理心理资源,提高适应及生存能力。然而,应激也会让人过度焦虑,损害身心健康,甚至导致器质性损伤和疾病。具体效应的不同,往往在于应激程度的差异。短暂轻微的应激能提高谷氨酸水平,增强神经可塑性,强化工作记忆等。而急性、剧烈的应激则会导致谷氨酸受体、突触蛋白表达抑制,决策等工作记忆功能受损。长期慢性的应激会造成前额叶皮层(prefrontal cortex,PFC)锥体神经元萎缩、树突棘丢失、认知功能损伤。虽然不同程度的应激诱发的机体响应,以及对认知的影响不同,但应激反应的诱发过程却大致相同,均通过两套激素相关系统的激活,及一系列下游机制来产生。然其具体机制及产生效应存在明显的差别,本文将从递质及激素水平改变、下游信号通路成分变化及相关基因表达等层面,对不同程度应激下应激反应对认知功能的影响进行讨论。
1 应激反应的程度对认知功能的影响目前尚无经典的根据应激程度区分应激的方法,人们主要通过应激反应强度及应激作用效果是正面还是负面,将不同程度的应激分为良性应激和劣性应激两大类[2]。
1.1 良性应激良性应激即生理性应激,指持续时间短,应激源轻微的应激过程。良性应激对个体损伤轻微,通常还有一定的认知增强作用,如考前的紧张状态能让人在考场更专注。实验模型如Karsdorp等[3]采用冷水浸手臂的冷加压应激(cold pressor task,CPT)。Porcelli等[4]通过fMRI研究显示,CPT能增强被试者PFC信号,提高PFC神经元放电水平,改善个体工作记忆任务的表现。良性应激的动物模型有Luine等[5]采用的适度束缚应激,将大鼠每天束缚6 h,连续13 d后进行八臂迷宫测试,前8次探索的正确选择次数高于对照组。此外,Salehi等[6]用低温(19 ℃)Morris水迷宫处理大鼠,也观察到应激组行为学表现优于25 ℃水温的非应激组。
1.2 劣性应激劣性应激也叫病理性应激,包括应激源剧烈的急性应激,或持续时间长的慢性应激。其产生的应激反应有损伤作用,如应激性消化系统溃疡、认知受损等。动物模型如Yang等[7]采用不可预知性足底电击造成小鼠习得性绝望。轻度应激持续时间较长也会对个体造成损伤,Luine等[5]将大鼠每天束缚6 h,处理21 d后,八臂迷宫测试中表现出空间记忆受损,海马神经元出现树突萎缩;Su等[8]采用昼夜颠倒、禁食24 h等慢性不可预知性轻度应激处理小鼠4周后,小鼠出现抑郁样行为,同时血清和海马中IL-1β等炎性因子水平升高。
这两种应激类型没有绝对区分,个体接受的是哪种应激除了取决于应激强度和时间以外,也与个体对应激的接受能力有关[2]。
2 应激反应通路应激源刺激个体后通过一系列激活机制产生应激反应,让个体更好地适应环境。脑桥蓝斑核(nucleus ceruleus,LC)对应激高度敏感。应激状态下LC激活后,其上的去甲肾上腺素(noradrenaline,NE)能神经元向其他脑区的投射激活交感-肾上腺髓质系统(sympathetico-adrenomedullary system,SAMS),随后下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPAA)也被激活,两条通道共同产生下游效应,即应激反应的双通道激活[9]。
2.1 SAMS通路的激活LC下行NE能投射激活交感神经,产生加快心率、舒张骨骼肌血管等应对应激的外周作用,同时交感神经节前纤维产生乙酰胆碱,结合肾上腺髓质嗜铬细胞上的N型ACh受体,激活嗜铬细胞产生酪氨酸-β-羟化酶,大量合成、分泌肾上腺素等儿茶酚胺类激素,进一步加强交感神经作用,并作用下游通路来影响认知。
2.2 HPA轴通路的激活由于下丘脑室旁核上行纤维与杏仁核、海马等边缘系统结构存在联系,同时LC也有直达下丘脑室旁核的NE能投射,故蓝斑产生的NE能神经冲动也激活下丘脑室旁核神经元,促使下丘脑分泌促肾上腺皮质激素释放激素作用垂体,使其分泌促肾上腺皮质激素,激活HPA轴,肾上腺皮质分泌糖皮质激素(glucocorticoid,GC),调节机体产生应激反应。
应激反应产生需要一系列介导过程,以下将分别讨论应激通路中的相关分子及其作用,并阐述不同应激反应对认知产生不同效应的机制。
3 神经递质 3.1 肾上腺素正常情况下,肾上腺素不能通过血脑屏障,应激发生时,肾上腺素通过迷走神经上行纤维激活脑干相关核团的NE能神经元,产生中枢作用。Lalumiere等[10]研究显示,情绪唤醒训练后电刺激大鼠迷走神经上行纤维能产生记忆增强现象。说明肾上腺素作用下,迷走神经会进一步激活上行中枢系统中学习记忆相关结构。迷走神经上行纤维和孤束核(nuclei tractus solitarii,NTS)存在神经联系,同时在LC、下丘脑、边缘系统等中枢系统结构中存在广泛投射,能将迷走神经的信号中继至这些结构。还有研究显示,大鼠肾上腺素的内源性释放或NTS注射,都能诱导杏仁核释放NE,增强记忆巩固作用,进一步证明了应激下肾上腺素的认知改善功能。
3.2 NENE影响认知时,其浓度和认知功能间存在“倒U”关系,即水平过高或过低均损害认知,这与其作用受体不同有关。
3.2.1 良性应激下NE效应Li等[11]研究发现,良性应激下脑内NE浓度升至最佳水平,该水平的NE能激活猕猴PFC神经元突触后膜上的α2A受体(α2AR)。α2AR激活主要发生在代表与当前目标任务相关的特征的神经元上,通过Gi蛋白介导胞内cAMP降低。其介导的环核苷酸门控阳离子通道(hyperpolarization-activated and cyclic nucleotide-gated channels,HCN)激活的作用减弱[12]。有证据表明,cAMP主要通过对HCN通道的作用来调节神经元及神经网络放电,进而调节工作记忆。树突棘上的HCN关闭后,通过HCN外流的Na+、K+等阳离子形成的外向Ih电流减弱,神经元超极化水平降低。使接受目标相关特征神经元网络输入的神经元放电水平增强,神经元调节促进目标导向的工作记忆增强。此状态处于“倒U”曲线中间位置。
3.2.2 劣性应激下NE效应劣性应激时中枢系统中的NE浓度高于最适水平,处于“倒U”曲线右端。高水平NE激活PFC中的α1受体及β受体,损伤PFC功能。
α1受体的激活通过Gq蛋白介导蛋白激酶C(PKC)活化。Birnbaum等[13]研究表明,PKC激动剂注入大鼠或猴子的PFC均能模拟劣性应激所致的工作记忆障碍,反之,PKC抑制剂能阻断α1受体激动所致的认知损伤。这些证据说明PKC能介导工作记忆损伤。另外,Ca2+释放也会开启胞体上的小电导Ca2+激活K+通道(SK通道),产生Isk电流,抑制神经元放电,进一步损伤认知功能。
β受体激活通过Gs蛋白介导胞内cAMP水平升高,激活蛋白激酶A(PKA)。尽管PKA能够诱导LTP,调节神经可塑性,产生记忆巩固作用。但cAMP也会介导交换蛋白(RAPGEF3)及HCN通道的激活,树突棘上的HCN激活后Na+、K+等阳离子外流,产生外向Ih电流,神经元超极化[14]。PKA的激活还会调节K+通道Kv7的开放,K+外流产生超极化M电流,进一步抑制神经元放电,损伤认知功能。
Ca2+释放虽能诱导神经元产生去极化电流ICAN,促进神经元正常放电,而PKC的激活和高水平cAMP又会抑制ICAN。整体上表现为神经元放电抑制,导致神经元功能障碍,学习记忆损伤[15]。
3.3 多巴胺(dopamine,DA) 3.3.1 应激下的多巴胺效应DA对认知的作用亦存在“倒U”关系,应激介导PFC上的DA释放,并对其受体产生不同程度的激活作用。D1受体(D1R)的适度或过度激活均通过Gs蛋白介导胞内cAMP升高,但不同神经元D1R激活程度也不同。Funahashi等[16]用猴子进行动眼神经延迟反应任务(oculomotor delayed response task,ODR),发现在基于目标的工作记忆任务中,代表目标方向的神经元激活,非目标方向特征的神经元则被抑制。进一步研究显示这由于不同的神经元D1R激活程度不同。D1R激活主要发生在代表其他外界干扰特征的神经元上,高水平cAMP使DA能神经元树突棘上HCN通道开启,通过HCN外流的Na+、K+等阳离子形成的外向Ih电流增强,神经元超极化水平升高,无关放电受抑制,目标相关放电分辨率升高,学习记忆增强。
劣性应激情况下,DA水平过高导致D1R无细胞选择性地过度激活,在ODR中表现为代表所有方向的神经元活动均被抑制。而当DA水平过低,没有足够的D1R激活时,代表非目标相关特征的神经元活动未能被抑制,会干扰正常的工作记忆[15]。
3.3.2 应激下参与DA影响认知过程的相关基因有证据显示,儿茶酚-O-甲基转移酶(catechol-O-methyl transferase,COMT)基因rs4680位点的多态性会导致COMT蛋白上相应位点缬氨酸(Val)突变为甲硫氨酸(Met),造成COMT酶活性降低,PFC中DA代谢能力随之降低。高水平的DA增加了应激下机体发生认知损伤的可能。近期,Crum等[17]对rs4680位点基因型不同人的研究还发现,虽然Met/Met基因型的个体会经历更高水平的社会心理压力,但进行建设性心态干预操作后,其积极情绪增加、认知改善水平要比Val/Val个体更明显。证明COMT基因变异可以改变心态干预对应激反应的调节能力。此外,低应激条件下,Met/Met型个体在认知任务中表现优于Val/Val个体,而应激下过量DA涌入PFC会抑制正常的认知加工。这可能是应激下的认知改善存在个体差异的原因之一。建设性心态干预后表现出更加明显的作用则可能也与高水平DA有关。
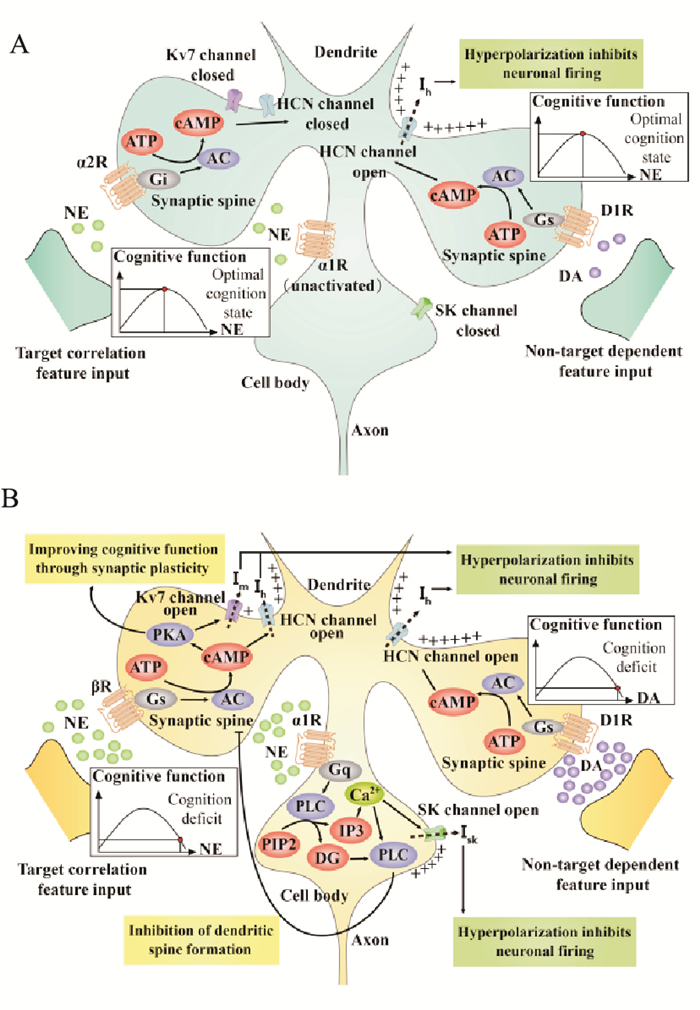
|
| Fig 1 Difference in downstream mechanism of neurotransmitters under different stress intensity A: Eustress condition; B: Distress condition. |
一般认为良性应激过程中DA和NE存在互补作用。NE激活α2A受体,增加代表目标相关的神经网络放电;DA激活D1R,降低与目标无关的神经网络放电。两种机制共同增强PFC功能,抑制和当前任务无关的内在想法,提高个体注意力,使之在工作记忆任务中表现更佳,改善认知。
3.4 5-羟色胺(5-hydroxytryptamine,5-HT)5-HT也参与应激影响认知的作用。个体遭受应激后,突触间5-HT水平升高会降低个体对厌恶性刺激的反应。一般认为这是脑中5-HT激活突触后5-羟色胺2A受体(5-HT2AR)所致。Carhart-Harris等[18]在针对5-HT1AR和5-HT2AR的研究中提出,二者参与应激对认知影响的效应互补。5-HT1AR介导应激的被动应对,提高个体的应激承受力,缓和应激下个体的压力和情绪反应,提高压力调节能力。而5-HT2AR介导应激的主动应对,即面对应激时旨在改变处境的积极灵活应对,增强神经可塑性。良性应激时5-HT首先与中脑及边缘系统等处的5-HT1AR结合,介导神经细胞超极化,抑制放电,降低应激敏感性,抑制劣性应激反应。应激加重时,尽管5-HT2AR水平不变,但一定程度上能改变其与配体的亲和力,并进一步激活下游NLGN、CamK1g等即早基因表达。在PFC上表达水平更高的5-HT2AR去极化激活神经元,产生兴奋作用。5-HT2AR在兴奋性Glu能锥体神经元树突上具有较高的表达水平,5-HT2AR激活也会导致皮层Glu能神经元激活,产生依赖NMDAR的神经可塑性,在一定程度上改善认知,使个体灵活应对应激。
4 GC介导应激对认知的影响肾上腺皮质分泌的GC进入海马和杏仁核等脑区神经元后,能与盐皮质激素受体(mineralocorticoid receptor,MR)和糖皮质激素受体(glucocorticoid receptor,GR)结合。GC的作用也呈“倒U”型,水平过低或过高均对认知有不利影响。非应激状态下,糖皮质激素主要结合与其亲和力较高的MR。而GC水平过低时则会产生神经损伤作用。我们课题组研究发现,小鼠肾上腺切除后,糖皮质激素水平的下降会降低学习记忆任务中的表现,同时海马齿状回还发现有神经退行性变性[19]。
4.1 良性应激状态下GC的作用良性应激时,高浓度糖皮质激素在结合MR达饱和后,能结合亲和力相对较低的GR。此时,细胞质中的GR会从GR-热休克蛋白Hsp90复合物中解离,GC-GR复合体进入细胞核,特异性结合到其所调控的认知、神经可塑性相关基因的糖皮质激素反应元件(glucocorticoid responsive element,GRE)上,如结合到血清/糖皮质激素调节激酶(serum/glucocorticoid regulated kinase,SGK)基因启动子上游的GRE上,调控此类基因的表达,改善认知。而人FK506结合蛋白5(human FK506 binding protein 5,FKBP5)[20]和核受体亚家族3C组成员1(nuclear receptor subfamily 3 group C member 1,NR3C1)等调节GR复合体入核效率和GR功能的基因,也会对应激下的认知改善造成影响[21]。这些基因在上游调节GR的活性,或在GR下游产生作用,共同影响认知功能。
在PFC或基底外侧杏仁核(basolateral amygdala,BLA)中,GC能阻断突触间隙的儿茶酚胺转运体,提高突触间隙NE水平,增强NE作用。同时GC和GR负反馈作用于HPA轴,降低HPA轴激活程度。位于下丘脑室旁核神经元上的GR激活,能抑制CRH的产生,一般认为其机制涉及激活的GR入核,并作用于CRH基因启动子上的负性糖皮质激素反应元件(nGRE),进而抑制下丘脑CRH转录[22]。
4.2 劣性应激状态下GC的作用当劣性应激作用机体时,会有大量的GR长期处于激活状态,造成受体脱敏,负反馈作用钝化[19]。慢性应激作用下,持续长时间、高水平的GC会导致神经元死亡。有研究发现,大鼠持续GC暴露会使海马神经元退行性变性,并出现抑郁样症状。
4.3 GC上游相关因子作用研究显示,GR的伴侣蛋白之一FKBP5会影响HPA轴调节。FKBP5结合在热休克蛋白Hsp90上,调控GR敏感性及GR-GC复合体入核效率。Guidotti等[23]研究发现,FKBP5基因高表达时,大鼠腹侧海马和PFC上GR的配体亲和力和核转运效率均下降,个体也会对应激损伤更加敏感。编码GR的NR3C1基因能调控GR功能,其存在的诸多单核苷酸多态性也会改变GR活性,并影响个体的应激反应及应激对认知的改善作用。如Bcl1-rs41423247导致指向他人的躯体攻击和库欣综合征患者GC敏感性升高,同时也增加个体对社会应激的GC反应程度;ER22/23EK-rs8169导致GC抵抗,社会应激压力下GC反应程度降低;N363S-rs6195也会导致应激下GC反应程度升高。此外,NR3C1基因启动子区甲基化也会对应激及认知造成影响。
4.4 GC下游调控GR是一种配体诱导的转录因子,活化后能通过转录激活或转录抑制作用调控基因转录。Li等[24]研究发现应激下小鼠PFC中SGK1水平升高。SGK是一种由血清或GC刺激激活的即早基因,编码一种丝氨酸/苏氨酸蛋白激酶。GC激活增强SGK1蛋白的胞质定位。研究发现,SGK能够增加非洲爪蟾卵母细胞质膜蛋白质丰度,如Glu1亚基、上皮Na+、Ca2+通道等。说明应激下SGK能增加细胞离子通道和转运蛋白的水平。进一步研究显示,SGK1能够调节NMDAR和AMPAR在神经元上的转运,调节膜表面NMDAR和AMPAR的数量,进而导致Glu能传递增强。这一过程需要Rab4和Rab5蛋白的参与。Rab蛋白参与囊泡形成、囊泡内容物的选择、运输及在靶位点的融合。Rab4则直接参与GC引起的PFC神经元上NMDAR、AMPAR转移的增强,它通过SGK依赖的机制激活,控制早期内体转运至细胞表面的循环过程。由于PFC是实现工作记忆的重要脑区,同时研究发现,阻断应激下SGK的表达会阻止Glu能传递增强,并进一步干扰工作记忆改善。因此GR激活SGK诱导的PFC上NMDAR、AMPAR转运水平升高,可能是介导应激下认知改善的原因之一[21]。
还有证据指出,SGK1能够磷酸化激活IκB激酶α(IκKα),通过NF-κB通路,上调NMDAR亚基NR2A、NR2B的表达,进一步诱导LTP,产生记忆改善作用[25]。
5 小结与展望应激对认知的影响具有双重性,良性应激能改善认知,而劣性应激则会导致认知损伤。应激首先导致NE、DA、5-HT等递质水平升高。不同的应激程度下,激素水平差异导致激活的受体种类及程度不同,这些受体通过下游信号通路对神经元放电产生调节作用,改善或损伤认知功能。糖皮质激素作用于受体,会通过GRE及促进下游SGK等蛋白转录的基因组途径,作用囊泡相关蛋白,促进Glu等递质释放等机制,参与对认知的调控。此外,还有COMT、FKBP5、NR3C等诸多参与应激影响认知功能的基因异常或过度表达均会对认知造成影响。基于上述总结,我们对应激程度差异及其作用机制差异有了更深入了解,为利用良性应激改善认知水平,寻找促智药的潜在靶点提供理论基础;另一方面,通过研究劣性应激对认知的损伤,可为临床治疗抑郁、创伤性应激障碍,改善焦虑等应激相关疾病提供新的思路和策略。
| [1] |
Rochette L, Vergely C. Hans Selye and the stress response: 80 years after his "letter" to the Editor of Nature[J]. Ann Cardiol Angeiol, 2017, 66(4): 181-3. doi:10.1016/j.ancard.2017.04.017 |
| [2] |
Selye H. Forty years of stress research: principal remaining problems and misconceptions[J]. Can Med Assoc J, 1976, 115(1): 53-6. |
| [3] |
Karsdorp P A, Geenen R, Vlaeyen J W. Response inhibition predicts painful task duration and performance in healthy individuals performing a cold pressor task in a motivational context[J]. Eur J Pain, 2014, 18(1): 92-100. |
| [4] |
Porcelli, Cruz A J, Wenberg D, et al. The effects of acute stress on human prefrontal working memory systems[J]. Physiol Behav, 2008, 95(3): 282-9. doi:10.1016/j.physbeh.2008.04.027 |
| [5] |
Luine V, Martinez C, Villegas M, et al. Restraint stress reversibly enhances spatial memory performance[J]. Physiol Behav, 1996, 59(1): 27-32. doi:10.1016/0031-9384(95)02016-0 |
| [6] |
Salehi B, Cordero M I, Sandi C. Learning under stress: the inverted-U-shape function revisited[J]. Learn Mem, 2010, 17(10): 522-30. doi:10.1101/lm.1914110 |
| [7] |
Yang Y, Wang Z H, Jin S, et al. Opposite monosynaptic scaling of BLP-vCA1 inputs governs hopefulness- and helplessness-modulated spatial learning and memory[J]. Nat Commun, 2016, 7: 11935. doi:10.1038/ncomms11935 |
| [8] |
Su W J, Zhang Y, Chen Y, et al. NLRP3 gene knockout blocks NF-κB and MAPK signaling pathway in CUMS-induced depression mouse model[J]. Behav Brain Res, 2017, 322: 1-8. doi:10.1016/j.bbr.2017.01.018 |
| [9] |
段海军, 王雪微, 王博韬, 等. 急性应激:诱发范式、测量指标及效果分析[J]. 心理科学进展, 2017, 25(10): 1780-90. Duan H J, Wang X W, Wang B T, et al. Acute stress: induction, measurement and effect analysis[J]. Adv Psychol Sci, 2017, 25(10): 1780-90. |
| [10] |
Lalumiere R T, Mcgaugh J L, Mcintyre C K. Emotional modulation of learning and memory: pharmacological implications[J]. Pharmacol Rev, 2017, 69(3): 236-55. |
| [11] |
Li B M, Mei Z T. Delayed-response deficit induced by local injection of the alpha 2-adrenergic antagonist yohimbine into the dorsolateral prefrontal cortex in young adult monkeys[J]. Behav Neural Biol, 1994, 62: 134-9. doi:10.1016/S0163-1047(05)80034-2 |
| [12] |
Dickstein D L, Weaver C M, Luebke J I, Hof P R. Dendritic spine changes associated with normal aging[J]. Neuroscience, 2013, 251: 21-32. doi:10.1016/j.neuroscience.2012.09.077 |
| [13] |
Birnbaum S G. Protein kinase C overactivity impairs prefrontal cortical regulation of working memory[J]. Science, 2004, 306(5697): 882-4. doi:10.1126/science.1100021 |
| [14] |
Wahl-Schott C. Hcn channels: structure, cellular regulation and physiological function[J]. Cell Mol Life Sci, 2009, 66(3): 470-94. doi:10.1007/s00018-008-8525-0 |
| [15] |
Arnsten A F. Stress signalling pathways that impair prefrontal cortex structure and function[J]. Nat Rev Neurosci, 2009, 10(6): 410-22. doi:10.1038/nrn2648 |
| [16] |
Funahashi S, Bruce C J, Goldman-Rakic P S. Mnemonic coding of visual space in the monkey's dorsolateral prefrontal cortex[J]. J Neurophysiol, 1989, 61(2): 331-49. doi:10.1152/jn.1989.61.2.331 |
| [17] |
Crum A J, Akinola M, Turnwald B P, et al. Catechol-O-methyltransferase moderates effect of stress mindset on affect and cognition[J]. PLoS One, 2018, 13(4): e0195883. doi:10.1371/journal.pone.0195883 |
| [18] |
Carhart-Harris R L, Nutt D J. Serotonin and brain function: a tale of two receptors[J]. J Psychopharmacol, 2017, 31(9): 1091-120. doi:10.1177/0269881117725915 |
| [19] |
He W B, Zhao M, Machida T, Chen N H. Effect of corticosterone on developing hippocampus: short-term and long-term outcomes[J]. Hippocampus, 2009, 19(4): 338-49. doi:10.1002/hipo.20523 |
| [20] |
陈姣, 楚世峰, 陈乃宏. 糖皮质激素与抑郁发病相关机制研究进展[J]. 中国药理学通报, 2013, 29(11): 1493-5. Chen J, Chu S F, Chen N H. Research progress in glucocorticoid and pathophysiology of depression[J]. Chin Pharmacol Bull, 2013, 29(11): 1493-5. doi:10.3969/j.issn.1001-1978.2013.11.004 |
| [21] |
Yuen E Y, Liu W, Karatsoreos I N, et al. Mechanisms for acute stress-induced enhancement of glutamatergic transmission and working memory[J]. Mol Psychiatry, 2011, 16(2): 156-70. doi:10.1038/mp.2010.50 |
| [22] |
Chu S C, Yu C H, Chen P N, et al. Role of oxidative stress in disrupting the function of negative glucocorticoid response element in daily amphetamine-treated rats[J]. Psychoneuroendocrinology, 2016, 71: 1-11. |
| [23] |
Guidotti G, Calabrese F, Anacker C, et al. Glucocorticoid receptor and FKBP5 expression is altered following exposure to chronic stress: modulation by antidepressant treatment[J]. Neuropsychopharmacology, 2013, 38(4): 616-27. doi:10.1038/npp.2012.225 |
| [24] |
Li Y C, Wang L L, Pei Y Y, et al. Baicalin decreases SGK1 expression in the hippocampus and reverses depressive-like behaviors induced by corticosterone[J]. Neuroscience, 2015, 311: 130-7. doi:10.1016/j.neuroscience.2015.10.023 |
| [25] |
Tai D J, Su C C, Ma Y L, Lee E H. SGK1 phosphorylation of IkappaB kinase alpha and p300 up-regulates NF-kappaB activity and increases N-methyl-D-aspartate receptor NR2A and NR2B expression[J]. J Biol Chem, 2009, 284(7): 4073-89. doi:10.1074/jbc.M805055200 |
