

2. 广东天普生化医药股份有限公司,广东 广州 510520
李民(1976-),男,博士,副教授,博士生导师,研究方向:分子药理学、细胞自噬,通讯作者,E-mail: limin65@mail.sysu.edu.cn
 ,
LI Si-tong1,
CHEN Jian-wen1,
TAN Fei2,
ZHENG Zhi-hua1,
ZHANG Zhi-jun2,
LIU Pei-qing1
,
LI Si-tong1,
CHEN Jian-wen1,
TAN Fei2,
ZHENG Zhi-hua1,
ZHANG Zhi-jun2,
LIU Pei-qing1
 ,
LI Min1
,
LI Min1

2. Techpool Bio-pharmaceutical Co., Ltd, Guangzhou 510520, China
术后肠梗阻(postoperative ileus,POI)是一种常见的腹部外科手术后的并发症。由于手术的创伤和腹腔的炎症,造成肠壁水胀并渗出脓液,导致黏连性肠梗阻,进而影响胃肠蠕动[1]。现在已知的POI发病机制主要是两种:神经机制和炎症机制。其中,由神经系统介导的主要是在POI的早期阶段,手术带来的创伤和疼痛让交感神经异常兴奋,从而抑制迷走神经,触发神经炎症的发生。炎症机制主要是在POI的持续阶段,其过程复杂,也是临床上的防治重点。这两种机制间存在着相互影响的交互效应[2-3]。POI的严重程度和持续时间决定着病人的术后恢复时间[4]。尽早预防和治疗POI能减少病人住院天数,降低医疗费用。
乌司他丁(ulinastatin,UTI)是一种由143个氨基酸组成的人内源性酸性糖蛋白,其蛋白活性功能区被称为Kunitz结构域,能够抑制多种水解酶、蛋白酶活性,是一种广谱的蛋白酶抑制剂。UTI药理作用广泛,如抗炎、抗休克作用,稳定溶酶体膜从而抑制多种水解酶活性,神经保护作用,免疫调节作用等。且UTI临床不良反应少,临床适应症众多,但大部分都与炎症反应相关。通过其抗炎、抗氧化作用阻断级联式炎症反应,在临床上广泛应用于急性胰腺炎的治疗[5]。基于以上背景,本研究建立腹腔手术造成的POI大鼠模型,研究UTI对大鼠POI的预防和治疗作用,以及对POI大鼠肠道屏障功能的保护作用,初步探讨其治疗POI及保护肠道黏膜的机制,为今后的POI及UTI临床研究和治疗提供实验依据。
1 材料与方法 1.1 试剂与仪器UTI(天普洛安公司);戊巴比妥钠、伊文氏蓝溶液(美国Sigma公司);TRIzol(日本TaKaRa公司);RNA逆转录试剂盒、RT-PCR试剂盒(美国Thermo公司);SYBR Green(日本TOYOBO公司);D-乳酸比色法检测试剂盒(武汉艾美捷科技有限公司);内毒素ELISA试剂盒(上海酶联生物科技有限公司)。手术器械(深圳瑞沃德生命科技有限公司);倒置荧光显微镜(德国Leica公司);酶标仪(美国BioTek公司);实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 动物实验♂SD大鼠,体质量(200~250) g,实验编号2017-261DS,购自中山大学动物实验中心。将92只♂SPF级SD大鼠随机分为正常对照组(10只)、模型组(10只)、给药组(共72只,每组8只)。对照组不做任何手术处理。其余大鼠参照文献报道方法建立术后早期炎性肠梗阻模型[6]。SD大鼠禁食12 h后,腹腔注射3%戊巴比妥钠(45 mg·kg-1)进行麻醉。在大鼠下腹部正中线切口,暴露全部小肠(胃幽门至回肠末端),用干燥医用纱布反复擦拭肠管15 min后缝合伤口。给药组分为3种给药途径:预防组(Pre)在麻醉前1 h尾静脉注射UTI溶液(溶于生理盐水)1次;治疗组(Tre)在术后24、48 h分别尾静脉注射UTI溶液(溶于生理盐水)1次;围术期组(Peri)在麻醉前1 h和术后24、48 h分别尾静脉注射UTI溶液(溶于生理盐水)1次。其中,各给药组又分为低、中、高(3.0×104、9.0×104、2.5×105 U·kg-1)3个剂量。
1.3 胃肠传输功能测定手术48 h,用0.15 mL伊文氏蓝溶液进行经口灌胃,30 min后腹腔注射3%戊巴比妥钠(45 mg·kg-1)进行麻醉。开腹取出小肠,在无张力状态下,测量小肠总长(胃幽门起至回肠末端)和肠管蓝染的长度,计算胃肠推进率,胃肠推进率/%=蓝染肠管长度/全小肠长度×100%。
1.4 形态学检测回肠末端组织置于4%多聚甲醛中固定,常规石蜡包埋后,厚5 μm的连续石蜡切片,进行HE染色以及AB/PAS染色。
1.4.1 小肠绒毛完整性检测每组取6只大鼠HE切片,在倒置荧光显微镜下观察SD大鼠肠绒毛。采用Chiu肠黏膜损伤评分法进行分级评分[7],根据光镜下肠黏膜损伤情况,评分一共分为5级:绒毛正常评分为0级;绒毛顶端下间歇增宽评分为1级;绒毛顶端上皮脱落、破溃评分为2级;绒毛顶端破坏扩展到基底部评分为3级;上皮完全脱落评分为4级;固有层崩溃,出现溃疡及出血点评分为5级。
1.4.2 杯状细胞数量测定每组取6只大鼠AB/PAS切片,随机选取视野和选择5个完整隐窝和小肠绒毛,进行杯状细胞数量统计。
1.5 D-乳酸、内毒素含量检测从大鼠腹腔静脉抽取5 mL血液,在室温中静置4 h,再4 ℃静置过夜,提取分离的血清备用。严格按照试剂盒说明书对大鼠血清中D-乳酸和内毒素进行检测。
1.6 qPCR检测炎症因子及肠道屏障相关mRNA的表达取小肠组织20 mg,严格按照TRIzoL说明书进行提取组织总RNA实验操作,逆转录合成cDNA后,进行real-time PCR扩增。PCR反应体系由cDNA模板、上下游引物、SYBR Master Mix和DEPC水混合构成,加入离心管中瞬时离心后,置于PCR仪中。参数设定为:95 ℃ 6 min,95 ℃ 6 s,60 ℃ 35 s,循环进行35次。内参为β-actin,每组样品设置3个复孔。引物序列见Tab 1。
| Gene | Primer sequence(5′ to 3′) |
| IL-6 | F: AGTTGCCTTCTTGGGACTGA |
| R: CCTCCGACTTGTGAAGTGGT | |
| IL-1β | F: CAGCAGCATCTCGACAAGAG |
| R: AAAGAAGGTGCTTGGGTCCT | |
| TNF-α | F: TGCCTCAGCCTCTTCTCATT |
| R: ATGAGAGGGAGCCCATTTG | |
| β-actin | F: TGAGCTGCGTTTTACACCCT |
| R: GCCTTCACCGTTCCAGTTTT | |
| MUC1 | F: CGGCCAACTTGTAGGAGCAA |
| R: AGTGGACTGCTGGAGCCAACT | |
| MUC2 | F: GCCAGATCCCGAAACCA |
| R: TATAGGAGTCTCGGCAGTCA | |
| MUC3 | F: CTCGTGGGAGCCGGG |
| R: AGTGGACGGAGAACACAGCG | |
| HD5 | F: TGAACCTACCCCAAAAACAGATG |
| R: TCAGCGGCAACAGAGTATGG | |
| HD6 | F: AGGACCAGGATGTGTCTGTCT |
| R: CAGAACGCAGTGGCATATTCTTT |
实验数据均表示为x±s。采用GraphPad Prism 5.0进行多组样本间差异分析(one way ANOVA)。
2 结果 2.1 UTI对POI模型大鼠胃肠传输功能的影响采用反复擦拭方法进行肠梗阻造模,比较给药前后的肠道蠕动情况。如Fig 1所示,与对照组相比,模型组胃肠推进率明显下降,且肠道组织水肿,严重黏连并伴有恶臭。与模型组相比,UTI预处理中、高剂量组均能明显提高胃肠推进率,肠道组织未见明显水肿黏连。而围术期组和治疗组的低、中、高剂量给药,均未明显改善胃肠推进率和肠道组织表型。
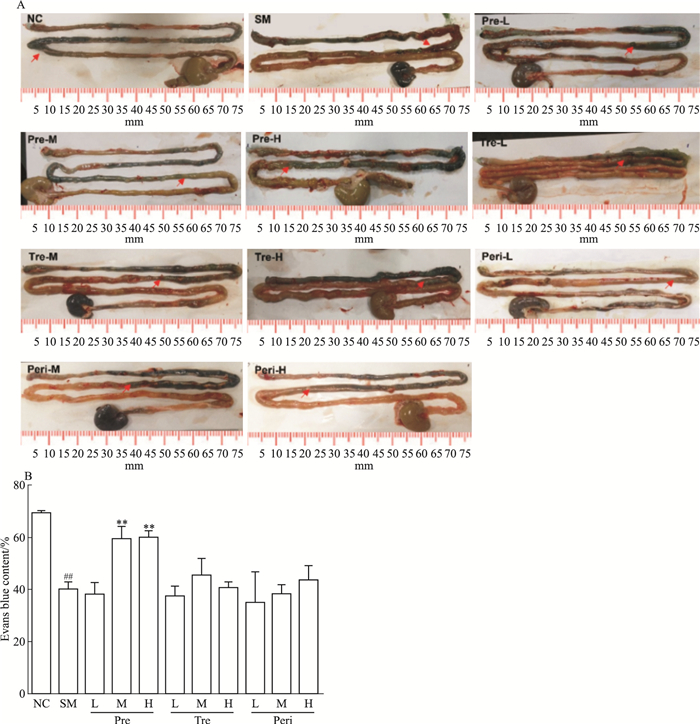
|
| Fig 1 Effect of UTI on intestinal peristalsis function(x±s, n=8) A: The small intestine with Evans blue dye stain(arrows); B: The statistics of the ratio of the length of Evans blue dye stain to the length of total small intestine. NC: Negative control; SM: Surgery model; Pre-: Pretreatment; Tre-: Treatment; Peri-: Perioperation; L, M, H: Low, middle, high dose.##P < 0.01 vs NC; **P < 0.01 vs SM. |
根据对大鼠回肠末端组织HE染色结果,分析比较给药后肠黏膜形态变化。对照组大鼠小肠组织的无缺损绒毛占有比例高,光镜下观察绒毛排列整齐,纤长,断层绒毛数少;模型组大鼠无缺损绒毛占有比例明显降低,绒毛排列无序,基本呈断层碎片状。UTI预防组中剂量给药以及围术期组高剂量给药后,大鼠无缺损绒毛占有比例明显高于模型组,而其余治疗组无缺损绒毛占有比例变化差异无统计学意义(Fig 2A)。
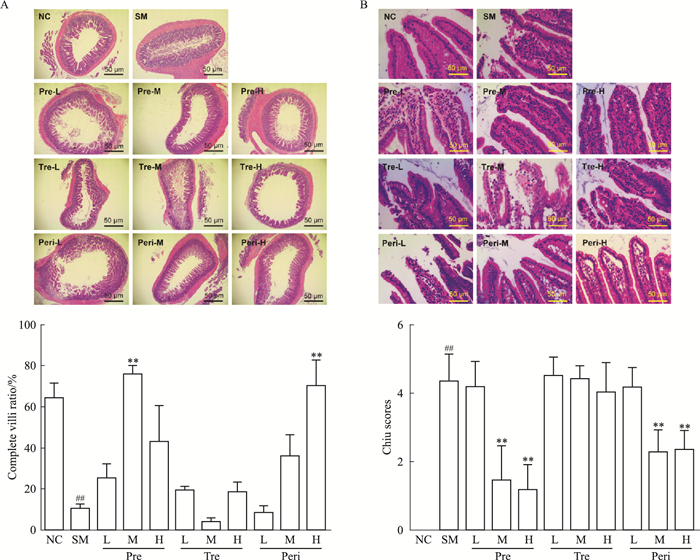
|
| Fig 2 Effect of UTI on integrity of small intestinal villi(x±s, n=8) A: The arrangement and morphology of intestinal villi observed from HE staining tissue sections and statistics of the ratio of non-defective villi in the intestinal walls(scale bar=50 μm). B: The micrographs of intestinal villi observed from HE staining tissue sections and Chiu scores of each groups(scale bar=50 μm).##P < 0.01 vs NC; **P < 0.01 vs SM. |
根据Chiu肠黏膜损伤评分法,进一步对大鼠肠绒毛结构完整性进行评估。Chiu肠黏膜损伤评分法中,绒毛损伤程度越严重,评分分数越高。如Fig 2B所示,模型组的肠绒毛上皮几乎完全脱落,评分最高。UTI预防组和围术期组中、高剂量给药后,评分数较低,绒毛结构相对完整,而其余治疗组与模型组评分相近,肠绒毛的破损结构没有明显改善。
2.3 UTI对POI模型大鼠小肠组织中炎症因子的影响利用qPCR法检测小肠组织中的炎症因子mRNA水平变化。如Fig 3所示,与对照组相比,模型组中炎症因子TNF-α、IL-6、IL-1β含量明显增加在不同给药方式处理组中,与模型组相比,预防组中、高剂量能有效降低3种炎症因子mRNA水平。治疗组与模型组相比,炎症因子mRNA水平未有明显改变。围术期组低、中、高剂量均能有效降低IL-6、IL-1β mRNA水平,对TNF-α mRNA水平在均值上有降低,但差异无统计学意义。。
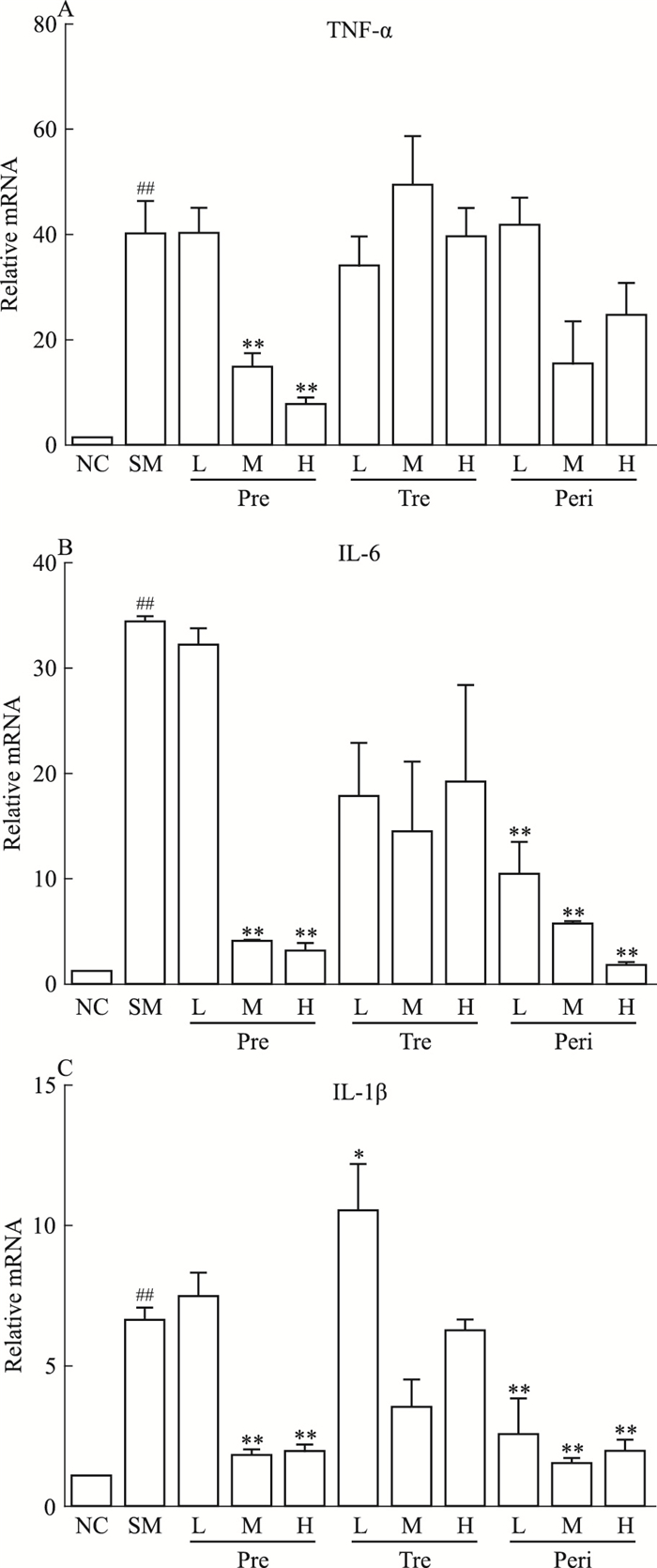
|
| Fig 3 Effect of UTI on POI-induced intestinal inflammatory factor(x±s, n=8) The mRNA levels of TNF-α(A), IL-6(B) and IL-1β(C) were measured by qPCR.##P < 0.01 vs NC; *P < 0.05, **P < 0.01 vs SM. |
进一步对不同组大鼠血清中的D-乳酸和内毒素含量进行比较。如Fig 4所示,模型组与对照组相比含量明显增加。与模型组比较,预防组中UTI中剂量组D-乳酸和内毒素含量均明显下降;治疗组3个剂量组均没有明显变化,围术期组中、高剂量给药D-乳酸和内毒素含量均明显下降。
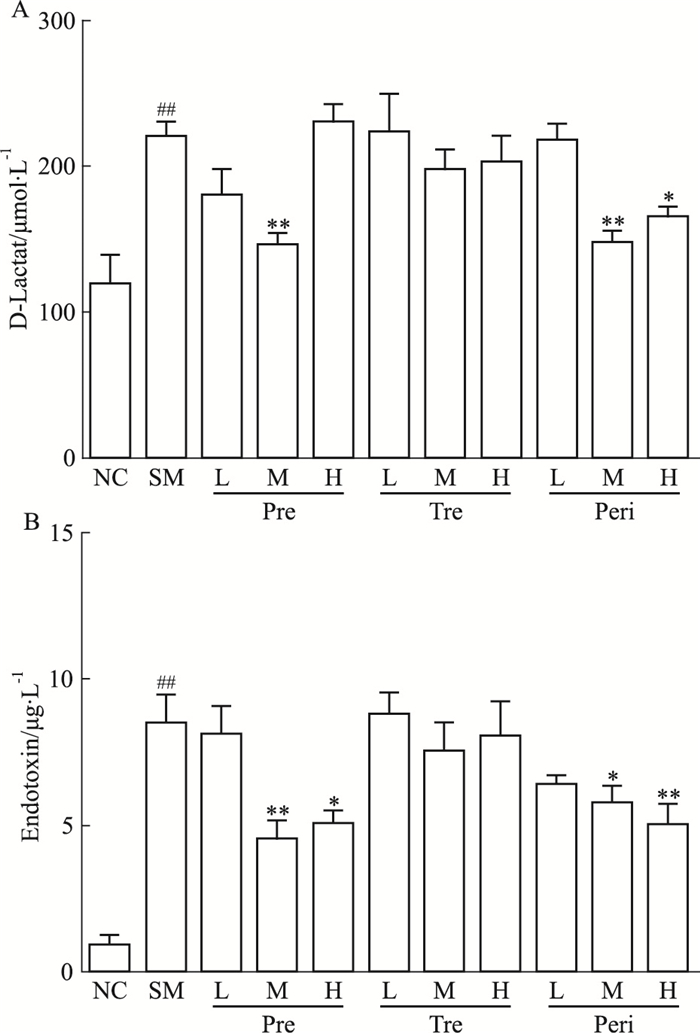
|
| Fig 4 Effect of UTI on POI-induced increase in bacterial metabolites in serum(x±s, n=8) A:The level of D-lactate in the different groups; B:The level of endotoxin in different groups.##P < 0.01 vs NC; *P < 0.05, **P < 0.01 vs SM. |
观察大鼠回肠末端组织AB/PAS染色切片,与对照组相比,POI模型组小肠绒毛上杯状细胞数目没有明显变化,预处理中剂量UTI给药后,与模型组相比杯状细胞明显增加(Fig 5A)。如Fig 5B所示,模型组与对照组比较,隐窝中的杯状细胞数量大大提升,预处理中剂量UTI给药后,与模型组对比,杯状细胞数量明显下降。
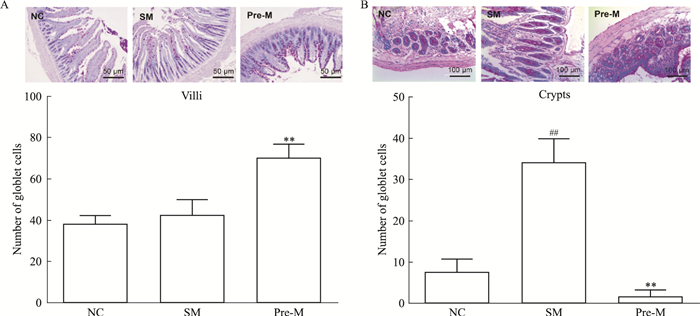
|
| Fig 5 Effect of UTI on number of goblet cells(x±s, n=6) The micrographs of goblet cells observed from AB/PAS staining tissue sections and the statistics of the number of goblet cells of different groups in villi(A) and in crypts(B)(scale bar=100 μm).##P < 0.01 vs NC; **P < 0.01 vs SM. |
如Fig 6所示,与对照组相比,造模组MUC2、MUC3 mRNA水平明显升高,HD5 mRNA水平明显下降;预处理组中剂量UTI给药后,与模型组相比,HD5 mRNA水平明显升高,MUC2、MUC3 mRNA水平明显下降。MUC1、HD6 mRNA水平变化差异无统计学意义。
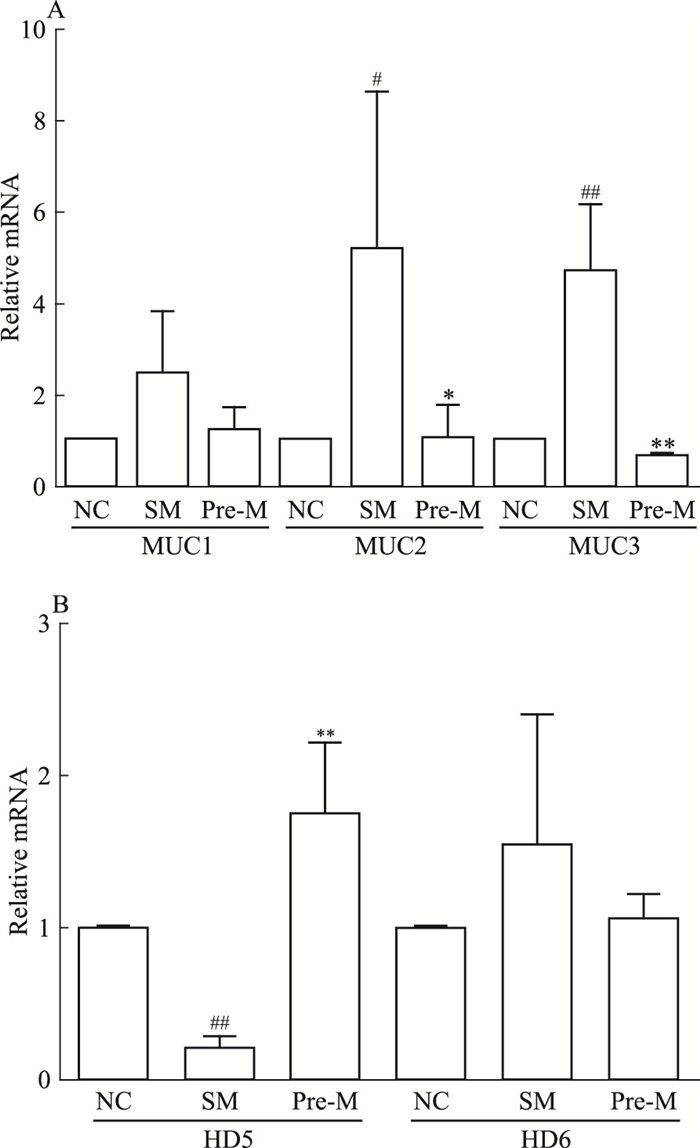
|
| Fig 6 Effects of UTI on mRNA transcription associated with intestinal mucosal barrier(x±s, n=8) A: The mRNA levels of MUC1, MUC2 and MUC3 were measured by qPCR; B: The mRNA levels of HD5 and HD6 were measured by qPCR.#P < 0.05, ##P < 0.01 vs NC; *P < 0.05, **P < 0.01 vs SM. |
POI是腹部外科手术后常见的并发症,研究者们将POI定义为“手术干预后引起肠蠕动等功能障碍,阻止了肠内容物的有效运输或者口服摄入的耐受度”。POI关键病因之一是炎症的过度反应,现在临床上对于POI的预防和治疗并没有理想的方案[8]。UTI是临床上广泛用于治疗急性胰腺炎的糖蛋白药物,能够抑制炎症细胞的激活和炎症介质的释放,是一种广谱蛋白酶抑制剂[5]。本实验通过对POI大鼠模型进行不同的UTI给药方式和剂量的比较发现,预处理中剂量给药,即在大鼠腹腔造模手术前1 h给予9.0×104 U·kg-1 UTI能够有效降低炎症因子mRNA水平,改善大鼠腹腔手术后肠梗阻造成胃肠传输功能下降。此结果提示,腹腔手术前预处理给予UTI,在POI大鼠模型中能够发挥抗炎作用,有效预防和治疗术后肠梗阻。
胃肠道的黏膜屏障是先天宿主防御的第一道防线[9],肠黏膜屏障的一个重要部分是机械屏障,是由肠黏膜上皮细胞以及细胞之间的紧密连接等构成[10]。当肠黏膜屏障受损后,将引起肠壁通透性的增加,致使一些肠道细菌和其代谢物异位入血,加剧肠道炎症和免疫反应,其中D-乳酸和内毒素就是常见的细菌发酵代谢产物,所以检测血液中的D-乳酸和内毒素水平能够反映出肠通透性及其受损程度。研究发现,POI模型大鼠的小肠组织呈现充血水肿的状态,小肠绒毛结构严重破坏,D-乳酸和内毒素水平明显升高,预处理中剂量UTI给药后能够明显改善这些现象。此结果提示,UTI可以通过修复肠黏膜屏障功能中的机械屏障,降低肠壁通透性,来减缓POI大鼠肠道炎症。
根据以上各组POI大鼠病理生理结果,我们认为UTI预防组中剂量给药治疗POI效果最佳,以预防组中剂量给药为标准,初步研究了与肠道屏障功能相关的部分指标。除了小肠绒毛外,肠道杯状细胞分泌出的各种黏蛋白、水以及无机盐等,构成了凝胶样的黏液层以保护肠上皮细胞,抵御外界病原生物等的侵犯和维持肠道内环境稳态[11]。杯状细胞由肠道隐窝基底处的干细胞分化而成,从隐窝基底向绒毛顶端迁移成熟,变成典型的杯状形态[12]。根据杯状细胞数量统计结果推测,POI大鼠肠黏膜屏障被破坏,刺激隐窝处干细胞分化,黏液细胞分泌增加,杯状细胞数量明显增加。UTI给药后,杯状细胞迁移生长速度加快,绒毛处杯状细胞明显增加,而隐窝处杯状细胞数量明显降低。根据杯状细胞分泌黏蛋白MUC1、MUC2、MUC3 mRNA的变化,推测大鼠肠道屏障受损,机体会自发增加黏蛋白的分泌,保护肠道,UTI给药后,通过抗炎和修复小肠绒毛,加快了疾病恢复,MUC2和MUC3蛋白相应减少。
α-防御素是一种抗菌多肽,由小肠上皮细胞中的潘氏细胞分泌,同杯状细胞分泌的黏蛋白一样,也是肠黏膜屏障的重要部分,主要起到溶菌和杀菌等作用。HD5和HD6是人体内分泌出现的两种α-防御素,在肠道天然免疫中发挥着重要作用[13]。根据本实验结果推测,肠黏膜屏障破坏会影响HD5蛋白的分泌,而UTI可以恢复甚至刺激这种蛋白的分泌,来抵御外来的破坏,维持肠道稳态。
综上所述,预处理中剂量UTI给药能有效预防和治疗术后肠梗阻大鼠。在POI大鼠中,UTI能够发挥抗炎作用,维持小肠绒毛以及肠黏膜屏障的完整性。本研究结果对UTI治疗术后炎性肠梗阻提供了一些理论依据,同时初步探索了POI大鼠模型中UTI对肠道屏障功能的影响。
( 致谢: 本实验在中山大学药学院药理毒理实验室完成,在此对给予实验帮助的老师和同学表示感谢。)
| [1] |
李幼生, 黎介寿. 再论术后早期炎性肠梗阻[J]. 中国实用外科杂志, 2006, 26(1): 38-9. Li Y S, Li J S. The discussion of early postoperative inflammatory small bowel obstruction[J]. Chin J Practical Surg, 2006, 26(1): 38-9. doi:10.3321/j.issn:1005-2208.2006.01.015 |
| [2] |
de Jonge W, van den Wijngaard R, The F, et al. Postoperative ileus is maintained by intestinal immune infiltrates that activate inhibitory neural pathways in mice[J]. Gastroenterology, 2003, 125(4): 1137-47. doi:10.1016/S0016-5085(03)01197-1 |
| [3] |
Bragg D, El-Sharkawy A, Psaltis E, et al. Postoperative ileus: recent developments in pathophysiology and management[J]. Clin Nutr, 2015, 34(3): 367-76. doi:10.1016/j.clnu.2015.01.016 |
| [4] |
Holte K, Kehlet H. Postoperative ileus: a preventable event[J]. Br J Surg, 2000, 87(11): 1480-93. doi:10.1046/j.1365-2168.2000.01595.x |
| [5] |
Pan Y, Fang H, Lu F, et al. Ulinastatin ameliorates tissue damage of severe acute pancreatitis through modulating regulatory T cells[J]. J Inflamm(Lond), 2017, 14: 7. doi:10.1186/s12950-017-0154-7 |
| [6] |
Turler A, Kalff J, Moore B, et al. Leukocyte-derived inducible nitric oxide synthase mediates murine postoperative ileus[J]. Ann Surg, 2006, 244(2): 220-9. doi:10.1097/01.sla.0000229963.37544.59 |
| [7] |
王翠翠, 王曦滔, 程辰, 等. 肠黏膜屏障功能评价指标的检测和应用[J]. 医学综述, 2010, 16(4): 623-5. Wang C C, Wang X T, Cheng C, et al. The application of evaluation index of mucosa barrier function[J]. Med Recapitulate, 2010, 16(4): 623-5. doi:10.3969/j.issn.1006-2084.2010.04.050 |
| [8] |
Rychter J, Clave P. Intestinal inflammation in postoperative ileus: pathogenesis and therapeutic targets[J]. Gut, 2013, 62(11): 1534-5. doi:10.1136/gutjnl-2012-304176 |
| [9] |
Kim Y, Ho S. Intestinal goblet cells and mucins in health and disease: recent insights and progress[J]. Curr Gastroenterol Rep, 2010, 12(5): 319-30. doi:10.1007/s11894-010-0131-2 |
| [10] |
丁少桢, 丁浩, 梅俏, 等. 同型半胱氨酸调控MEK-ERK-MLCK通路影响结肠炎大鼠肠黏膜通透性的实验研究[J]. 中国药理学通报, 2016, 32(4): 498-502. Ding S Z, Ding H, Mei Q, et al. Effect of homocysteine on the intestinal permeability by regulating MEK-ERK-MLCK signal transduction in experimental colitis rats[J]. Chin Pharmacol Bull, 2016, 32(4): 498-502. doi:10.3969/j.issn.1001-1978.2016.04.012 |
| [11] |
McCauley H, Guasch G. Three cheers for the goblet cell: maintaining homeostasis in mucosal epithelia[J]. Trends Mol Med, 2015, 21(8): 492-503. doi:10.1016/j.molmed.2015.06.003 |
| [12] |
Radwan K, Oliver M, Specian R. Cytoarchitectural reorganization of rabbit colonic goblet cells during baseline secretion[J]. Am J Anat, 1990, 189(4): 365-76. doi:10.1002/aja.1001890408 |
| [13] |
Shukla P, Meena A, Rao V, et al. Human defensin-5 blocks ethanol and colitis-induced dysbiosis, tight junction disruption and inflammation in mouse intestine[J]. Sci Rep, 2018, 8(1): 16241. doi:10.1038/s41598-018-34263-4 |