

创伤后应激障碍(post-traumatic stress disorder,PTSD)是个体经历了威胁生命的重大创伤事件之后,延迟出现的身心疾病。其核心症状包括创伤经历的病理性重现、警觉性增高和持续性回避,此外,还会有恐惧、焦虑和抑郁等常见临床表现。PTSD在当今社会中发病率不断提高,并且难以治愈,终身患病率高[1],引起了社会各界的关注。目前,治疗PTSD的临床一线药物都是以抗抑郁药为主,包括5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)和选择性5-羟色胺与去甲肾上腺素再摄取抑制剂(serotonin and norepinephrine reuptake inhibitors,SNRIs),如帕罗西汀(paroxetine,PRX)、文拉法辛等。但是这些抗抑郁的药物并不能完全治愈PTSD,有些症状仍长期存在。此外,长期服用此类药物还会出现明显的副作用。因此,寻找和发现安全有效的抗PTSD新药非常必要。
单一延长应激(single prolonged stress,SPS)是目前研究PTSD最常采用的动物造模方法之一,SPS很好地模拟了PTSD患者的临床表现,如焦虑抑郁、易激惹、高唤醒、学习记忆能力下降等[2]。皮质酮(corticosterone,CORT)是评价下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能的一个重要指标。但是,对PTSD而言,不管是临床还是对啮齿类动物的研究,有关外周血中CORT水平的报道却不尽相同,或升高或下降或不变[3]。由于PTSD是迟发性的精神心理疾病,因此,不同时间点的检测可能会对CORT的结果造成重要影响。尽管有关CORT的报道不一致,但HPA轴负反馈增强是有关PTSD的较为公认的病理基础[4],因此,调节HPA轴功能紊乱对于PTSD治疗具有重要的意义。龟鹿二仙胶(Guiluerxianjiao,GLEXJ)由鹿角胶、龟板、枸杞子、人参组成,具有补肾填精的功效。研究发现,GLEXJ能提高自然衰老小鼠的抗氧化能力和学习记忆能力,明显改善一氧化碳中毒迟发性脑病患者的症状体征,显示出其在神经系统疾病治疗中的良好效果[5]。本研究采用SPS方法建立PTSD大鼠模型,在不同时间点动态观察PTSD大鼠HPA轴功能和行为学的变化,以及GLEXJ的影响,以期揭示GLEXJ治疗PTSD的潜在价值。
1 材料与方法 1.1 实验动物分组及饲养环境SPF级成年SD大鼠282只,体质量(180~220) g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤)-2016-0041。大鼠每笼5只,随机分成正常组(control)、模型组(SPS)、龟鹿二仙胶组(GLEXJ)和帕罗西汀组(PRX)。整个实验过程中大鼠自由饮食,饲养在室温(23±2)℃,湿度(55±5)%,12 h光照/黑暗周期的环境中。所有的动物实验均符合广州中医药大学动物实验伦理委员会的要求。
1.2 药物的制备与给药方法鹿角胶、龟板、枸杞子、党参,均购于广州至信药业股份有限公司,按3:2:2:1的比例,水煎浓缩至所需浓度,给药剂量为3.6 g·kg-1。PRX购于浙江华海药业股份有限公司(规格:每片20 mg,批号:H20031106),用蒸馏水配制成2 g·L-1的溶液待用,给药剂量为10 mg·kg-1。自造模后d 8起,每日8:30~10:30对GLEXJ和PRX组大鼠分别灌胃给药,连续14 d或21 d;对正常组和模型组大鼠则给予纯水灌服。地塞米松磷酸钠注射液,购于遂成药业股份有限公司(规格:5 mg·mL-1,批号:H41021255)。体积分数为0.05的葡萄糖注射液,购于广东科伦药业有限公司(规格:50 mg·mL-1,批号:H51020636)。地塞米松磷酸钠注射液用体积分数为0.05葡萄糖注射液配制成浓度为1.5 g·L-1的溶液待用。
1.3 试剂与仪器CORT ELISA试剂盒(批号:ab108821),购于英国Abcam公司;促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH) ELISA试剂盒(批号:ESB-EO6875r),购于武汉华美生物工程有限公司;水合氯醛(批号:Q/12DJ0149-2014),购于天津市大茂化学试剂厂;乙醚(批号:20180102-1),购于广州化学试剂厂。YZB/USA3903-2010多功能酶标仪(Bio-Rad公司);GB/T23111电子分析天平(梅特勒-托利多仪器上海有限公司);YHC-11001A体重秤(瑞安市英衡电器有限公司);旷场实验设备(TM-ZFT)、高架十字迷宫实验设备(TM-GJT)及视频分析系统,均由广州飞迪生物科技公司提供。
1.4 PTSD大鼠模型的制备采用目前公认,也是文献报道最多的SPS方法制备PTSD大鼠模型[4]。SPS造模方法:经过7 d适应性喂养后,除正常组外,所有的大鼠均先束缚2 h,再强迫游泳20 min,休息15 min,最后乙醚麻醉至意识丧失后,放回原笼继续无打扰静养7 d。束缚器为直径6 cm、深20 cm的可活动亚克力装置。游泳装置为直径20 cm、高50 cm的亚克力游泳桶,游泳时水深35 cm,水温(24±1)℃。
1.5 体质量测量分别称量大鼠造模后第1周、第3周、第5周,即造模后d 8、22、28的体质量。
1.6 行为学检测造模后d 8、9、22、23、29、30,进行旷场实验(open field test,OFT)和高架十字迷宫实验(elevated plus maze test,EPMT),检测大鼠的行为学表现。所有行为学检测均在17:00~23:00进行,OFT后24 h,再进行EPMT实验。
1.6.1 OFT实验OFT是检测大鼠焦虑样行为和自主活动的经典实验[2]。旷场装置由100 cm×100 cm×40 cm的黑色亚克力敞口旷场箱、红外摄像头及分析软件组成。在黑暗的条件下,将大鼠放置于旷场箱中央,摄像头记录大鼠5 min的活动,由分析软件计算出总路程,即代表大鼠的自主活动。每次实验间隙予体积分数为0.01的苯扎溴铵溶液擦洗旷场箱后,用体积分数为0.75的酒精擦干,以减少动物间的干扰。
1.6.2 EPMT实验EPMT用于检测大鼠的焦虑样行为。大鼠探索开放臂活动减少,代表其有较高的焦虑情绪[6]。高架十字迷宫的装置由距离地面高36 cm的2条相对开放臂(15 cm×48 cm)和2条相对闭合臂(15 cm×48 cm×40 cm)及中央区(15 cm×15 cm)连接而成。设备上方安装跟踪摄像头,由分析软件计算出5 min内大鼠进入开放臂次数百分比、开放臂路程百分比及开放臂时间百分比。每次实验前均用体积分数为0.01的苯扎溴铵溶液清洗大鼠活动区,再用体积分数为0.75的酒精擦干,后将大鼠头朝固定开放臂放入中央区。
1.7 地塞米松抑制实验(dexamethasone suppression test,DST)DST是利用SPS-再应激(束缚制动)的模式,检测血浆ACTH含量,用以反映HPA轴快速负反馈功能[4]。DST分别在造模后d 8和d 22进行。首先,向大鼠皮下注射地塞米松(3 mg·kg-1),再立即束缚30 min,解除束缚后,用体积分数为0.07的水合氯醛麻醉,而后眼眶静脉取血。血液用含EDTA的采血管采集,3 000 r·min-1、4 ℃离心10 min后,吸取上清到另一1 mL的EP管,存放于-80 ℃冰箱中。ACTH检测采用ELISA法,操作方法按照试剂盒说明书进行。
1.8 CORT检测CORT检测分别于造模后d 8、22、28进行,乙醚轻度麻醉大鼠后,眼眶静脉取血,血浆收集及保存方法如上所述。血浆中CORT水平用ELISA法检测,按照说明书方法操作。每个实验流程如Fig 1所示,为防止3个实验间相互影响及重复检测带来的干扰,不同实验及不同观察时间点均选用不同批次的大鼠独立进行。
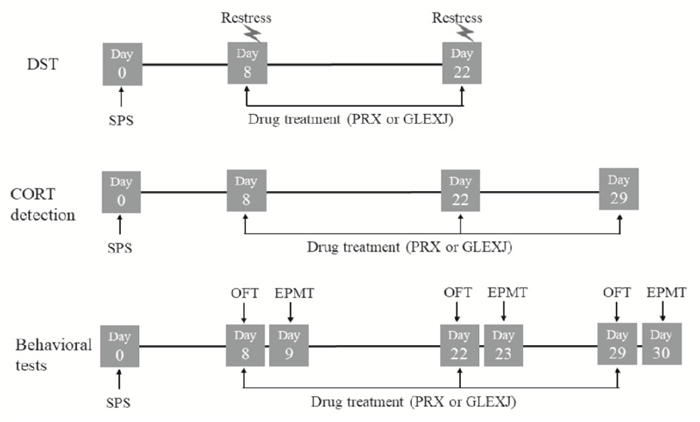
|
| Fig 1 Experimental design |
数据用x±s表示,所有数据均使用SPSS 22.0软件分析,两组间比较使用独立样本t检验,其他数据使用单因素方差分析(ANOVA)的检验方法。
2 结果 2.1 体质量结果各组大鼠体质量变化如Fig 2所示,各组间体质量无明显差异(P>0.05)。
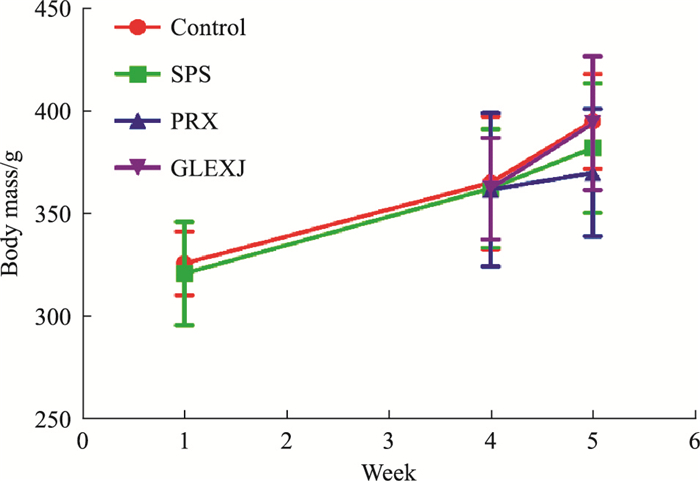
|
| Fig 2 Effect of GLEXJ on body mass of PTSD model rats after SPS(x±s) Week1, n=31;Week4, n=30~32;Week 5, n=23~24 |
如Fig 3所示,与正常组相比,模型组的总路程在SPS后d 8、22均有下降趋势,但差异无统计学意义;d 29总路程明显下降(P < 0.01)。GLEXJ和PRX连续给药14 d,即SPS后d 22,总路程有升高的趋势,但差异均无统计学意义;连续给药21 d,即SPS后d 29,总路程均明显增加(P < 0.01)。
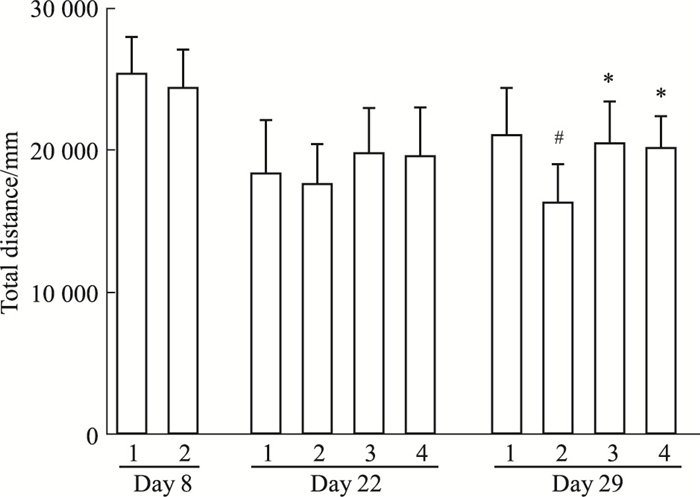
|
| Fig 3 Effects of GLEXJ on locomotor activities(x±s, n=10~12) The behavior was presented by total distances in the OFT(1.Control; 2. SPS; 3. PRX; 4. GLEXJ).#P < 0.05 vs control; *P < 0.05 vs SPS. |
如Fig 4所示,与正常组相比,SPS后d 9模型组的开放臂时间百分比、开放臂路程百分比差异均无统计学意义,进入开放臂次数百分比则明显下降(P < 0.05)。SPS后d 23、30,模型组的开放臂时间百分比与正常组比较,差异无统计学意义,但是开放臂路程百分比和进入开放臂次数百分比均明显下降(P < 0.05,P < 0.01)。GLEXJ组与PRX组连续给药14 d后,大鼠开放臂时间百分比、开放臂路程百分比、进入开放臂次数百分比有升高的趋势,但是差异无统计学意义。GLRXJ组连续给药21 d后,大鼠开放臂时间百分比、开放臂路程百分比有升高的趋势,但差异无统计学意义,而进入开放臂次数比明显升高(P < 0.01)。PRX组连续给药21 d后,大鼠开放臂时间百分比差异无统计学意义,开放臂路程百分比和进入开放臂次数百分比均明显升高(P < 0.05,P < 0.01)。
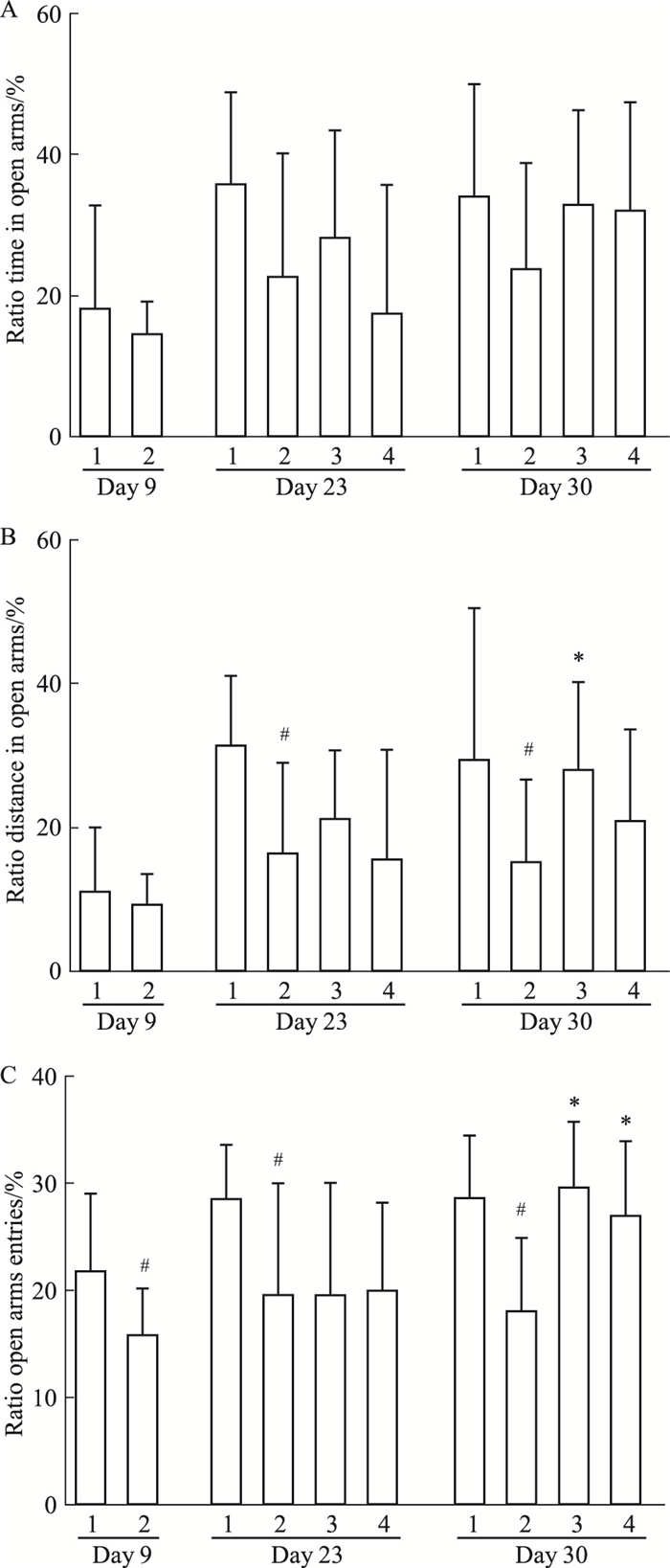
|
| Fig 4 Effects of GLEXJ on anxiety-like behaviors in EPMT(x±s, n=9~13) The behavior was presented by the percentages of time (A), distance; (B), entries; (C) into the open arms: 1.Control; 2. SPS; 3. PRX; 4. GLEXJ. #P < 0.05 vs control; *P < 0.05 vs SPS. |
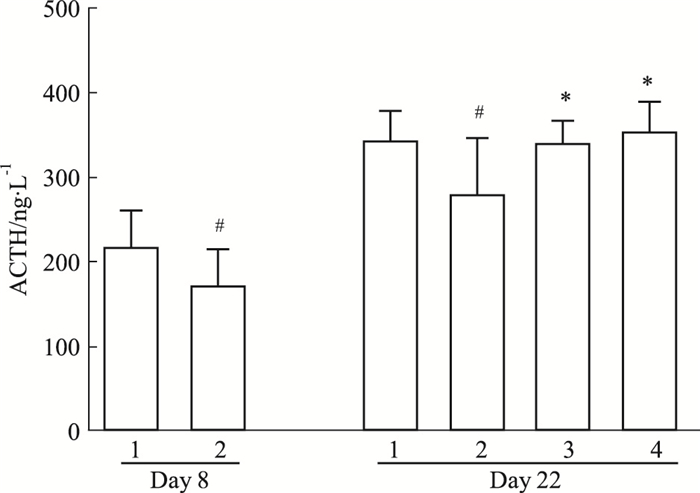
如Fig 5所示,SPS后d 8,与正常组相比,模型组的血浆ACTH含量明显下降(P < 0.05)。到d 22时,血浆ACTH仍明显低于对照组(P < 0.01)。GLEXJ组和PRX组连续给药14 d后,两组大鼠血浆ACTH含量均明显升高(P < 0.05,P < 0.01)。
|
| Fig 5 Effects of GLEXJ on content of plasma ACTH(x±s, n=8~9) 1.Control; 2. SPS; 3. PRX; 4. GLEXJ.#P < 0.05 vs control; *P < 0.05 vs SPS |
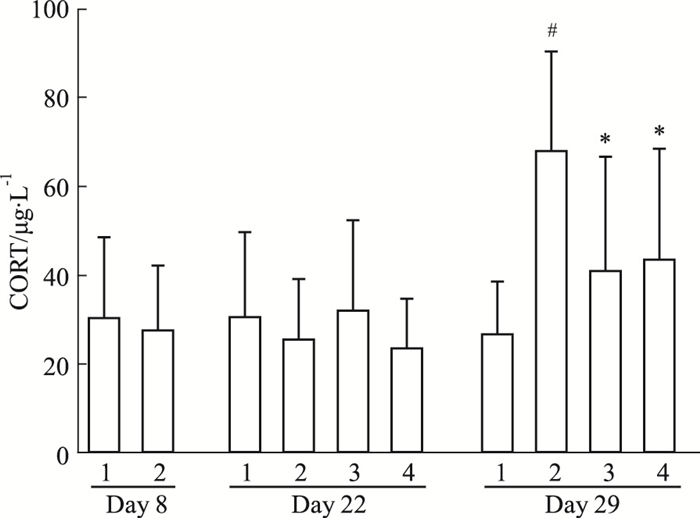
如Fig 6所示,SPS后d 8模型组CORT水平与正常组相比,差异无统计意义;d 22模型组CORT水平虽有升高,但差异无统计学意义;d 29,模型组CORT水平明显升高(P < 0.01)。GLEXJ连续给药14 d后,大鼠CORT水平略有下降,但差异无统计学意义;在连续给药21 d后,大鼠CORT水平与模型组比较明显下降(P < 0.05)。PRX连续给药14 d后,大鼠CORT水平与模型组比,差异无统计学意义;连续给药21 d后,CORT水平明显下降(P < 0.01)。
|
| Fig 6 Effects of GLEXJ on levels of plasma CORT(x±s, n=11~12) 1.Control; 2. SPS; 3. PRX; 4. GLEXJ.#P < 0.05 vs control; *P < 0.05 vs SPS |
在PTSD的研究中,其HPA轴功能的改变一直是人们关注的重点。CORT是HPA轴分泌的终末激素,通常用来评价HPA轴的基础功能。由于PTSD患者HPA轴功能紊乱,机体对这种紊乱的自我调节与适应是一个长期的过程,在此过程中,HPA轴的基础功能和负反馈功能相互影响,使得皮质醇呈现出长期的动态变化。所以在不同时间点检测外周血皮质醇水平,结果会不尽相同,或升高或降低或不变[3]。啮齿动物研究中,CORT的报道也是如此[7-8]。虽然皮质醇含量变化的报道不一致,但是PTSD患者普遍存在着HPA轴负反馈增强的现象[9]。Liberzon等[4]利用SPS-再应激(束缚制动)的研究模式,通过对比造模前后注射皮质醇与不注射皮质醇的大鼠,在束缚30 min后血浆ACTH的含量,发现如果大鼠的HPA轴负反馈增强,则ACTH的含量会明显下降。我们采用相同的方法研究发现,在SPS后的d 8,模型组大鼠的HPA轴负反馈功能出现增强,而且这种改变到d 22时仍然存在。在本研究中,在不实施再应激的情况下,我们从造模后d 8~29,动态观察了各组大鼠血浆CORT水平的变化。结果表明,模型组大鼠d 8虽然出现HPA轴负反馈功能增强,但外周血CORT水平并没有发生改变;d 22时虽然大鼠HPA轴负反馈功能增强仍然存在,但血浆CORT水平却呈现出升高的趋势;到d 29血浆CORT水平则明显升高。虽然血浆CORT水平的检测结果与一些文献报道一致[2],但为什么在HPA轴负反馈增强的情况下,会出现血浆CORT水平不降反升的现象?有研究认为,负反馈增强是HPA轴整体功能紊乱过程中的一种表现,当机体对这种功能亢进逐渐适应时,CORT对ACTH的刺激敏感性下降,进而开始分泌减少[10]。此外,有学者提出,PTSD患者皮质醇的分泌具有时间序列特征,表现为先升高,然后持续高水平,再降低,最后持续在低水平阶段[3]。在本研究中,d 29的模型大鼠可能仍处于PTSD发病的早期阶段,故CORT水平表现出升高的状态。随着机体对HPA轴功能亢进的逐渐适应,CORT水平可能会出现下降。此外还有一些研究发现,PTSD患者皮质醇水平出现不一致的情况除了与检测时间不同有关外,还可能跟性别有关,皮质醇水平下降的结果通常出现在有关女性PTSD群体的研究中[11],而在有关男性PTSD群体的研究中,皮质醇常出现升高或不变[12]。本实验观察到的CORT升高现象也可能与我们选用的动物性别有关,考虑到♀动物自身的性激素周期性变化可能会影响研究结果[13],故均选用了♂大鼠。本研究发现,GLEXJ在连续给药14 d后,能明显抑制HPA轴负反馈功能的增强,血浆CORT水平呈现下降趋势;在连续给药21 d后,大鼠血浆CORT水平明显下降。实验结果表明,GLEXJ能调节SPS导致的HPA轴功能紊乱。
OFT是利用大鼠对新环境的探索行为和趋避性,来检测大鼠自发活动的良好方法,用总路程来评价大鼠的自发活动情况。EPMT则是检测大鼠焦虑水平的常见方法。EPMT主要测试动物的非条件性反射,利用动物对新异环境的探究特性和对高悬敞开臂的恐惧心理所形成的矛盾冲突,来考察动物的焦虑状态。进入开放臂次数百分比、开放臂停留时间百分比和开放臂路程百分比越低,代表焦虑水平越高[6]。OFT结果表明,在SPS造模后d 8、22,自主活动均没有明显改变,与很多文献报道一致[2],但在d 29时自主活动下降。EPMT结果表明,模型组大鼠从造模后d 9开始出现焦虑水平升高,持续到d 30,表现出持久的焦虑,这与其他文献报道一致[6]。本研究发现,GLEXJ在连续给药14 d后能明显改善SPS引起的大鼠焦虑样行为,在连续给药21 d后能明显提高大鼠的自主活动能力。研究结果表明,GLEXJ能明显改善SPS导致的行为学异常。
大量的研究发现,HPA轴功能的紊乱是导致焦虑抑郁样行为出现的重要机制。一般情况下,当机体面对应激,首先是交感神经系统做出快速反应,然后HPA轴功能激活,调节较长时间的应激反应,故HPA轴功能紊乱时会导致机体出现行为障碍。本研究发现,当SPS大鼠HPA轴出现负反馈增强时,尽管当时CORT水平没有变化,但焦虑水平明显升高,这与文献报道一致[8]。HPA轴的负反馈功能主要受前额叶皮质-海马-杏仁核等脑区的糖皮质激素受体(glucocorticoid receptor,GR)/盐皮质激素受体(mineralocorticoid receptor,MR)和促肾上腺皮质激素释放因子1型受体(corticotropin-releasing factor-1 receptor,CRF1R)表达的影响。近年来研究表明,这些脑区中MR和GR的表达对焦虑、恐惧情绪反应等起重要调节作用[14],杏仁核中CRF1R的表达增多,能导致焦虑样行为的出现[15]。本研究结果表明,GLEXJ抑制了PTSD模型大鼠HPA轴负反馈功能的增强,改善了PTSD大鼠的行为异常,其作用机制可能与调节HPA轴功能紊乱有关。但GLEXJ是如何影响HPA轴的高位调节中枢,以及与HPA轴负反馈密切相关的激素及其受体的关系尚不清楚。这将是我们今后进一步深入研究的内容。
| [1] |
张黎明, 张有志, 李云峰. 创伤后应激障碍的神经生物学研究进展[J]. 中国药理学通报, 2010, 26(6): 704-7. Zhang L M, Zhang Y Z, Li Y F. The progress of neurobiological mechanisms on PTSD[J]. Chin Pharmacol Bull, 2010, 26(6): 706-7. |
| [2] |
Patki G, Li L, Allam F, et al. Moderate treadmill exercise rescues anxiety and depression-like behavior as well as memory impairment in a rat model of posttraumatic stress disorder[J]. Physiol behav, 2014, 130: 47-53. doi:10.1016/j.physbeh.2014.03.016 |
| [3] |
张权, 陈崝, 王玮文, 邓慧华. 创伤后应激障碍患者的HPA轴功能变化的时间序列特征[J]. 心理科学进展, 2016, 24(4): 536-46. Zhang Q, Chen Z, Wang W W, Deng H H. Temporal characteristics of change in HPA activity among PTSD patients[J]. Adv Psychol Sci, 2016, 24(4): 536-46. |
| [4] |
Liberzon I, Krstov M, Young E. Stress-restress:effects on ACTH and fast feedback[J]. Psychoneuroendocrinology, 1997, 22(6): 443-53. doi:10.1016/S0306-4530(97)00044-9 |
| [5] |
王珏, 唐朋林. 龟鹿二仙胶的现代运用[J]. 浙江中西医结合杂志, 2015, 25(17): 981-4. Wang J, Tang P L. Modern application of guiluerxianjiao[J]. Zhejiang JITCWM, 2015, 25(10): 981-4. doi:10.3969/j.issn.1005-4561.2015.10.039 |
| [6] |
Han F, Ding J, Shi Y. Expression of amygdala mineralocorticoid receptor and glucocorticoid receptor in the single-prolonged stress rats[J]. BMC Neurosci, 2014, 77(15): 1471-2202. |
| [7] |
Lee B, Sur B, Cho S G, et al. Ginsenoside Rb1 rescues anxiety-like responses in a rat model of post-traumatic stress disorder[J]. J Nat Med, 2016, 70(2): 133-44. doi:10.1007/s11418-015-0943-3 |
| [8] |
Zhang Y, Gandhi P, Standifer K. Increased nociceptive sensitivity and nociceptin/orphanin FQ levels in a rat model of PTSD[J]. Mol Pain, 2012, 8: 76. |
| [9] |
王宣尹, 吴丽丽, 严灿. HPA轴编程及其有关表观遗传修饰机制与创伤后应激障碍发病的研究进展[J]. 中国药理学通报, 2016, 33(1): 22-7. Wang X Y, Wu L L, Yan C. Epigenetic pathogenesis of post-traumatic stress disorder based on the HPA aixs[J]. Chin Pharmacol Bull, 2016, 33(1): 22-7. doi:10.3969/j.issn.1001-1978.2016.01.006 |
| [10] |
李鹤展, 吴建玲, 张亚林, 等. 创伤后应激障碍与抑郁症患者对小剂量地塞米松抑制试验的反应[J]. 神经疾病与精神卫生, 2005, 5(6): 420-1. Li H Z, Wu J L, Zhang Y L, et al. Pituitary-adrenal responses to low-dose dexamethasone suppression tests in depressive patients and posttraumatic stress disorder[J]. Nervous Dis Mental Health, 2005, 5(6): 420-1. doi:10.3969/j.issn.1009-6574.2005.06.004 |
| [11] |
Pacella M, Feeny N, Zoellner L, Delahanty D. The impact of PTSD treatment on the cortisol awakening response[J]. Depress Anxiety, 2014, 31(10): 862-9. doi:10.1002/da.2014.31.issue-10 |
| [12] |
Dekel S, Ein-Dor T, Gordon K M, et al. Cortisol and PTSD symptoms among male and female high-exposure 9/11 survivors[J]. J Trauma Stress, 2013, 26(5): 621-5. doi:10.1002/jts.2013.26.issue-5 |
| [13] |
范琼尹, 薛瑞, 李洋, 等. 单程延迟性应激诱导雌性大鼠创伤后应激障碍模型的建立[J]. 中国药理学与毒理学杂志, 2013, 27(4): 715-9. Fan Q Y, Xue R, Li Y, et al. Establishment of female rat model for post-traumatic stress disorder induced by single prolonged stress[J]. Chin J Pharmacol Toxicol, 2013, 27(4): 715-9. doi:10.3867/j.issn.1000-3002.2013.04.019 |
| [14] |
Souza R, Noble L, Mcintyre C. Using the single prolonged stress model to examine the pathophysiology of PTSD[J]. Front Pharmacol, 2017, 8: 615. doi:10.3389/fphar.2017.00615 |
| [15] |
Vicentini J, Céspedes I, Nascimento J, et al. CRF type 1 receptors of the medial amygdala modulate inhibitory avoidance responses in the elevated T-maze[J]. Horm Behav, 2014, 65(3): 195-202. doi:10.1016/j.yhbeh.2014.01.004 |

