

2. 武汉市第三医院(武汉大学附属同仁医院)放射科,湖北 武汉 430061;
3. 武汉市普仁医院心内科,湖北 武汉 430080
2. Dept of Radiology, Wuhan Third Hospital (Tongren Hospital of Wuhan University), Wuhan 430061, China;
3. Dept of Cardiology, Wuhan Puren Hospital, Wuhan 430080, China
流行病学调查表明,糖尿病患者心血管疾病患病率是非糖尿病人群心血管疾病的2~3倍[1],糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者严重的心血管并发症之一,研究DCM发病机制对寻找防治DCM的方法具有重要意义。近年来研究表明,自噬现象和DCM关系密切。在糖尿病转基因小鼠模型中,自噬是上调的,过表达Beclin-1促进过度自噬,导致了心肌肥厚加重,提示过度自噬导致了DCM。我们前期研究建立的DCM大鼠模型中心肌自噬是降低的,而且心肌纤维化明显[2]。
所谓自噬,就是通过激活自噬相关蛋白诱导自噬发生,降解细胞内长寿命蛋白、损伤蛋白及细胞器,并对降解后成分再利用[3]。生理条件下的自噬作为细胞应激的保护机制,处于一种持续的低水平状态,然而,环境非理性的变化会导致自噬过度激活,引起细胞程序性死亡。对于心肌细胞而言,适度的自噬对其功能维持起着重要作用,但也可能会引起心肌疾病[4]。
乙酰胆碱(acetylcholine,ACh)最先发现于神经细胞合成的神经递质,后来人们逐渐认识到,ACh在非神经组织如上皮、内皮、间皮等细胞中广泛存在。通过自分泌或旁分泌作用,ACh可参与自身和临近细胞基本功能的调节,如增殖、分化、凋亡、分泌、黏附、免疫功能等。心肌细胞可合成、释放ACh,同样,心肌细胞也分布着各种ACh受体(M、N受体)。研究表明,ACh激活M受体促进心肌细胞自噬,可减少缺氧/复氧过程中心肌凋亡[5]。但对于神经递质在DCM中的作用不甚明确,既然自噬在DCM中有重要意义,而且ACh可调节心肌细胞自噬活性,那么ACh是否在DCM发生、发展中有一定的作用?本研究建立高糖诱导心肌细胞损伤模型,探讨ACh能否改善高糖导致的心肌细胞损伤,并探究自噬在其中的作用及其机制,为治疗DCM提供新的治疗途径。
1 材料与方法 1.1 材料 1.1.1 细胞株大鼠心肌细胞系H9c2细胞,购自中国科学院细胞库。
1.1.2 试剂ACh、3-甲基腺嘌呤(3-methyladenine,3-MA)、雷帕霉素(rapamycin,Rap)、AICAR(AMPK激活剂),购自Sigma公司;DMEM培养基、胰蛋白酶、胎牛血清,购自ScienCell公司;β-actin抗体、二抗,购自中杉金桥公司;LC3、Beclin-1、Bcl-2、Bax、p62抗体,购自Cell Signaling Technology公司;AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)、p-AMPK、p-mTOR、mTOR抗体,购自Abcam公司;MTT、ATP、BCA试剂盒,购自北京索莱宝科技有限公司。
1.1.3 仪器生物洁净工作台(苏州安泰空气技术有限公司);CO2细胞培养箱(美国Thermo Forma公司);倒置生物显微镜(日本Olympus公司);全波段酶标仪(美国Thermo公司);全套蛋白电泳电转装置(美国Bio-Rad公司);超薄切片仪(德国Leica公司);透射电镜(日本JEOL公司)。
1.2 细胞培养与分组将H9c2心肌细胞复苏后,在含10%胎牛血清的DMEM细胞培养基中培养,并置于37 ℃、5% CO2的培养箱中,培养基2~3 d更换1次,待细胞贴壁生长至70%~80%时,消化收集细胞进行传代,实验所用细胞为7~15代细胞。实验分为6组:(1)对照组(control):用正常浓度葡萄糖培养基培养H9c2细胞72 h;(2)高糖(high glucose,HG)组:用含终浓度为30、17 mmol·L-1葡萄糖的培养基[6]培养H9c2细胞72 h;(3)不同浓度ACh组:在含有30 mmol·L-1葡萄糖的心肌细胞培养基中,同时分别加入10-6、10-5、10-4 nmol·L-1的ACh培养H9c2细胞72 h;(4)HG+3-MA组:在终浓度为30 mmol·L-1葡萄糖培养基中,同时加入2 mmol·L-1的3-MA,培养H9c2细胞72 h; (5)HG+ACh+Rap组:在终浓度为30 mmol·L-1葡萄糖培养基中,同时加入50 nmol·L-1的Rap及10-4 nmol·L-1的ACh,培养H9c2细胞72 h; (6)HG+ACh+AICAR组:在终浓度为30 mmol·L-1葡萄糖培养基中同时加入10-4 nmol·L-1的ACh及0.5 mmol·L-1 AICAR[7],培养H9c2细胞72 h。3-MA及Rap浓度借鉴于我们前期的实验研究[8]。
1.3 MTT法检测细胞活性取生长对数期细胞铺板,每孔约104个细胞,每个药物浓度设置5个复孔,同时设置调零孔和对照孔,药物处理结束后,加入10 μL MTT溶液,4 h后,加入150 μL二甲基亚砜充分溶解结晶,利用酶联免疫检测仪在490 nm处测量吸光度值(OD)。细胞相对活性=(药物组OD平均值-空白组OD值平均值)/(对照组OD值平均值-空白组OD值平均值)。
1.4 ATP含量的检测按BCA蛋白提取试剂盒提取总蛋白,计算蛋白浓度,利用ATP试剂盒提供的ATP标准品制作出标准曲线,将待测样品稀释成不同浓度梯度,向96孔板中加入待测样品,混匀后,用化学发光仪测定相对光单位(relative light unit, RLU)值,最后根据标准曲线计算出待测样品中ATP的浓度,根据蛋白浓度,将ATP的浓度换算成μmol·g-1蛋白的形式。
1.5 Western blot检测取出药物处理后的H9c2细胞,在冷的RIPA蛋白裂解液中充分裂解。将裂解物离心后,收集上清液进行蛋白分析,应用BCA蛋白测定试剂盒测量蛋白浓度。取20 μg蛋白,经SDS-PAGE分离后,转移到NC膜或PVDF膜上。用5%脱脂牛奶封闭1 h,随后加入一抗(LC3、Beclin-1、Bcl-2、Bax、p62、p-mTOR、mTOR的稀释比例均为1:1 000,p-AMPK、AMPK稀释比例为1:2 000,β-actin稀释比例为1:10 000),4 ℃孵育过夜,用PBST清洗干净后,放入二抗中室温孵育2 h,用ECL曝光显色,利用ImageJ软件分析结果,检测蛋白灰度值与β-actin灰度值的比值表示目的蛋白的表达水平。
1.6 透射电镜观察细胞自噬体将处理的H9c2细胞用2.5%戊二醛固定2 h,然后用1%锇酸固定液固定2~3 h,最后用0.1 mol·L-1磷酸漂洗液漂洗15 min,共3次,依次经不同浓度梯度的乙醇脱水后,将其包埋在环氧树脂中。使用超薄切片仪切成70 nm,并用含3%醋酸铀-枸橼酸铅双染色。透射电镜观察拍片。对于自噬体的定量分析,每组检查10个随机区域。
1.7 统计学分析数据分析及绘制统计图表均采用GraphPad Prism 6.0统计软件。数据用x±s表示,各组数据先进行正态性和方差齐性检验,采用t检验比较两组之间的差异。
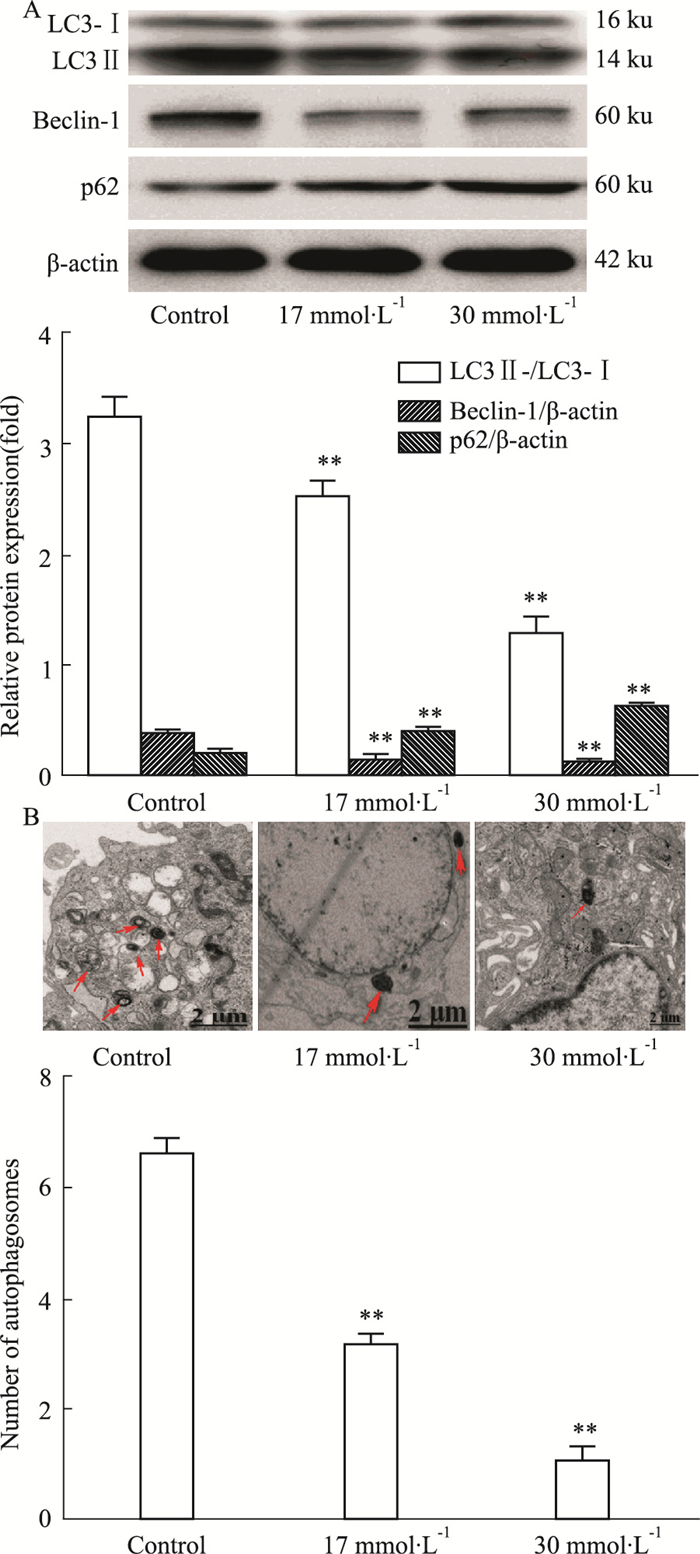
2 结果 2.1 高糖抑制H9c2细胞自噬如Fig 1所示,与对照组相比,高糖组(17、30 mmol·L-1)H9c2细胞中LC3-Ⅱ/LC3-Ⅰ、Bcelin-1的表达降低,p62表达升高(P < 0.01)。透射电镜观察细胞自噬体数目显示,与对照组相比,高糖组(17、30 mmol·L-1)自噬小体数目明显减少(P < 0.01)。
|
| Fig 1 Autophagy in H9c2 cells inhibited by high glucose (x±s, n=3) A: Expressions of LC3, Beclin-1, and p62 in cardiomyocytes; B: Transmission electron microscopy (scale bar: 2 μm, red arrow indicates autophagosomes). **P < 0.01 vs control. |
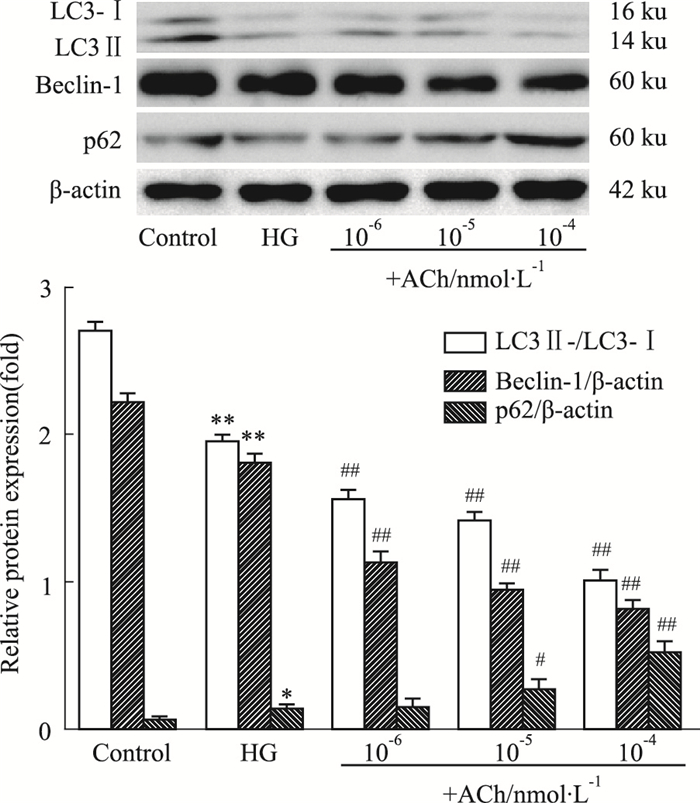
通过以上实验,确定高糖浓度30 mmol·L-1用于以下实验。如Fig 2所示,与对照组相比,高糖(30 mmol·L-1)环境中H9c2心肌细胞中LC3-Ⅱ/LC3-Ⅰ、Bcelin-1的蛋白表达降低(P < 0.01),p62表达升高(P < 0.05);ACh(10-6、10-5、10-4 nmol·L-1)处理,可降低LC3-Ⅱ/LC3-Ⅰ、Bcelin-1表达,增加p62表达(P < 0.01)。
|
| Fig 2 Expressions of LC3, Beclin-1 and p62 in H9c2 cells (x±s, n=3) **P < 0.01 vs control; ##P < 0.01 vs HG |
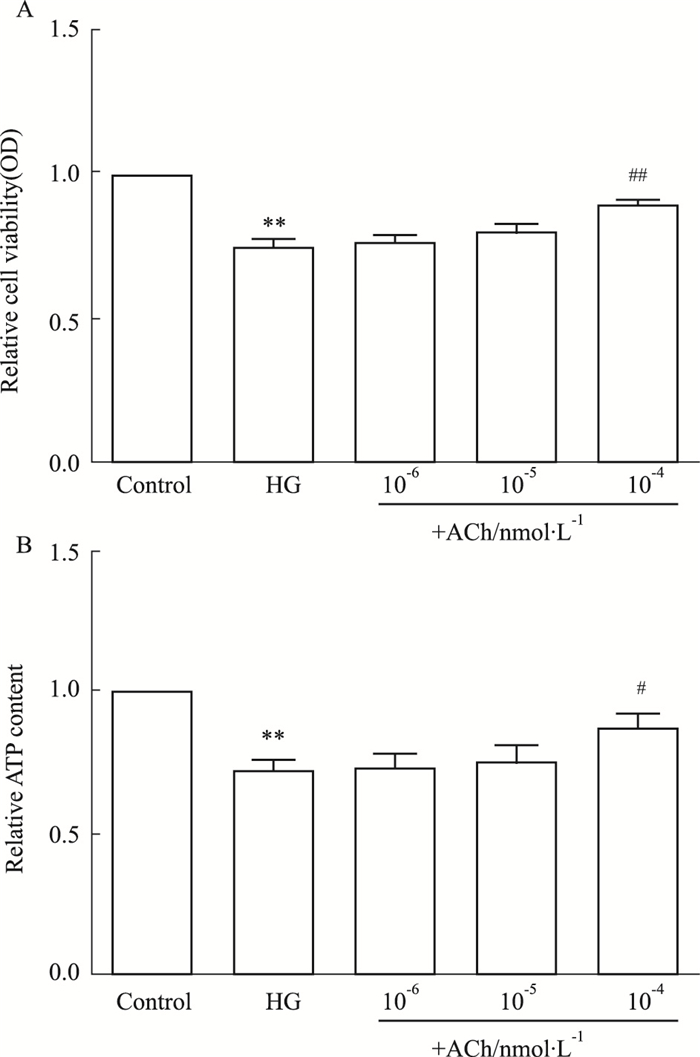
Fig 3的MTT结果显示,相比于对照组,高糖组细胞活性降低(P < 0.01);相比于高糖组,ACh组细胞活性明显增加,且ACh浓度大于10-4 nmol·L-1差异具有统计学意义(P < 0.05)。细胞内ATP含量检测显示,相比于对照组,高糖组细胞内ATP含量明显降低(P < 0.05);相比于高糖组,ACh组细胞内ATP含量明显增加,且ACh浓度大于10-4 nmol·L-1差异具有统计学意义(P < 0.05)。
|
| Fig 3 H9c2 cell activity under high glucose increased by ACh (x±s, n=3) A: Relative cell viability in each group; B: Relative ATP content in each group. **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs HG. |
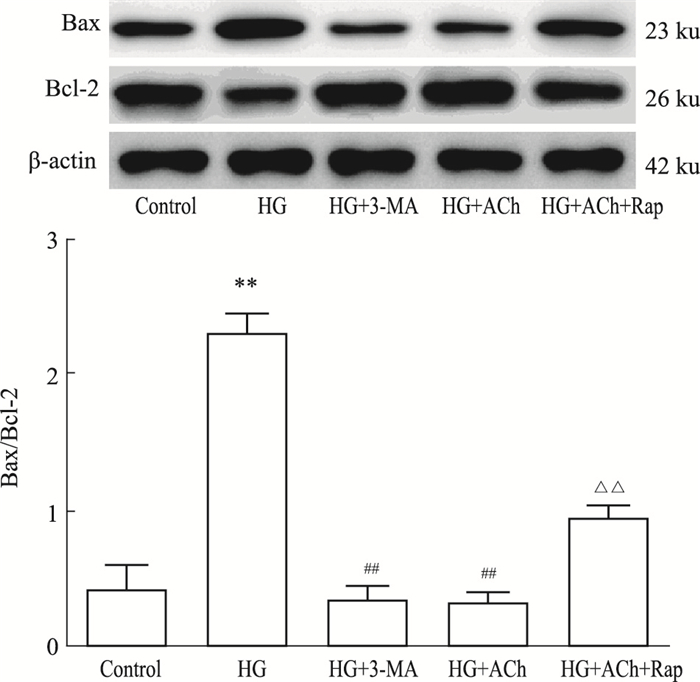
根据上述细胞活性实验及ATP含量测定,ACh浓度为10-4 nmol·L-1用于以下实验。Fig 4的Western blot结果显示,相比于对照组,高糖组Bax/Bcl-2比值升高(P < 0.01);相比于高糖组,HG+ACh组及HG+3-MA组Bax/Bcl-2比值均降低(P < 0.01);相比于HG+ACh组,Ach+Rap组Bax/Bcl-2比值反而升高(P < 0.01)。
|
| Fig 4 Expressions of Bax, Bcl-2 in H9c2 cells (x±s, n=3) **P < 0.01 vs control; ##P < 0.01 vs HG; △△P < 0.01 vs HG+ ACh |
如Fig 5所示,相比于对照组,高糖组LC3-Ⅱ/LC3-Ⅰ,p-AMPK/AMPK比值下降, p-mTOR/mTOR比值上升(P < 0.01);相比于高糖组,HG+ACh组LC3-Ⅱ/LC3-Ⅰ,p-AMPK/AMPK比值下降(P < 0.01),而p-mTOR/mTOR比值上升(P < 0.01);相比于HG+Ach组,HG+ACh+AICAR组p-AMPK/AMPK比值上升,而p-mTOR/mTOR比值下降,LC3-Ⅱ/LC3-Ⅰ比值上升(P < 0.01)。提示ACh抑制自噬时,伴有p-AMPK/AMPK比值的下降及p-mTOR/mTOR比值的上升,而利用AMPK激活剂AICAR上调AMPK信号通路,可部分上调自噬水平。
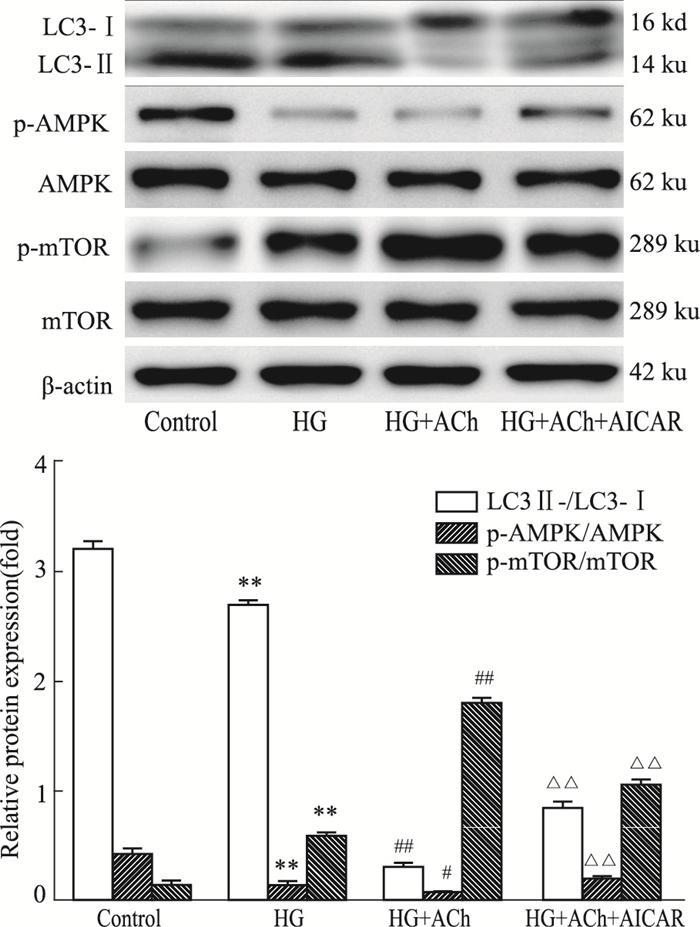
|
| Fig 5 Expressions of LC3, p-AMPK, AMPK, p-mTOR, mTOR in H9c2 cells (x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs HG; △△P < 0.01 vs HG+ ACh |
在临床上,DCM是一个排除性诊断,不易被诊断,当糖尿病患者出现心血管并发症,并诊断为DCM时,提示患者预后差。大量研究已证实, 糖尿病可影响糖代谢及脂代谢,从脂质毒性、糖毒性、氧化应激增强、线粒体功能失常、炎症、内质网应激等多个方面损伤心肌细胞,导致DCM的发生发展。因此,寻找治疗DCM新的治疗靶点极具意义。有研究表明,自噬参与糖尿病微血管及大血管并发症的发生与进展[2, 9-10],近年来研究发现,ACh可调控AMPK途径介导的细胞自噬,影响心肌细胞凋亡。本实验成功构建了高糖诱导心肌细胞损伤模型,在细胞水平探究了ACh在其中的作用及机制。
与既往的研究一致[6],本研究再次证实高糖可抑制心肌细胞自噬,利用自噬抑制剂3-MA抑制自噬水平,发现心肌细胞凋亡水平反而下降,提示高糖抑制细胞自噬对高糖诱导的细胞损伤是一种保护效应。我们的研究发现,ACh可增加高糖状态下心肌细胞活性,并伴随有细胞内ATP含量升高。进一步研究发现,ACh抑制自噬水平,作用类似自噬抑制,ACh处理后抑制心肌细胞自噬,可减少高糖诱导的细胞凋亡,而在ACh处理后再利用Rap处理,反而出现了细胞凋亡的增加。而Zhao等[11]的研究表明,ACh可促进缺氧复氧过程中心肌细胞自噬,减少缺氧复氧造成的心肌损伤。之所以存在ACh既可抑制心肌细胞自噬,也可促进心肌细胞自噬,我们推测其原因可能与建立的细胞损伤模型不同有关。生理状态下,细胞自噬是维持细胞稳态的一种适应性机制,在不同的应激条件下,自噬水平的高低对细胞存活是一把双刃剑。因此,可能存在ACh在不同条件下,以不同的方式调控自噬活性,维持细胞稳态。
在饥饿、缺血、缺氧、氧化应激等营养或能量限制条件下,会诱导自噬水平升高。鉴于葡萄糖剥夺(营养限制条件)能够诱导自噬,高葡萄糖(营养过剩的条件)会抑制心肌细胞中的自噬并不奇怪。自噬可在胰腺β-细胞中保护其免受糖尿病诱导的氧化损伤,因此,可以理解的是,在本研究中抑制的自噬并不会导致高葡萄糖毒性。相反,这种适应性反应构成了在高葡萄糖暴露期间,促进心肌细胞存活的机制的一部分。支持我们的结果有,葡萄糖输注减少了肝脏中的自噬,伴随着脂多糖诱导的全身性炎症的减弱[12]。这些结果强调了一个事实,即自噬可能是保护性的,也可能是有害的,这取决于细胞类型和细胞环境。因此,必须单独确定在不同病理条件下自噬的功能意义。
自噬受哺乳动物雷帕霉素靶蛋白(mTOR)、活性氧簇(reactive oxygen species,ROS)、NF-κB等众多信号转导通路调节,其中mTOR是最重要的一条通路,负向调控自噬活性。PI3K/Akt与AMPK是mTOR上游的两条通路, 且相互密切联系[13]。抑制PI3K/Akt可降低mTOR的活化,从而促进自噬的发生[14],AMPK与之相反[15]。本研究发现,ACh是通过抑制AMPK,促进mTOR的活化,从而抑制自噬。
自噬在病理状态下作为一种适应性应激来维持整体的平衡,作为细胞应对不良环境的一种防御机制。目前研究最多的是巨自噬。在肿瘤、神经退行性疾病、衰老、心血管疾病、感染等众多疾病的病理生理过程中,自噬都起了重要作用,调控自噬可能成为防治相关疾病潜在靶点之一。本研究发现,ACh可作为干预靶点调节自噬活性,ACh通过抑制自噬,降低高葡萄糖毒性,进一步推测,ACh可能通过自噬途径参与众多疾病的发生、发展。此外,离体细胞模型与体内模型存在差异,因此,本课题组拟在糖尿病心肌病动物模型展开进一步研究。
( 致谢: 本实验在江西省高血压研究所完成,在此感谢张婉老师及曾俊义老师在实验中给予的帮助与支持。)
| [1] |
Eastman R C, Keen H. The impact of cardiovascular disease on people with diabetes: the potential for prevention[J]. Lancet, 1997, 350(Suppl 1): 129-32. |
| [2] |
柯旋, 李宾公, 郝艳琴, 等. Vaspin在糖尿病心肌病中的作用及机制研究[J]. 中国药理学通报, 2018, 34(10): 1403-8. Ke X, Li B G, Hao Y Q, et al. The role and mechanism of vaspin in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2018, 34(10): 1403-8. doi:10.3969/j.issn.1001-1978.2018.10.015 |
| [3] |
Saito T, Asai K, Sato S, et al. Autophagic vacuoles in cardiomyocytes of dilated cardiomyopathy with initially decompensated heart failure predict improved prognosis[J]. Autophagy, 2016, 12(3): 579-87. doi:10.1080/15548627.2016.1145326 |
| [4] |
Kobayashi S, Liang Q. Autophagy and mitophagy in diabetic cardiomyopathy[J]. Biochim Biophys Acta, 2015, 1852(2): 252-61. doi:10.1016/j.bbadis.2014.05.020 |
| [5] |
Sun L, Zhao M, Yang Y, et al. Acetylcholine attenuates hypoxia/reoxygenation injury by inducing mitophagy through PINK1/Parkin signal pathway in H9c2 cells[J]. J Cell Physiol, 2016, 231(5): 1171-81. doi:10.1002/jcp.v231.5 |
| [6] |
Kobayashi S, Xu X, Chen K, et al. Suppression of autophagy is protective in high glucose-induced cardiomyocyte injury[J]. Autophagy, 2012, 8(4): 577-92. doi:10.4161/auto.18980 |
| [7] |
Ge W, Guo R, Ren J. AMP-dependent kinase and autophagic flux are involved in aldehyde dehydrogenase-2-induced protection against cardiac toxicity of ethanol[J]. Free Radic Biol Med, 2011, 51(9): 1736-48. doi:10.1016/j.freeradbiomed.2011.08.002 |
| [8] |
Ke X, Hao Y, Li B, et al. Vaspin prevents tumor necrosis factor-alpha-induced apoptosis in cardiomyocytes by promoting autophagy[J]. J Cardiovasc Pharmacol, 2018, 77(5): 257-67. doi:10.1097/FJC.0000000000000562 |
| [9] |
Pei Z, Deng Q, Babcock S A, et al. Inhibition of advanced glycation endproduct (AGE) rescues against streptozotocin-induced diabetic cardiomyopathy: role of autophagy and ER stress[J]. Toxicol Lett, 2018, 284: 10-20. doi:10.1016/j.toxlet.2017.11.018 |
| [10] |
王敏, 余薇, 查文良. 自噬和线粒体自噬在糖尿病心肌病中的作用研究进展[J]. 中国药理学通报, 2018, 34(10): 1337-40. Wang M, Yu W, Zha W L. Research progress of autophagy and mitochondrial autophagy in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2018, 34(10): 1337-40. doi:10.3969/j.issn.1001-1978.2018.10.002 |
| [11] |
Zhao M, Sun L, Yu X J, et al. Acetylcholine mediates AMPK-dependent autophagic cytoprotection in H9c2 cells during hypoxia/reoxygenation injury[J]. Cell Physiol Biochem, 2013, 32(3): 601-13. doi:10.1159/000354464 |
| [12] |
Hagiwara S, Iwasaka H, Hasegawa A, et al. Infusion of a glucose solution reduces autophagy in the liver after LPS-induced systemic inflammation[J]. Inflammation, 2012, 35(1): 249-58. doi:10.1007/s10753-011-9311-y |
| [13] |
Hale A N, Ledbetter D J, Gawriluk T R, et al. Autophagy: regulation and role in development[J]. Autophagy, 2013, 9(7): 951-72. doi:10.4161/auto.24273 |
| [14] |
Wang Z G, Li H, Huang Y, et al. Nerve growth factor-induced Akt/mTOR activation protects the ischemic heart via restoring autophagic flux and attenuating ubiquitinated protein accumulation[J]. Oncotarget, 2017, 8(3): 5400-13. |
| [15] |
Xie Z, He C, Zou M H. AMP-activated protein kinase modulates cardiac autophagy in diabetic cardiomyopathy[J]. Autophagy, 2011, 7(10): 1254-5. doi:10.4161/auto.7.10.16740 |

