

病理性心肌肥大是心脏在面对多种病理性刺激所发生的代偿性反应,初始心脏特征为心室腔变小、心室壁变厚。在细胞层面,其主要表现为心肌细胞表面积增大,蛋白如心钠素(atrial natriuretic factor,ANF)、脑钠肽(brain natriuretic polypeptide,BNP)、β肌球蛋白重链(beta-myosin heavy chain,β-MHC)的表达增多,随着疾病进程的发展,最终导致单个心肌细胞的延长而变薄,心室壁扩张且变薄,造成收缩功能障碍和心力衰竭[1]。但其具体病理机制仍有待进一步阐明。
活化T细胞核转录因子家族(nuclear factor of activated T cells,NFATs)在细胞信号转导中扮演着重要的角色,能够在胞质、胞核中穿梭,发挥调节转录功能。研究表明,该家族的NFATc3和NFATc4亚型与心脏功能密切相关,在心脏发育过程中发挥重要作用[2]。本实验室前期研究证明,NFATc3和NFATc4在心肌肥大的病理过程中被激活[3-4],而去磷酸化激活后的NFATc4结合到BNP的启动子上,促进肥大基因BNP的表达[5]。
多聚腺苷二磷酸核糖聚合酶1(poly-ADP-ribose polymerase 1,PARP1)是真核细胞内具有多聚腺苷二磷酸核糖及聚合酶活性的蛋白家族的首要亚型,其活性至少占据该家族的85%。PARP1能够被受损的DNA激活,催化烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)分解为ADP核糖以及烟酰胺,然后以ADP核糖为底物,使受体蛋白及自身发生多聚腺苷酸二磷酸核糖(polymers of ADP-ribose,PAR)化修饰,进而发挥修复DNA的作用[6]。但近年来,多项研究表明PARP1与心脏关系密切。本实验室前期研究发现,PARP1可以影响多个蛋白的出入核来影响心肌肥大。PARP1可通过修饰STAT3使其保持在核内,加剧心肌肥大[7],也可通过促进高迁移率蛋白B1的出核,进而促进心肌肥大的发生[8]。还可以通过影响叉头转录因子O3(forkhead box O3,FoxO3)的翻译后修饰水平,促进其出核转运,抑制其转录活性,进而诱导心肌肥大的发生[9]。基于此,本研究旨在探究在病理性心肌肥大疾病模型下,PARP1与NFATc3、NFATc4的关系,为阐明病理性心肌肥大机制提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞与实验动物本实验所采用的细胞均为从出生1~3 d的Sprague-Dawley(SD)大鼠分离得的原代心肌细胞。SPF级SD大鼠,♂,体质量(200 ± 20)g,购自于广东省医学实验动物中心,动物质量合格编号:NO.44007200055692,用于构建异丙肾上腺素(isoprenaline,ISO)诱导的心肌肥大模型。SD大鼠乳鼠,购自于中山大学动物实验中心,动物质量合格编号:No.44008500017332。
1.1.2 试剂磷酸盐缓冲液(PBS,武汉博士德公司);胎牛血清(美国Gibco);胰酶、5-溴脱氧尿嘧啶核苷(5-bromo-2′-deoxy-uridine,BrdU)、DAPI(美国Sigma);TRIzol(日本Takara);RNA逆转录试剂盒、SYBR Premix EX Taq、BCA蛋白定量试剂盒(美国Thermo);NFATc3抗体、NFATc4抗体(美国Santa Cruz);PARP1抗体、Lamin B1抗体(美国CST);α-tubulin抗体(美国Sigma);PAR抗体(美国Trevigen);荧光二抗(美国PTG);ISO粉末(日本TCI);罗丹明鬼笔环肽、Lipofectamine 2000、Opti-MEM培养基(美国Invitrogen);核蛋白抽提试剂盒(美国Active Motiff);3AB(美国MCE)。
1.1.3 仪器超净工作台(苏州净化设备有限公司);CO2培养箱、ArrayScanVTI全自动细胞组高内涵筛选分析系统、荧光定量PCR仪(美国Thermo);XD5-1B倒置显微镜(德国Leica);FV3000激光扫描共聚焦显微镜(日本奥林巴斯);冷冻台式高速离心机(德国Eppendorf);蛋白电泳、电转仪(美国Bio-Rad);LAS4000化学发光成像仪(美国Waukesha)。
1.2 方法 1.2.1 主要试剂配制ISO溶液(细胞用)配制浓度为10 mmol·L-1;ISO溶液(动物用)配制浓度为12.5 g·L-1;3AB溶液配制浓度为10 mmol·L-1;BrdU溶液配制浓度为10 mmol·L-1。
1.2.2 SD大鼠乳鼠原代心肌细胞培养用酒精消毒1~3 d的已麻醉的SD大鼠乳鼠腹部表面,开胸将心脏转移至含有预冷PBS溶液的平皿中,在PBS中除去残血及结蹄组织后,将心脏均匀剪成大小为1 mm3的组织块。随即转移至锥形瓶中,PBS洗涤后,加入15 mL的0.8 g·L-1胰蛋白酶进行冷消化20 min。之后用0.8 g·L-1胰蛋白酶,于磁力搅拌器上37 ℃水浴搅拌消化,离心收集细胞。多次反复消化至组织块消化完全,后于两个25 cm2培养瓶中(以14只乳鼠心肌细胞量为例),于培养箱中孵育1 h差速培养,分离成纤维细胞与心肌细胞。按需求稀释心肌细胞并种皿,培养24 h等待心肌细胞贴壁,换液,24 h后进行后续处理。注意在培养基中加入0.1 mmol·L-1 BrdU来抑制残余的成纤维细胞生长。
1.2.3 Western blot检测实验处理的细胞加入适量RIPA裂解液,在冰上裂解30 min后,12 000×g离心15 min,取上清进行BCA蛋白定量,与5×上样缓冲液制备成蛋白样品。SDS-PAGE凝胶电泳分离,转膜后,封闭1 h,用TBST洗涤3次后,在4 ℃孵育一抗过夜,TBST洗涤3次后,在室温下孵育相应的二抗1 h,TBST洗涤3次,进行化学发光显影检测。
1.2.4 qPCR检测弃去细胞培养基,PBS洗涤后,用TRIzol将细胞转入EP管。室温下加入氯仿,剧烈震荡后,将含RNA的水相层转移入另一新EP管。加入异丙醇混匀,室温下静置后离心得到RNA沉淀。用DEPC水配制的75%的乙醇洗涤沉淀,再次离心后吸净上清,在室温下干燥,适量加入DEPC水,溶解RNA以检测RNA的纯度、浓度。使用逆转录试剂盒,参照说明书进行逆转录反应合成cDNA。参照SYBY Premix ExTaq的说明书,进行反应体系构建。PCR仪参数如下:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 30 s,循环50次;95 ℃ 15 s,60 ℃ 1 h;65 ℃ 30 s,循环61次。引物由上海生工公司合成,采用β-actin为内参基因。引物序列如下:β-actin:正向5′-TCGTGCGTGACATTAAAGAG-3′,反向5′-ATTGCCGATAGTGATGACCT-3′;ANF:正向5′-CCGTATACAGTGCGGTGTCC-3′,反向5′-CAGAGAGGGAGCTAAGTGCC-3′;BNP:正向5′-AGCTGCTTTGGGCAGAAGAT-3′,反向5′-AAAACAACCTCAGCCCGTCA-3′。
1.2.5 细胞水平干预PARP1过表达PARP1蛋白采用PARP1腺病毒(Ad-PARP1)感染原代心肌细胞48 h,含绿色荧光蛋白的腺病毒(Ad-GFP)为对照组,病毒购于上海吉凯基因化学技术有限公司。敲低PARP1蛋白以8 cm2小皿为例,分别用250 μL Opti-MEM培养基与5 μL Lipo-2000、10 μL浓度为20 μmol·L-1的干扰序列,轻柔混匀,室温静置5 min后混匀,静置20 min后,一并加入培养皿中培养。6 h后换液继续培养。PARP1干扰序列:sense:5′-GGGACUAACUCCUAUUACATT-3′,antisence:5′-UGUAAUAGGAGUUAGUCCCTT-3′[7]。
1.2.6 心肌肥大动物模型的建立20只SD大鼠随机分为对照组与模型组,模型组大鼠皮下注射1.2 mg·kg-1·d-1的ISO,连续7 d,对照组注射等量生理盐水。之后,用7%水合氯醛麻醉SD大鼠,迅速打开胸腔,灌注0.1 mol·L-1 KCl溶液后,使心脏停止跳动,取出心脏进行外观拍摄后,沿横截面分切,部分固定于4%的多聚甲醛,24 h后进行石蜡包埋切片,HE染色;剩余部分冻存于液氮中,提取组织蛋白后,用免疫印迹法检测相关蛋白的表达。
1.2.7 免疫荧光共定位将细胞种于激光共聚集显微镜专用的Confocal小皿中,根据需求分组处理后,弃去培养基,用37 ℃的PBS轻轻洗涤去残余的培养基,在皿中加入1 mL 4%的多聚甲醛,室温下固定15 min。弃去多聚甲醛,在室温下干燥10 min。用PBS清洗3次,加入预配制好体积分数为1%的Triton破膜15 min。弃去破膜液,用PBS清洗3次后,加入10%的山羊血清室温下封闭1 h。除去山羊血清,分别加入一抗4 ℃过夜。次日,加入对应的荧光二抗(1 :100),室温下避光孵育1 h。用PBS洗3次,DAPI染细胞核3 min后,PBS清洗3次,在激光共聚焦扫描显微镜下观察。
1.2.8 核蛋白提取使用核蛋白抽提试剂盒进行核蛋白的提取,核蛋白提取采用70 mm的中皿。除去培养基后用预冷的PBS/PI清洗3次,弃去,加入1 mL的PBS/PI轻柔刮下细胞,转移至预冷的1.5 mL EP管中。4 ℃、1 200×g离心10 min后,弃上清。用50 μL 1×Hypotonic Buffer重悬细胞,在冰上孵育15 min。加入12.5 μL的去污剂,剧烈涡旋后,4 ℃、14 000×g离心30 s。离心后上清为胞质蛋白,沉淀为核蛋白。用25 μL的完全裂解液重悬沉淀,剧烈涡旋后,在冰上摇摆孵育30 min。随后剧烈涡旋30 s,再次离心10 min,上清即为核蛋白。用考马斯亮蓝法分别对核蛋白、胞质蛋白进行定量后,制备样品以备后续的Western blot检测。
1.2.9 实验分组(1) 肥大指标的检测分为Control组和ISO组;(2)NFATs胞质、胞核蛋白检测设立ISO时间点为0、1、3、6 h;(3)免疫荧光共定位检测,依据NFATc3和NFATc4分设Control组和ISO组;(4)动物心脏组织中NFATs胞质、胞核蛋白检测分设NS组和ISO组;(5)过表达PARP1后,NFATs胞质、胞核蛋白检测分为过表达GFP蛋白和过表达PARP1蛋白两组;(6)抑制PARP1功能后,胞质、胞核蛋白检测分为对照组、单独ISO刺激组、合并给予ISO+3AB组;(7)敲低PARP1后,NFATs胞质、胞核蛋白检测分为对照组、ISO组、si PARP1组、si PARP1合并给予ISO四组。
1.2.10 统计学方法所有数据均表示为x±s,所用统计学软件为GraphPad Prism 5.0。两组间比较,采用t检验,多组间比较采用单因素方差分析(ANOVA),并结合Bonferroni法进行多组间两两比较。
2 结果 2.1 心肌肥大细胞模型中ISO刺激NFATs发生转位入核Fig 1A结果显示,与对照组相比,原代心肌细胞在10 μmol·L-1的ISO刺激24 h下,经罗丹明-鬼笔环肽染色,在荧光显微镜下可以观察到心肌细胞表面积明显变大,而高内涵系统测定总体细胞表面积明显上升,并具有统计学差异。同时,我们进一步检测了对照组和ISO刺激下ANF、BNP、β-MHC的mRNA水平变化。Fig 1B结果显示,在ISO刺激下,ANF、BNP、β-MHC mRNA水平均明显上调,进一步确定ISO诱导心肌肥大模型成功。
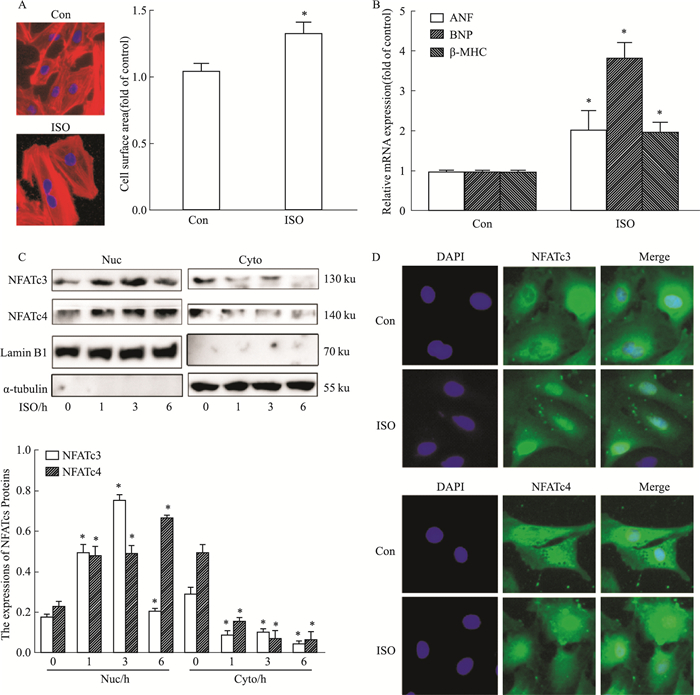
|
| Fig 1 ISO affected nuclear translocation of NFATc3 and NFATc4 in primary neonatal rat cardiomyocytes (NRCMs) Cultured NRCMs were incubated with 10 μmol·L-1 ISO for the indicated durations. A:The cell surface area was measured by high content screening (HCS) analysis; B:The mRNA levels of hypertrophic biomarkers (ANF, BNP and β-MHC) were detected by qPCR(x±s, n=3); C:Western blot analysis showed the protein expressions of the NFATc3 and NFATc4 in the nucleus and cytoplasm(x±s, n=3); D:The subcellular localization of NFATc3 and NFATc4 was identified by confocal immunofluorescence microscopy. *P < 0.05 vs control group. |
如Fig 1C所示,10 μmol·L-1的ISO分别刺激原代心肌细胞0、1、3、6 h后,结果发现,在没有ISO刺激时,NFATc3和NFATc4在细胞核与细胞质中均有明显分布,而随着ISO刺激时长的增加,NFATc3和NFATc4发生了核转位,导致核内NFATc3和NFATc4增多,而细胞质的NFATc3和NFATc4减少。由Fig 1D的免疫荧光结果可以直观地看到,与对照组相比,NFATc3、NFATc4细胞核的共定位情况明显增加,进一步说明了在ISO的刺激下,NFATc3和NFATc4的入核增加。
2.2 心肌肥大动物模型中ISO同样刺激NFATs发生转位入核Fig 2A的结果显示,ISO刺激引起了SD大鼠的心脏外观较对照组明显变大,同时由Fig 2B的HE染色结果可以看到,ISO引起心肌细胞明显变大,心肌细胞排列紊乱。如Fig 2C所示,ISO组的ANF蛋白表达量明显上调,以上结果表明在ISO刺激下,SD大鼠的心脏发生肥大。在成功建立了心肌肥大的动物模型后,我们检测了心脏组织NFATc3和NFATc4的亚细胞定位情况,与细胞实验结果一致,ISO分别引起了核内的NFATc3和NFATc4入核增加,而细胞质中的蛋白量减少,说明在动物水平上,ISO同样可以刺激心脏中的NFATc3和NFATc4由细胞质转位入核,发挥转录调控作用。
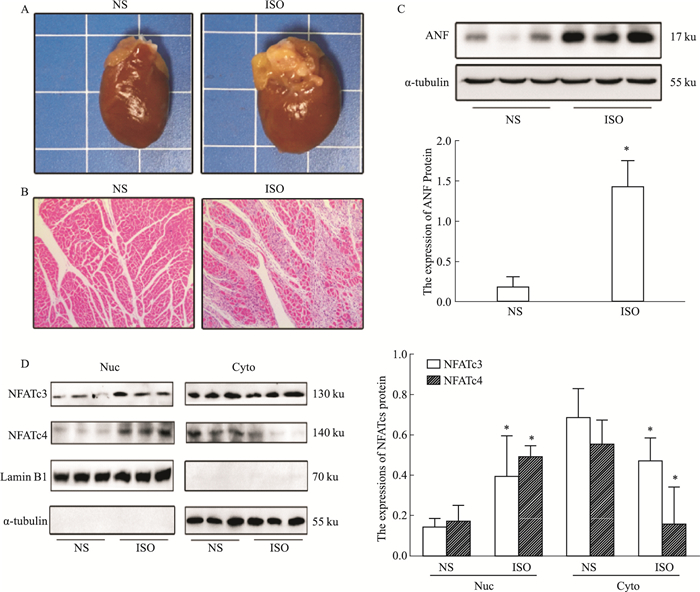
|
| Fig 2 ISO promoted nuclear translocation of NFATc3 and NFATc4 in ISO-induced cardiac hypertrophy in vivo(x±s, n=3) SD rats were submitted to the s.c. injection of ISO (1.2 mg·kg-1·d-1) for 7 days. The control animals obtained normal saline (NS). A, B:Hypertrophic changes of the hearts were observed by gross morphologic examination (A) and HE staining (B). C:The protein expression of ANF was detected by Western blot; D:Western blot analysis showed the subcellular localization of NFATc3 and NFATc4 of the hearts. *P < 0.05 vs NS group. |
如Fig 3A所示,给予ISO刺激后,细胞内的PAR化程度增加,但是PARP1的蛋白表达量却无明显变化,而在ISO诱导的大鼠心肌肥大模型中(Fig 3B),我们检测到了同样的结果。这些实验结果表明,无论是在心肌细胞水平,还是整体动物水平,ISO诱导的病理性心肌肥大模型中,PARP1的酶活性升高,而其蛋白表达量未发生明显改变。
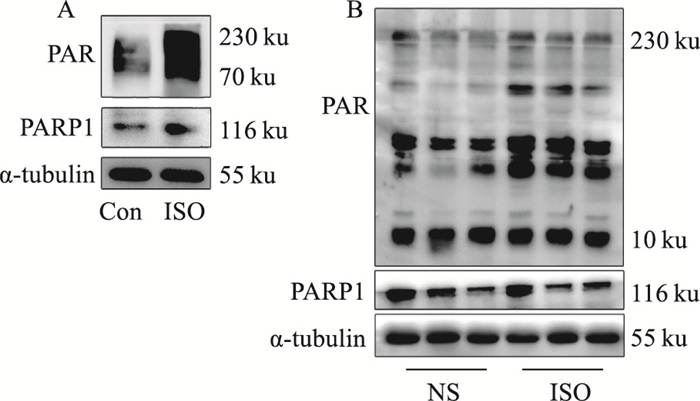
|
| 图 3 ISO increased activity of PARylation without affecting protein expression of PARP1 both in vivo and in vitro The changes of activity of PARylation and the protein expression of PARP1 were detected in NRCMs (A) or SD rats (B) treated with NS or ISO by Western blot. |
为了探讨PARP1对NFATs的影响,我们使用PARP1的腺病毒(Ad-PARP1)进行过表达,观察NFATc3和NFATc4的亚细胞定位的改变。如Fig 4A所示,与对照组Ad-GFP相比,Ad-PARP1组的NFATc3和NFATc4蛋白由细胞质转位进入细胞核。为了进一步探究PARP1和NFATc3、NFATc4及心肌肥大的关系,分别设置对照组、单独加入ISO刺激组、合并加入了ISO刺激和PARP1抑制剂3AB组。Fig 4B结果提示,单独给予ISO,可以促进NFATs的入核转运,相较于单独ISO组,ISO合并3AB组明显使NFATc3和NFATc4的细胞质蛋白含量增加,而核内蛋白含量减少,说明NFATc3和NFATc4的转位入核可能与PARP1的酶活性增强有关。我们进一步通过转染靶向PARP1的siRNA敲低PARP1表达,Fig 4C结果显示,敲低PARP1使ISO引起的NFATc3、NFATc4入核减少。进一步证明NFATc3和NFATc4的转位入核与PARP1关系密切。

|
| 图 4 PARP1 promoted shuttling between nucleus and cytoplasm of NFATc3 and NFATc4(x±s, n=3) A:The subcellular localization changes of NFATc3 and NFATc4 were detected by Western blot in cultured NRCMs infected with Ad-PARP1 or Ad-GFP; B:The subcellular localization of the NFATc3 and NFATc4 was observed in cultured NRCMs treated with PARP1 inhibitor 3AB or in the presence of ISO by Western blot; C:NRCMs were transfected with siRNA targeting PARP1 or negative control siRNA (NC), and Western blot was performed to compare the subcellular localization changes of NFATc3 and NFATc4(Nuc and Cyto: 1. NC; 2. NC+ISO; 3. siPARP1; 4. siPARP1+ISO). *P < 0.05 vs control group; #P < 0.05 vs ISO group. |
病理性心肌肥大的发生机制十分复杂,过度的心肌肥大最终会导致心脏重构,进而导致心衰。研究表明,心脏中的β肾上腺受体的长时间激活可以导致心肌肥大和左心室功能失调,最终发展为心衰。β肾上腺受体的激活,可通过介导心肌生长因子等途径,促进心肌蛋白的合成,也可进一步激活环磷酸腺苷通路,使心肌细胞中的cAMP含量升高,引发下游一些与心肌肥大密切相关的转录因子及信号通路的活化,进而发生心肌肥大。还可以通过影响肌浆网的Ca2+水平,进而诱导Ca2+的释放,影响心肌收缩功能的改变[10]。研究同样表明,在引起心肌肥大的同时,可以检测到Ca2+水平升高,促进CaMKⅡδB表达,诱导心肌肥大[11]。目前,ISO已经成为病理性心肌肥大常用的造模药物。在本研究中,在心肌原代细胞中,给予10 μmol·L-1的ISO刺激24 h;在动物实验中,对SD大鼠皮下注射1.2 mg·kg-1·d-1的ISO,连续7 d,成功建立病理性心肌肥大模型。
NFATs家族是一类Ca2+/CaN依赖的转录因子,其在结构上存在两个串联结构域NFAT同源区(NFAT-homology region,NHR),DNA结合域(DNA binding domain,DBD),而核定位序列(nuclear localization sequence,NLS)则在其NHR和DBD两个区域。在静止状态下,NFAT的调节结构域因呈高度磷酸化状态而限制了其转位入核,主要分布于细胞质之中。而在进一步去磷酸化后,则可以促使NFATs的核定位序列暴露,进而转位入核[12]。而前述转位入核的NFATs可通过调控BNP的转录,从而影响心肌肥大。我们在ISO心肌肥大细胞模型和动物模型中,观察到NFATc3和NFATc4均发生了明显的核转位现象,由细胞质转位进入了细胞核。
PARPs是一类能够将NAD的核糖基转移到底物上,发挥PAR化修饰的聚合酶蛋白家族。其中,PARP1亚型与心肌肥大、心衰的关系最为密切,也是该家族的优势亚型,引起研究者们广泛的关注。在本实验室的前期研究中,发现PARP1可以通过PAR化修饰FoxO3,促进了FoxO3的磷酸化,从而抑制其转录活性,导致心肌肥大。另一报道则直接表明,在T细胞中,PARP1可直接PAR化NFATs的DNA结合域,进而提高NFATs与核内DNA的结合能力,进而调节转录[13]。本研究发现,在ISO刺激下,PARP1表达量并无明显变化,但其PAR化酶活性却明显上升。过表达PARP1也可诱导NFATc3和NFATc4转位入核。而使用PARP1的抑制剂3AB以及敲低了PARP1之后,均可以减少ISO引起的转位入核,这一结果提示,ISO引起的NFATc3、NFATc4转位入核可能与PARP1密切相关。
在ISO刺激下,PARP1的PAR化酶活性上升,细胞质中的NFATc3和NFATc4向细胞核内聚集。我们推测,活化的PARP1可能通过PAR化修饰细胞核中的NFATc3和NFATc4,稳定NFATc3和NFATc4的去磷酸化状态,延长其在细胞核内的存留。又由于PARP1可以PAR化NFATs的DNA结合区,导致其与DNA的结合能力加强,进而使其调节转录能力上升,促进肥大基因的进一步转录表达,促进心肌肥大的发生。但其具体调节机制仍待进一步研究。
研究表明,在ISO刺激下,NFATc3和NFATc4上游发挥去磷酸化功能的蛋白被激活,导致NFATc3和NFATc4的调节结构域被去磷酸化,核定位序列暴露,从而转位入核[14]。那么这一上游是什么呢?我们实验室发现,PARP1可以促进FoxO3、NFATs的核内聚集,那么二者之间又有何联系呢,也是我们以后的研究方向之一。
| [1] |
Nakamura M, Sadoshima J. Mechanisms of physiological and pathological cardiac hypertrophy[J]. Nat Rev Cardiol, 2018, 15(7): 387-407. doi:10.1038/s41569-018-0007-y |
| [2] |
Crabtree G R, Olson E N. NFAT signaling:choreographing the social lives of cells[J]. Cell, 2002, 109(Suppl): S67-79. |
| [3] |
Li H, Gao S, Ye J T, et al. COX-2 is involved in ET-1-induced hypertrophy of neonatal rat cardiomyocytes:role of NFATc3[J]. Mole Cell Endocrinol, 2014, 382(2): 998-1006. doi:10.1016/j.mce.2013.11.012 |
| [4] |
Le K, Li R F, Xu S W, et al. PPARalpha activation inhibits endothelin-1-induced cardiomyocyte hypertrophy by prevention of NFATc4 binding to GATA-4[J]. Arch Biochem Biophys, 2012, 518(1): 71-8. doi:10.1016/j.abb.2011.11.024 |
| [5] |
Fiedler B, Lohmann S M, Smolenski A, et al. Inhibition of calcineurin-NFAT hypertrophy signaling by cGMP-dependent protein kinase type Ⅰ in cardiac myocytes[J]. Proc Natl Acad Sci USA, 2002, 99(17): 11363-8. doi:10.1073/pnas.162100799 |
| [6] |
郑宇静, 左彤彤, 封宇飞. 靶向DNA损伤反应途径:PARP抑制剂抗肿瘤治疗研究进展[J]. 中国药理学通报, 2018, 34(2): 157-61. Zheng Y J, Zuo T T, Feng Y F. Targeting DNA damage response pathway:recent progress of PARP inhibitors in cancer therapy[J]. Chin Pharmacol Bull, 2018, 34(2): 157-61. doi:10.3969/j.issn.1001-1978.2018.02.003 |
| [7] |
Wang L P, Li Z M, Tan Y Z, et al. PARP1 interacts with STAT3 and retains active phosphorylated-STAT3 in nucleus during pathological myocardial hypertrophy[J]. Mol Cell Endocrinol, 2018, 474: 137-50. doi:10.1016/j.mce.2018.02.020 |
| [8] |
Li Q, Li Z M, Sun S Y, et al. PARP1 interacts with HMGB1 and promotes its nuclear export in pathological myocardial hypertrophy[J]. Acta Pharmacol Sin, 2019, 40(5): 589-98. doi:10.1038/s41401-018-0044-4 |
| [9] |
Lu J, Zhang R W, Hong H Q, et al. The poly(ADP-ribosyl)ation of FoxO3 mediated by PARP1 participates in isoproterenol-induced cardiac hypertrophy[J]. Biochim Biophy Acta, 2016, 1863(12): 3027-39. doi:10.1016/j.bbamcr.2016.09.019 |
| [10] |
Osadchii O E. Cardiac hypertrophy induced by sustained beta-adrenoreceptor activation:pathophysiological aspects[J]. Heart Fail Rev, 2007, 12(1): 66-86. |
| [11] |
王桂军, 姚玉胜, 王洪新. Ca2+/CaMKⅡ信号通路在肿瘤坏死因子-α诱导心肌肥大中的作用[J]. 中国药理学通报, 2010, 26(3): 387-91. Wang G J, Yao Y S, Wang H X. Ca2+/CaMKⅡ are involved in tumor necrosis factor α-induced cardiomyocyte hypertrophy in rats[J]. Chin Pharmacol Bull, 2010, 26(3): 387-91. |
| [12] |
Mognol G P, Carneiro F R, Robbs B K, et al. Cell cycle and apoptosis regulation by NFAT transcription factors:new roles for an old player[J]. Cell Death Dis, 2016, 7: e2199. doi:10.1038/cddis.2016.97 |
| [13] |
Olabisi O A, Soto-Nieves N, Nieves E, et al. Regulation of transcription factor NFAT by ADP-ribosylation[J]. Mol Cell Biol, 2008, 28(9): 2860-71. doi:10.1128/MCB.01746-07 |
| [14] |
Shin S Y, Yang J M, Choo S M, et al. System-level investigation into the regulatory mechanism of the calcineurin/NFAT signaling pathway[J]. Cell Signal, 2008, 20(6): 1117-24. doi:10.1016/j.cellsig.2008.01.023 |

