


2. 湖南中医药大学 中医诊断学湖南省重点实验室,湖南 长沙 410208;
3. 广东药科大学中药学院,广东 广州 510006;
4. 澳门科技大学中药质量研究国家重点实验室,澳门 999078
刘良(1957-),男,博士,教授,博士生导师,研究方向:中药抗炎免疫药理学,通讯作者,E-mail:liuliang@must.edu.mo
 ,
LI Xin2,
YANG Zhen1,
TANG Lin3,
ZHANG Ting1,2,
YU Huang-he1,
DING Chang-song2,
LIAO Jing1,
CAI Xiong1,3
,
LI Xin2,
YANG Zhen1,
TANG Lin3,
ZHANG Ting1,2,
YU Huang-he1,
DING Chang-song2,
LIAO Jing1,
CAI Xiong1,3
 ,
LIU Liang4
,
LIU Liang4

2. Hunan Provincial Key Lab of Diagnostic and Therapeutic Research in Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China;
3. School of Chinese Materia Medica, Guangdong Pharmaceutical University, Guangzhou 510006, China;
4. State Key Lab of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078, China
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的,以关节疼痛、肿胀、晨僵、畸形和功能障碍为主要临床表现的自身免疫性疾病,其病理特征为多关节滑膜慢性炎症增生、血管翳形成、软骨及软骨下骨的破坏,最终导致关节畸形和功能障碍[1]。RA全球发病率约为0.5%~1%,我国患病率约为0.28%~0.36%,其5年致残率高达30%~50%,是造成劳动力丧失及致残的主要疾病之一[2]。RA确切病因尚不清楚,发病机制复杂,目前国内外临床治疗RA常用传统缓解病情抗风湿药(disease-modifying antirheumatic drugs,DMARDs)及生物制剂,也包括改善症状的非甾体类抗炎药和糖皮质激素,但常用DMARDs,如甲氨蝶呤、来氟米特等存在疗程长、病人难以耐受、明显肝肾损害等毒副反应问题,而新型生物制剂价格昂贵,长期使用有可能诱发癌症。中医药治疗RA历史悠久,其疗效主要通过整体调节实现,对病情的缓解和治疗均具有明显优势,且安全性较高,目前临床上使用中医药治疗RA已成为发展趋势[3]。
表观遗传学(epigenetics)是指基因核苷酸序列不发生改变,基因的表达与功能发生可遗传的改变,其调节机制主要包括DNA甲基化(DNA methylation)、组蛋白修饰(histone modification)和miRNA表达调控等。现代研究表明,在RA患者表观基因组中,发现了DNA甲基化、组蛋白修饰和miRNA表达的改变,影响关键的炎症和基质降解途径,在RA的发病机制中起重要作用[4]。本文拟从表观遗传学在RA发生、发展中的机制,以及中药单体成分和复方通过调控DNA甲基化、组蛋白修饰、miRNA对RA的作用进行阐述,以期从分子水平更深入阐明中药防治RA的作用机制,为研发治疗RA的药物提供新的科学依据。
1 表观遗传学在RA发生发展中的机制 1.1 DNA甲基化与RADNA甲基化(DNA methylation)是由DNA甲基转移酶(DNA methyltransferases,DNMTs)催化S腺苷甲硫氨酸(S-adenosyl methionine,SAM)提供的甲基供体,将胞嘧啶(cytosine)转化为5-甲基胞嘧啶(5-methylcytosine)的过程,从而调节细胞分化与基因表达。越来越多研究显示,DNA甲基化参与RA的发病过程,介导遗传变异与患者结局之间的关系。
RA滑膜成纤维细胞(synovial fibroblast,RASF)异常增生是介导RA病情发展和关节破坏的关键因素。Takami等[5]研究显示,RASF死亡受体3(death receptor 3,DR3)基因的CpG岛呈高甲基化,使DR3蛋白水平表达降低,进而抑制RASF凋亡,导致滑膜增生。缪成贵等[6]研究发现,RA模型大鼠成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)中存在分泌性卷曲蛋白1(secreted frizzled-related protein 1,SFRP1)表达下调,同时甲基CpG结合蛋白2(methyl CpG-binding protein 2,MeCP2)表达增高,Wnt经典通路关键基因β-catenin表达上调。对FLS使用甲基化抑制剂后,SFRP1表达不同程度上调,β-catenin表达不同程度下调,进一步说明在病变过程中发生了SFRP1基因甲基化,并且病变过程激活了Wnt经典通路。Sun等[7]探讨MeCP2调节蛋白质修补同系物1(protein patched homolog 1,PTCH1)表达的分子机制,结果显示,在RA中,MeCP2表达明显升高,PTCH1明显降低,发现MeCP2通过调控基因启动子甲基化水平,降低FLS中PTCH1的表达,促进IL-6和TNF-α分泌,参与关节炎症的产生。
1.2 组蛋白修饰与RA组蛋白修饰(histone modification)是在染色质的组蛋白上发生特异位点的翻译后修饰,常见的组蛋白尾部修饰方式有乙酰化(acetylation)、甲基化(methylation)、磷酸化(phosphorylation)、泛素化(ubiquitination)、小类泛素化等,其中乙酰化修饰最常见。组蛋白乙酰转移酶和组蛋白去乙酰化酶(histone deacetylases,HDACs)通过调节组蛋白或转录因子的乙酰化状态,来调节基因的活化或沉默,其中HDACs被认为在促炎基因转录调控中起重要作用,其抑制剂常用于RA的发病机制研究。
Zhang等[8]研究发现,曲古抑菌素A(trichostatin A, TSA)是HDACs抑制剂,可明显抑制RASF的活力,并诱导细胞凋亡,亦可降低基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、MMP-9和磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)的表达,以及抑制Akt的磷酸化。Chung等[9]证实了HDACs抑制剂FK228能使滑膜细胞中组蛋白过度乙酰化,降低TNF-α和IL-1β水平,并抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)产生,阻断滑膜血管增生。李会丹等[10]探索HDACs在IL-17上调RA滑膜细胞中重组人富半胱氨酸蛋白61(cysteine-rich 61,Cyr61)表达过程中的调控机制,发现HDAC1通过影响核因子-κB(nuclear factor kappa-B,NF-κB)通路,参与IL-17促进RA滑膜细胞中Cyr61的表达(Fig 1)。Tarcic等[11]研究发现,E3泛素连接酶RNF20/RNF40可以使组蛋白H2B单泛素化,引起NF-κB下游基因的组蛋白H3K9三甲基化,使相关基因表达在转录水平受到抑制。
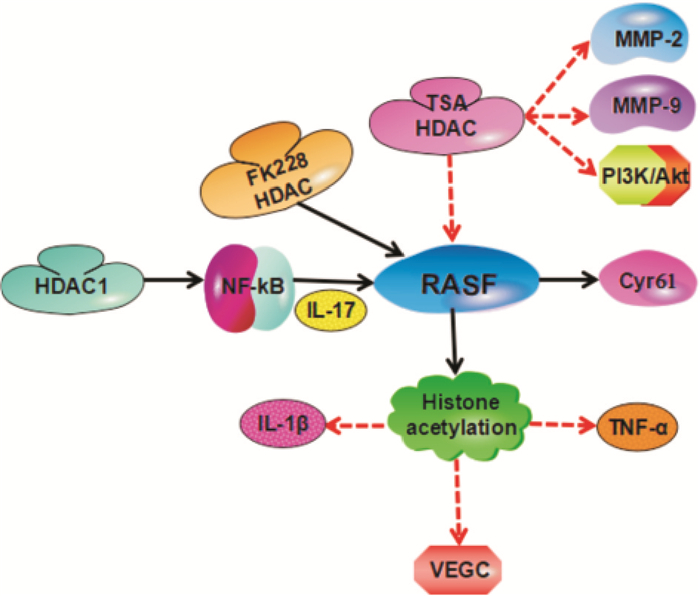
|
| Fig 1 Histone modification pathway of RA TSA, an inhibitor of HDACs, inhibits RASFs and reduces the expression of MMP-2, MMP-9, PI3K and phosphorylation of Akt. HDACs inhibitor FK228 promotes histone hyperacetylation in synoviocytes, which reduces TNF-α and IL-1β levels, and inhibits VEGC. HDAC1 participates in IL-17 by affecting NF-κB pathway and promotes the expression of Cyr61 in RASF. |
miRNA是一类广泛存在于生物体内的非编码单链小分子RNA,miRNA通过与靶基因mRNA特定区域的结合而引起mRNA的降解或翻译抑制,调控基因表达。近年来许多研究揭示RA患者存在miRNA的调节异常。
Li等[12]研究结果显示,RA患者血清miR-155呈高水平表达,通过靶向调控细胞因子信号抑制物1(suppressor of cytokine signaling 1,SOCS1)的表达,导致TNF-α和IL-1β上调,参与关节炎性反应过程。Hong等[13]研究发现,RA患者滑膜中miR-143表达上调,胰岛素样生长因子结合蛋白5(insulin like growth factor binding protein 5,IGFBP5)作为miR-143的潜在靶向基因,其表达水平与miR-143呈负相关,低水平表达的IGFBP5使RASF对TNF-α刺激敏感,促进IL-6的产生和激活NF-κB通路,介导关节炎症发生。Li等[14]探讨miR-140-5p对RASF增殖和炎性细胞因子分泌的影响,研究发现,RASF中存在miR-140-5p下调,Toll样受体4(Toll-like receptor 4,TLR4)上调,miR-140-5p的下调或上调不仅明显增加或降低TLR4的表达,还可以促进或抑制RASF增殖和IL-6、IL-8的分泌。此外,TLR4的过表达可以逆转miR-140-5p对RASF的增殖和炎性细胞因子释放的抑制作用。
2 中药调控表观遗传对RA的作用新近越来越多的研究表明,中药通过作用于DNA甲基化、组蛋白修饰和miRNA调控基因表达,在RA发生、发展中发挥重要作用(Tab 1)。
| 表观遗传类别 | 中药 | 作用靶标 | 与RA效应相关 |
| DNA甲基化 | 瑞香素[15] | DNMT1、DNMT3a和DNMT3b | 促进大鼠滑膜细胞凋亡 |
| 乌头汤[16] | DNMT1 mRNA | 抑制大鼠滑膜增生,减轻关节炎症状 | |
| 白虎加桂枝汤[17] | 热痹特征性甲基化上调基因Agxt mRNA与下调基因Ahcy及Rpl3 mRNA | 改善大鼠足肿胀度和病理损伤 | |
| 组蛋白修饰 | 乌头汤[16] | 组蛋白H3 | 减轻CIA大鼠足肿胀度,抑制滑膜增生 |
| 姜黄素[18] | 组蛋白H3 | 抑制IL-6 mRNA及蛋白的表达 | |
| 黄芪与当归[19] | E3泛素连接酶 | 影响NF-κB及TGF-β介导的信号转导通路,抑制免疫炎症反应 | |
| miRNA | 雷公藤[20] | miR-146a | 明显减轻RA患者临床症状 |
| 益气清络方[21] | miR-146a | 抑制RA患者炎症反应的强度,减轻炎症反应对机体的损伤 | |
| 雷公藤内酯醇[22] | miR-155 | 抑制RA患者体内TNF-α、IL-6介导的炎症反应 | |
| 清络通痹方[23] | miR-143 | 减轻RA的免疫、炎症、疼痛等多种病理过程 | |
| 清络通痹方[24] | miR-140-5p | 调控破骨细胞的分化,抑制RA骨破坏的发生 | |
| 清风痛胶囊联合甲氨喋呤[25] | miRNA-146a和miRNA16 | 抑制RA患者体内TNF-α、IL-1β的分泌及滑膜细胞增殖 |
目前研究发现,RA患者基因组呈低甲基化水平,且与健康人群相比,其DNMT1 mRNA表达明显增高。Shu等[15]探究瑞香素(daphnetin)抗RA的作用机制,结果显示,瑞香素通过降低胶原性关节炎(collagen Ⅱ-induced arthritis,CIA)大鼠滑膜中DNMT1、DNMT3a和DNMT3b的表达,导致促凋亡基因DR3、程序化死亡基因5、FasL、p53基因去甲基化,上调促细胞凋亡基因和蛋白质的表达,促进滑膜细胞凋亡。Liu等[16]探讨乌头汤对CIA大鼠DNA甲基化的影响,结果显示,与正常组相比,CIA大鼠DNMT1 mRNA高表达;与CIA组相比,乌头汤组大鼠DNMT1 mRNA表达明显降低,提示乌头汤可能通过抑制DNMT1 mRNA的表达,抑制大鼠滑膜增生,减轻关节炎症状。陈欢等[17]考察湿热环境下,热痹模型大鼠特征性甲基化基因及白虎加桂枝汤对热痹特征性甲基化基因的调控作用,发现白虎加桂枝汤可能通过抑制大鼠热痹模型特征性甲基化,下调基因Ahcy、Rpl3 mRNA的表达,促进热痹特征性甲基化上调基因Agxt mRNA的表达水平,从而明显改善模型大鼠足肿胀度和病理损伤。
2.2 中药通过调控组蛋白修饰对RA的作用近年研究广泛认为,HDACs抑制剂对RA具有预防保护作用,乌头汤除了上述作用外,亦可作为非选择性HDAC抑制剂(HDACIs),影响组蛋白H3乙酰化,减轻大鼠足肿胀度,抑制滑膜增生,发挥抗炎免疫作用[16]。Wada等[18]研究发现,RA患者IL-6启动子中组蛋白H3乙酰化的水平明显升高,诱导RASF中IL-6水平升高。姜黄素可明显抑制IL-6启动子中组蛋白H3乙酰化,进而抑制IL-6 mRNA及蛋白的表达,从而抑制RA炎症发生。王妍[19]研究显示,黄芪与当归配伍影响E3泛素连接酶靶点,通过蛋白质泛素化途径,进而影响NF-κB及转化生长因子β(transforming growth factor β,TGF-β)介导的信号转导通路作用于RA。
2.3 中药通过调控miRNA对RA的作用新近研究发现,RA患者体内的miR-146a表达明显增加,miR-146a抑制辅助性T细胞1(Th1)介导的细胞反应,激活Treg细胞。雷公藤可明显降低RA患者体内miR-146a的表达,抑制关节炎症,改善患者临床症状[20]。而另有研究显示,miR-146a与RA患者的C反应蛋白、血沉水平呈负相关,益气清络方可上调RA患者外周血单个核细胞中miR-146a的表达水平,而miR-146a增高的意义可能在于抑制炎症反应的强度,减轻炎症反应对机体的损伤[21]。彭桉平等[22]研究证实,雷公藤内酯醇通过抑制miR-155的表达,上调单核细胞中SOCS1和SH2结构域肌醇5-磷酸酶1(Src homology 2 domain-containing inositol 5-phosphatase 1,SHIP1)的表达,进而抑制RA患者外周血单核细胞中TNF-α、IL-6的炎症反应,从而缓解RA患者风湿病情。朱亚梅等[23]探讨清络通痹方对CIA小鼠miRNA网络的调控作用,结果发现,多种miRNA的异常表达参与CIA的病理过程,清络通痹方可能通过干预miR-143,影响RA的免疫、炎症、疼痛等多种病理过程。另有研究显示,破骨细胞分化后期,miR-140-5p下调较为明显,而清络通痹方干预后可上调miR-140-5p的表达水平,参与调控破骨细胞的分化,抑制RA骨破坏的发生[24]。冯知涛[25]研究表明,清风痛胶囊联合MTX通过下调RA患者外周血miRNA-146a和miRNA16的表达,抑制细胞因子TNF-α、IL-1β的分泌及滑膜细胞增殖,抑制过度的炎症反应,从而减轻关节炎症。
3 总结与展望综上所述,新近越来越多的研究都证实表观遗传修饰参与了RA发病的各个机制,而中药通过表观遗传修饰治疗RA是一个全新的研究方向,初步揭示了中药通过调节表观遗传修饰,对病情的缓解和治疗均具有独特的优势。但中药对RA的表观遗传学研究仍存在一些问题:其一,RA病因不明确,发病机制复杂,目前尚未完全阐明;其二,现有的中药研究主要是针对某一靶标而进行的,忽略了中药治疗RA是通过多个靶标共同作用而发挥整体药效;其三,表观遗传主要研究的是在DNA序列不变的情况下,基因表型功能的可逆、可遗传改变,通过相互作用,多途径、多层次影响和调控着遗传基因的功能与特性,其作用机制亦复杂多样,且尚处于起步阶段。中药治疗RA的作用与表观遗传修饰均是多途径、多靶点、多机制的综合效应。因此,如何建立有效的研究手段阐明其多途径、多靶点、多机制的关系,是未来工作的难点和重点。希望未来对中药防治RA表观遗传调节机制的详尽掌握,为中药现代化奠定坚实的理论基础。
| [1] |
Smolen J S, Aletaha D, Barton A, et al. Rheumatoid arthritis[J]. Nat Rev Dis Primers, 2018, 4: 18001. doi:10.1038/nrdp.2018.1 |
| [2] |
McInnes I B, Schett G. Pathogenetic insights from the treatment of rheumatoid arthritis[J]. Lancet, 2017, 389(10086): 2328-37. doi:10.1016/S0140-6736(17)31472-1 |
| [3] |
余黄合, 曾嵘, 李鑫, 等. 土家族药物血筒抗佐剂性关节炎药效作用研究[J]. 中国药理学通报, 2016, 32(10): 1427-32. Yu H H, Zeng R, Li X, et al. Tujia ethnomedicine Xuetong suppresses onset and progression of adjuvantinduced arthritis in rats[J]. Chin Pharmacol Bull, 2016, 32(10): 1427-32. doi:10.3969/j.issn.1001-1978.2016.10.019 |
| [4] |
Ospelt C, Gay S, Klein K. Epigenetics in the pathogenesis of RA[J]. Semin Immunopathol, 2017, 39(4): 409-19. doi:10.1007/s00281-017-0621-5 |
| [5] |
Takami N, Osawa K, Miura Y, et al. Hypermethylated promoter region of DR3, the death receptor 3 gene, in rheumatoid arthritis synovial cells[J]. Arthritis Rheum, 2006, 54(3): 779-87. doi:10.1002/(ISSN)1529-0131 |
| [6] |
缪成贵, 黄成, 黄艳, 等. Wnt调控类风湿性关节炎研究进展[J]. 中国药理学通报, 2013, 29(2): 149-53. Miao C G, Huang C, Huang Y, et al. Research progress of the Wnt in rheumatoid arthritis[J]. Chin Pharmacol Bull, 2013, 29(2): 149-53. doi:10.3969/j.issn.1001-1978.2013.02.01 |
| [7] |
Sun Z H, Liu Y H, Liu J D, et al. MeCP2 regulates PTCH1 expression through DNA methylation in rheumatoid arthritis[J]. Inflammation, 2017, 40(5): 1497-508. doi:10.1007/s10753-017-0591-8 |
| [8] |
Zhang Y, Zhang B. Trichostatin A, an inhibitor of histone deacetylase, inhibits the viability and invasiveness of hypoxic rheumatoid arthritis fibroblast-like synoviocytes via PI3K/Akt signaling[J]. J Biochem Mol Toxicol, 2016, 30(4): 163-9. doi:10.1002/jbt.2016.30.issue-4 |
| [9] |
Chung Y L, Lee M Y, Wang A J, et al. A therapeutic strategy uses histone deacetylase inhibitors to modulate the expression of genes involved in the pathogenesis of rheumatoid arthritis[J]. Mol Ther, 2003, 8(5): 707-17. doi:10.1016/S1525-0016(03)00235-1 |
| [10] |
李会丹, 孙悦, 火蓉芬, 等. 组蛋白去乙酰化酶1通过NF-κB调控炎症性滑膜细胞表达Cyr61[J]. 现代免疫学, 2014, 34(1): 1-6. Li H D, Sun Y, Huo R F, et al. HDAC1 regulates expression of cyr61 in inflammatory synovial cells through NF-κB[J]. Current Immunol, 2014, 34(1): 1-6. |
| [11] |
Tarcic O, Pateras I S, Cooks T, et al. RNF20 links histone H2B ubiquitylation with inflammation and inflammation-associated cancer[J]. Cell Rep, 2016, 14(6): 1462-76. doi:10.1016/j.celrep.2016.01.020 |
| [12] |
Li X, Tian F, Wang F. Rheumatoid arthritis-associated microRNA-155 targets SOCS1 and upregulates TNF-α and IL-1β in PBMCs[J]. Int J Mol Sci, 2013, 14(12): 23910-21. doi:10.3390/ijms141223910 |
| [13] |
Hong B K, You S, Yoo S A, et al. MicroRNA-143 and -145 modulate the phenotype of synovial fibroblasts in rheumatoid arthritis[J]. Exp Mol Med, 2017, 49(8): e363. doi:10.1038/emm.2017.108 |
| [14] |
Li H, Guan S B, Lu Y, et al. MiR-140-5p inhibits synovial fibroblasts proliferation and inflammatory cytokines secretion through targeting TLR4[J]. Biomed Pharmacother, 2017, 96: 208-14. doi:10.1016/j.biopha.2017.09.079 |
| [15] |
Shu K, Kuang N, Zhang Z, et al. Therapeutic effect of daphnetin on the autoimmune arthritis through demethylation of proapoptotic genes in synovial cells[J]. J Transl Med, 2014, 12: 287. doi:10.1186/s12967-014-0287-x |
| [16] |
Liu Y F, Wen C Y, Chen Z, et al. Effects of Wutou decoction on DNA methylation and histone modifications in rats with collagen-induced arthritis[J]. Evid Based Complement Alternat Med, 2016, 2016: 5836879. |
| [17] |
陈欢, 巨少华, 魏江平, 等. 白虎加桂枝汤对热痹模型大鼠特征性甲基化基因表达的影响[J]. 中国中药杂志, 2017, 42(2): 332-40. Chen H, Ju S H, Wei J P, et al. Effect of Baihu Guizhi decoction on characteristic methylation genes expression of pyretic arthralgia rat model[J]. China J Chin Mater Med, 2017, 42(2): 332-40. |
| [18] |
Wada T T, Araki Y, Sato K, et al. Aberrant histone acetylation contributes to elevated interleukin-6 production in rheumatoid arthritis synovial fibroblasts[J]. Biochem Biophys Res Commun, 2014, 444(4): 682-6. doi:10.1016/j.bbrc.2014.01.195 |
| [19] |
王妍.雷公藤与甲氨蝶呤、黄芪与当归联用治疗RA机制的生物信息学分析[D].北京: 中国中医科学院, 2012. Wang Y. Bioinformatics analysis on the mechanisms of rheumatoid arthritis treatment by tripterygium wilfordii in combination with methotrexate, astragalus arid angelica[D]. Beijing: China Academy Chinese medical Science, 2012. http://cdmd.cnki.com.cn/Article/CDMD-84502-1012483646.htm |
| [20] |
Chen Z Z, Zhang X D, Chen Y, et al. The role of circulating miR-146a in patients with rheumatoid arthritis treated by Tripterygium wilfordii Hook F[J]. Medicine(Baltimore), 2017, 96(20): e6775. |
| [21] |
朴雪梅, 薛鸾, 胡建东. 益气清络方对类风湿关节炎患者外周血单个核细胞中miR-146a表达的影响[J]. 上海中医药大学学报, 2015, 29(1): 37-40. Piao X M, Xue L, Hu J D. Effect of Yiqi Qingluo Formula on expression of miR-146a in peripheral blood mononuclear cells in patients with rheumatoid arthritis[J]. Acta Univ Tradit Med Sin Pharmacol Shanghai, 2015, 29(1): 37-40. |
| [22] |
彭桉平, 黄宪章, 刘瑞萍, 等. 雷公藤内酯醇调控miR-155抑制类风湿性关节炎患者单核细胞促炎反应[J]. 细胞与分子免疫学杂志, 2014, 30(6): 635-8. Peng A P, Huang X Z, Liu R P, et al. Triptolide inhibits the inflammatory response of monocytes from rheumatoid arthritis patients by regulating miR-155[J]. Chin J Cell Mol Immunol, 2014, 30(6): 635-8. |
| [23] |
朱亚梅, 周玲玲, 彭孝武, 等. 清络通痹方调控miRNA网络干预类风湿关节炎的研究[J]. 中国免疫学杂志, 2016, 32(4): 495-9. Zhu Y M, Zhou L L, Peng X W, et al. Study of Qingluo Tongbi compound treating rheumatoid arthritis based on miRNA network[J]. Chin J Immunol, 2016, 32(4): 495-9. doi:10.3969/j.issn.1000-484X.2016.04.010 |
| [24] |
彭孝武, 周玲玲, 朱亚梅, 周孝平. 清络通痹方对佐剂性关节炎大鼠破骨细胞分化相关miRNA表达的影响[J]. 中国中西医结合杂志, 2016, 36(10): 1213-8. Peng X W, Zhou L L, Zhu Y M, Zhou X P. Effect of Qingluo Tongbi Compound on osteoclast differentiation related miRNA expressions in adjuvant induced arthritis rats[J]. Chin J Integr Tradit West Med, 2016, 36(10): 1213-8. doi:10.7661/CJIM.2016.10.1213 |
| [25] |
冯知涛. RA患者外周血miR-146a、miR-16表达与疾病活动、中医证型相关性及青藤碱制剂对其干预的研究[D].广州: 南方医科大学, 2011. Feng Z T. Intervention of sinomenine preparation miR-145a and miR-16 expressions in peripheral blood of rheumatoid arthritis patients and correlation with the expression levels and both disease activity and TCM syndrome type[D]. Guangzhou: Southern Medical University, 2011. http://cdmd.cnki.com.cn/article/cdmd-90023-1012250900.htm |