


2. 河南中医药大学第一附属医院药学部,河南 郑州 450000
黄立华(1986-),男,博士,讲师,研究方向:中药药性理论与应用,通讯作者,E-mail:378097998@qq.com

 ,
HUANG Li-hua1
,
HUANG Li-hua1
 ,
TANG Jin-fa2,
LI Wei-xia2,
MA Xiao1,
CHEN Nian1,
DONG Tai-wei1
,
TANG Jin-fa2,
LI Wei-xia2,
MA Xiao1,
CHEN Nian1,
DONG Tai-wei1
2. Dept of Pharmacy, the First Hospital Affiliated to Henan University of Chinese Medicine, Zhengzhou 450000, China
远志,首载于《神农本草经》:能利九窍,益智慧,耳目聪明,不忘,强志倍力。但大剂量使用远志,可导致恶心、呕吐、腹胀等不良反应[1]。课题组前期研究亦发现,生远志可导致胃肠动力障碍,同时伴随胃黏膜损伤,具有出血点等不良反应,尤以醇提物及70%乙醇洗脱部位所致胃肠毒副作用最为明显[2]。针对远志所致的胃肠毒副作用,课题组前期原创性筛选出行气消积药厚朴2倍于远志(2 :1配比)时,可明显缓解远志所致的胃肠动力障碍,并保存其安神益智、祛痰的功效[3]。然而,厚朴缓解远志所致胃肠动力障碍机制仍需探索。
代谢组学将机体作为一个完整的系统,观测药物对机体的整体代谢轮廓的影响,与中医整体观的理念吻合,为阐释药物作用机制提供了技术手段[4]。因此,本实验采用超高效色谱串联质谱(ultra-high performance liquid chromatography-quadrupole-time of flight-mass spectrometry,UPLC-Q-TOF-MS),研究厚朴远志配伍对大鼠尿液中代谢物的影响,借以探讨厚朴缓解远志所致胃肠动力障碍的可能机制,为揭示“相杀”配伍关系的科学内涵提供参考。
1 材料与方法 1.1 药物与试剂厚朴、远志药材,购于成都荷花池中药材市场,经成都中医药大学卢先明教授鉴定为木兰科植物厚朴Magnolia officinalis Rehd. et Wils.的干燥干皮及远志科植物远志Polygala tenuifolia Willd.的干燥根,依据2015年版《中国药典》(一部)规定方法,测得厚朴中和厚朴酚(1.86%)与厚朴酚(2.55%)含量共为4.41%,远志中细叶远志皂苷含量为6.73%,均符合其含量要求。厚朴、远志饮片打粉,过三号筛,分别用10倍量90%乙醇回流提取3次,每次2 h,过滤并合并滤液,分别减压浓缩干燥得厚朴、远志浸膏,计算得膏率分别为25.41%和48.59%。分别称取厚朴、远志浸膏11.12 g、10.63 g,用5%吐温80溶液研磨,配制成分别含175 g·L-1、87.5 g·L-1的厚朴、远志醇提物供试液,即给药剂量分别为相当于原生药量厚朴3.50 g·kg-1和远志1.75 g·kg-1。配伍供试液为两单药混合后研磨配制而成,制备方法与单味药相同。聚山梨酯-80(吐温80,成都市科隆化学品有限公司,批号2017111401);甲酸、乙腈、甲醇为色谱纯;其他试剂均为分析纯。
1.2 仪器ACQUITY I-Class UPLC超高效液相色谱-Xevo G2-XS型四级杆-飞行时间质谱联用仪(美国Waters公司,含MassLynx 4.1工作站);Neofuge 1600R低温离心机(上海力申科学仪器有限公司);Vortex3涡旋混匀器(德国IKA公司);JA5003电子分析天平(上海舜宇恒平科学仪器有限公司);ULT1386-3-V-80 ℃冰箱(美国赛默飞Revco公司)。
1.3 实验动物SD大鼠,♂,SPF级,体质量(200±20)g,购于四川省医学科学院实验动物研究所,合格证号:SCXK(川) 2013-15。实验场地为成都中医药大学,国家中医药管理局中药药理三级科研实验室(NO:TCM-09-315)及河南中医药大学第一附属医院,中药临床评价技术河南省工程实验室。本文涉及的动物实验经成都中医药大学实验动物伦理委员会批准,批准号TCM-2016-312。
2 方法 2.1 动物的分组及给药将大鼠适应性喂养3 d后,按体质量随机分为对照组、厚朴组(3.50 g·kg-1)、远志组(1.75 g·kg-1)、配伍组(3.50+1.75 g·kg-1),每组10只,各组均按20 mL·kg-1灌胃相应药液(给药剂量系前期胃肠动力实验研究结果,另文发表),对照组给予同体积5%吐温80,连续给药3 d。
2.2 尿样的收集和处理参考文献方法[5],收集末次给药后24 h的尿样,于接尿管中提前加入50 μL质量浓度为10 g·L-1叠氮钠作为防腐剂,采集过程中保持冰浴,收集的尿样放置于-80 ℃下保存备用。尿液处理时,200 μL尿样加入600 μL预冷的甲醇,涡旋3 min,4 ℃、14 000 r·min-1离心10 min,取上清液进样分析。同时,精密量取每个尿液样品10 μL,混合后按照上述过程进行处理作为质量控制样品(quality control,QC),在实验过程中每隔10个样品进样1次QC,以确保整个实验过程中仪器的稳定性。
2.3 检测条件 2.3.1 色谱条件参考文献方法[5],样品温度为4 ℃,柱温40 ℃,流动相:乙腈(A)、0.1%甲酸水(B),流速0.5 mL·min-1,运行时间12 min,进样量4 μL。流动相洗脱梯度:0~4 min,2%~20% A;4~8 min,20%~95% A;8~8.1 min,95%~99% A;8.1~9 min,99% A;9~10 min,99%~100% A;10~10.1 min,100%~2% A;10.1~12 min,2% A。
2.3.2 质谱条件参考文献方法[5],采用电喷雾电离(ESI)离子源进行正负离子模式下的代谢物的检测,采集范围m/z:50~1 200;源温度110 ℃;毛细管电压1.5 kV; 采样锥电压40 V;去溶剂化气流速800 L·h-1;去溶剂化气温度500 ℃; 锥孔气流速50 L·h-1; 扫描时间0.15 s,扫描间延迟时间0.02 s;流速4.5 mL·min-1,用亮氨酸脑啡肽和甲酸钠校正仪器。
2.4 数据处理与分析将所得样本数据通过软件Progenesis QI V2.0进行提取。通过全扫描模式提取荷质比在50~1 200的离子信息,记录其保留时间,并采用SIMCA-P 14.0对提取的数据进行多元分析。采用无监督模式的主成分分析(principal components analysis,PCA)对各给药组分别进行分类,并评价所建立模型的效率。进一步采用偏最小二乘法-判别分析(partial least squares-discriiminate analysis,PLS-DA)对各给药组进行监督性分类,绘制Loading plot,选取p(corr)绝对值≥0.5及变量重要性投影(variable importance in the projection,VIP)值≥1.0的变量。将所选取的变量采用单因素方差分析,并计算差异倍数(fold changes,FC),选定差异具有显著性P<0.05及FC≥1.5作为代谢标志物。将代谢标志物与人类代谢组数据库(Human Metabolome Database,HMDB)进行比对鉴定,并采用MetPA(http://www.metaboanalyst.ca/)进行通路分析。
3 结果 3.1 大鼠尿液代谢物的轮廓分析 3.1.1 正离子模式下的不同给药组间尿液样本的分类情况正离子模式下,PCA得分图(Fig 1A)表明,对照组、远志组、厚朴组及配伍组4组间的代谢物差异无法区分,因此采用PLS-DA进一步分析4组的尿液代谢物情况。PLS-DA得分图(Fig 1B)表明,对照组(黄色)、远志组(红色)、厚朴组(绿色)与配伍组(蓝色)能够明显区分,提示远志、厚朴及其配伍对大鼠尿液代谢物产生了明显的影响。载荷图(Fig 1C)进一步展现了拟合模型中的整体代谢物在各组间的分布水平,距离原点越远的点对4组的分类贡献越大。PLS-DA模型响应结果置换图(Fig 1D)显示,R2、Q2值均小于原始值(R2=0.588,Q2=-0.555),证明模型有效。S-Plot(Fig 1E)中距离原点越远的代谢物对组间分类贡献越大;VIP图(Fig 1F)显示每个代谢物对分组所起的贡献值。本次研究通过VIP≥1.0、p(corr)≥0.5或p(corr)≤-0.5共筛选出203个特征代谢物。
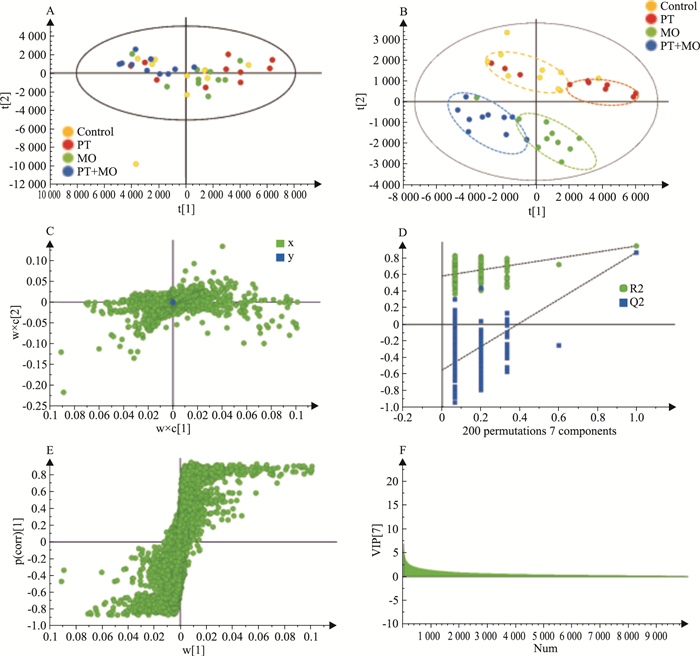
|
| Fig 1 Distribution of urinary metabolic components between different administration groups in positive ion mode A: PCA score plot; B: PLS-DA score plot; C: Loading plot; D: Response replace-ment graphs of PLS-DA model; E: S-plot; F: VIP plot. PT: Polygala tenuifolia; MO: Magnolia officinalis. |
负离子模式下,PCA得分图(Fig 2A)显示,对照组、远志组、厚朴组及配伍组间的代谢物差异尚可明显区分;在PLS-DA模式下(Fig 2B),对照组(黄色)、远志组(红色)、厚朴组(绿色)、配伍组(蓝色)4组间能够明显区分,提示对照组、3组给药组间的代谢成分有明显的区别。载荷图(Fig 2C)中距离原点越远的点对4组的分类贡献越大。PLS-DA模型响应结果置换图(Fig 2D)中R2、Q2值均小于原始值(R2=0.574,Q2=-0.469),证明模型有效。S-Plot图(Fig 2E)中距离原点越远的代谢物对组间分离贡献越大;VIP图(Fig 2F)显示每个代谢物对分组所起的贡献值。由VIP≥1.0、p(corr)≥0.5或p(corr)≤-0.5共筛选出390个特征代谢物。
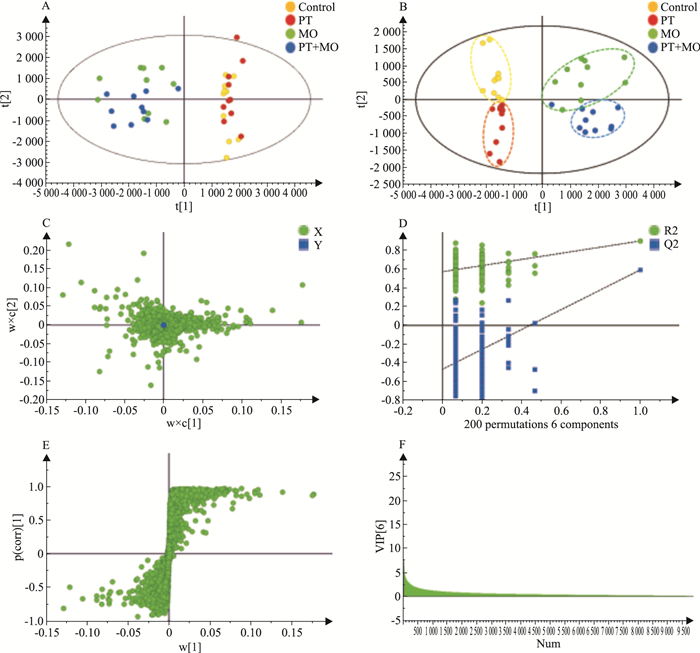
|
| Fig 2 Distribution of urinary metabolic components between different administration groups in negative ion mode A: PCA score plot; B: PLS-DA score plot; C: Loading plot; D: Response replace-ment graphs of PLS-DA model; E: S-plot; F: VIP plot. |
基于VIP值及p(corr)的筛选结果,将正、负离子模式中的特征代谢物分别采用One-way ANOVA分析计算组间P值,计算4组间标准化的峰面积均值,比较各组间的FC,选取P < 0.05及FC≥1.5的代谢物作为特征代谢标志物,并将其导入HMDB,最终共鉴别出2-氨基苯甲酸、D-葡萄糖醛酸-6, 3-内酯、3-甲氧基-4-羟基苯乙醛等16个代谢物(Tab 1)。同时,计算16个代谢物在10个QC样本中含量的RSD为1.94%~6.50%,提示仪器稳定性较好,数据结果较为可靠。
| No. | RT/min | m/z | Chemical formula |
Error /ppm |
Metabolite name |
Variation of metabolite(mean±SD) | FC value compared with PT | Metabolicpathway | ||||||
| Control | PT | MO | PT+MO | Control | MO | PT+MO | ||||||||
| 1 | 0.5 | 138.0553 | C7H7NO2 | 2.58 | 2-Aminobenzoic acid | 1.06×104±2.06×103 | 1.30×104±4.44×103 | 9.49×103±2.38×103 | 7.19×103±1.44×103## | 1.22 | 1.37 | 1.81 | b | |
| 2 | 0.52 | 175.0249 | C6H8O6 | 0.66 | D-Glucurono-6, 3-lactone | 6.17×103±2.01×103 | 5.83×103±1.20×103 | 4.50×103±1.22×103** | 3.61×103±7.49×102## | 1.06 | 1.3 | 1.62 | f | |
| 3 | 3.66 | 331.1184 | C9H10O3 | -0.86 | Homovanillin | 1.27×102±3.06×101 | 4.98×101±8.49×101 | 1.47×103±4.26×102** | 2.30×103±8.29×102## | 2.54 | 29.58 | 46.28 | a | |
| 4 | 3.78 | 185.0811 | C9H12O4 | 1.56 | Vanylglycol | 2.51×102±7.76×101 | 2.00×102±5.75×101 | 5.07×103±9.62×102** | 3.97×103±6.73×102## | 1.26 | 25.38 | 19.89 | a | |
| 5 | 3.82 | 359.098 | C15H20O10 | -1.05 | 3-Methoxy-4-hydroxyphenylglycol glucuronide | 1.46×103±3.96×102 | 1.48×103±6.03×102 | 6.34×103±1.88×103** | 4.12×103±6.65×102## | 1.01 | 4.3 | 2.79 | j, k | |
| 6 | 3.83 | 153.0199 | C7H6O4 | 3.6 | Gentisic acid | 1.10×104±2.82×103 | 1.05×104±1.79×103 | 8.56×103±1.68×103** | 6.11×103±1.25×103## | 1.05 | 1.23 | 1.72 | a | |
| 7 | 4.17 | 492.1001 | C17H29N4O8P2S+ | -0.32 | 2-Methyl-1-hydroxybutyl-ThPP | 1.25×104±3.00×103 | 1.06×104±2.19×103* | 7.76×103±1.29×103** | 7.06×103±9.17×102## | 1.18 | 1.37 | 1.5 | m | |
| 8 | 5.25 | 327.0875 | C9H8O3 | 0.15 | Phenylpyruvic acid | 2.80×102±4.05×101 | 2.27×102±1.07×102 | 3.59×103±3.65×102** | 3.88×103±8.81×102## | 1.23 | 15.84 | 17.14 | c, h | |
| 9 | 5.34 | 161.0248 | C9H8O4 | 2.08 | 2-Hydroxy-3-(4-hydroxyphenyl)propenoic acid | 5.51×102±1.39×102 | 1.03×103±3.53×102** | 3.34×102±8.06×101* | 6.91×102±1.69×102## | 1.87 | 3.09 | 1.49 | a | |
| 10 | 5.57 | 186.0561 | C11H11NO3 | 0.2 | 5-Methoxyindoleacetate | 8.38×103±2.75×103 | 9.41×103±1.72×103 | 4.06×103±7.13×102** | 3.28×103±4.38×102## | 1.12 | 2.32 | 2.87 | b | |
| 11 | 5.93 | 269.0898 | C13H16N2O3 | -3.69 | 6-Hydroxymelatonin | 4.60×103±1.64×103 | 3.70×103±9.22×102* | 2.21×103±4.04×102** | 1.39×103±3.25×102## | 1.24 | 1.68 | 2.66 | b | |
| 12 | 5.95 | 230.0218 | C8H12NO6P | -2.37 | Pyridoxine 5′-phosphate | 0.00±0.00 | 6.15×102±6.04×101** | 0.00±0.00 | 4.15×102±5.94×101## | - | - | 1.48 | g | |
| 13 | 6.31 | 471.3114 | C27H46O5 | 4.95 | 3a, 7a, 12a-Trihydroxy-5b-cholestanoic acid | 8.56×101±2.68×101 | 1.55×103±7.90×102** | 4.49×101±1.72×101 | 6.46×102±1.94×102## | 18.08 | 34.52 | 2.4 | i | |
| 14 | 7.5 | 455.3164 | C27H46O4 | 4.91 | 3a, 7a, 12a-Trihydroxy-5b-cholestan-26-al | 0.00±0.00 | 6.00×102±1.46×102** | 0.00±0.00 | 8.18×102±3.32×102## | - | - | 1.36 | i | |
| 15 | 8.9 | 255.2328 | C16H32O2 | -0.59 | Palmitic acid | 2.13×103±4.56×102 | 3.05×103±9.08×102** | 1.85×103±3.81×102 | 1.74×103±4.18×102## | 1.43 | 1.65 | 1.75 | d, e, l, n | |
| 16 | 9.37 | 283.2642 | C18H36O2 | -0.28 | Stearic acid | 3.00×103±6.68×102 | 4.57×103±1.30×103** | 2.92×103±6.11×102 | 2.74×103±6.52×102## | 1.53 | 1.57 | 1.67 | d, e | |
| a: Tyrosine metabolism; b: Tryptophan metabolism; c: Phenylalanine, tyrosine and tryptophan biosynthesis; d: Biosynthesis of unsaturated fatty acids; e: Fatty acid biosynthesis; f: Primary bile acid biosynthesis; g: Ascorbate and aldarate metabolism; h: Vitamin B6 metabolism; i: Phenylalanine metabolism; j: Pentose and glucuronate interconversions; k: Starch and sucrose metabolism; l: Fatty acid elongation in mitochondria; m: Valine, leucine and isoleucine degradation; n: Fatty acid metabolism(same as in Fig 3).*P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PT group; - indicates no FC value. | ||||||||||||||
将Tab 1中的代谢物的HMDB号输入MetPA进行通路分析。由Fig 3、Tab 2可知,厚朴配伍远志缓解远志所致胃肠动力障碍的作用机制可能与酪氨酸代谢、色氨酸代谢,以及苯丙氨酸、酪氨酸、色氨酸生物合成等14条代谢通路有关。结合文献报道以及KEGG通路分析,酪氨酸代谢、色氨酸代谢、初级胆汁酸生物合成和维生素B6代谢可能是其主要相关代谢通路(Fig 4)。
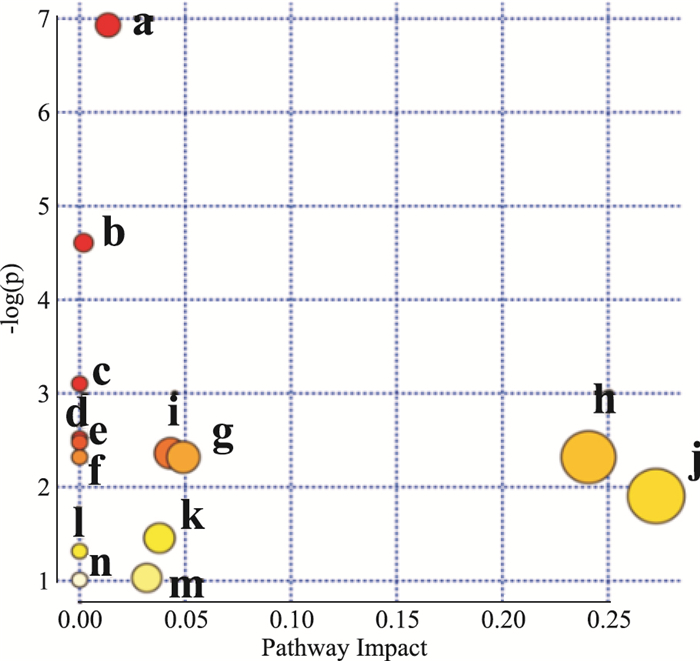
|
| Fig 3 Pathway analysis of characteristic metabolic markers with MetPA |
| No. | Metabolism pathway | Match status | P | -log(P) | Impact |
| a | Tyrosine metabolism | 2/21 | 9.77×10-4 | 6.93 | 1.35×10-2 |
| b | Tryptophan metabolism | 3/41 | 9.98×10-3 | 4.61 | 1.9×10-3 |
| c | Phenylalanine, tyrosine and tryptophan biosynthesis | 1/4 | 4.49×10-2 | 3.10 | 0.00 |
| d | Biosynthesis of unsaturated fatty acids | 1/21 | 8.06×10-2 | 2.52 | 0.00 |
| e | Fatty acid biosynthesis | 2/43 | 8.40×10-2 | 2.48 | 0.00 |
| f | Primary bile acid biosynthesis | 1/23 | 9.44×10-2 | 2.36 | 4.3×10-2 |
| g | Ascorbate and aldarate metabolism | 1/9 | 9.84×10-2 | 2.32 | 0.00 |
| h | Vitamin B6 metabolism | 1/9 | 9.84×10-2 | 2.32 | 4.9×10-2 |
| i | Phenylalanine metabolism | 1/9 | 9.84×10-2 | 2.32 | 2.41×10-1 |
| j | Pentose and glucuronate interconversions | 1/14 | 1.49×10-1 | 1.90 | 2.73×10-1 |
| k | Starch and sucrose metabolism | 1/23 | 2.34×10-1 | 1.45 | 3.78×10-2 |
| l | Fatty acid elongation in mitochondria | 1/27 | 2.69×10-1 | 1.31 | 0.00 |
| m | Valine, leucine and isoleucine degradation | 1/38 | 3.57×10-1 | 1.03 | 3.18×10-2 |
| n | Fatty acid metabolism | 1/39 | 3.65×10-1 | 1.01 | 0.00 |
| Match status: the number of identified metabolites/the total number of metabolites in the pathway; P: the raw P value obtained by pathway analysis; Impact: the pathway impact value obtained by topological analysis. | |||||

|
| Fig 4 Network diagram of the metabolic pathways Ellipse represents urinary characteristic metabolic markers; blue indicates tyrosine metabolism; orange indicates tryptophan metabolism; pink indicates primary bile acid biosynthesis; green indicates vitamin B6 metabolism. indicates control, PT, MO, PT+MO respectively. The level of the metabolite content is expressed by the color depth. If the content is 0, it is white. |
课题组前期研究表明,厚朴远志2 :1配伍可明显缓解远志所致的胃肠动力障碍[6],厚朴中的酚类物质可抑制远志中皂苷类成分在肠道的吸收,远志可促进厚朴中酚类物质的溶出而促进其发挥促胃动力的疗效,但其深层次生物机制尚不清楚。本研究基于前期研究结果,以中医整体观为指导,采用UPLC-Q-TOF-MS结合多变量数据统计分析方法,进一步从整体代谢轮廓探讨厚朴缓解远志胃肠动力障碍作用机制,结果表明,其可能与酪氨酸代谢、色氨酸代谢、初级胆汁酸生物合成和维生素B6代谢等通路相关。除此以外,考虑到♀大鼠生理期对体内代谢物的影响,本次实验均选用♂大鼠作为实验对象。
酪氨酸可代谢为多巴胺和去甲肾上腺素,均为人体内重要的神经递质,以多巴胺为介质的脑-肠轴对调节胃肠功能具有重要作用。研究表明,肠系膜器官可产生的大量的多巴胺,抑制胃体、胃窦运动[7]。多巴胺可在酶的作用下降解为香草酸,去甲肾上腺素则降解为香草扁桃酸。本次研究结果显示,远志可导致该代谢过程中的中间代谢产物3-甲氧基-4-羟基苯乙醛、香草乙二醇降低,以及酪氨酸代谢终产物2-羟基-3-(4-羟基苯基)丙烯酸极明显升高,提示远志可引起酪氨酸代谢紊乱,配伍厚朴可明显回调上述代谢物的变化。同时,研究表明[8],厚朴中厚朴酚可抑制酪氨酸酶活性,和厚朴酚可抑制乙酰胆碱诱导的多巴胺的分泌。由此推测,远志可能导致酪氨酸紊乱,抑制多巴胺的分解代谢,导致多巴胺含量升高增多,进而引起胃肠动力障碍,厚朴可能通过抑制多巴胺的分泌,进而缓解远志所致的胃肠动力障碍。
色氨酸在体内可被分解代谢为5-羟色胺(5-HT),5-HT是一种的重要神经递质和旁分泌信号分子,主要参与调节肠道的蠕动和分泌功能,可直接作用于肠神经元及肌细胞等效应器参与肠道蠕动反射[9]。5-HT可代谢为血清素,进而转化为褪黑素,参与体内调节肠道动力、肠道免疫、肠道分泌等过程[10]。褪黑素在肝脏中进一步代谢为6-羟基褪黑素与5-甲氧基吲哚乙酸,其中,6-羟基褪黑素具有强抗氧化作用,可通过抗炎和免疫调节保护上消化道。若褪黑素代谢发生紊乱,则会影响到胃肠道正常消化功能。Cezary等[11]研究发现,消化功能不良患者血清中褪黑素浓度明显升高,尿样中6-硫酸基褪黑素排泄明显降低。本实验结果显示,远志组大鼠尿液中5-甲氧基吲哚乙酸水平升高,6-羟基褪黑素明显下降,提示远志导致色氨酸代谢紊乱,配伍厚朴可明显回调该代谢物的变化。另有研究表明[12],厚朴中厚朴酚与和厚朴酚可剂量依赖性地抑制5-HT所致的平滑肌收缩。以上提示,远志可能导致色氨酸代谢过程中5-HT的代谢紊乱,进而引起胃肠动力障碍,厚朴可能通过调节色氨酸代谢,缓解远志所致胃肠动力障碍。
胆汁酸是胆汁的主要成分,在人体内,胆汁酸通过肠肝循环,可以乳化脂肪,促进疏水性营养素的消化和肠吸收。肝细胞以胆固醇为原料直接合成的胆汁酸称为初级胆汁酸。3a, 7a, 12a-三羟基-5b-胆甾烷酸是初级胆汁酸经典合成途径中重要中间代谢物。胆汁酸的合成代谢与肝、肠及胆道系统密切相关,部分胆汁酸可以调节胃肠运动[13]。若发生胃肠道疾病如腹泻等,则会导致肠肝循环受阻,进而导致胆汁酸合成代谢紊乱,其代谢途径中关键酶的活性下降或缺失,大量胆固醇和胆甾烷醇则通过尿液、粪便排出[14]。本次实验过程中,远志组大鼠出现胃肠胀气、胃肠动力不足,以及拉稀、毛色无光泽等现象,提示远志可能破坏胆汁酸肝肠循环。检测结果表明,远志组大鼠尿液中3a, 7a, 12a-三羟基-5b-胆甾烷酸明显升高,并检测到新代谢物3a, 7a, 12a-三羟基-5b-胆甾-4-烯,配伍厚朴可回调上述代谢物的变化。以上提示,远志导致胃肠动力障碍可能与破坏胆汁酸的肝肠循环,进而引起初级胆汁酸的生物合成紊乱有关,厚朴可能通过调控该过程,缓解远志引起的胃肠动力障碍,这或许与厚朴“行气,促消化”有关。
另有研究表明[15],维生素B6可通过减少乙酰胆碱的释放抑制胃肠蠕动,解除内脏平滑肌痉挛,从而缓解阿奇霉素导致的胃肠不适。本研究显示,远志组与对照组、厚朴组比较,尿液中新检测到吡哆醇5′-磷酸盐,而配伍后可明显降低该代谢物水平,提示厚朴缓解远志所致的胃肠动力障碍可能与维生素B6代谢有关。
综上,本研究从整体轮廓提示,厚朴可能通过调控酪氨酸代谢、色氨酸代谢、初级胆汁酸生物合成和维生素B6代谢等代谢通路,缓解远志引起的胃肠动力障碍。然而,本研究尚未对上述通路中相关分子机制进行验证,后续将开展相关通路验证,并采用胆汁代谢组学进一步探讨厚朴缓解远志所致胃肠动力障碍的作用机制。
( 致谢: 本文实验在国家中医药管理局中药药理三级科研实验室(NO:TCM-09-315)及河南中医药大学第一附属医院,中药临床评价技术河南省工程实验室完成。感谢课题组成员的帮助!)
| [1] |
王建, 郭娟, 武云. 远志不同炮制品对胃肠运动及消化功能的影响[J]. 中药药理与临床, 2006, 22(3/4): 120-1. Wang J, Guo J, Wu Y. Effects of different processed products of Polygalae on gastrointestinal motility and digestive function[J]. Pharmacol Clin Chin Mater Med, 2006, 22(3/4): 120-1. |
| [2] |
李达.远志与厚朴配伍前后化学成分对比及解毒机理初步研究[D].成都: 成都中医药大学, 2009. Li D. Preliminary study on chemical composition comparison and detoxification mechanism between Polygalae and Magnolia before and after compatibility[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2009. http://cdmd.cnki.com.cn/article/cdmd-10633-2010077319.htm |
| [3] |
江娟, 王建, 李达, 等. 远志与厚朴不同煎煮时间及不同配比对小鼠胃肠运动的影响[J]. 西安交通大学学报(医学版), 2009, 30(3): 380-2. Jiang J, Wang J, Li D, et al. Effects of radix Polygalae and Magnolia of different decoction time and compatibility proportion on mouse gastrointestinal motility[J]. J Xi′an Jiaotong Univ(Med Sci), 2009, 30(3): 380-2. |
| [4] |
牟菲, 段佳林, 边海旭, 等. 降香水提物和挥发油对心肌缺血/再灌注损伤大鼠预防作用的代谢组学研究[J]. 中国药理学通报, 2016, 32(10): 1377-82. Mu F, Duan J L, Bian H X, et al. Metabolomic study on preventive effect of aqueous extract and volatile oil of Dalbergia Odorifera on myocardial ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2016, 32(10): 1377-82. doi:10.3969/j.issn.1001-1978.2016.10.010 |
| [5] |
Manna S K, Patterson A D, Yang Q, et al. UPLC-MS-based urine metabolomics reveals indole-3-lactic acid and phenyllactic acid as conserved biomarkers for alcohol-induced liver disease in the Ppara-null mouse model[J]. J Proteome Res, 2011, 10(9): 4120-33. doi:10.1021/pr200310s |
| [6] |
黄立华, 王建, 吴明权, 等. 远志、厚朴配伍对其活性成分在大鼠肠段吸收的影响[J]. 中成药, 2015, 37(4): 739-45. Huang L H, Wang J, Wu M Q, et al. Active elements from Yuanzhi and Houpo, and their intestinal absorption due to the combined use[J]. Tradit Chin Med Patent Prescription, 2015, 37(4): 739-45. doi:10.3969/j.issn.1001-1528.2015.04.011 |
| [7] |
Eisenhofer G, Aneman A, Friberg P, et al. Substantial production of dopamine in the human gastrointestinal tract[J]. J Clin Endocrinol Metab, 1997, 82(11): 3864-71. doi:10.1210/jcem.82.11.4339 |
| [8] |
Tachikawa E, Takahashi M, Kashimoto T. Effects of extract and ingredients isolated from Magnolia obovata thunberg on catecholamine secretion from bovine adrenal chromaffin cells[J]. Biochem Pharmacol, 2000, 60(3): 433-40. doi:10.1016/S0006-2952(00)00343-9 |
| [9] |
丁健华, 傅传刚, 赵荣华. 五羟色胺在胃肠道功能性疾病中的研究现状[J]. 世界华人消化杂志, 2005(20): 2405-8. Ding J H, Fu C G, Zhao R H. Research status of serotonin in gastrointestinal functional diseases[J]. World Chin J Digestol, 2005(20): 2405-8. doi:10.3969/j.issn.1009-3079.2005.20.001 |
| [10] |
Aydin M, Canpolat S, Kuloglu T, et al. Effects of pinealectomy and exogenous melatonin on ghrelin and peptide YY in gastrointestinal system and neuropeptide Y in hypothalamic arcuate nucleus: immunohistochemical studies in male rats[J]. Regul Pept, 2008, 146(1-3): 197-203. doi:10.1016/j.regpep.2007.09.009 |
| [11] |
Cezary C, Tomasz P, Grazyna K, et al. Secretion of melatonin and 6-sulfatoxymelatonin urinary excretion in functional dyspepsia[J]. World J Gastroenterol, 2011, 17(21): 2646-51. doi:10.3748/wjg.v17.i21.2646 |
| [12] |
张卫卫.半夏厚朴汤及厚朴主要成分促胃肠运动、抗焦虑和抗抑郁作用的研究[D].沈阳: 中国医科大学, 2004. Zhang W W. Effect of Banxia-Houpo decoction, magnolol and honokiol on gastrointestinal movement, and their anxiolytic and antidepressant effects[D]. Shenyang: China Medical University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10159-2004081943.htm |
| [13] |
Armstrong D N, Krenz H K, Modlin I M, et al. Bile salt inhibition of motility in the isolated perfused rabbit terminal ileum[J]. Gut, 1993, 34(4): 483-8. doi:10.1136/gut.34.4.483 |
| [14] |
Camilleri M, Murphy R, Chadwick V S. Dose-related effects of chenode-oxycholic acid in the rabbit colon[J]. Dig Dis Sci, 1980, 25: 433-8. doi:10.1007/BF01395507 |
| [15] |
吐热娜依, 汪忠诚. 维生素B6对减轻阿奇霉素胃肠道不良反应的临床随机对照研究[J]. 中国实用医药, 2006(3): 64-5. Tu R N Y, Wang Z C. Clinical control study that vitamin B6 alleviate abserve reaction of gasreoin testing tract that azitromycin inititate[J]. China Practical Med, 2006(3): 64-5. doi:10.3969/j.issn.1673-7555.2006.03.044 |