


肺癌是世界上发病率和死亡率最高的恶性肿瘤[1]。钙离子与钙信号转导在肺癌发生中起重要作用,但其具体机制尚未阐明。钙敏感受体(calcium-sensing receptor,CaSR)是细胞膜上的一种G蛋白偶联受体[2],其在肿瘤的发生中发挥着重要作用,但CaSR在肺癌转移中的作用鲜有报道。我们前期研究发现,CaSR蛋白在人非小细胞肺癌组织中表达增强,其表达强度与肿瘤大小、肿瘤分化程度、TNM分期及淋巴结转移情况有关,提示在非小细胞肺癌中,CaSR的表达可能与肿瘤细胞的增殖及侵袭、转移密切相关[3]。为探究CaSR在肺癌转移中的具体机制,本实验以A549及A549/DDP细胞为研究对象进行研究,以期为肺癌的防治提供新的药物作用靶点。
1 材料与方法 1.1 细胞人肺腺癌细胞A549、耐顺铂人肺腺癌细胞A549/DDP,购于中国科学院上海生命科学研究院细胞资源中心。
1.2 试剂与仪器基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)ELISA试剂盒,购于美国R&D公司; Transwell小室,购于Corning公司; CaSR、MMP-2、Akt、p-Akt、GAPDH的一抗及二抗,均购于Santa Cruz公司; LY294002(PI3K/Akt通路抑制剂)、NPS2143(CaSR抑制剂)、GdCl3(CaSR激动剂),购于Sigma公司。缺氧培养箱及酶标仪(Thermo); 倒置显微镜(Olympus); DF-D型恒压恒流电泳仪(北京六一厂); 高速离心机(美国Sigma公司); 化学发光成像系统(上海天能科技有限公司)。
1.3 实验分组及缺氧模型的复制A549及A549/DDP细胞在37 ℃、5% CO2条件下,含10%胎牛血清和1%双抗的RPMI 1640培养基中培养,顺铂维持浓度为2 mg·L-1。将处于对数生长期的细胞随机进行分组。对照组(control):细胞无血清培养24 h后,正常培养箱无血清培养24 h; 缺氧组(H):细胞无血清培养24 h后,缺氧箱内无血清培养24 h(93% N2、2% O2、5% CO2); GdCl3干预组(H+Gd):细胞无血清培养24 h,加入GdCl3(300 μmol·L-1)后,缺氧箱内无血清培养24 h; NPS2143干预组(H+NPS):细胞无血清培养24 h,加入NPS2143(10 μmol·L-1)后,缺氧箱内无血清培养24 h; LY294002干预组(H+LY+Gd):细胞无血清培养24 h,加入LY294002(10 μmol·L-1)孵育30 min后,加入GdCl3(300 μmol·L-1),缺氧箱内无血清培养24 h[4]。
1.4 Western blot检测CaSR、MMP-2、Akt、p-Akt的蛋白水平各细胞组达到实验终点后,细胞刮下后,加入蛋白裂解液及PMSF,冰上孵育40 min,4 ℃、12 000 r·min-1离心20 min,上清进行蛋白定量。取20 μg蛋白样品,10% SDS-PAGE电泳,300 mA转移2 h至硝酸纤维素薄膜,封闭1 h; 分别加入一抗MMP-2、Akt、p-Akt、GAPDH(1 :500)4 ℃过夜。洗膜,二抗(1 :1 000)孵育1 h,显色发光,吸光度扫描,半定量分析显影条带[5-7]。
1.5 ELISA法检测MMP-2含量收集各组细胞上清液,1 500 r·min-1离心10 min,取上清液1 mL待测。实验步骤按ELISA试剂盒说明书进行。所有标本均进行3个复孔检测,并为同批测定,均值为终质量浓度。分别以标准物的质量浓度及450 nm波长的吸光度(A)值为横纵坐标,在半对数坐标纸上绘出标准曲线。在坐标曲线上通过样品A值,查出相应的样品质量浓度(μg·L-1)[8]。
1.6 Transwell小室检测细胞侵袭情况按照基质胶:DMEM=1 :29比例稀释后,向上室铺基质胶。细胞分组同“1.3”,各组细胞分别离心后用无血清培养基重悬,调整细胞悬液浓度1.0×109·L-1种于上室,下室加入含有10% FBS的完全培养基600 μL,按照分组情况,分别于上室内加药后置于常氧及缺氧箱内培养24 h; 将上室取出,用棉签擦去上室内未迁移的细胞,PBS冲洗2次; 甲醇固定上室细胞20 min; PBS冲洗2次,适当风干后,0.5%结晶紫染色20 min,PBS冲洗2次,风干。倒置显微镜高倍镜下任意选取5个不相同的视野,拍照并计数细胞[9]。
1.7 划痕实验检测细胞迁移情况细胞分组同“1.3”。取2块6孔板,用marker笔分别在每块板背面划横线,每隔0.5~1 cm划一道,横穿过孔,每孔至少穿过5条线。每孔加入约5×105个细胞,以过夜能铺满为标准,细胞贴壁后去血清24 h。次日用200 μL的枪头比着直尺,垂至于背后的横线划痕。PBS冲洗3次,去除划下的细胞,按分组情况分别处理及加药,其中一块板置于正常培养箱内,另一块板置于缺氧箱内,分别培养24 h。取样,拍照[10]。分别测量0 h和24 h的划痕宽度,迁移距离=0 h的划痕宽度-24 h的划痕宽度。
1.8 统计学处理采用GraphPad Prism 5.0软件作图,统计学处理使用SPSS 17.0软件。数据以x±s表示,多组间均数比较采用单因素方差分析,两两比较采用SNK-q检验。
2 结果 2.1 不同处理因素对CaSR表达的影响如Fig 1所示,与对照组比较,H组CaSR表达增加(P < 0.05);与H组比较,GdCl3能增加CaSR表达(P < 0.05),CaSR抑制剂NPS2143的作用相反,A549/DDP细胞CaSR蛋白表达结果与A549细胞一致。

|
| Fig 1 The protein expression of CaSR determined by Western blot in different groups of A549 and A549/DDP cells(x±s, n=3) H: hypoxia, NPS: NPS2143.*P < 0.05 vs control group; #P < 0.05 vs H group. |
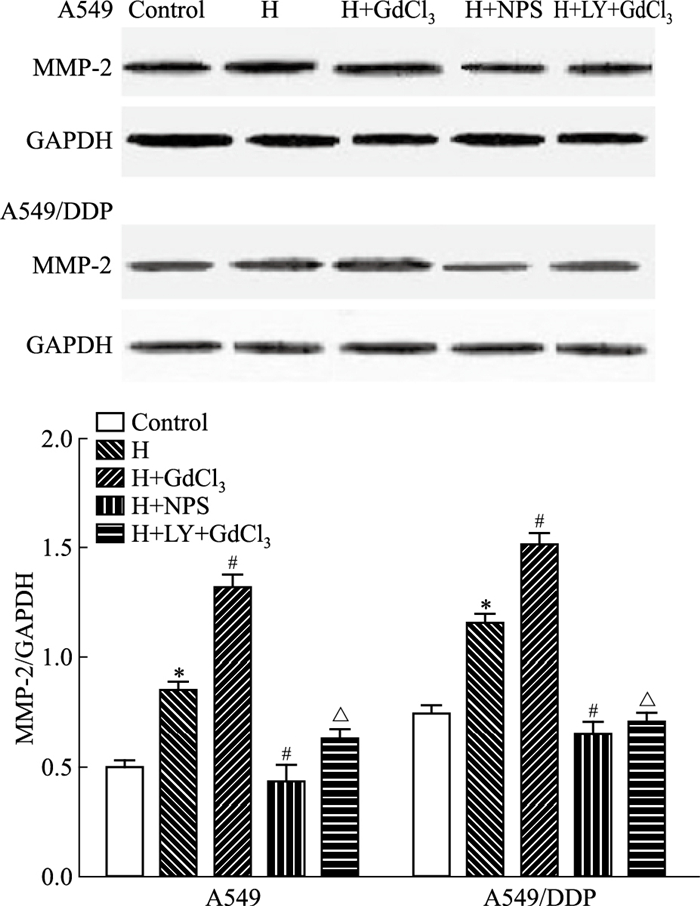
如Fig 2所示,与对照组比较,H组MMP-2蛋白表达增加(P < 0.05);与H组比较,缺氧基础上GdCl3和NPS2143分别能上调和下调这种作用(P < 0.05);与H+GdCl3组比较,LY294002能够抑制MMP-2蛋白的表达上调(P < 0.05),A549/DDP细胞MMP-2的变化趋势与A549细胞一致。
|
| Fig 2 The protein levels of MMP-2 in A549 and A549/DDP cells determined by Western blot(x±s, n=3) H: hypoxia; NPS:NPS2143; LY: LY294002.*P < 0.05 vs control group; #P < 0.05 vs H group; △P < 0.05 vs H+GdCl3 group. |
2种细胞Western blot检测结果显示(Fig 3),与对照组比较,缺氧能够上调Akt蛋白磷酸化水平(P < 0.05);与H组比较,缺氧基础上GdCl3能够进一步增加其磷酸化的水平(P < 0.05);与H+GdCl3比较,这种促进效应可以被PI3K通路阻断剂LY294002抑制(P < 0.05);NPS2143则与GdCl3作用相反。

|
| Fig 3 The protein levels of p-Akt in A549 and A549/DDP cells determined by Western blot(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs H group; △P < 0.05 vs H+GdCl3 group |
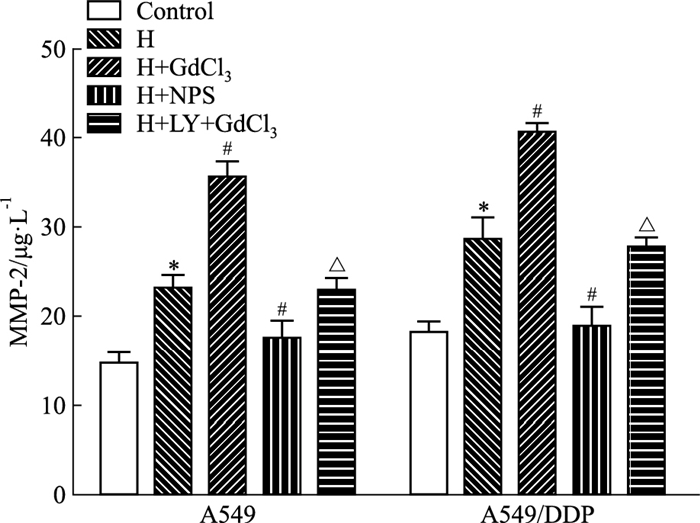
如Fig 4所示,H组A549及A549/DDP细胞上清液中的MMP-2蛋白浓度高于对照组(P < 0.05),但却明显低于H+GdCl3组(P < 0.05),而缺氧和GdCl3的作用可被PI3K抑制剂LY294002所抑制(P < 0.05),NPS2143则与GdCl3作用相反。
|
| Fig 4 Level of MMP-2 in A549 and A549/DDP cell cultured media determined by ELISA(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs H group; △P < 0.05 vs H+GdCl3 group |
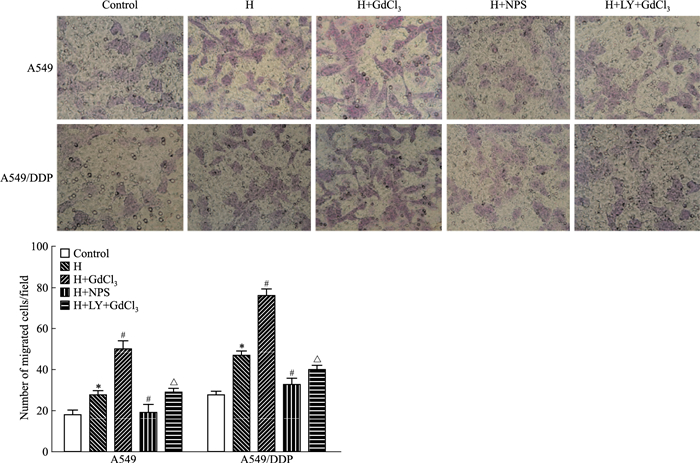
Transwell结果显示(Fig 5),在A549及A549/DDP细胞,与对照组比较,H组平均每个高倍(400倍)视野穿过滤膜的细胞数明显增加(P < 0.05),提示缺氧可明显增加A549细胞的运动侵袭能力。缺氧基础上NPS2143能抑制A549细胞侵袭,GdCl3能促进其侵袭(P < 0.05),但这种促进作用可被LY294002阻断(P < 0.05)。
|
| Fig 5 The invasion ability analysis by transwell migration assay in A549 and A549/DDP cells(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs H group; △P < 0.05 vs H+GdCl3 group |
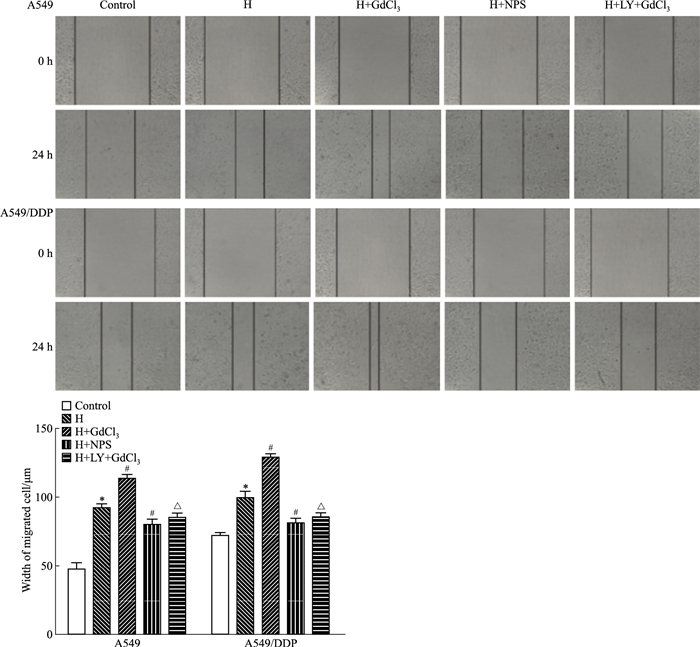
如Fig 6所示,在A549细胞H组较对照组迁移距离增加(P < 0.05);与H组比较,NPS2143抑制细胞迁移(P < 0.05),GdCl3能促进A549细胞的迁移(P < 0.05),而PI3K抑制剂LY294002则可抑制GdCl3的作用(P < 0.05),A549/DDP细胞迁移的变化趋势与A549细胞一致。
|
| Fig 6 Width of migrated cell determined by wound scratch assay in different groups of A549 and A549/DDP cells(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs H group; △P < 0.05 vs H+GdCl3 group |
侵袭和转移是临床上恶性肿瘤患者治疗失败和死亡的主要原因,因此,揭示恶性肿瘤转移的机制,将有助于判断患者预后和选择合理、有效的治疗方案, 延长患者的生存期限及提高生活质量。目前,我国已为世界第一肺癌大国,因此肺癌的诊疗已成为我国临床工作者面临的严峻挑战。钙离子作为细胞内重要的信息分子,可以激活不同的信号通路,参与许多重要生命活动的调节。恶性肿瘤发生、发展过程常伴随钙离子信号的异常,但其发生机制不甚清楚。因此,认识钙信号在肺癌发生、发展中的作用,对于进一步揭示肺癌发生的分子机制,改善患者预后,提高其生存质量有重要意义。
CaSR是G蛋白偶联受体C家族成员之一。Brown等[2]于1993年首先从牛的甲状旁腺中克隆出CaSR。CaSR在维持全身钙的平衡系统中具有重要作用,此外,还可参与细胞增殖、分化、分泌、趋化、凋亡、基因表达、离子通道开关、维持膜电位、衰老等过程。大量研究表明,CaSR在肿瘤的发生、发展过程中发挥重要作用。CaSR是影响乳腺癌预后的独立风险因子[11-12]。本课题组前期研究发现,CaSR蛋白在非小细胞肺癌组织中表达增强,其表达强度与肿瘤大小、肿瘤分化程度、TNM分期及淋巴结转移情况密切相关,提示在非小细胞肺癌中CaSR的表达或活化可能与肿瘤细胞的增殖及侵袭、转移相关[3]。但其具体发生机制如何,目前尚无相关报道。
众所周知,实质性肿瘤细胞物理微环境的基本特征之一是缺氧,缺氧可活化多种细胞膜上的CaSR[13]。研究中,我们观察到缺氧能够上调A549及A549/DDP细胞CaSR蛋白的表达,在此基础上,GdCl3能够进一步加强CaSR的表达,而CaSR抑制剂NPS2143能减弱CaSR的表达,说明缺氧能够活化A549及A549/DDP细胞的CaSR。
Brennan等[14]研究表明,激活的CaSR能够促进乳腺癌及前列腺癌骨转移的发生。新近研究揭示,CaSR在体内和体外促进肾细胞癌的骨转移进程[15]。本研究结果显示,缺氧促进A549及A549/DDP细胞迁移距离,增加穿过滤膜细胞数量和侵袭能力。上述这些作用能够被CaSR激动剂GdCl3所增强,被CaSR激动剂NPS2143所抑制,提示缺氧活化的CaSR可能参与了A549及A549/DDP细胞的迁移和侵袭过程。
基底膜或细胞外基质的降解是肿瘤浸润转移的重要环节,MMP-2和MMP-9能有效降解基底膜或细胞外基质,在肿瘤的浸润和转移灶的形成过程中起重要作用。本研究显示,缺氧组A549及A549/DDP细胞MMP-2蛋白表达增多,同时分泌到培养液中的MMP-2蛋白浓度增加,GdCl3能上调缺氧的这种效应,NPS2143作用相反。说明缺氧活化的CaSR可能通过促进A549及A549/DDP细胞MMP-2蛋白的表达,进而促进A549及A549/DDP细胞的侵袭和转移的进程。
PI3K/Akt通路是肿瘤细胞侵袭转移的经典信号途径之一,为进一步探索PI3K/Akt通路在缺氧活化CaSR促进A549细胞侵袭的作用,我们选用了PI3K信号通路的抑制剂LY294002进行实验。结果显示,LY294002能够减弱GdCl3所引起的细胞侵袭效应,表现为细胞迁移距离减少,穿过滤膜细胞的数量减少; 蛋白检测结果显示,缺氧能够增加Akt蛋白磷酸化水平,GdCl3能增强缺氧的作用,但该作用被LY294002所减弱。这些结果均提示,PI3K/Akt信号通路在缺氧活化CaSR促进A549及A549/DDP细胞侵袭中起重要作用。
( 致谢: 本实验在齐齐哈尔医学院基础医学院分子生物学实验室完成,感谢课题组成员的支持和协助。)
| [1] |
Parkin D M, Bray F, Ferlay J, et al. Global cancer statistics[J]. 2002, CA Cancer J Clin, 2005, 55(2):74-108.https://seer.cancer.gov/statfacts/html/vulva.html.
|
| [2] |
Brown E M, Gamba G, Riccardi D, et al. Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid[J]. Nature, 1993, 366(6455): 575-80. doi:10.1038/366575a0 |
| [3] |
崔恺麟, 吴冰霞, 李波, 等. 钙敏感受体在非小细胞肺癌中的表达及临床病理意义[J]. 中国医药导报, 2015, 1(12): 27-9. Cui K L, Wu B X, Li B, et al. Expression and clinicopathologic significance of calcium sensing receptor in non-small cell lung cancer[J]. China Med Herald, 2015, 1(12): 27-9. |
| [4] |
李光伟, 苗宏志, 李波, 等. 钙敏感受体通过PI3K/AKT通路对缺氧诱导的A549细胞增殖的影响[J]. 中国病理生理杂志, 2017, 33(3): 505-9. Li G W, Miao H Z, Li B, et al. Calcium-sensing receptor mediates hypoxia-induced proliferation of A549 cells through PI3K/AKT pathway[J]. Chin J Pathophysiol, 2017, 33(3): 505-9. doi:10.3969/j.issn.1000-4718.2017.03.020 |
| [5] |
林琴, 贾金雪, 王涛, 等. 抑制NF-κB的活化对免疫性肝损伤大鼠CYP1A2的影响[J]. 中国药理学通报, 2018, 34(11): 1605-9. Lin Q, Jia J X, Wang T, et al. Effect of blunted NF-κB activation on CYP1A2 in immunological liver injury rats[J]. Chin Pharmacol Bull, 2018, 34(11): 1605-9. doi:10.3969/j.issn.1001-1978.2018.11.025 |
| [6] |
林岩, 肖薇, 李波, 等. 二氟甲基鸟氨酸对异丙肾上腺素诱导的心肌细胞肥大与凋亡的影响[J]. 中国药理学通报, 2015, 31(5): 668-72. Lin Y, Xiao W, Li B, et al. Effect of difluoromethyl ornithine on myocardial hypertrophy and apoptosis induced by isoproterenol[J]. Chin Pharmacol Bull, 2015, 31(5): 668-72. doi:10.3969/j.issn.1001-1978.2015.05.016 |
| [7] |
孙军, 温昌明, 张保朝, 等. 槲皮素通过调控PI3K/AKT信号通路对血管内皮祖细胞发挥保护作用[J]. 中国药理学通报, 2019, 35(1): 85-90. Sun J, Wen C M, Zhang B C, et al. The protective effect of quercetion on vascular endothelial progenitor cells by refulating PI3K/AKT signal pathway and its mechanisms[J]. Chin Pharmacol Bull, 2019, 35(1): 85-90. doi:10.3969/j.issn.1001-1978.2019.01.017 |
| [8] |
Han M L, Zhao Y F, Tan C H, et al. Cathepsin L upregulation-induced EMT phenotype is associated with the acquisition of cisplatin or paclitaxel resistance in A549 cells[J]. Acta Pharmacol Sin, 2016, 37: 1606-22. doi:10.1038/aps.2016.93 |
| [9] |
Zhang L, Chang L, Jin H, et al. Benzopyrene promotes lung cancer A549 cell migration andinvasion through up-regulating cytokine IL-8 and chemokines CCL2 and CCL3 expression[J]. Exp Biol Med, 2016, 241(8): 1516-23. |
| [10] |
Yuan Y, Zheng S, Li Q, et al. Overexpression of miR-30a in lung adenocarcinoma A549 cell line inhibits migration and invasion via targeting EYA2[J]. Acta Biochim Biophys Sin, 2016, 48(3): 220-8. doi:10.1093/abbs/gmv139 |
| [11] |
Vanhouten J N, Wysolmerski J J. The calcium-sensing receptor in the breast[J]. Best Pract Res Clin Endocrinol Metab, 2013, 27(3): 403-14. doi:10.1016/j.beem.2013.02.011 |
| [12] |
Li X, Li L, Moran M S, et al. Prognostic significance of calcium-sensing receptor in breast cancer[J]. Tumour Biol, 2014, 35(6): 5709-15. doi:10.1007/s13277-014-1756-9 |
| [13] |
Peng X, Li H X, Shao H J, et al. Involvement of calcium-sensing receptors in hypoxia-induced vascular remodeling and pulmonary hypertension by promoting phenotypic modulation of small pulmonary arteries[J]. Mol Cell Biochem, 2014, 396(1-2): 87-98. doi:10.1007/s11010-014-2145-9 |
| [14] |
Brennan S C, Thiem U, Roth S, et al. Calcium sensing receptor signalling in physiology and cancer[J]. Biochim Biophys Acta, 2013, 1833: 1732-44. doi:10.1016/j.bbamcr.2012.12.011 |
| [15] |
Frees S, Breuksch I, Haber T, et al. Calcium-sensing receptor(CaSR) promotes development of bone metastasis in renal cell carcinoma[J]. Oncotarget, 2018, 9(21): 15766-79. |

