

杜冠华(1956-),男,博士,研究员,博士生导师,研究方向:神经药理学与新药发现,通讯作者,E-mail: dugh@imm.ac.cn
脑卒中是一种高发病率、高致残率、高致死率疾病。根据2017年《Circulation》最新发表的中国脑卒中流行病学资料显示,中国脑卒中年龄标准化患病率、发病率和死亡率分别为每10万人1114.8、246.8和114.8。中国因脑卒中导致的家庭和社会负担在过去30年中明显增加,尤其在农村地区,并具有持续增加趋势[1]。我国目前脑卒中防控形势严峻。脑卒中临床上分为缺血性脑卒中、出血性脑卒中和短暂性脑缺血,其中缺血性脑卒中占比87%,是脑卒中主要类型[2]。
缺血性脑卒中治疗核心是及时通过药物以及手术恢复缺血区域血流再灌注。再灌注虽然有助于挽救半暗带濒死细胞,但会触发一系列继发反应,加重缺血脑组织损伤。显然,最终的脑组织损伤程度取决于缺血本身损伤与再灌注损伤两方面的综合作用。目前,临床上尚缺乏理想的治疗缺血性脑卒中药物,唯一被FDA批准的治疗急性缺血性脑卒中的药物仅有重组组织型纤溶酶原激活剂(recombinant tissue-type plasminogen activator,rt-PA)。更值得注意的是,抗缺血性脑卒中药物的研发屡屡受挫[3]。总之,缺血性脑卒中已经成为国人主要致死因素,尚缺乏合理防控措施与治疗药物,深入了解缺血性脑卒中病理生理机制,对开发相关药物具有重要意义。
线粒体相关内质网膜(mitochondria-associated endoplasmic reticulum membranes,MAM)是介导内质网(endoplasmic reticulum,ER)与线粒体之间紧密连接的特殊结构域,构成ER和线粒体细胞器之间的通讯物理基础。大量的证据表明,线粒体与ER通过MAM直接通讯,以调控Ca2+稳态、氧化应激、炎症反应、线粒体形态功能、脂质代谢、细胞凋亡、自噬等基本细胞过程[4]。从缺血性脑卒中的病理生理机制来看,MAM介入该病发生发展的多个环节,如线粒体功能障碍、Ca2+超载、氧化应激、炎症、细胞凋亡等。目前,虽然直接证明MAM在缺血性脑卒中损伤过程中扮演重要角色的文献相对较少,但是有关MAM相关蛋白参与缺血性脑卒中病理生理过程的研究却屡见不鲜。本文就MAM作为抗缺血性脑卒中潜在靶点的可能性做一综述。
1 MAM是线粒体与内质网互作平台内质网和线粒体之间的关联,亦称为线粒体-内质网接触(mitochondrial endoplasmic reticulum contact,MERC),是最先被发现的细胞器间接触。MAM被认为是ER膜与线粒体外膜之间相互靠近形成的特化区域。通过“募集”多种蛋白,如电压依赖性阴离子通道(voltage dependent anion channels,VDACs)、1, 4, 5-三磷酸肌醇受体(inositol 1, 4, 5-triphosphate receptor,IP3R)、葡萄糖调节蛋白75(glucose regulated protein,GRP75)、囊泡相关膜蛋白相关蛋白B(vesicle-associated membrane protein-associated protein B,VAPB)、线粒体融合蛋白1/2(mitofusin1/2,Mfn1/2)等,构成细胞器之间相互通讯的物理平台,以实现ER与线粒体功能的正常维持与相互协作,这对保证细胞生命活动至关重要。
研究表明,MAM介导的线粒体-内质网连接是动态可逆的,涉及多种蛋白的“募集”与“解聚”,并且MAM的形成面积与其连接的线粒体-内质网膜间距会随着细胞状态不同在5%~20%、10~30 nm的范围波动。然而,MAM的组成蛋白却在不同物种(人和小鼠96.56 %)之间,在不同组织(睾丸和大脑70.98%)之间高度保守[5]。目前几个科研小组已经提出MAM中基于功能的详细的蛋白质列表。由于研究对象与研究方法不同,MAM蛋白数量有稍许变化[5]。总体来说,MAM蛋白分为以下3类:(1)仅存在于MAM中的蛋白,“MAM专有蛋白”; 通常被作为MAM标记蛋白,如乙酰辅A乙酰转移酶1(acetyl-CoA acetyltransferase 1,ACAT1)、BiP/GRP78、钙联蛋白(calnexin)、钙网蛋白(calreticulin)、Erlin-1、Erlin-2、VDACs。(2)主要存在于MAM中,同时在其他细胞器中也有分布的蛋白,“MAM富集蛋白”,如高尔基体、溶酶体蛋白。(3)暂存于MAM中的蛋白,“MAM关联蛋白”。多种报道所得结论一致,MAM相关蛋白参与能量代谢、脂质合成、Ca2+稳态调节、线粒体功能维持,并且参与上述相关过程的蛋白大多属于“MAM专有蛋白”[6]。另外,MAM中的一些蛋白具有多种功能,参与不同细胞过程。例如Bip/GRP78既是蛋白分子伴侣,同时也可以与IP3R结合,调节Ca2+从MAM到线粒体的转运。总之,MAM蛋白组成具有复杂性、多功能性以及动态性,这为MAM参与多种病理过程创造了条件。
目前,内质网膜与线粒体外膜相互靠近形成MAM的机制尚不清楚。在哺乳动物中,研究者们发现了4种可能介导MAM形成的蛋白锚定复合物。(1)GRP75将ER膜上IP3R和线粒体外膜VDAC连接构成的锚定复合物。(2)ER膜上Mfn2与线粒体外膜上Mfn1/2锚定复合物,但是有来自3个不同实验室的研究显示,Mfn2的丢失反而导致MAM形成面积增加,这一发现使研究者对其作为锚定复合物的“身份”产生质疑[7]。(3)ER膜上VAPB与线粒体外膜上蛋白酪氨酸磷酸酶相互作用蛋白51(protein tyrosine phosphatase interacting protein 51,PTPIP51)锚定复合物,VAPB和PTPIP51之间的生物化学相互作用已被独立验证。(4)ER上B细胞受体相关蛋白31(B-cell receptor-associated protein 31,Bap31)与线粒体裂变蛋白Fission1同系物(Fission 1 homologue,Fis1)锚定复合物。另外,磷酸弗林蛋白酶酸性氨基酸簇分选蛋白2(phosphofurin acidic cluster sorting protein 2, ,PACS2)和Bap31复合物与MAM形成相关,但是该复合物是锚定复合物还是锚定调节因子,还需要进一步的研究验证。锚定复合物将线粒体和ER限制在合适的距离,以便发挥MAM功能[6]。
2 MAM参与缺血性脑卒中病理进程 2.1 Ca2+稳态Ca2+稳态是细胞中多种生化反应正常进行的基础。Ca2+信号起源于ER,主要作用于线粒体,调节多种细胞过程,是跨细胞器信息交流的主要方式[8]。线粒体在缓冲胞质Ca2+、调节分泌、维持机体稳态、细胞代谢、细胞存活、增殖、迁移和死亡等方面,起着至关重要的作用。线粒体摄取Ca2+深度依赖MAM介导的ER和线粒体紧密结合。MAM于内质网-线粒体之间形成“高钙微区”,尤其IP3R/Grp75/VDAC构成“Ca2+高速通道”,允许线粒体通过内膜上低Ca2+亲和力的Ca2+单向转运体(mitochondrial Ca2+ uniporter,MCU)迅速摄取Ca2+。在线粒体中,Ca2+信号根据其时空特性被解码,构成促生存信号,精确调节细胞代谢。反之,Ca2+稳态失调引起Ca2+超载,Ca2+信号异常进而导致细胞凋亡。线粒体基质Ca2+高浓度长时间累积,会引起线粒体通透性转换(mitochondrial permeability transition,MPT)。MPT引起线粒体内膜渗透性丧失,线粒体膜电位降低,ATP耗竭,线粒体外膜和细胞器破裂,最终导致细胞死亡。这种机制在病理性细胞死亡中已被广泛研究,特别是与局部缺血和再灌注损伤有关的细胞死亡。MAM功能障碍会破坏线粒体对Ca2+的缓冲能力和细胞整体Ca2+稳态,对细胞命运产生重要影响[9]。
2.2 氧化应激在生理情况下,机体自由基生成与体内抗氧化防御系统处于动态平衡之中。各种原因导致体内自由基超出正常水平则会引起氧化应激。线粒体是产生自由基的主要场所。与线粒体相比,ER在自由基产生方面研究较少,部分原因是由于测定方法的限制。在ER中,来自细胞色素P450家族的蛋白质,NADPH氧化酶4(NADPH oxidase 4,Nox4)和内质网氧化还原蛋白(ER oxidoreductin 1,Ero1)都是被广泛认可的自由基产生蛋白。MAM由于是介导线粒体与ER信息传递的动态结构,所以非常有可能在调节自由基生成方面发挥作用。另外,研究发现,75% Ero1的异形体Ero1-α定位于MAM[10]。MAM蛋白p66SHC在氧化应激条件下被激活,并移位于线粒体活性氧簇(reactive oxygen species,ROS)产生部位[11]。在缺血性脑卒中病理过程中,多篇文献报道了过量自由基在导致脑组织结构和功能损伤中的重要作用。在缺血刺激以及再灌注刺激时,细胞内产生过量自由基并长时间积累,损伤线粒体,导致功能障碍,引起细胞凋亡和坏死。
2.3 炎症反应MAM是炎症小体形成的关键位点[12]。几年前,研究者认识到ROS可以促进激活NLRP3炎症小体。NLRP3可以感知来自外来微生物的损伤信号、宿主的损伤信号和任何其他侵害信号,诱导炎症反应发生。NLRP3炎症小体一旦组装完成,则激活白介素1β((interleukin-1β,IL-1β)和IL-18,引起炎症反应。迄今为止,NLRP3是唯一一个被报道与MAM相关的炎症小体[13]。NLRP3在大多数组织中表达,但主要集中于巨噬细胞中。未激活的NLRP3定位于ER膜和胞质,被激活时,NLRP3及其衔接子ASC重新定位至MAM部分,感知线粒体Ca2+、ROS[13]等信号。最近,有许多研究者关注其他炎症小体动态定位以及激活机制,并发现内质网应激特异性上调NLRP1。所有这些数据都说明了MAM在引起炎症反应中的重要性。然而,炎症反应是造成缺血性脑卒中晚期损伤的典型事件,Ca2+、ROS炎症等共同参与该病的病理生理过程。
2.4 线粒体的分裂与融合线粒体的分裂与融合是线粒体形态调控的基本方式,也是线粒体数目调控的基础。线粒体分裂与融合的平衡对细胞存活至关重要。线粒体分裂起源于MAM。Mfn1和Mfn2在MAM高度富集,并且Mfn1和Mfn2是促使线粒体融合,保持线粒体正常形态,线粒体摄取Ca2+必不可少的要素。MAM可能是调节线粒体动力学和形态学所必需的[4]。线粒体分裂与融合状态与线粒体功能高度统一。在缺血性脑卒中损伤早期,神经细胞线粒体分裂与融合失调导致神经细胞死亡。
2.5 脂质代谢细胞与细胞器膜上脂质对维持膜的完整性和流动性非常重要,膜脂质成分与各成分所占比重被精确控制。研究表明,MAM与脂质在内质网-线粒体之间的转运与代谢密切相关[14]。MAM介导甘油三酯、磷脂酰胆碱和磷脂酰乙醇胺(phosphatidylethanolamine,PE)等脂质合成和转运。磷脂酰丝氨酸合成酶(phosphatidylserine synthetase,PSS)催化磷脂酰胆碱合成磷脂酰丝氨酸(phosphatidylserine,PS)。经MAM转运,PS在线粒体内膜上磷脂酰丝氨酸脱羧酶的作用下,转化为PE。PS合成酶PSS1/2于MAM高度富集。另外,催化磷脂酰胆碱最终合成的磷脂酰乙醇胺N-甲基转移酶2(phosphatidylethanolamine N-methyltransferase 2,PEMT2)仅于MAM发现。催化三酰甘油合成,促进脂滴形成的酰基辅酶A/二酰甘油酰基转移酶2(diacylglycerol O-acyltransferase 2,DGAT2)位于MAM。脂肪酸辅酶A连接酶4(fatty acid-CoA ligase 4,FACL4)等脂质代谢酶作为MAM标志物。MAM富集脂质代谢酶以及介导脂质在ER和线粒体之间转运的特性,使MAM在维持脂质正常代谢中发挥重要作用。脂质含量丰富是脑组织的生化特征之一。在缺血性脑卒中的病理过程中,细胞膜脂质在氧化应激的状态下导致脂质过氧化,破坏细胞膜,是引起神经细胞功能障碍甚至死亡的重要因素。
2.6 细胞凋亡细胞凋亡是指机体为维持内环境稳定,触发细胞内预存基因导致的细胞死亡过程。基于MAM对内质网-线粒体之间Ca2+信号的调节作用,MAM与细胞凋亡密切相关是意料之中的。研究表明,细胞凋亡与MAM介导的Ca2+超载密切相关,其中MAM相关蛋白VDAC在MPT现象和细胞凋亡中起到关键作用,VDAC的过表达会导致各种细胞类型的凋亡。MAM转运Ca2+功能的过度激活,导致线粒体Ca2+超载,激活线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)而促进细胞凋亡[15]。MAM与细胞凋亡的关系复杂,其通过调节线粒体的融合与分裂、Ca2+稳态、ROS水平,都可以影响细胞凋亡。细胞凋亡正是缺血性脑卒中神经细胞死亡的主要类型[3]。
2.7 自噬自噬是为了维持细胞自身代谢以及更新衰老受损细胞器,通过溶酶体降解细胞器和大分子物质的过程。自噬维持细胞内稳态,也是细胞极端情况下的自我生存机制。自噬膜的起源目前没有确证,线粒体外膜、质膜都被认为是自噬膜的起源部位。最新研究发现,MAM是自噬膜的起源部位,在自噬起始过程中起关键作用。在诱导细胞自噬时,自噬发生过程中的关键蛋白,如Atg5、Atg14、DFCP、Beclin-1、Vps15、Vps34,定位于MAM,并且在整个自噬体形成过程中定位稳定。当MAM被破坏时,Atg14标记消失,自噬小体数量减少。自噬负调节因子mTORC2激酶定位于MAM,调节MAM的完整性和线粒体活性。自噬基本过程维持,如LC3-I脂质化成LC3-Ⅱ和将calnexin募集到含有GD-3的筏状微区,取决于MAM功能的完整性[16]。另外,在酵母中,当内质网-线粒体偶联结构(ER-mitochondria encounter structure,ERMES)缺陷时,线粒体自噬会急剧降低。这些研究结果都说明了MAM招募自噬相关蛋白并启动自噬的重要功能。同时,自噬是缺血性脑卒中神经细胞死亡的又一类型。
3 缺血性脑卒中的潜在治疗靶点—MAM在过去的几十年研究中,研究者发现多种机制参与缺血性脑卒中的不可逆损伤。兴奋性毒性与钙超载是引起早期阶段细胞死亡的主要因素。其中,兴奋性毒性主要导致缺血性细胞内钙超载,通过线粒体途径引起细胞凋亡。同时钙超载可同时引起氧化应激,作为触发细胞死亡的额外机制。氧化和亚硝化应激也是损伤的强有力推动者。炎症反应在局部缺血发生的几个小时内发生,是缺血性脑卒中晚期损伤的典型事件。在温和损伤的条件下,也就是研究者关注的半暗带,凋亡机制占主要部分。总之缺血性脑卒中是一种多因素、多机制的复杂疾病[3]。
有趣的是,MAM介导的生物学功能与缺血性脑卒中病理生理机制存在高度重叠。研究发现,通过干预MAM锚定蛋白复合物VDAC/IP3R/GRP75对Ca2+的转运,抑制Ca2+超载,进而抑制mPTP的开放和线粒体内的细胞色素C释放,保护半暗带损伤神经细胞[15]; MAM蛋白Mfn2通过线粒体途径,改善缺氧诱导的神经细胞凋亡,延长缺血性脑卒中治疗时间窗[17]; 在小鼠大脑中动脉闭塞模型中,缺血后沉默MAM相关蛋白p66Shc,可保护血脑屏障完整性,减小梗死面积,改善神经功能缺损,提高小鼠存活率[18]; MAM蛋白FUNDC1、calnexin、DRP1协同作用,抑制缺氧神经细胞线粒体裂变和线粒体自噬的发生[19]; 多种MAM相关蛋白参与mPTP组成,并可能直接调节其开放和关闭[20],而mPTP开放是缺血/再灌注期间神经细胞死亡的重要标志。
另一方面,多种具有明确抗脑卒中作用的药物或化合物,被证实通过MAM相关蛋白发挥作用。胡黄连苷Ⅱ通过下调VDAC1的表达,降低mPTP的通透性以及抑制凋亡[21],减轻脑缺血/再灌注损伤[22]; 青藤碱抑制NLRP3炎症小体激活,发挥抗缺血性脑卒中的神经保护作用[23]; 多不饱和脂肪酸可以通过影响MAM蛋白PSS1,减少新生儿缺氧缺血性脑损伤[24]; 2-甲硫腺苷5'二磷酸通过IP3R调节Ca2+稳态,减少并部分逆转缺血性脑卒中神经元损伤,并且小鼠敲除IP3R后,化合物保护作用消失甚至损伤加重,这表明IP3R-Ca2+信号通路是发挥神经保护的关键组分[25]。
综上所述,MAM可以从多个环节、多个方面参与缺血性脑卒中病理过程,这为MAM作为治疗缺血性脑卒中的潜在靶点提供了可靠依据。
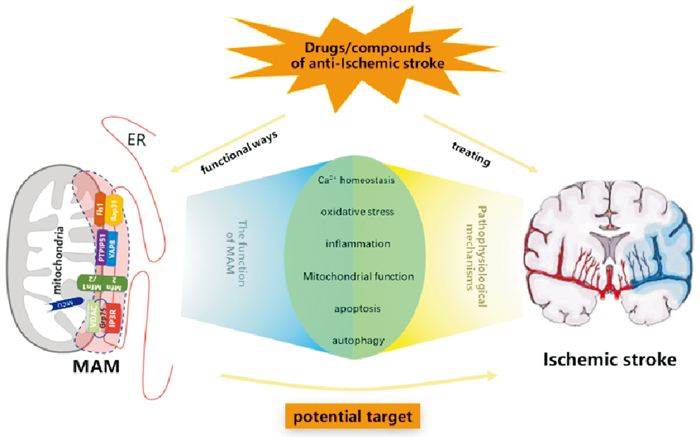
|
| Fig 1 MAM as a potential target for ischemic stroke |
ER和线粒体都是执行多种细胞功能的细胞器, 它们之间信号转导和功能协调影响整个细胞生命过程。MAM作为内质网-线粒体通讯的“偶联”平台,可以通过整合Ca2+稳态、氧化应激、炎症、线粒体形态功能调控、脂质代谢、细胞凋亡、自噬等多种途径,影响线粒体和ER的形态功能,进而决定细胞命运。如前文所述,从机制分析,MAM功能与缺血性脑卒中病理生理机制存在高度重叠。另一方面,多种已知具有抗脑卒中作用的药物或者化合物,如胡黄连苷Ⅱ、2-甲硫腺苷5'二磷酸、青藤碱、多不饱和脂肪酸,都通过调控MAM相关蛋白发挥作用,这都提示我们MAM具有作为治疗缺血性脑卒中治疗靶点的巨大潜力。要明确MAM与缺血性脑卒中的关系,研究者首先需要验证缺血性脑卒中患者的MAM水平是否异常,比如MAM形成面积增加或者线粒体-内质网膜间距变小。研究MAM面临的一大难题便是如何对MAM的变化进行全方位量化评价。MAM组成的复杂性、功能的多样性以及动态性,决定了量化MAM水平变化的困难性。研究者需要抽丝剥茧,分清主次,找出关键指征,为临床应用做铺垫。总之,MAM仍有许多问题有待阐明,研究MAM对探寻缺血性脑卒中等复杂性疾病的治疗靶点具有重要意义。
| [1] |
Wang W, Jiang B, Sun H, et al. Prevalence, incidence, and mortality of stroke in china clinical perspective: results from a nationwide population-based survey of 480687 adults[J]. Circulation, 2017, 135(8): 759. doi:10.1161/CIRCULATIONAHA.116.025250 |
| [2] |
Members W G, Mozaffarian D, Benjamin E J. American Heart Association Statistics Committee; Stroke Statistics Subcommittee:Heart Disease and Stroke Statistics-2016 update: a report from the American Heart Association[J]. Circulation, 2016, 133(4): e38-60. |
| [3] |
杜冠华, 张雯, 杜立达, 等. 抗脑缺血药物研发现状分析与策略研究[J]. 神经药理学报, 2018, 8(1): 1-8. Du G H, Zhang W, Du L D, et al. Analysis and strategy research on the development of anticerebral ischemia drugs[J]. Acta Neuropharmaco, 2018, 8(1): 1-8. doi:10.3969/j.issn.2095-1396.2018.01.001 |
| [4] |
Rowland A A, Voeltz G K. Endoplasmic reticulum-mitochondria contacts: function of the junction[J]. Nat Rev Mol Cell Biol, 2012, 13(10): 607-25. doi:10.1038/nrm3440 |
| [5] |
Wang X, Wen Y, Dong J, et al. Systematic in-depth proteomic analysis of mitochondria-associated endoplasmic reticulum membranes (MAM) in mouse and human testes[J]. Proteomics, 2018, 18(14): e1700478. doi:10.1002/pmic.v18.14 |
| [6] |
Janikiewicz J, Szymański J, Malinska D, et al. Mitochondria-associated membranes in aging and senescence: structure, function, and dynamics[J]. Cell Death Dis, 2018, 9(3): 332. doi:10.1038/s41419-017-0105-5 |
| [7] |
Filadi R, Greotti E, Turacchio G, et al. Mitofusin 2 ablation increases endoplasmic reticulum-mitochondria coupling[J]. Proc Natl Acad Sci USA, 2015, 112(17): E2174. doi:10.1073/pnas.1504880112 |
| [8] |
Kerkhofs M, Bittremieux M, Morciano G, et al. Emerging molecular mechanisms in chemotherapy: Ca2+ signaling at the mitochondria-associated endoplasmic reticulum membranes[J]. Cell Death Dis, 2018, 9(3): 334. doi:10.1038/s41419-017-0179-0 |
| [9] |
Danese A, Patergnani S, Bonora M, et al. Calcium regulates cell death in cancer: Roles of the mitochondria and mitochondria-associated membranes (MAMs)[J]. Biochim Biophys Acta Bioenerg, 2017, 1858(8): 615-27. doi:10.1016/j.bbabio.2017.01.003 |
| [10] |
Gilady S Y, Bui M, Lynes E M, et al. Ero1alpha requires oxidizing and normoxic conditions to localize to the mitochondria-associated membrane (MAM)[J]. Cell Stress Chaperones, 2010, 15(5): 619-29. doi:10.1007/s12192-010-0174-1 |
| [11] |
Pinton P, Giorgi C, Missiroli S, et al. Mitochondria-associated membranes (MAMs): composition, molecular mechanisms and physiopathological implications[J]. Antioxid Redox Signal, 2015, 22(12): 995-1019. doi:10.1089/ars.2014.6223 |
| [12] |
Missiroli S, Patergnani S, Caroccia N, et al. Mitochondria-associated membranes (MAMs) and inflammation[J]. Cell Death Dis, 2018, 9(3): 329. doi:10.1038/s41419-017-0027-2 |
| [13] |
Rimessi A, Bezzerri V, Patergnani S, et al. Mitochondrial Ca2+-dependent NLRP3 activation exacerbates the Pseudomonas aeruginosa-driven inflammatory response in cystic fibrosis[J]. Nat Commun, 2015, 6: 6201. doi:10.1038/ncomms7201 |
| [14] |
Vance J E. MAM (mitochondria-associated membranes) in mammalian cells: lipids and beyond[J]. Biochim Biophys Acta, 2014, 1841(4): 595-609. |
| [15] |
Schfer M K, Pfeiffer A, Jaeckel M, et al. Regulators of mitochondrial Ca2+ homeostasis in cerebral ischemia[J]. Cell Tissue Res, 2014, 357(2): 395-405. doi:10.1007/s00441-014-1807-y |
| [16] |
Garofalo T, Matarrese P, Manganelli V, et al. Evidence for the involvement of lipid rafts localized at the ER-mitochondria associated membranes in autophagosome formation[J]. Autophagy, 2016, 12(6): 917-35. doi:10.1080/15548627.2016.1160971 |
| [17] |
Peng C, Rao W, Zhang L, et al. Mitofusin 2 ameliorates hypoxia-induced apoptosis via mitochondrial function and signaling pathways[J]. Int J Biochem Cell Biol, 2015, 69: 29-40. doi:10.1016/j.biocel.2015.09.011 |
| [18] |
Spescha R D, Klohs J, Semerano A, et al. Post-ischaemic silencing of p66Shc reduces ischaemia/reperfusion brain injury and its expression correlates to clinical outcome in stroke[J]. Eur Heart J, 2015, 36(25): 1590-600. doi:10.1093/eurheartj/ehv140 |
| [19] |
Wu W, Lin C, Wu K, et al. FUNDC1 regulates mitochondrial dynamics at the ER-mitochondrial contact site under hypoxic conditions[J]. Embo J, 2016, 35(13): 1368-84. doi:10.15252/embj.201593102 |
| [20] |
Bonora M, Bononi A, De M E, et al. Role of the c subunit of the FO ATP synthase in mitochondrial permeability transition[J]. Cell Cycle, 2013, 12(4): 674-83. doi:10.4161/cc.23599 |
| [21] |
张红艳, 翟丽, 王婷婷, 等. 胡黄连苷Ⅱ通过抑制cyto C/caspase-9/caspase-3通路发挥神经保护作用[J]. 中国药理学通报, 2017, 33(5): 668-74. Zhang H Y, Zhai L, Wang T T, et al. Picroside Ⅱ plays a neuroprotective role by inhibiting cyto C/caspase-9/caspase-3 pathway[J]. Chin Pharmacol Bull, 2017, 33(5): 668-74. doi:10.3969/j.issn.1001-1978.2017.05.016 |
| [22] |
Li S, Wang T, Zhai L, et al. Picroside Ⅱ exerts a neuroprotective effect by inhibiting mPTP permeability and EndoG release after cerebral ischemia/reperfusion injury in rats[J]. J Mol Neurosci, 2018, 64(1): 144-55. doi:10.1007/s12031-017-1012-z |
| [23] |
Qiu J, Wang M, Zhang J, et al. The neuroprotection of Sinomenine against ischemic stroke in mice by suppressing NLRP3 inflammasome via AMPK signaling[J]. Int Immunopharmacol, 2016, 40: 492-500. doi:10.1016/j.intimp.2016.09.024 |
| [24] |
Zhang W, Liu J, Hu X, et al. Polyunsaturated fatty acids reduce neonatal hypoxic/ischemic brain injury by promoting phosphatidylserine formation and Akt signaling[J]. Stroke, 2015, 46(10): 2943-50. doi:10.1161/STROKEAHA.115.010815 |
| [25] |
Zheng W, Talley W L, Holstein D M, et al. P2Y1R-initiated, IP3R-dependent stimulation of astrocyte mitochondrial metabolism reduces and partially reverses ischemic neuronal damage in mouse[J]. J Cereb Blood Flow Metab, 2013, 33(4): 600-11. doi:10.1038/jcbfm.2012.214 |

